Se estudiaron 27 especies de Agaricomycetes xilófagos que crecen en la planicie central del desierto sonorense. Se muestreó en 10 localidades durante las 4 estaciones del año, en 3 tipos de vegetación. La mayor diversidad se registró en el matorral desértico micrófilo (16 spp.), seguido del mezquital (10 spp.) y matorral sarcocaule (8 spp.). El hospedero en donde se encontró el mayor número de esporomas y especies fue Prosopis glandulosa (Fabaceae). Siete especies causaron pudrición marrón, que representan el 25.9%, mientras que 20 (74.1%) ocasionaron pudrición blanca. El mayor número de especies se observó en verano con 26. Crinipellis zonata, Fomitiporia texana, Fuscoporia chrysea, Ganoderma sessiliforme, Perenniporia phloiophila y Phellinus robiniae son nuevos registros para Sonora. Exidiopsis calcea, Hyphodontiella multiseptata y Mycoacia uda se citan por primera vez para México, lo que aumenta a 670 especies de hongos conocidos para Sonora.
Twenty-seven species of xylophagous Agaricomycetes growing in the central plain of the Sonoran desert were studied. A sampling of 10 localities was carried out during the 4 seasons in 3 different types of vegetation. The greatest diversity was recorded in microphyllous desert scrub (16 spp.), followed by mezquital (10 spp.) and sarcocaule scrub (8 spp.). Prosopis glandulosa (Fabaceae) was the host with the highest number of sporomes and species. Seven species caused a brown rot (25.9%) and 20 (74.1%) a white rot of wood. The highest number of species was observed in summer with 26. Crinipellis zonata, Fomitiporia texana, Fuscoporia chrysea, Ganoderma sessiliforme, Perenniporia phloiophila, and Phellinus robiniae are new records for Sonora. Exidiopsis calcea, Hyphodontiella multiseptata, and Mycoacia uda are cited for the first time to Mexico, which increase to 670 species of fungi known for Sonora.
El desierto de Sonora (DS) es parte del inmenso corredor norteamericano de ecosistemas áridos que se extiende desde el sureste de Washington, Estados Unidos, hasta el estado de Hidalgo en el altiplano central de México y desde el centro de Texas hasta las costas del Pacífico en la península de Baja California. Este corredor árido cubre casi un millón de kilómetros cuadrados, de los cuales el DS ocupa una superficie de 223 009km2, el 29% se localiza en Arizona y California, y el 71% en Sonora (Robles-Gil et al., 2001). El 80% del área silvestre se conserva intacta debido a su historia biogeográfica única que evolucionó durante el pleistoceno y sus estrechas conexiones con las selvas bajas caducifolias tropicales que cubren las costas del Pacífico.
La vegetación está directamente vinculada a las condiciones climáticas, de tal manera que predominan los matorrales xerófilos con climas secos a muy secos, donde se desarrollan 3 tipos de comunidades vegetales: 1), mezquital (M) constituido por especies de mezquites como Prosopis glandulosa Torr., P. glandulosa var. torreyana (L.D. Benson) M. C. Johnst. y P. velutina Wooton; 2), matorral sarcocaule (MS) conformado por arbustos de tallos carnosos o jugosos, algunos con corteza papirácea como Bursera spp., Jatropha spp., Cercidium floridum Benth. ex A. Gray, Fouquieria splendens Engelm., P. glandulosa var. torreyana y 3), matorral desértico micrófilo (MDM) integrado por Larrea tridentata Coville, C. microphyllum Rose y I. M. Johnst., C. floridum, Olneya tesota A. Gray, F. splendens, Acacia spp., P. glandulosa, Ambrosiachenopodiifolia (Benth.) W. W. Payne, A. dumosa (A. Gray) W. W. Payne y Encelia farinosa A. Gray ex Torr. (Shreve y Wiggins, 1975; Robichaux, 1999).
Algunas de estas especies son utilizadas como sustrato por los Agaricomycetes xilófagos y son los agentes primarios en la degradación de lignocelulosa en estos ecosistemas. El método de degradación es por medio de la pudrición de la madera, ya sea marrón (degradación de celulosa, hemicelulosa y modificación de lignina) o blanca (degradación de lignocelulosas) (Cullen y Kersten, 1996). El presente tiene por objetivo determinar las especies de Agaricomycetes xilófagos que crecen y se distribuyen en la planicie central del desierto sonorense y así contribuir al conocimiento de las interacciones entre los hongos lignocelulolíticos y las especies arbóreas en este ecosistema.
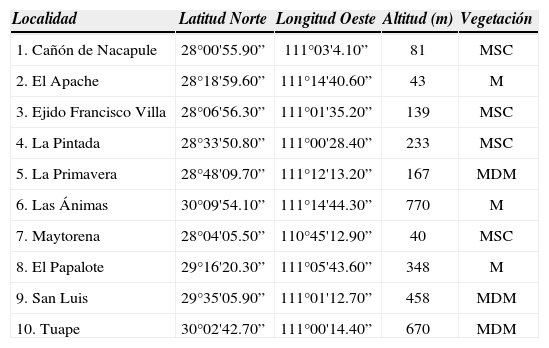
Materiales y métodosSe realizaron 4 muestreos, 1 por cada estación del año, en 10 localidades de la planicie central del desierto sonorense (Cuadro 1). Las sitios se referenciaron con un GPS Garmin eTrex Vista HCx; se utilizó el Datum WGS84 como procesador de imágenes digitales. Los ejemplares se recolectaron y caracterizaron de acuerdo con las técnicas convencionales propuestas por Cifuentes et al. (1986). La determinación de los ejemplares se realizó con claves de Dai (1999), Gilbertson y Ryvarden (1986, 1987), Jülich y Stalpers (1980), Larsen y Cobb-Poulle (1989), Parmasto (2001), Ryvarden (2004), Ryvarden e Iturriaga (2003) y Valenzuela et al. (2007). Se consideró el sistema de clasificación de Kirk et al. (2008), excepto en los taxones de la familia Hymenochaetaceae donde se siguió la propuesta de Wagner y Fischer (2001, 2002). Los ejemplares se encuentran depositados en la colección de hongos del herbario ENCB (Escuela Nacional de Ciencias Biológicas).
Localidades de la planicie central del desierto sonorense
| Localidad | Latitud Norte | Longitud Oeste | Altitud (m) | Vegetación |
|---|---|---|---|---|
| 1. Cañón de Nacapule | 28°00'55.90” | 111°03'4.10” | 81 | MSC |
| 2. El Apache | 28°18'59.60” | 111°14'40.60” | 43 | M |
| 3. Ejido Francisco Villa | 28°06'56.30” | 111°01'35.20” | 139 | MSC |
| 4. La Pintada | 28°33'50.80” | 111°00'28.40” | 233 | MSC |
| 5. La Primavera | 28°48'09.70” | 111°12'13.20” | 167 | MDM |
| 6. Las Ánimas | 30°09'54.10” | 111°14'44.30” | 770 | M |
| 7. Maytorena | 28°04'05.50” | 110°45'12.90” | 40 | MSC |
| 8. El Papalote | 29°16'20.30” | 111°05'43.60” | 348 | M |
| 9. San Luis | 29°35'05.90” | 111°01'12.70” | 458 | MDM |
| 10. Tuape | 30°02'42.70” | 111°00'14.40” | 670 | MDM |
Vegetación: MSC, matorral sarcocaule; M, mezquital; MDM, matorral desértico micrófilo.
En la planicie central del desierto sonorense se determinaron 27 especies de Agaricomycetes xilófagos (Cuadro 2), ubicados en los órdenes Agaricales (3 especies), Auriculariales y Gloeophyllales (1 especie cada uno) e Hymenochaetales y Polyporales (11 especies cada uno), lo que constituye el 81.4% del total de las especies. Con respecto a las familias, la Hymenochaeaceae fue la mejor representada con 11 taxones (40.7%), posiblemente debido a que sea la mejor adaptada a las condiciones de este ecosistema (Drechsler-Santos et al., 2010), incluso es relevante señalar que la mayoría de las especies presentan esporas pigmentadas y basidiomas de consistencia leñosa, le sigue Polyporaceae con 4 (14.8%) y Ganodermataceae con 3 (11.5%). Finalmente, los géneros mejor representados fueron Fuscoporia, Phellinus y Ganoderma con 3 especies cada uno.
Especies de Agaricomycetes xilófagos de la planicie central del desierto sonorense
| Localidades | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Especie | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Agaricomycetes | ||||||||||
| Agaricales | ||||||||||
| Clavariaceae | ||||||||||
| **Hyphodontiella multiseptata Å. Strid | V | |||||||||
| Marasmiaceae | ||||||||||
| *Crinipellis zonata (Peck) Sacc. | V | |||||||||
| Schizophyllaceae | ||||||||||
| Schizophyllum commune Fr. | V | V | P | |||||||
| Incertae sedis | ||||||||||
| Auriculariales | ||||||||||
| Auriculariaceae | ||||||||||
| **Exidiopsis calcea (Pers.) K. Wells | v | |||||||||
| Gloeophyllales | ||||||||||
| Gloeophyllaceae | ||||||||||
| Gloeophyllum striatum (Sw.) Murrill | I | I | I | |||||||
| Hymenochaetales | ||||||||||
| Hymenochaetaceae | ||||||||||
| Aurificaría luteo-umbrina (Romell) D. A. Reid | V | V | ||||||||
| *Fomitiporia texana Murrill | ||||||||||
| *Fuscoporia chrysea (Lév.) Baltazar y Gilbertoni | I,V | |||||||||
| Fuscoporia contigua (Pers.) G. Cunn. | V | |||||||||
| F. gilva (Schwein.) T. Wagner y M. Fisch. | V | |||||||||
| Hymenochaete escobarii J. C. Léger | V | I | I,V | V | ||||||
| Inocutis texana (Murrill) S. Martínez | I,V | |||||||||
| Inonotus rickii (Pat.) D. A. Reid | V | |||||||||
| Phellinus badius (Berk. ex Cooke) G. Cunn. | V | V | V | I,V | V | I | ||||
| Phellinus rimosus (Berk.) Pilát | V | V | V | |||||||
| *Phellinus robiniae (Murrill) A. Ames | I | |||||||||
| Polyporales | ||||||||||
| Fomitopsidaceae | ||||||||||
| Antrodia albida (Fr.) Donk | I,V | |||||||||
| Ganodermataceae | ||||||||||
| Ganoderma adspersum (Schulzer) Donk | I | |||||||||
| Ganoderma curtisii (Berk.) Murrill | V | |||||||||
| *Ganoderma sessiliforme Murrill | I | |||||||||
| Meruliaceae | ||||||||||
| **Mycoacia uda (Fr.) Donk | I | |||||||||
| Phanerochaetaceae | ||||||||||
| Byssomerulius corium (Pers.) Parmasto | I,V | |||||||||
| Phanerochaete allantospora Burd. y Gilb. | V | V | ||||||||
| Polyporaceae | ||||||||||
| Hexagonia hydnoides (Sw.) M. Fidalgo | V | |||||||||
| *Perenniporia phloiophila Gilb. y M. Blackw. | V | I | ||||||||
| Trametes villosa (Sw.) Kreisel | I | |||||||||
| Trichaptum byssogenum (Jungh.) Ryvarden | I | I | ||||||||
Estaciones: I, invierno; P, primavera; V, verano. Localidades: 1, cañón de Nacapule; 2, El Apache; 3, ejido Francisco Villa; 4, La Pintada; 5, La Primavera; 6, Las Ánimas; 7, Maytorena; 8, El Papalote; 9, San Luis; 10, Tuape.
Se encontraron 7 especies de Agaricomycetidae causantes de pudrición marrón, lo cual representa el 25.9% del total encontrado, a saber, Antrodia albida, Crinipellis zonata, Exidiopsis calcea, Gloeophyllum striatum, Byssomerulius corium, Mycoacia uda y Phanerochaete allantospora. En contraste, 20 especies ocasionan pudrición blanca que representan el 74.1%, entre las que destacan los representantes de la Familia Hymenochaetaceae por su alta frecuencia de basidiomas en arbustos vivos principalmente de Acacia y Prosopis. Drechsler-Santos et al. (2010), indican que pueden ser parásitos facultativos u obligados.
En el matorral desértico micrófilo se encontró el mayor número de especies (16), de acuerdo con el hábito de estos hongos, porque hay más especies de plantas leñosas como hospederos (L. tridentata, C. microphyllum, F. splendens, Acacia spp. y P. glandulosa). Este tipo de vegetación se presentó en las localidades La Primavera, San Luis y Tuape. En esta última se registró el mayor número de especies (15) de hongos xilófagos. En el mezquital se observaron 10 especies sobre Prosopis spp., mientras que en el matorral sarcocaule se encontraron 8, prácticamente el 50% de las que se distribuyen en matorral desértico micrófilo, aun cuando este tipo de vegetación se distribuye en las localidades Cañón de Nacapule, Francisco Villa, La Pintada y Maytorena, siendo la mayoría de las plantas hospederas C. floridum, F. splendens y P. glandulosa var. torreyana.
Con respecto a las localidades muestreadas, Tuape presentó el mayor número de especies (15, 55.5%); seguido de la localidad El Apache con 5 especies (18.5%); después el Ejido Francisco Villa y Las Ánimas con 4 taxones cada una. En cuanto a la distribución de las especies por localidad, Phellinis badius se recolectó en 6 localidades, seguido por Hymenochaete escobarii (4), así como G. striatum y Schizophyllum commune con 3 sitios. Con respecto a la abundancia, Fuscoporia contigua y H. escobarii fueron las más recolectadas con 7 y 6 especímenes, respectivamente. Cabe resaltar que H. escobarii, P. badius y S. commune son las únicas especies que se encontraron en los 3 tipos de vegetación representados en el DS.
La estación del año mejor representada fue el verano con 20 especies, equivalente al 74.1%; seguido del invierno con 16 especies (59.3%); mientras que en primavera únicamente se encontró a S. commune; y en otoño no se observaron fructificaciones. Las especies que sólo se encontraron durante el verano son: Aurificaria luteoumbrina, C. zonata, E. calcea, Ganoderma curtisii, F. contigua, F. gilva, Hexagonia hydnoides, Hyphodontiella multiseptata, P. allantospora y Phellinus rimosus. En el invierno: G. adspersum, G. sessiliforme, G. striatum, M. uda, P. robiniae, Trametes villosa y Trichaptum byssogenum. Por otro lado, A. albida, B. corium, Fomitiporia texana, F. chrysea, H. escobarii, Inocutis texana, Perenniporia phloiophila y P. badius se registraron tanto en verano como invierno.
DiscusiónCon respecto a Hymenochaetales, uno de los órdenes mejor representados en el DS, se encontró a A. luteoumbrina (Fig. 1A) mencionada por Valenzuela et al. (2007), quienes la citan de selva baja caducifolia y matorral xerófilo, en esta ocasión en matorral desértico micrófilo y mezquital. Fomitiporia texana (Fig. 1B) presenta basidiomas pileados, ungulados, rimosos y con una costra negra, con poros de 4–6 por mm y setas ausentes; las basidiosporas son de 7−8.4x6.5−8.0μm; se encontró durante el verano sobre Guaiacum coulteri A. Gray (Zygopyllaceae) en matorral desértico micrófilo y se cita por primera vez para el desierto sonorense. Una especie similar es F. robusta (P. Karst.) Fiasson y Niemela, la cual tiene esporas más pequeñas (6−7.5x5.5−7μm) y sólo crece sobre Quercus en Europa como fue señalado por Vlasák y Kout (2011) y Amalfi et al. (2012).
Agaricomycetes xilófagos del desierto sonorense. A, Aurificaria luteo-umbrina (X3.0); B, Fomitiporia texana (X0.5); C, Fuscoporia chrysea (X0.5); D, Fuscoporia contigua (X4.0); E, Hymenochaete escobarii (X1); F, Inocutis texana (X0.5); G, Phellinus badius (X2.0); H, Phellinus rimosus (X2.0); I, Phellinus robiniae (X2.0); J, Phanerochaete allantospora (X2.0); K, Perenniporia phloiophila (X1.25); L, Hyphodontiella multiseptata (X2.0); M, N, Crinipellis zonata (X0.5); O, Exidiopsis calcea (X2.0).
Fuscoporia chrysea (Fig. 1C) se caracteriza por sus basidiomas resupinados con el margen amarillo dorado, esporas elipsoides y hialinas; se encontró en la base de Acacia sp., solamente durante el verano en matorral desértico micrófilo. Se registra por primera vez para Sonora; con anterioridad se citó de Jalisco (Ryvarden y Guzmán, 1993) y zonas tropicales de Belice, Brasil, Colombia, Costa Rica, Jamaica y Venezuela (Ryvarden, 2004). Fuscoporia contigua (Fig. 1D) crece resupinada principalmente sobre madera en descomposición y árboles vivos de G. coulteri, en matorral sarcocaule durante el verano; citada para Quintana Roo de selva baja caducifolia (Ryvarden y Guzmán, 1993) y Sonora de bosque de pino-encino (Montaño et al., 2006). Fuscoporia gilva es cosmopolita previamente registrada de Sonora de bosque de pino encino y mezquital (Montaño et al., 2006); en esta ocasión se localizó únicamente en Tuape, en matorral desértico micrófilo. Hymenochaete escobarii (Fig. 1E) se citó por primera vez para Sonora por Montaño et al. (2006) sobre leguminosas, en el DS crece sobre P. glandulosa en los 3 tipos de vegetación en verano e invierno (Cuadro 2).
Inocutis texana (Fig. 1F) se observó durante el verano en matorral desértico micrófilo. Cibrián y Valenzuela (2007) mencionan que esta especie crece sobre árboles vivos de Prosopis y Acacia, causando pudrición blanca de duramen. Se citó por primera vez de México para Sonora como Inonotus texanus Murrill por Montaño et al. (2006) en Prosopis sp. Inonotus rickii se observó únicamente en su estado anamórfico, en Cañón de Nacapule, en matorral sarcocaule.
Phellinus badius (Fig. 1G) representa la especie con mayor frecuencia y distribución en verano, pero también encontrada en invierno en los 3 tipos de vegetación del DS. Presentó poca variabilidad morfológica, algunas veces se asemeja a P. rimosus (Fig. 1H) y P. robiniae (Fig. 1I), de las cuales se separa básicamente por el número de poros por mm, ya que las características de las fructificaciones y el tamaño de las esporas son similares. Por sus afinidades macro y microscópicas, estos taxones conforman un complejo, el cual requiere una revisión exhaustiva que incluya análisis de secuencias moleculares. Todas se han registrado previamente en el norte, centro y sur del país por Díaz-Moreno et al. (2009), Ojeda-López et al. (1986) y Raymundo y Valenzuela (2003), respectivamente.
Otro orden con el mismo número de especies que el anterior es Polyporales; no obstante, en este grupo se encontró un mayor número de segregaciones por familias (5) y géneros (9). La familia Fomitopsidaceae está representada por Antrodia albida, recolectada durante verano e invierno únicamente en Tuape sobre angiospermas, aunque también se ha observado desarrollándose en coníferas (Gilbertson y Ryvarden, 1986). Una especie afín, con la cual se confunde frecuentemente, es A. heteromorpha (Fr.) Donk, pero se separan por el tamaño mayor de las esporas y crecer sobre gimnospermas (Valenzuela et al., 2008). Ganoderma es uno de los géneros mejor representados en esta región con 3 especies G. adspersum, G. curtisii y G. sessiliforme, las dos primeras previamente citadas de Sonora por Montaño et al. (2006); G. adspersum y G. sessiliforme presentes en invierno y con distribución limitada a la localidad Tuape con matorral desértico micrófilo. Por su parte, G. curtisii solamente se observó en verano en Maytorena con matorral sarcocaule; es una especie con una morfología macroscópica muy variable y de amplia distribución geográfica (Torres-Torres y Guzmán-Dávalos, 2005). La aparente estacionalidad restringida que se observó en las especies de Ganoderma encontradas, es posible que se deba a los altos niveles de sequía en el DS, y que además propician el deterioro de los basidiomas por el consumo ocasionado por insectos ante la escasez de alimento, aspecto que también se observó en otros ejemplares de otras localidades y estaciones del año, cuyo deterioro imposibilitó su determinación taxonómica. Esta hipótesis se apoya en la experiencia personal del segundo autor, quien ha recolectado macrohongos por más de 30 años en diferentes regiones y tipos de vegetación de México, y siempre ha observado la preferencia de los insectos por cierto tipo de macrohongos xilófagos que tienen consistencia subcarnosa, correosa o suberosa, como la de los géneros Ganoderma, Trametes, Coriolopsis, Hexagonia, Schizophyllum, entre otros y no así otros macrohongos que por su consistencia leñosa y dura del basidioma no son apetecibles para los insectos, como Phellinus, Fuscoporia, Fulvifomes, Hymenochaete, entre otros. En las zonas áridas ha observado además, que el deterioro es mayor en estos hongos por la escasa diversidad de especies y, por lo tanto de alimento, no así en las zonas tropicales y templadas, en donde los insectos tienen de que alimentarse por la mayor diversidad no solo de hongos xilófagos, sino también de los que se desarrollan en suelo, hojarasca y micorrizógenos que hay en dichas regiones.
Dentro de Polyporales, la familia Meruliaceae está representada con Mycoacia uda, que se cita por primera vez para el país; produce basidiomas resupinados, cerosos, con espinas cónicas de color amarillento a pálido anaranjado, margen pruinoso, sistema hifal monomítico, hifas generativas hialinas con fíbulas, cistidiolos subfusoides, basidiosporas ampliamente elipsoides de 4.5−6x2−3μm. De la familia Phanerochaetaceae sólo se encontraron B. corium y P. allantospora (Fig. 1J), ambas ubicadas en Tuape y la última, también en el mezquital de Las Ánimas, principalmente en el verano. Finalmente, en Polyporaceae se recolectaron a H. hydnoides, ampliamente distribuida en las zonas tropicales de México, generalmente en selva baja caducifolia (Valenzuela y Chacón-Jiménez, 1993, Valenzuela et al., 2002; Raymundo y Valenzuela, 2003), pero en esta ocasión se encontró en la localidad Maytorena en un matorral sarcocaule. Perenniporia phloiophila (Fig. 1K) se citó por primera vez para México por Valenzuela et al. (2004) y representa un segundo registro en el país. Anteriormente se observó sobre Quercus y en esta ocasión sobre Acacia en las localidades Papalote y Tuape, en verano e invierno, respectivamente. La distribución de T. villosa varía desde dunas, matorrales xerófilos, selvas bajas caducifolias a nivel del mar hasta encinares con influencia tropical en altitudes de 700m (Pompa-González et al., 2011). En el DS sólo se localizó en el mezquital de Tuape. Trichaptum byssogenum comúnmente encontrada en bosques tropicales, se observó sobre Prosopis en Las Ánimas y Tuape, durante el invierno.
El orden Agaricales está representado por 3 especies C. zonata (Figs. 1L, M), H. multiseptata (Fig. 1N) y S. commune. La primera se encontró abundante durante el verano sobre madera en descomposición, en el mezquital de la localidad El Apache. La segunda representa el primer registro en México, ubicada en matorral desértico micrófilo de Tuape durante el verano, únicamente se conocía de Europa (Jülich y Stalpers, 1980); produce basidiomas resupinados de color pálido amarillento, himenóforo liso, sistema hifal monomítico, hifas con fíbulas hialinas, de paredes gruesas, cistidios ausentes y esporas hialinas, subfusiformes, lisas e inamiloides. La tercera es una especie de amplia distribución en altitudes de 1 200m hasta nivel del mar, en selvas bajas caducifolias hasta encinares tropicales.
Exidiopsis calcea (Fig. 1O) del orden Auriculariales, representa un nuevo registro para México, se caracteriza por basidiomas resupinados de color blanquecinos a grisáceos, abundantes, que crecen sobre Prosopis sp. En el orden Gloeophyllales, G. striatum se recolectó en las localidades Francisco Villa, San Luis y Tuape, tanto en matorral sarcocaule como desértico micrófilo. Esta especie es de amplia distribución en las zonas tropicales de México.
Sonora es una de las entidades federativas más estudiadas en México con 661 especies de hongos registradas (Esqueda et al., 2010, 2011), encontrándose en cuarto lugar, después de Veracruz (más de 1 400) (Guzmán, 1998), Jalisco (1 040) (Sánchez-Jácome y Guzmán-Dávalos, 2011) y Estado de México (726) (Frutis y Valenzuela, 2009). Con base en las aportaciones del presente estudió se incrementó a 670 especies.
La planicie central del desierto sonorense se caracterizó por una baja diversidad de Agaricomycetes xilófagos (27 spp.), debido a las condiciones climáticas de la región, baja humedad y la menor diversidad de especies arbóreas leñosas; en contraste con los estudios realizados en la Reserva Forestal Nacional y Refugio de Fauna Silvestre Ajos-Bavispe (Montaño et al., 2006) con 57 especies y Reserva de Biosfera Sierra de Álamos-Río Cuchujaqui con 54 especies (Esqueda et al., 1999). El matorral desértico micrófilo presentó la mayor diversidad de taxones (16), así como el mayor número de especies arbóreas leñosas, siendo la localidad de Tuape la mejor representada (15 spp.) y dominada por este tipo de vegetación. En el verano e invierno se registró el mayor número de especies y la humedad más alta, ya que las escasas precipitaciones ocurren en estas épocas del año. De las 27 especies de Agaricomycetes estudiadas, 3 son nuevos registros para México y 6 para el estado de Sonora.
Los autores agradecen a Conabio por el financiamiento del presente estudio por medio del proyecto DC026. Ricardo Valenzuela y Tania Raymundo agradecen al Instituto Politécnico Nacional (IPN) el apoyo financiero otorgado mediante el proyecto SIP-20130034 y a la Universidad Nacional Autónoma de México (UNAM) por el apoyo recibido del proyecto PAPIIT: IN-207311. Tania Raymundo agradece el apoyo al Conacyt por la beca otorgada para realizar sus estudios de posgrado. Ricardo Valenzuela reconoce el apoyo otorgado por la Comisión de Operación y Fomento de Actividades Academicas (COFAA) y del IPN a sus investigaciones.