Se realizó un estudio faunístico de Coleoptera (Insecta) del bosque tropical caducifolio de Acahuizotla, Guerrero, México, entre febrero del 2008 y octubre del 2009. Mediante redes entomológicas y trampas de luz, se recolectaron 4,738 coleópteros adultos que corresponden a 50 familias, 251 géneros y 523 morfoespecies. Aproximadamente el 80.5% de los ejemplares recolectados fueron obtenidos con trampas de luz. La diversidad de orden 1 (exponencial del índice de Shannon) alcanzó un valor de 153.32 especies efectivas, mientras que la diversidad de orden 2 (inverso del índice de Simpson) fue de 68.30 especies efectivas. De acuerdo con los estimadores Chao1 y ACE, la riqueza esperada para la localidad es de 903 y 844 morfoespecies, respectivamente (de las cuales se recolectaron entre el 57.9% y el 61.9%). La similitud de los sitios fue mayor entre aquellos donde se colocaron trampas de luz, posiblemente, debido a la afinidad de las especies en su conducta de fototropismo positivo.
A faunistic study of Coleoptera (Insecta) in the tropical dry forest of Acahuizotla, Guerrero, Mexico between February 2008 and October 2009 was done. Using entomological nets and light traps, 4,738 adult specimens were collected belonging to 50 families, 251 genera and 523 morphospecies. 80.5% of the specimens were collected with light traps. Diversity of order 1 (exponential of the Shannon index) reached a value of 153.32 effective species while diversity of order 2 (inverse of the Simpson index) was 68.30 effective species. According to the Chao1 and ACE estimates, the expected richness is 903 and 844 morphospecies, respectively (our sampling representing between 57.9% and 61.9%). The similarity between the sites was higher in those where light traps were used, because these insects were attracted by the artificial light.
El bosque tropical caducifolio (BTC) o selva seca tiene una amplia distribución mundial. Se estima que cerca del 42% de los bosques tropicales corresponde a comunidades de este tipo, con plantas que habitan en condiciones secas y estacionales (Murphy y Lugo, 1986). La estructura de los BTC está típicamente conformada por asociaciones de árboles de baja estatura, que miden alrededor de 7-8 m de altura (Trejo, 1996, 2010). Tanto la distribución geográfica como la fisonomía del BTC están determinadas por las condiciones climáticas en las que se establecen, que le otorgan la característica más importante de estos bosques: su marcada estacionalidad, ya que al menos durante 5 meses tienen pocos eventos de precipitación menores a 100mm y donde la mayor parte de la vegetación pierde las hojas en la época seca (Murphy y Lugo, 1995). En México, las condiciones climáticas en las que se desarrolla el BTC son variables, pero por lo general se ubica en regiones donde las temperaturas son cálidas y casi siempre coinciden con el clima cálido subhúmedo (Aw0) (Köppen, modificado por García, 1988; Trejo, 1999).
En México, la distribución del BTC es bastante amplia, pues se ubica desde el sur de la península de Baja California y de Sonora, en áreas extensas desde las cuencas de los ríos Santiago y Balsas, pasando por la vertiente del Pacífico y formando una franja casi continua hasta Chiapas; existen otros manchones importantes en la vertiente del Golfo, con una distribución discontinua desde Tamaulipas hasta Yucatán (Trejo, 1996). El BTC mexicano está mejor representado a lo largo de la vertiente del Pacífico mexicano en los estados de Sonora, Sinaloa, Nayarit, Jalisco, Colima, Michoacán, Morelos, Guerrero, Oaxaca y Chiapas. Aunque el BTC parece ser menos diverso que otros ecosistemas tropicales, su nivel de endemismos es mucho mayor de lo que se consideraba hasta hace algunas décadas (Ceballos, 1995; Ceballos y Brown, 1995; Gentry, 1995), lo que le otorgaría mayor relevancia en términos de conservación. Es probable que estos endemismos se presenten en muchos grupos de organismos, como parecen indicarlo estudios específicos de algunos grupos de insectos (CEDEMUN, 1986; Chemsak y Noguera, 1993).
Actualmente, la información sobre la diversidad de insectos que existe en el BTC mexicano es reducida y se restringe a estudios regionales de ciertos grupos; por ejemplo, los órdenes mejor inventariados son Coleoptera e Hymenoptera, que registran un mayor número de especies en los estados de Chiapas y Oaxaca (Zaragoza-Caballero, Noguera, González-Soriano, Ramírez-García y Rodríguez-Palafox, 2010). González-Soriano, Noguera, Zaragoza-Caballero y Ramírez-García (2009) reportan para la diversidad de Odonata del BTC de la Sierra de San Javier, Sonora, un total de 1,015 individuos, pertenecientes a 7 familias, 27 géneros y 47 especies. Jiménez-Sánchez, Zaragoza-Caballero y Noguera (2009) realizaron un estudio entomológico con trampas de luz en el BTC de la sierra de Huautla, Morelos, en el cual recolectaron 14,886 individuos de 91 especies, 49 géneros, 15 tribus y 9 subfamilias de coleópteros estafilínidos (Coleoptera: Staphylinidae). Por otro lado, Rodríguez-Velez, Zaragoza-Caballero y Rodríguez (2009) registraron para la región de BTC en Huatulco, Oaxaca, un total de 61 especies, 30 géneros y 13 tribus de Encyrtidae (Hymenoptera); el mayor número de géneros y especies fueron de la subfamilia Encyrtinae, con 22 géneros y 44 especies. Por otra parte, Noguera et al. (2007) realizaron un estudio faunístico de Cerambycidae en el BTC de San Buenaventura, Jalisco, reportando 1,265 individuos, 109 especies, 76 géneros, 30 tribus y 5 subfamilias; el patrón de abundancia mostró pocas especies muy abundantes y la mayoría con pocos individuos.
En el país, los estudios del componente beta de la diversidad se centran principalmente en grupos bien conocidos como mamíferos, aves o plantas, mientras que los grupos de invertebrados han sido escasamente estudiados (Koleff et al., 2008). Por ejemplo, Pérez-Hernández y Zaragoza-Caballero (2015) reportan una gran diferencia en la composición de especies de Cantharidae (Coleoptera) entre pares de ensambles en el BTC mexicano, que es resultado de un remplazo de especies, más que de las diferencias en riqueza específica; ellos señalan que esto es un reflejo del número de especies exclusivas de cada localidad. En su estudio, los autores añaden que las condiciones ambientales no tienen mucha influencia sobre los ensambles.
Este estudio tiene el objetivo de analizar la diversidad de Coleoptera recolectados en el BTC del ejido de Acahuizotla, Guerrero, México, mediante la medición de la abundancia, riqueza y diversidad de morfoespecies, como aproximaciones al componente alfa de la diversidad. También se evaluó la similitud entre los sitios de muestreo, para analizar cómo varía la composición de morfoespecies entre sitios, y se evaluó si dicha similitud está relacionada con la elevación y con la distancia geográfica entre sitios.
Material y métodosEl trabajo de campo se llevó a cabo en el ejido de Acahuizotla, municipio de Chilpancingo de los Bravo, Guerrero (17°23′00″N, 99°27′00″O) (fig. 1). El clima es semicálido-semihúmedo tipo A (C) w2 (w) ig, con un promedio anual de temperatura de 22°C y un promedio anual de precipitación de 1,373mm (Velázquez, 2010). La vegetación predominante es de tipo BTC, que forma parte de la ecorregión de los Bosques Secos del Pacífico Mexicano G-200 (Ceballos, Martínez, García, Espinoza y Bezaury, 2010).
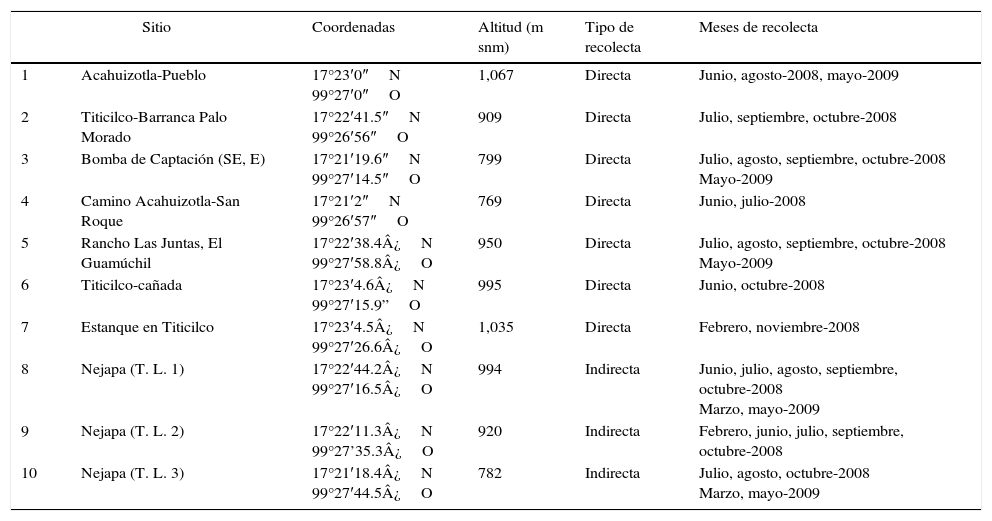
Se realizaron recolectas entomológicas por 9 meses (febrero, junio-noviembre del 2008, y marzo y mayo del 2009) en 10 sitios del ejido de Acahuizotla (fig. 1) durante 5 días de cada mes. En la tabla 1 se muestran detalles de las recolectas en los distintos sitios. La recolecta se realizó de forma directa, utilizando redes entomológicas por 2 personas de 9:00 a 15:00; e indirecta, con trampas de atracción luminosa tipo Pennsylvania-Minnesota (Southwood, 1966), modificadas por Zaragoza-Caballero para el proyecto «Los Insectos del Bosque Seco», las cuales operaban por 4 horas consecutivas (Noguera, 2016).
Sitios de recolecta de Coleoptera en el ejido de Acahuizotla, Guerrero, del 2008 al 2009.
| Sitio | Coordenadas | Altitud (m snm) | Tipo de recolecta | Meses de recolecta | |
|---|---|---|---|---|---|
| 1 | Acahuizotla-Pueblo | 17°23′0″N 99°27′0″O | 1,067 | Directa | Junio, agosto-2008, mayo-2009 |
| 2 | Titicilco-Barranca Palo Morado | 17°22′41.5″N 99°26′56″O | 909 | Directa | Julio, septiembre, octubre-2008 |
| 3 | Bomba de Captación (SE, E) | 17°21′19.6″N 99°27′14.5″O | 799 | Directa | Julio, agosto, septiembre, octubre-2008 Mayo-2009 |
| 4 | Camino Acahuizotla-San Roque | 17°21′2″N 99°26′57″O | 769 | Directa | Junio, julio-2008 |
| 5 | Rancho Las Juntas, El Guamúchil | 17°22′38.4¿N 99°27′58.8¿O | 950 | Directa | Julio, agosto, septiembre, octubre-2008 Mayo-2009 |
| 6 | Titicilco-cañada | 17°23′4.6¿N 99°27′15.9”O | 995 | Directa | Junio, octubre-2008 |
| 7 | Estanque en Titicilco | 17°23′4.5¿N 99°27′26.6¿O | 1,035 | Directa | Febrero, noviembre-2008 |
| 8 | Nejapa (T. L. 1) | 17°22′44.2¿N 99°27′16.5¿O | 994 | Indirecta | Junio, julio, agosto, septiembre, octubre-2008 Marzo, mayo-2009 |
| 9 | Nejapa (T. L. 2) | 17°22′11.3¿N 99°27’35.3¿O | 920 | Indirecta | Febrero, junio, julio, septiembre, octubre-2008 |
| 10 | Nejapa (T. L. 3) | 17°21′18.4¿N 99°27′44.5¿O | 782 | Indirecta | Julio, agosto, octubre-2008 Marzo, mayo-2009 |
Para la determinación a nivel de familia se siguió la clasificación de Bouchard et al. (2011) y para la determinación a nivel de género se consultó bibliografía (Arce-Pérez y Morón, 2010, 2011; Barbosa, Fernandes y Oliveira, 2013; De la Cruz et al., 2013; Fitton y Eversham, 2006; Martínez, 2005; Moret, 2003; Navarrete-Heredia, Newton, Thayer, Ashe y Chandler, 2002; Peck y Newton, 2013; Pinto, 1999; Ross, 1961; Roughley y Solís, 2013; Triplehorn y Johnson, 2005; White, 1983). Asimismo, se compararon las morfoespecies con ejemplares determinados de la Colección de Coleoptera de la Colección Nacional de Insectos del Instituto de Biología, UNAM (CNIN). Además, se consultó a especialistas para la determinación de género y en algunos casos de especie.
La diversidad de Coleoptera del BTC de Acahuizotla, Guerrero, se analizó para el ensamble completo y para cada sitio de muestreo. La abundancia se determinó de acuerdo al número total de individuos recolectados por familia y morfoespecie. La riqueza de especies observada corresponde aquí al número de morfoespecies de cada familia y cada sitio. Para analizar cuánta de la riqueza total esperada de Coleoptera fue obtenida con este estudio, se construyeron curvas de acumulación de especies con el estimador Chao1 y el estimador de cobertura basado en la abundancia (ACE), utilizando como unidad de muestreo el número de especies recolectadas por mes, mediante el programa EstimateS (Colwell, 2013). El primer estimador le otorga mayor importancia al número de especies raras (Magurran, 2004), mientras que el estimador ACE reconoce más a las especies que están ampliamente distribuidas o que son más abundantes y que se esperaría quedaran incluidas en cualquier muestra (Colwell y Coddington, 1994).
La diversidad se analizó mediante los índices de equidad de Pielou (J), el cual calcula la regularidad con la que los individuos se dividen entre los taxones presentes y en donde la equidad máxima (igual a 1) se alcanza cuando todas las especies del ensamble tienen el mismo número de individuos (Magurran, 1988). Ambos análisis se hicieron mediante el programa PAST (Hammer, Harper y Ryan, 2016). La diversidad alfa también se analizó de acuerdo con el concepto de diversidad verdadera (Jost, 2006), calculada con el programa SPADE (Chao y Shen, 2010); para ello se consideró la diversidad alfa de orden 1 y 2 (equivalentes al exponencial del índice de Shannon e inverso del índice de Simpson, respectivamente). La primera fue estimada a través del «Bias-corrected Shannon diversity estimator», propuesto para casos donde no se tiene conocimiento completo de la comunidad; mientras que para la segunda, se utilizó el estimador Minimum variance inbiased estimator (MVUE), el cual otorga mayor importancia a las especies dominantes.
Otro de los objetivos del estudio fue analizar la similitud en la composición de morfoespecies entre los sitios de muestreo. Para ello, se hizo una comparación de la composición de los 10 sitios muestreados mediante un escalamiento multi-dimensional no métrico (NMDS, por sus siglas en inglés), empleando el índice de Jaccard como medida de similitud. Este análisis se realizó mediante el software PAST (Hammer et al., 2016).
Con el objetivo de evaluar la posibilidad de que exista decaimiento de la similitud en la composición de especies debida al incremento de la distancia geográfica entre sitios, se realizaron pruebas simples de Mantel (Sokal y Rohlf, 1995) usando 9,999 permutaciones. Se utilizó una matriz de similitud en la composición de especies entre pares de sitios, obtenida mediante el índice de Jaccard, que se basa en la presencia-ausencia de las especies en los sitios, mientras que la matriz de la distancia geográfica se construyó con la distancia absoluta entre pares de sitios. El mismo procedimiento se utilizó para evaluar la posible influencia de la altitud.
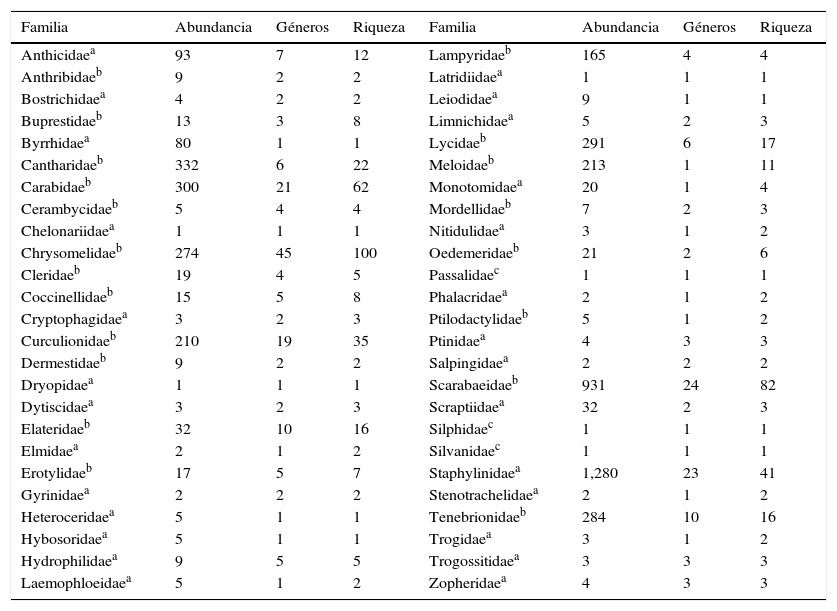
ResultadosCon un total de 260h de recolecta invertidas, considerando ambos métodos, se obtuvieron 4,738 coleópteros, que pertenecen a 50 familias, 251 géneros y 523 morfoespecies. De ellos, 684 individuos (14.5%) y 120 morfoespecies (22.9%) fueron recolectados de forma directa; 3,566 ejemplares (75.2%) y 370 morfoespecies (70.8%) se obtuvieron mediante atracción luminosa, y empleando ambos métodos se recolectaron 488 individuos (10.3%) y 33 morfoespecies (6.3%). Las familias más abundantes en términos de número de individuos fueron Staphylinidae (1,280), Scarabaeidae (931), Cantharidae (332), Lycidae (291), Tenebrionidae (284) y Chrysomelidae (274), familias que en algunos casos también resultaron ser las más diversas en términos de riqueza de especies. Por el contrario, 30 familias estuvieron representadas con menos de 10 individuos (116 coleópteros adultos) y representan el 2% del total recolectado (tabla 2).
Abundancia y riqueza de géneros y especies para las familias de Coleoptera recolectadas en el BTC de Acahuizotla, Guerrero, México.
| Familia | Abundancia | Géneros | Riqueza | Familia | Abundancia | Géneros | Riqueza |
|---|---|---|---|---|---|---|---|
| Anthicidaea | 93 | 7 | 12 | Lampyridaeb | 165 | 4 | 4 |
| Anthribidaeb | 9 | 2 | 2 | Latridiidaea | 1 | 1 | 1 |
| Bostrichidaea | 4 | 2 | 2 | Leiodidaea | 9 | 1 | 1 |
| Buprestidaeb | 13 | 3 | 8 | Limnichidaea | 5 | 2 | 3 |
| Byrrhidaea | 80 | 1 | 1 | Lycidaeb | 291 | 6 | 17 |
| Cantharidaeb | 332 | 6 | 22 | Meloidaeb | 213 | 1 | 11 |
| Carabidaeb | 300 | 21 | 62 | Monotomidaea | 20 | 1 | 4 |
| Cerambycidaeb | 5 | 4 | 4 | Mordellidaeb | 7 | 2 | 3 |
| Chelonariidaea | 1 | 1 | 1 | Nitidulidaea | 3 | 1 | 2 |
| Chrysomelidaeb | 274 | 45 | 100 | Oedemeridaeb | 21 | 2 | 6 |
| Cleridaeb | 19 | 4 | 5 | Passalidaec | 1 | 1 | 1 |
| Coccinellidaeb | 15 | 5 | 8 | Phalacridaea | 2 | 1 | 2 |
| Cryptophagidaea | 3 | 2 | 3 | Ptilodactylidaeb | 5 | 1 | 2 |
| Curculionidaeb | 210 | 19 | 35 | Ptinidaea | 4 | 3 | 3 |
| Dermestidaeb | 9 | 2 | 2 | Salpingidaea | 2 | 2 | 2 |
| Dryopidaea | 1 | 1 | 1 | Scarabaeidaeb | 931 | 24 | 82 |
| Dytiscidaea | 3 | 2 | 3 | Scraptiidaea | 32 | 2 | 3 |
| Elateridaeb | 32 | 10 | 16 | Silphidaec | 1 | 1 | 1 |
| Elmidaea | 2 | 1 | 2 | Silvanidaec | 1 | 1 | 1 |
| Erotylidaeb | 17 | 5 | 7 | Staphylinidaea | 1,280 | 23 | 41 |
| Gyrinidaea | 2 | 2 | 2 | Stenotrachelidaea | 2 | 1 | 2 |
| Heteroceridaea | 5 | 1 | 1 | Tenebrionidaeb | 284 | 10 | 16 |
| Hybosoridaea | 5 | 1 | 1 | Trogidaea | 3 | 1 | 2 |
| Hydrophilidaea | 9 | 5 | 5 | Trogossitidaea | 3 | 3 | 3 |
| Laemophloeidaea | 5 | 1 | 2 | Zopheridaea | 4 | 3 | 3 |
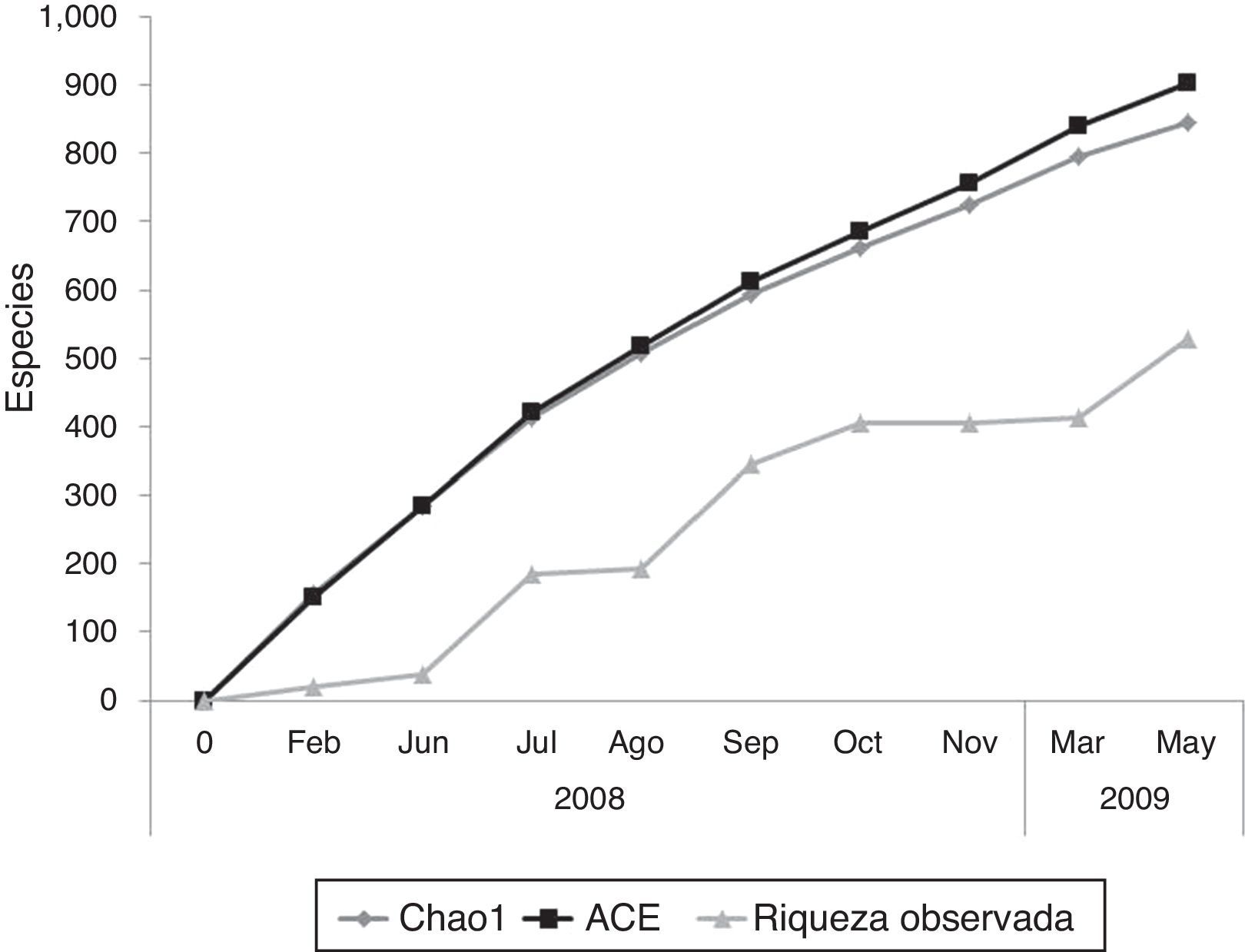
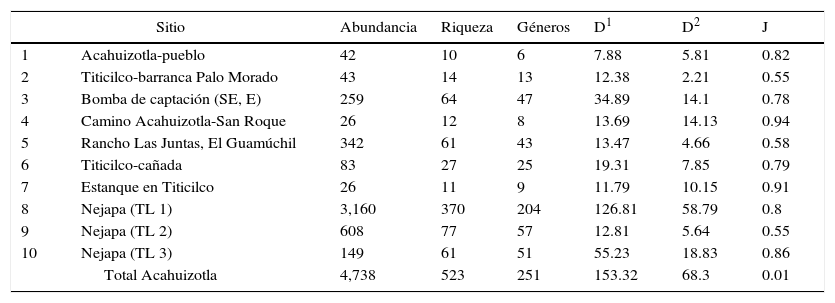
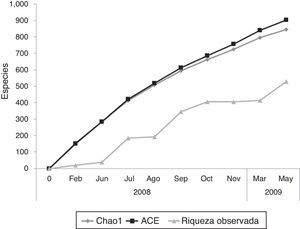
Las curvas de acumulación de especies indican que para Acahuizotla se podría esperar una riqueza total de entre 844-903 morfoespecies (estimada con Chao1 y ACE, respectivamente) (fig. 2), es decir, que en este trabajo se registró entre el 58 y 62% del total estimado para la localidad. Los valores de diversidad de Coleoptera del ejido Acahuizotla y los sitios de muestreo visitados para este estudio se anotan en la tabla 3. Tanto para la riqueza de especies, como para las medidas de diversidad y equitatividad, hubo una amplia variación entre los sitios de muestreo.
Valores de diversidad en los sitios de recolecta de Acahuizotla, Guerrero, México.
| Sitio | Abundancia | Riqueza | Géneros | D1 | D2 | J | |
|---|---|---|---|---|---|---|---|
| 1 | Acahuizotla-pueblo | 42 | 10 | 6 | 7.88 | 5.81 | 0.82 |
| 2 | Titicilco-barranca Palo Morado | 43 | 14 | 13 | 12.38 | 2.21 | 0.55 |
| 3 | Bomba de captación (SE, E) | 259 | 64 | 47 | 34.89 | 14.1 | 0.78 |
| 4 | Camino Acahuizotla-San Roque | 26 | 12 | 8 | 13.69 | 14.13 | 0.94 |
| 5 | Rancho Las Juntas, El Guamúchil | 342 | 61 | 43 | 13.47 | 4.66 | 0.58 |
| 6 | Titicilco-cañada | 83 | 27 | 25 | 19.31 | 7.85 | 0.79 |
| 7 | Estanque en Titicilco | 26 | 11 | 9 | 11.79 | 10.15 | 0.91 |
| 8 | Nejapa (TL 1) | 3,160 | 370 | 204 | 126.81 | 58.79 | 0.8 |
| 9 | Nejapa (TL 2) | 608 | 77 | 57 | 12.81 | 5.64 | 0.55 |
| 10 | Nejapa (TL 3) | 149 | 61 | 51 | 55.23 | 18.83 | 0.86 |
| Total Acahuizotla | 4,738 | 523 | 251 | 153.32 | 68.3 | 0.01 | |
D1: exponencial del índice de Shannon; D2: inverso del índice de Simpson; J: índice de equidad de Pielou.
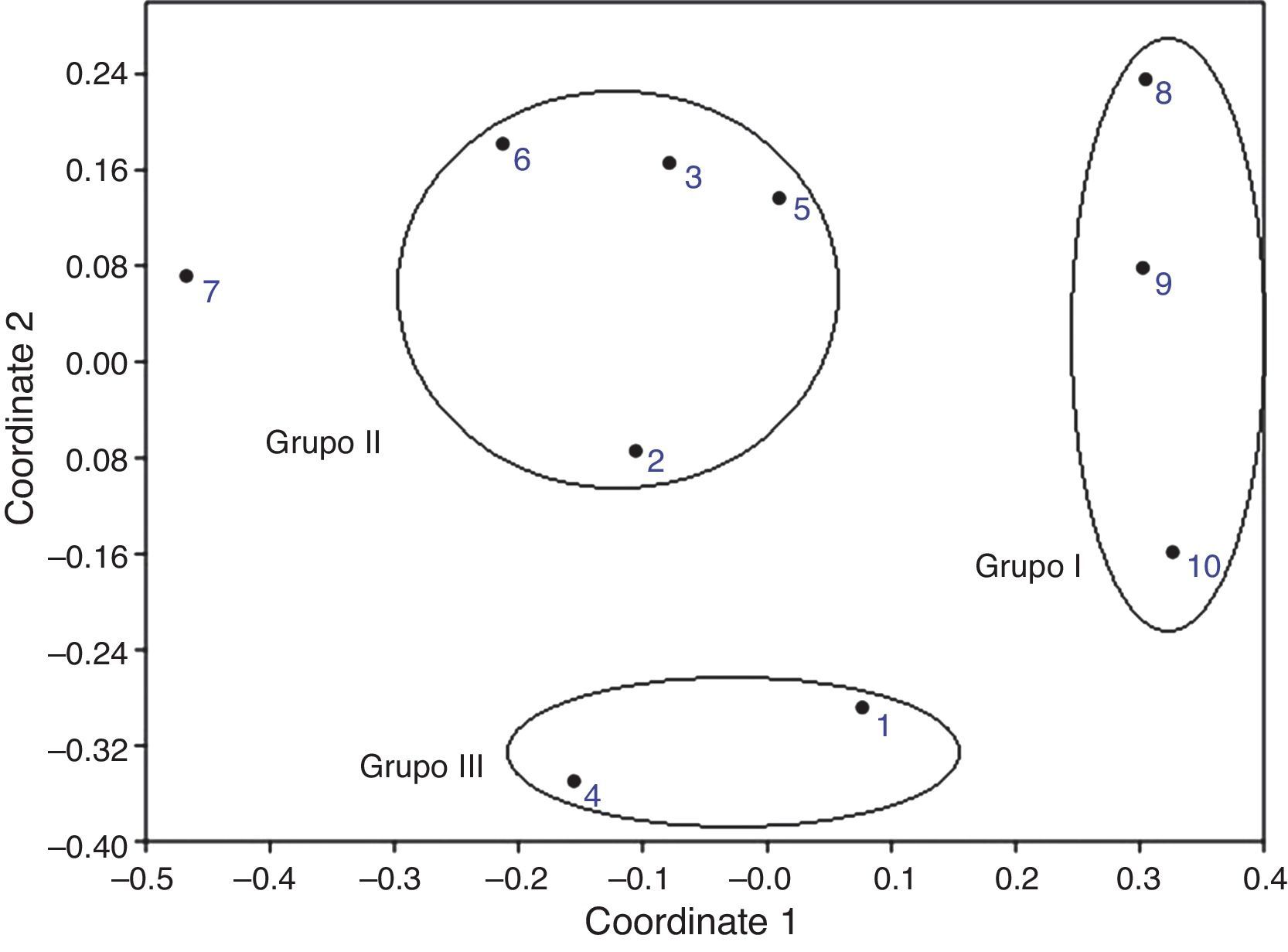
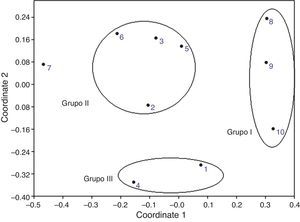
En el análisis NMDS se formaron 3 grupos, de acuerdo con las especies compartidas entre los sitios: el grupo i estuvo conformado por los sitios Nejapa 1, Nejapa 2 y Nejapa 3, en donde se colocaron las trampas de luz; el grupo ii lo integraron los sitios Titicilco-Barranca Palo Morado, «Bomba de captación (SE, E)», Rancho Las Juntas/El Guamúchil, Titicilco-Cañada. Mientras que el grupo iii incluyó a Acahuizotla/Pueblo y camino Acahuizotla-San Roque (fig. 3). El sitio Estanque en Titicilco quedó fuera de este ordenamiento debido a que tuvo pocos registros. Los análisis de correlación con las pruebas de Mantel no determinaron ninguna correlación significativa entre la similitud en la composición de morfoespecies y la distancia geográfica o la altitud.
Análisis de escalamiento multidimensional no métrico (NMDS, por sus siglas en inglés) aplicado para el ordenamiento de los sitios de recolecta de Coleoptera en Acahuizotla, Guerrero. Sitios: 1: Acahuizotla-Pueblo, 2: Titicilco-Barranca Palo Morado, 3: bomba de captación (SE, E), 4: camino Acahuizotla-San Roque, 5: rancho Las Juntas, El Guamúchil, 6: Titicilco-Cañada, 7: estanque en Titicilco, 8: Nejapa (trampa de luz 1), 9: Nejapa (trampa de luz 2), 10: Nejapa (trampa de luz 3).
El estudio de Coleoptera realizado en el BTC de Acahuizotla, Guerrero, es importante desde distintas perspectivas, principalmente porque hay pocos estudios a nivel de orden para la región y en general en el BTC. Los resultados obtenidos indican que la riqueza y diversidad de Coleoptera asociada con este bosque es alta, ya que las 50 familias registradas aquí representan el 43.8% del total de familias reportadas para México (Navarrete-Heredia y Fierros-López, 2001). También es relevante el alto número de géneros determinados para la localidad (251), así como la riqueza expresada en las morfoespecies recuperadas (523).
Los métodos de recolecta utilizados en este estudio son complementarios en números de riqueza de especies, lo cual ayudó a que nuestro inventario fuera más completo. Asimismo, estos métodos determinaron exclusividad de familias a un tipo de recolecta y familias obtenidas por ambos métodos de recolecta. Las familias Passalidae, Silphidae y Silvanidae fueron las únicas exclusivas a recolecta directa; otras 27 familias (e.g. Anthicidae, Bostrichidae, Byrrhidae, Heteroceridae y Trogidae) lo fueron a recolecta por atracción luminosa y 20 familias más se obtuvieron por ambos métodos (e. g. Anthribidae, Chrysomelidae, Erotylidae y Oedemeridae). Podría decirse que las trampas de atracción luminosa representan el mejor método de recolecta; sin embargo, consideramos que en realidad son métodos complementarios de muestreo que, en conjunto, permitieron una captura más representativa de la localidad.
A pesar de que la curva de acumulación de especies observadas no llegó a ser asintótica, se puede considerar que la recolecta obtenida es representativa de la fauna de Coleoptera de la región. Al mismo tiempo, nos indica que todavía faltan más muestreos por realizarse en el área, para poder determinar la máxima riqueza de morfoespecies del ensamble.
La diversidad alfa verdadera para el ejido de Acahuizotla presentó un valor de 153.32 especies efectivas durante el año de recolecta; cifra que representa apenas el 29.25% del valor máximo esperado, es decir, el número total de especies recolectadas en el ensamble de Acahuizotla (523 morfoespecies). Es una cifra muy baja que indica la presencia de pocas especies muy dominantes y muchas especies raras.
En ese sentido, más de la mitad de las familias de coleópteros estuvieron representadas por 10 o menos ejemplares y, en general, por una riqueza de coleópteros también baja. Respecto a este punto, se ha señalado que la abundancia de las especies en un sitio determinado responde a factores ambientales y bióticos (como las interacciones con otros organismos) y, por lo tanto, puede variar enormemente dentro del área de distribución (Piñol y Martínez-Vilalta, 2006).
Mateo, Felicísimo y Muñoz (2011) indican que las relaciones entre los organismos y el medio abiótico son una de las causas de los patrones espaciales de distribución, lo que significa que a escalas espaciales amplias (kilómetros), la distribución de los organismos está determinada por factores climáticos. En cambio, a escalas menores (cientos de metros o menos) es más probable que dicha distribución responda a factores como el reparto de recursos y variaciones microtopográficas en las condiciones ambientales. Para las especies de coleópteros de Acahuizotla este tipo de factores pudieron influir en aquellas familias que estuvieron representadas por un solo individuo, ya que una especie puede ampliar o reducir su distribución espacial en función de cambios en el ambiente (Jiménez-Valverde y Hortal, 2003). Trejo (1998) menciona que la heterogeneidad del BTC disminuye la posibilidad de recolectar especies que solo se encuentran en hábitats muy específicos o que están fuertemente asociadas con recursos poco representados en el ecosistema.
Una ventaja importante de analizar la diversidad en términos del número de especies efectivas es que se puede evaluar directamente la magnitud de cambio entre comunidades o ensambles (García-Morales, Moreno y Bello-Gutiérrez, 2011). En el caso de Acahuizotla, las diferencias entre los valores de diversidad alfa obtenidos para los 10 sitios fueron amplias y podrían ser resultado de las diferencias entre los métodos de recolecta aplicados en cada sitio o del estado de conservación de los sitios. En ese aspecto, es necesario destacar que la vegetación de la localidad tiene altos niveles de perturbación, la cual se observó durante los muestreos y fue más evidente en los sitios Acahuizotla/Pueblo, Titicilco-Barranca Palo Morado, Camino Acahuizotla-San Roque y Estanque en Titicilco. Probablemente, la combinación del tipo de muestreo aplicado y el grado de conservación del sitio fue determinante para la diversidad alfa de cada sitio, ya que esta fue mayor en aquellos en donde se emplearon trampas de atracción luminosa y/o que formaban parte del remanente de BTC mejor conservado (e.g. Nejapa [trampa de luz 1], Nejapa [trampa de luz 3], bomba de captación [SE, E]).
Por otro lado, el análisis NMDS está basado en la comparación de la composición de especies de cada ensamble, de modo que en la gráfica construida los sitios más cercanos son aquellos que más especies comparten. En este trabajo se esperaba que una mayor cercanía geográfica pudiera determinar una mayor similitud en la composición de morfoespecies entre sitios.
Se ha observado que las condiciones ambientales cambian conforme aumenta la distancia, lo que implica que haya una mayor separación de las especies con diferentes características fisiológicas que con el paso del tiempo provocan que la composición de especies sea relativamente predecible, de acuerdo con el tipo de ambiente. Este patrón de decaimiento en la similitud depende de la configuración del ambiente e influye en el movimiento de las especies: a mayor número de barreras, la similitud decrece más abruptamente que en un sitio topográficamente abierto y homogéneo (Nekola y White, 1999; Soininen, McDonald y Hillebrand, 2007). También depende de la capacidad de dispersión de las especies, pues la relación similitud-distancia ocurre aun si el ambiente es totalmente homogéneo, debido a las diferencias en la vagilidad de las especies (Calderón-Patrón, Moreno y Zuria, 2012).
Existen estudios que indican que con un amplio número de taxones animales y vegetales la riqueza de especies decrece progresivamente en función de la altitud (Ruggiero, 2001). En Acahuizotla, la combinación de factores como las condiciones microclimáticas a diferentes gradientes altitudinales y la degradación del hábitat pueden influir en la disimilitud de morfoespecies entre los sitios de recolecta.
De acuerdo con las pruebas de Mantel no existe una relación entre la distancia geográfica y la altitud con la disimilitud en la composición de especies. Es probable que las diferencias en el esfuerzo de muestreo y los métodos de colecta empleados en cada sitio influyan en nuestros resultados. También es posible que la escala espacial en la que se realizó este trabajo sea tan pequeña que no se percibe la influencia de estos factores, por lo que sería importante realizar estudios en distintas escalas espaciales, que permitan dilucidar los patrones de diversidad de coleópteros y los procesos asociados a estos.
Es importante destacar que Deloya, Madora y Covarrubias (2013) sugieren que la estructura del paisaje de Acahuizotla ha sido modificada drásticamente, lo que afecta las poblaciones de insectos. En su estudio, los autores notaron una disminución del 9.52% de la riqueza de especies de Scarabaeidae y Trogidae comparado con los resultados del estudio de Delgado-Castillo (1989) implementado 3 décadas atrás en Acahuizotla. Este tipo de cambios en la estructura del paisaje también se vieron reflejados en los sitios de recolecta de nuestro estudio, lo que probablemente influyó en la riqueza de morfoespecies obtenidas.
Finalmente, este tipo de estudios son importantes no solo por su aporte al inventario de especies de la región, sino también por su contribución a la comprensión de los patrones de diversidad de insectos y de los procesos asociados a estos. Y por supuesto, adquieren más relevancia cuando se llevan a cabo en ecosistemas tan amenazados como el BTC.
Por la ayuda prestada en la determinación de los ejemplares de las familias Curculionidae, a Magdalena Ordóñez-Reséndiz; Chrysomelidae, a Sara López-Pérez y Geovanni Rodríguez-Mirón; Elateridae, a Martín Zurita-García; Scarabaeidae y Melolonthidae, a Andrés Ramírez-Ponce y Tenebrionidae, a Paulina Cifuentes-Ruiz y Viridiana Vega-Badillo, por su ayuda en la elaboración del mapa en el programa ArcGIS. Agradecemos al Programa de apoyo a proyectos de investigación e innovacióntecnológica, UNAM (DGAPA-PAPIIT IN228707-3) el apoyo económico para realizar el trabajo de campo.
La revisión por pares es responsabilidad de la Universidad Nacional Autónoma de México.