Este trabajo pretende actualizar la información sobre la biodiversidad de microalgas y protistas del fitoplancton marino en aguas mexicanas. Existe un mayor esfuerzo y literatura disponible para aguas del Pacífico mexicano, mientras que en la porción sur del golfo de México existen pocas obras recientes sobre grupos taxonómicos del fitoplancton. Indudablemente, las diatomeas y los dinoflagelados son los 2 grupos más diversos y dominantes en el fitoplancton marino en México, pero la fracción más pequeña, el picoplancton y ciertos grupos taxonómicos han revelado una diversidad desconocida e inesperada, y una relevancia que se incrementa con estudios modernos. Se siguen anotando nuevos registros en el fitoplancton de aguas mexicanas y se han venido describiendo nuevas especies, sobre todo de diatomeas, dinoflagelados y Parmophyceae. Ciertos grupos deberían ser estudiados con protocolos especializados, ya que son prácticamente desconocidos en México. Se proponen algunas perspectivas de estudio del fitoplancton marino en México para el futuro.
This paper attempts to provide an updated revision of the biodiversity of the microalgae and protists of the marine phytoplankton in Mexican waters. A higher effort has been given to studies from the Mexican Pacific, considering the available literature, whereas the southern Gulf of Mexico counts with few recent investigations on phytoplanktonic taxonomic groups. Diatoms and dinoflagellates are, with no doubt, the most diverse and dominant phytoplankton groups in Mexico, but the smallest fraction, the picoplankton, and certain groups have revealed an unknown and unexpected diversity, and an increasing importance noticed from recent studies. New records in the marine phytoplankton have been annotated and new species have been described, particularly diatoms, dinoflagellates and Parmophyceae. Certain groups, however, should be systematically studied following specialized protocols, as they are virtually unknown in Mexico. Some future perspectives for the phytoplankton study in Mexico are proposed.
En los últimos años, en los que ha existido un creciente deterioro del medio ambiente en todo el mundo, principalmente por actividades humanas, el conocimiento de la biodiversidad de las comunidades marinas de microorganismos ha adquirido una gran importancia. Una comunidad singular por su naturaleza y papel funcional en el ecosistema pelágico es el fitoplancton marino, constituido por especies de linajes algales y protistas, muy diversas en tallas y formas.
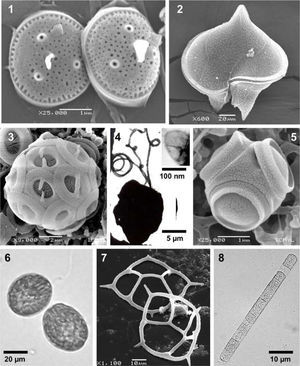
La importancia del fitoplancton marino ha sido enfatizada en diversas obras en todo el mundo, ya que es responsable de más de 45% de la producción primaria neta del planeta (Falkowsky et al., 2004; Simon et al., 2009). Además se puede mencionar el papel de casi cada grupo de microalgas y protistas fitoplanctónicos en los grandes temas de actualidad que preocupan a la sociedad humana y que tienen que ver con el agua (recursos acuáticos, contaminación, indicadores de la calidad), la biodiversidad (conocimiento, mantenimiento, uso, valor, amenaza) y el cambio climático (especies invasoras, incremento de especies productoras de toxinas, acidificación de los océanos) (Hallegraeff, 2010; Fioroni et al., 2011).
Casi cada clase taxonómica de algas y protistas está representado en el fitoplancton marino, ya sea desde organismos procariotas (Cyanobacteria), organismos eucariotas del gran clado llamado Chromalveolata, considerando Stramenopiles (Heterokontas y parientes), Cryptophyta, Haptophyta y Dinoflagellata, hasta grupos taxonómicos de algas verdes (Chlorophyta, con sus clases Chlorophyceae y Prasinophyceae, y Euglenophyta) (Simon et al., 2009). La categoría de talla en el fitoplancton marino ha adquirido gran relevancia, ya que muchos estudios recientes han mostrado las diferentes contribuciones a la biomasa y productividad de ciertas fracciones, como microplancton (mayores de 20µm), nanoplancton (entre 2 y 20µm) y picoplancton (menores de 2 µ), y han descubierto una diversidad inesperada, sobre todo en los organismos de tallas más pequeñas (picoplancton), utilizando herramientas moleculares (Guillou et al., 2004; Pedrós-Alió, 2006; Vaulot et al., 2008).
Algunos autores han mencionado que las diatomeas (Bacillariophyta), los dinoflagelados (Dinoflagellata), las Haptophyta y las algas verdes (Chlorophyta) podrían contar aproximadamente por el 40, 40, 10 y 6% de las especies de eucariotas presentes en el fitoplancton marino actual, mientras que la suma de otros grupos contribuiría un 2% (Simon et al., 2009), aunque existe información adicional indicando una mayor diversidad de diatomeas en el fitoplancton marino, con cerca de 5 000 especies (Katz et al., 2004).
A pesar de los múltiples y diferentes enfoques sobre el concepto de especie en microalgas y protistas que constituyen el fitoplancton marino, y que usualmente incluyen el concepto morfológico (e.g. basado en características morfológicas), el concepto filogenético (e.g. basado en caracteres moleculares) y el concepto biológico de especie (e.g. basado en aspectos de reproducción sexual, hibridación y descendencia fértil, que en organismos fitoplanctontes son muy difíciles de identificar) (Amato et al., 2007; Simon et al., 2009), en este trabajo se utilizará fundamentalmente el concepto de morfoespecie, que es al más cotidiano y ampliamente usado. Existe una clara dominancia de las fases vegetativas sobre estadios sexuales en especies de fitoplancton (von Dassow y Montresor, 2011). Sin embargo, el término y concepto de especies crípticas (e.g. especies con características morfológicas idénticas o muy similares, pero con caracteres moleculares distintos), se considera en esta revisión (Lundholm et al., 2003; Sarno et al., 2005; Smayda, 2011).
En 1993 apareció un primer acercamiento a la biodiversidad del fitoplancton marino en México (Hernández-Becerril, 1993), que continuó 10 años más tarde, con un recuento de los grupos taxonómicos y sus especies presentes en aguas mexicanas (Hernández-Becerril, 2003). A lo largo de esos últimos 10 años, se han incrementado notablemente los trabajos en México y todo el mundo que han contribuido al conocimiento sobre la biodiversidad del fitoplancton marino, o de sus grupos taxonómicos (e.g. Alonso-Rodríguez et al., 2009; Hoppenrath et al., 2009; Esqueda-Lara y Hernández-Becerril, 2010; Kraberg et al., 2010). Este trabajo pretende actualizar la información y conocer el estado-del-arte de la biodiversidad de esta importante comunidad en aguas marinas mexicanas.
DiversidadDentro del fitoplancton marino, algunos cálculos indican un número entre 3 444 y 4 375 especies reconocidas (Sournia et al., 1991), de entre 3 365 y 4 024 especies (Sournia, 1995) y cerca de 5 000 especies (Tett y Barton, 1995; Simon et al., 2009). En México, un número estimado de taxones (especies, formas y variedades) se aproxima a 1 488, incluidos en 211 géneros, que representa 33-42% del total calculado para todo el mundo (Hernández-Becerril, 2003), aunque hay que considerar las investigaciones más recientes (ver abajo).
A continuación, se describen de manera muy general las características morfológicas de los distintos grupos taxonómicos que componen el fitoplancton marino y de los cuales existe información reciente en aguas mexicanas.
CyanobacteriaSon organismos procariotas ancestrales, fotosintéticos y relativamente sencillos, cuyas formas en el fitoplancton marino pueden ser filamentosas en cadena (tricomas), cadenas de células cocoides o células esféricas, y pertenecen al microplancton o al picoplancton, debido a sus diferentes tallas. Algunas de sus especies son los organismos más abundantes en el planeta y contribuyen de manera importante a la productividad planctónica marina y a los ciclos de carbono y nitrógeno, mientras que otras especies están asociadas de manera simbiótica con organismos eucariotes, y otras producen toxinas de interés en la salud humana y la fauna marina (Hawser et al., 1992). Se han considerado pocos géneros de Cyanobacteria en el fitoplancton marino actual (Pearl, 2000), y entre 7-10 especies, aunque se sigue debatiendo la existencia de “razas” fisiológicas de ciertas especies picoplanctónicas (Ahlgren y Rocap, 2006).
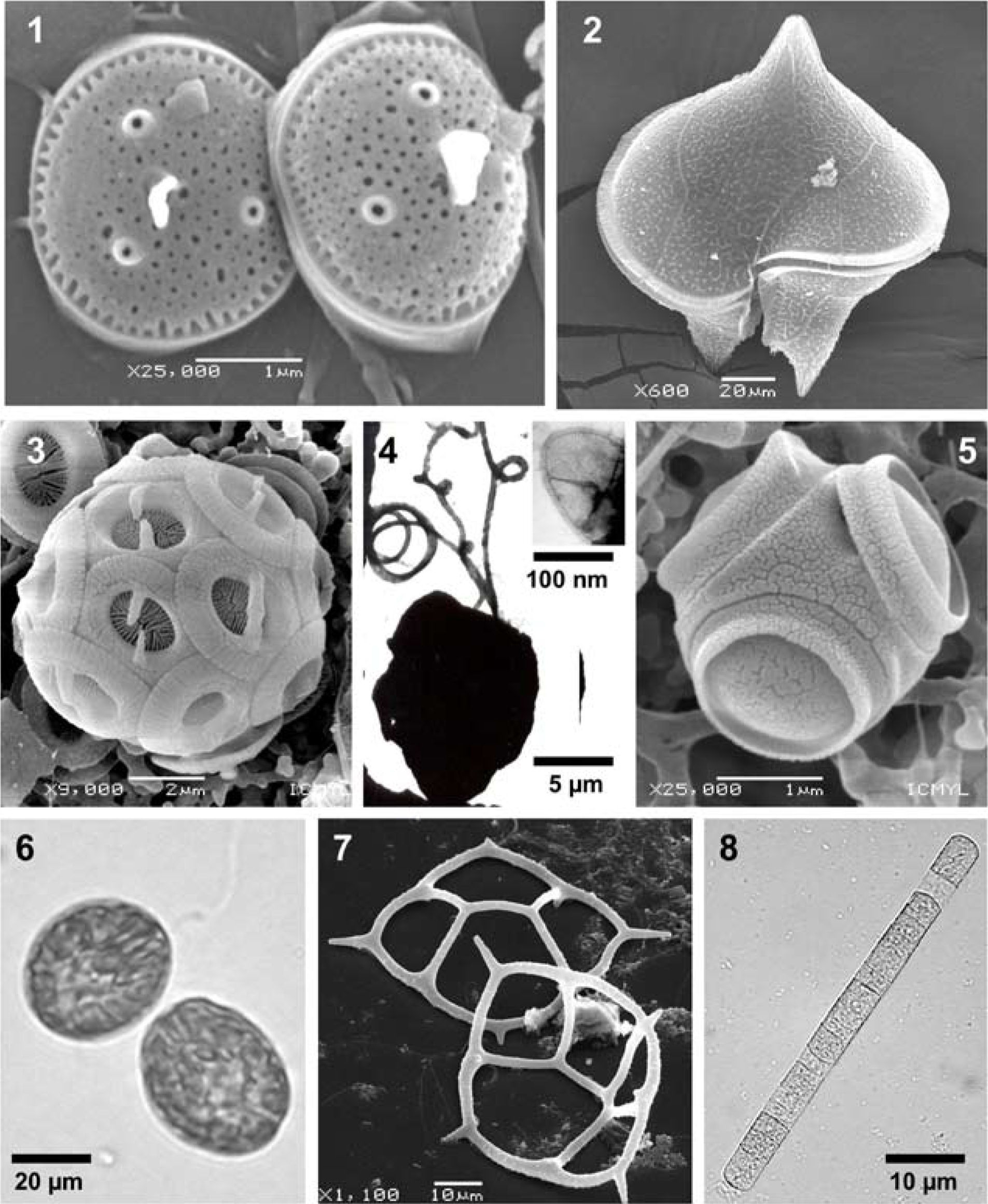
En aguas mexicanas de ambos litorales se han reconocido especies de los géneros Prochlorococcus y Synechococcus, tanto por observaciones directas en microscopio, como por el uso de ciertos equipos (citometría de flujo, HPLC) (Hernández-Becerril et al., 2012a) o de herramientas moleculares, así como las especies Richelia intracellularis y 3-4 especies del género Trichodesmium (Hernández-Becerril, 2003; Aldeco et al., 2009) (Fig. 8). Chlorophyta. Prasinophyceae. Este grupo está compuesto de microalgas verdes ancestrales, fotosintéticas, unicelulares, con una gran variedad de formas (desde cocoides, ovoides, hasta en forma de corazón), y tallas (pertenecientes al nano o picoplancton), con o sin flagelos y en general con escamas orgánicas externas muy ornamentadas. Se han reconocido unas 103-136 especies en el fitoplancton marino (Sournia, 1995). La especie Ostreococcus tauri, perteneciente a este grupo, es el organismo eucariota más pequeño del mundo (Chrétiennot-Dinet et al., 1995).
Especies de varios grupos taxonómicos de fitoplancton marino. Microscopía de luz (ML), microscopía electrónica de barrido (MEB) y microscopía electrónica de transmisión (MET). 1, Minidiscus comicus, una diatomea, MEB. 2, Protoperidinium depressum, un dinoflagelado, MEB. 3, Gephyrocapsa oceanica, un cocolitofórido, MEB. 4, Chrysochromulina sp., una Haptophyta, con una escama orgánica externa (recuadro), MET. 5, Tetraparma insecta, Parmophyceae, MEB. 6, Fibrocapsa japonica, una Raphydophyceae, ML. 7, Dictyocha californica, un silicoflagelado, MEB. 8, Trichodesmium thiebautii, una Cyanobacteria, ML.
En el Pacífico mexicano podemos contar las siguientes especies: Micromonas pusilla, Nephroselmis olivacea, Pyramimonas orientalis, P. cordata y Resultor mikron (López Tachiquín, 2002), mientras que hay evidencia de poblaciones importantes de Micromonas pusilla en el sur del Golfo de México (Hernández-Becerril et al., 2012a). Faltan muchos estudios detallados de este grupo en México, sobre todo de especies de Pyramimonas y de Prasinophyceae picoplanctónicos (Guillou et al., 2004).
EuglenophytaLas formas planctónicas marinas de este grupo son flageladas, fusiformes, fotosintéticas o heterótrofas. Presentan una película externa que les confiere plasticidad y uno o 2 flagelos que se insertan en la faringe, en la porción anterior. Aunque no son muy comunes ni abundantes, suelen ser indicadoras de contaminación costera. Los registros actuales indican la presencia de 36-37 especies en el fitoplancton marino (Sournia, 1995).
Varios estudios no publicados, sobre todo en aguas del Pacífico mexicano, dan cuenta de la ocurrencia de especies de los géneros Euglena, Eutreptia y Eutreptiella. Es claro que hacen falta investigaciones sistematizadas sobre este grupo, para conocer no sólo su biodiversidad, sino su distribución y papel funcional.
HeterokontophytaChrysophyceae. Comprende un grupo relativamente pequeño de microalgas Heterokontas unicelulares, de formas cocoides, con o sin flagelos y usualmente móviles, tanto fotosintéticas como hetrótrofas. Están presentes en ambientes continentales y marinos, aunque hay pocas especies en el plancton marino (96-126 especies, Sournia, 1995), entre ellas algunas formas picoplanctónicas (Vaulot et al., 2008; Simon et al., 2009).
Hay pocos registros confiables de especies de este grupo, pero se ha documentado la presencia de Meringosphaera mediterranea en el Pacífico mexicano (López Tachiquín, 2002). Algunos estudios sin publicar, en otras regiones del mundo, muestran la presencia de especies heterótrofas de este grupo, que podrían ocurrir también en aguas mexicanas, por lo que es necesario estudiar este grupo.
DictyochophyceaeEste grupo comprende especies Heterokontas unicelulares, incluyendo silicoflagelados y sus parientes, que son casi exclusivamente planctónicos y marinos, en sus formas fotosintéticas y heterótrofas. Los silicoflagelados se distinguen por tener un exoesqueleto silíceo que contiene al protoplasma y un solo flagelo. Se conocen un gran número de especies extintas de silicoflagelados y se debate cuántas especies vivientes podrían existir en los mares mundiales, que varían de 1-3 (Moestrup, 1995; Kristiansen y Preisig, 2001) hasta 8 taxa (Throndsen, 1997; Hernández-Becerril y Bravo-Sierra, 2001). Florenciella parvula es una especie descrita recientemente, de talla nanoplanctónica (Eikrem et al., 2004), mientras que Pseudochattonella verruculosa y Pseudochattonella farcimen son 2 especies de Dyctyochophyceae recientemente caracterizadas, que forman proliferaciones tóxicas para los peces (Riisberg y Edvardsen, 2008).
En aguas del Pacífico mexicano se pueden contar hasta 7 taxones de silicoflagelados, todos pertenecientes al género Dictyocha (Hernández-Becerril y Bravo-Sierra, 2001; Hernández-Becerril, 2003) (Fig. 7). Otros grupos de Dictyochophyceae deberían ser estudiados con detalle.
EustigmatophyceaeEl grupo contiene pocas especies de microalgas Heterokontas, fotosintéticas, cocoides, sin flagelos aparentes y con un estigma. Sólo se han reconocido 3 especies en el fitoplancton marino (Sournia, 1995). Aparentemente, se han reconocido especies del género Nannochloropsis en aguas mexicanas (Hernández-Becerril, 2003), y hay información no publicada de altas densidades de 1 o 2 especies del género en el Pacífico central mexicano.
ParmophyceaeSon algas Heterokontas, con afinidad a la clase Bolidophyceae y a las diatomeas (Ichinomiya et al., 2010). Existen pocas especies, todas planctónicas marinas de tallas generalmente menores de 5µm, cocoides y sin flagelos aparentes, con una cubierta rígida de sílice, compuesta por un número de placas de varias formas. Se anotan alrededor de 20 taxa (especies y categorías infraespecíficas) (Konno et al., 2007) en aguas de todo el mundo. En el Pacífico mexicano se han registrado 3 taxa: Tetraparma insecta (Fig. 5), Triparma laevis var. mexicana y T. retinervis, de las cuales la primera fue descrita originalmente en aguas marinas mexicanas, el Golfo de Tehuantepec (Bravo-Sierra y Hernández-Becerril, 2003).
RaphidophyceaeSon microalgas Heterokontas flageladas (2 flagelos desiguales insertados en la porción subapical), unicelulares, móviles y delicadas (sin cubierta rígida), con más afinidad al plancton marino. En general son formas fotosintéticas, con algunas especies donde se ha detectado mixotrofía, que pueden producir grandes proliferaciones poblacionales y toxinas que afectan a peces. Se reconocen 11-12 especies del grupo (Sournia, 1995).
En México, particularmente en el Pacífico, se han registrado las especies Chattonella marina, Chattonella cf. ovata, Fibrocapsa japonica (Fig. 6) y Heterosigma akashiwo (Band-Schmidt et al., 2004); recientemente se ha informado de ciertas proliferaciones causadas por ciertas especies y asociadas con mortandad de peces (Cortés-Altamirano et al., 2006).
BacillariophytaLas diatomeas son un grupo taxonómico de eucariotas unicelulares cuya característica más importante es la presencia de una pared silícea que puede tener multitud de variaciones morfológicas y ser muy ornamentada (Minidiscus comicus, una diatomea picoplanctónica, Fig. 1), y que representan el grupo de autótrofos más exitoso en el ambiente pelágico, tanto por su gran diversidad de formas y especies, como por su importante contribución a la productividad global (Kooistra et al., 2007). El número aproximado de especies planctónicas actuales es de 1 300-1 700 (Sournia, 1995), aunque existe un cálculo de unas 5 000 especies (Katz et al., 2004).
Para aguas del Pacífico mexicano se han listado 864 taxones de diatomeas planctónicas marinas, incluyendo muchas formas ticoplanctónicas (Meave et al., 2003), alrededor de 1 000 taxones para el todo el Golfo de México (incluyendo formas bentónicas) (Krayesky et al., 2009), y unos 255 taxones en el sur del Golfo de México, con numerosos nuevos registros (Licea et al., 2011). Recientemente se han descrito especies nuevas de diatomeas planctónicas marinas en aguas del Pacífico mexicano, como Pseudonitzschia roundii, y las ticoplanctónicas Cerataulus simsae y Fryxelliella pacifica (Hernández-Becerril y Díaz-Almeida, 2006; Hernández-Becerril y Barón-Campis, 2008; Hernández-Becerril et al., 2012b). Existen nuevos registros, al menos en el Pacífico mexicano, incluyendo 4 especies del género Nitzschia, 3 del género Pseudonitzschia (Hernández-Becerril y Díaz-Almeyda, 2006; Quijano-Scheggia et al., 2011), y las especies Rhizosolenia decipiens, Rhizosolenia fallax y Thalassiosira delicatula (Hernández-Becerril et al., 2009, 2010a), entre otras.
Los estudios de biodiversidad recomendados para las diatomeas planctónicas marinas incluyen la descripción de nuevas especies, los complejos de especies crípticas (e.g. Pseudonitzschia, Skeletonema, etc.) y la filogenia y biogeografía de las asociaciones y comunidades actuales. Cryptophyta. Microalgas unicelulares, móviles, ovoides y asimétricas, que son generalmente fotosintéticas (solo 2 géneros son heterótrofos). Tienen 2 flagelos similares, insertados en la porción apical o subapical, un periplasto externo, estructuras que descargan (eyectosomas), y un nucleomorfo (e.g. núcleo vestigial) interno. Las especies en el fitoplancton marino varían entre 57-73 (Sournia, 1995), aunque también se ha mencionado la cifra de 100 especies actuales (Cerino y Zingone, 2007). Hay información sin publicar que indica la presencia de especies de los géneros: Hemiselmis y Rhodomonas (Hernández-Becerril, 2003). Son urgentes los trabajos sobre las especies de este grupo taxonómico, que podría adquirir gran importancia ecológica en amplias zonas oceánicas.
HaptophytaEs un grupo de microalgas flageladas con una estructura adicional parecida a un tercer flagelo, el haptonema, que presentan escamas orgánicas o mineralizadas (carbonato de calcio o sílice) y son muy comunes y diversas en el fitoplancton marino de todo el mundo, particularmente los cocolitofóridos. Casi todas las especies son fotosintéticas, pero hay formas mixótrofas. El número de especies totales se calcula en 350 (Adl et al., 2007), mientras que en el fitoplancton marino se han listado 244-303 especies (Sournia, 1995), de las cuales se pueden considerar unas 280 especies de cocolitofóridos actuales (Young et al., 2003).
Se han podido listar unos 58 taxones de cocolitofóridos en el Pacífico mexicano y Golfo de México (Hernández-Becerril et al., 2001, 2008a) (Gephyrocapsa oceanica, Fig. 3), además se han registrado la ocurrencia de Phaeocystis pouchetii (López Tachiquín, 2002) y especies de Chrysochromulina (Fig. 4). Se sugieren estudios complementarios de cocolitofóridos, utilizando posibilidades de cultivo, así como de las especies con escamas orgánicas y silíceas (e.g. Chrysochromulina, Hyalolithus, etc.), y las potencialmente tóxicas y nocivas (e.g. Prymnesium, Phaeocystis, etc.)
ChlorarachniophytaEste pequeño grupo taxonómico está constituido por microalgas exclusivamente marinas, unicelulares, generalmente fotosintéticas, ameboides, cocoides o flageladas, con cloroplastos rodeados de 4 membranas, clorofilas a y b, y la presencia de un nucleomorfo. Se han reconocido solamente 1-2 especies en el fitoplancton marino actual (Sournia, 1995; Simon et al., 2009), aunque se han citado 5 géneros y 9 especies (Ishida et al., 2007), y se han venido describiendo nuevos géneros y especies en los últimos años (Ota et al., 2007a, 2009). La única especie reconocida para aguas mexicanas (Baja California Sur) es Norrisiella sphaerica (Ota et al., 2007b). De lo anterior, se anota la carencia de trabajos sobre este grupo y la urgencia de incrementar su conocimiento en el plazo inmediato.
DinoflagellataLos dinoflagelados son protistas alveolados (Alveolata) unicelulares que pueden formar cadenas, cenocitos o filamentos, en general poseen 2 flagelos de forma y función diferente, y pueden ser formas fotosintéticas, mixótrofas, heterótrofas o parásitas (Protoperidinium depressum, Fig. 2). Algunas especies planctónicas marinas producen altas proliferaciones poblacionales y/o toxinas que causan padecimientos a la fauna marina y a los humanos. Es el grupo taxonómico más diverso y que contribuye más a la biomasa y productividad planctónica, después de las diatomeas. La diversidad de especies actuales en el plancton marino varía de 1 514-1 880 (Sournia, 1995), 1 555 (Gómez, 2005), hasta cerca de 2 000 especies (Adl et al., 2007; Taylor et al., 2008).
Recientemente se han publicado una lista de dinoflagelados del orden Dinophysales en aguas marinas mexicanas, que incluye 90 taxones (Hernández-Becerril et al., 2003), estudios del género Protoperidinium tanto en el Pacífico mexicano como en el sur del Golfo de México, que indica 101 taxones y 46 especies estudiadas de ese género en esas zonas, respectivamente (Okolodkov, 2005, 2008), así como un trabajo elaborado en el Pacífico mexicano que ha listado 605 taxones (especies y taxones infraespecíficos), dentro de 91 géneros de dinoflagelados principalmente planctónicos marinos (Okolodkov y Gárate-Lizárraga, 2006). En la porción mexicana del Golfo de México se han registrado 252 especies de dinoflagelados (Licea et al., 2004), mientras que para todo el Golfo de México se han encontrado 644 taxones de dinoflagelados (casi todos planctónicos) (Steidinger et al., 2009). Se han descrito algunas nuevas especies de dinoflagelados planctónicos marinos en el Pacífico mexicano, como Amphisolenia fusiformis, Amphisolenia michoacana, Ceratium balechii, Dinophysis siankanensis (Almazán-Becerril y Hernández-Becerril, 2002; Meave et al., 2003; Hernández-Becerril et al., 2008b). También se han anotado varios nuevos registros en el Pacífico mexicano (Hernández-Becerril y Bravo-Sierra, 2004a, 2004b; Okolodkov y Gárate Lizárraga, 2006; Gárate-Lizárraga y Verdugo-Díaz, 2007; Gárate-Lizárraga, 2008, 2009; Hernández-Becerril et al., 2010b; Gárate-Lizárraga et al., 2011) y el sur del Golfo de México (Parra-Toriz et al., 2012), incluyendo especies raras o interesantes como Ceratium dens, Dinofurcula ultima, Heterocapsa pygmaea y Phalacroma turbineum, la primera considerada tradicionalmente de distribución exclusivamente Indo-Pacífica, mientras que la segunda y última fueron detectadas después de casi 100 años de su descripción original. Asimismo, Esqueda-Lara y Hernández-Becerril (2010) elaboraron una flora de dinoflagelados del Pacífico central mexicano y documentaron la presencia de 2 nuevos registros. Sin embargo, a pesar de los esfuerzos para estudiar la biodiversidad de los dinoflagelados planctónicos marinos, se deberían seguir estudiando intensamente ciertos grupos, particularmente dinoflagelados de tecas delicadas o delgadas (“thin-walled”), dinoflagelados desnudos y especies del orden Dinophysales, que requieren análisis morfológicos y filogenéticos.
Otros grupos taxonómicosExisten varios grupos taxonómicos presentes en el fitoplancton marino de todo el mundo, pero no reconocidos actualmente en México, como: Rhodophyceae, representado por 6 especies (Sournia, 1995); Bolidophyceae, clase taxonómica constituida por formas picoplanctónicas, con un sólo género (Bolidomonas) y 2 especies (Guillou et al., 1999); Pelagophyceae, que contiene algunas especies picoplanctónicas de amplia distribución y creciente importancia, como Aureococcus anophagefferens, Aureoumbra lagunensis, Pelagococcus subviridis y Pelagomonas calceolata (Andersen et al., 1993); Pinguiophyceae, de reciente descripción, incluyendo 5 géneros y 5 especies variables en tallas y formas, con alto contenido en ácidos grasos y omega3 (Kawachi et al., 2002); y Tribophyceae, grupo que cuenta con unas 9-13 especies (Sournia, 1995). El estudio sistemático de varios de estos grupos implica observaciones en vivo, establecimiento de cultivos, uso de técnicas y protocolos particulares y de equipos especializados, y empleo de métodos de biología molecular.
PerspectivasDe la información y datos aportados, resulta evidente que los grupos más diversos y mejor conocidos en el fitoplancton marino de México son las diatomeas y los dinoflagelados, y que recientemente se comienzan a estudiar ciertos otros grupos de flagelados o picoplanctónicos, destacando los cocolitofóridos (Haptophyta). Esto indudablemente que nos remite a la proporción anotada anteriormente sobre los porcentajes de especies reconocidas pertenecientes a los diferentes grupos taxonómicos propuestos por algunos autores (e.g. Simon et al., 2009). Si el número de aproximadamente 1 488 taxones reconocidos en aguas mexicanas (que representan 33-42% del total de especies calculado para el fitoplancton en todo el mundo) es confiable (Hernández-Becerril, 2003), deberemos añadir tanto los nuevos registros como las nuevas especies descritas en los últimos años, algunos de los cuales han sido referidos aquí en este trabajo.
Los estudios de ciclos e historias de vida adquieren cada día más importancia, ya que en muchos casos nos ayudan a entender la ecología e historia natural de las especies. Las poblaciones de una especie particular de fitoplancton en muestras naturales pueden contener células en diferentes fases de vida, con fuerte diferenciación en fisiología y diferentes papeles funcionales, aún cuando sean idénticas genéticamente (von Dassow y Montresor, 2011). Con el desarrollo y empleo cada vez más cotidiano de cultivos de microalgas y protistas planctónicos, existe un respaldo suficiente para estudios de morfología, fisiología, genética, filogenia molecular y ciclos de vida (desarrollo de estadios sexuales, producción de auxosporas, esporas, quistes) (e.g. Hernández-Becerril et al., 2010b). En estos tiempos es muy recomendable contar con colecciones de cultivos, así como de colecciones de muestras preservadas.
Diversas herramientas moleculares se vienen usando regularmente y con mayor intensidad para el reconocimiento de especies, sobre todo las pertenecientes a complejos de especies incluyendo especies crípticas o de tallas muy pequeñas (picoplancton), lo que implica la consideración del concepto de especie filogenético (e.g. Marin y Melkonian, 2010; Medlin y Schmidt, 2010; Smayda, 2011). Sin embargo, no se debe soslayar la importancia de estudiar la variación morfológica y posibles límites, en términos morfológicos, de las especies.
Recientemente se han identificado especies y grupos de especies indicadores de cambio climático global (Tunin-Ley et al., 2009) o como invasoras debido a este cambio o a las actividades humanas (e.g. eutrofización cultural, comercio marítimo - aguas de lastre de barcos-, entre otras). Ya es evidente que hay variaciones importantes del medioambiente causadas por el cambio climático, y que amenaza seriamente la biodiversidad de las comunidades de microorganismos (Boyce et al., 2010).
Para considerar la presencia de especies de fitoplancton invasivas o invasoras debemos contar con registros históricos y confiables, y cuando a menudo no se cuenta con la información histórica (e.g. períodos prolongados, generalmente mayores de 50 años) se puede recurrir al estudio de estructuras de perennación (quistes, esporas, células de latencia) producidas por algunos grupos de organismos y usualmente provenientes de los sedimentos en lechos marinos (muestras geológicas).
Se pueden anotar algunos requisitos o condiciones para continuar el estudio de la biodiversidad del fitoplancton marino, como los siguientes: 1, capacitar, entrenar y contar con personal especializado en taxonomía de especies de fitoplancton marino y en procedimientos de biología molecular (Karlson et al., 2010); 2, establecer y desarrollar trabajo de investigación colaborativo, tanto multidisciplinario como multiinstitucional; 3, utilizar nuevos conceptos, métodos y protocolos en el estudio de las microalgas planctónicas; y 4, producir bases de datos confiables y accesibles y el desarrollo de código de barras para el reconocimiento de las especies. En cuanto al tema de fitoplancton tóxico y nocivo, hay mucho que decir, pero por ahora es conveniente remitir a los lectores a las revisiones recientes que dan cuenta de la situación actual (Hernández-Becerril et al., 2007; Cortés-Altamirano y Sierra-Beltrán, 2008).
Se agradece el apoyo parcial por parte del Proyecto No. IN226209-3, financiado por PAPIIT, DGAPA, UNAM, y a Yolanda Hornelas Orozco (ICMyL, UNAM), por su asistencia en el uso del MEB.