Los poliquetos son uno de los grupos más importantes en el bentos desde cualquier punto de vista. Con el presente estudio se tiene el propósito de caracterizar la riqueza específica de la fauna de poliquetos de la costa occidental de Baja California, desde la boca de bahía Magdalena hasta punta Colonet, a través de recolectas realizadas por el crucero oceanográfico SIMSUP VIII. Se comparó latitudinal y batimétricamente el número de familias y especies encontradas en el estudio; asimismo, se realizó un análisis ecológico utilizando los índices de diversidad alfa, diversidad de Shannon-Wiener, dominancia de Simpson y equitatividad de Pielou. Se revisó un total de 60estaciones; 30 de estas fueron positivas, las cuales resultaron en 3,709organismos agrupados en 11órdenes, 27familias, 62géneros y 99especies. La familia Spionidae presenta la mayor riqueza con 4géneros y 12especies (12.2% de la diversidad global y 42.7% de la abundancia relativa) para un total de 1,583 ejemplares. Paraprionospio pinnata fue la especie más abundante, frecuente y dominante (24.2% del total de ejemplares). Del total de muestras, el 53.8% pertenecen a la zona centro, 26.9% a la sur y 19.2% a la norte. Se encontró la mayor riqueza (85.9%) y abundancia (62.8%) en la zona centro.
Polychaetes are one of the most important groups of the benthos from any point of view. The present study aims to characterize the species richness of polychaete fauna of the West Coast of Baja California, from the mouth of Magdalena Bay to Punta Colonet. Collections were made by the Oceanographic Cruise SIMSUP VIII. We compared the number of families and species collected both bathymetricaly and latitudinally, we also performed a diversity analysis using several indexes such as alpha diversity, Pielou evenness, Simpson dominance and specific dominance. A total of 60stations were revised, 30 of these were positive, finding 3,709specimens grouped in 11orders, 27families, 62genera and 99species. Spionidae has the highest richness with 4genera and 12species (12.2% of global diversity and 42.7% of the relative abundance) for a total of 1,583 specimens. Paraprionospio pinnata was the most abundant, frequent and dominant species (24.2% of all specimens). Of the total sample, 53.8% belong to the central zone, 26.9% to the southern one and 19.2% to the northern one. The highest richness (85.9%) and abundance (62.8%) correspond to the central zone.
Los fondos blandos son considerados el hábitat bentónico más extenso sobre la plataforma continental, pendientes y cuencas marinas. Estos se encuentran constituidos por sedimentos arenosos y fangosos, los cuales difieren en el tamaño de grano, proporcionando así hábitats distintos para diferentes especies de organismos (Schiff, Allen, Zeng y Bay, 2000). El tipo de sedimento, incluyendo el tamaño de grano, porosidad, contenido orgánico y productos orgánicos que estos pudieron haber absorbido, se encuentra estrechamente relacionado con la distribución de los organismos que constituyen las comunidades. Los anélidos poliquetos son considerados un grupo dominante en dichas comunidades debido a su diversidad, abundancia y funcionalidad ecológica, lo que les permite una alta adaptabilidad a los diferentes hábitats (Díaz-Castañeda y Harris, 2004). Asimismo, los poliquetos forman parte de los grupos pioneros en las áreas en donde existe alguna perturbación ambiental de cualquier tipo (Díaz-Castañeda y Almeda-Jauregui, 1999; Heilskov y Holmer, 2001). Estos organismos son una parte esencial en las cadenas alimenticias, sirviendo, además, como importantes indicadores de las condiciones del medio ambiente (Díaz-Castañeda, de León y Solana, 2005) e intervienen directamente en el proceso de sedimentación, proporcionando un enlace entre la meiofauna y la macrofauna, permitiendo así el buen funcionamiento del medio (Cacabelos, Moreira y Troncoso, 2006). Considerando la importancia de los poliquetos en la estructura de los ecosistemas acuáticos, se han realizado diversos estudios en la plataforma continental de la costa occidental de la península de Baja California (De León-González, 1988, 1990, 1992, 1994a,b, 1998; Fauchald, 1968, 1970, 1972, 1982a,b; Hartman, 1939a,b, 1940, 1941, 1944a,b,c, 1950, 1956, 1957 y Hartman, 1961; Salazar-Vallejo, 1987; asimismo de De León-González, Hernández-Guevara y Rodríguez-Valencia, 2006; De León-González y Díaz-Castañeda, 1998; De León-González y Rodríguez-Valencia, 1996; De León-González y Solís-Weiss, 1998, 2000, 2001; Díaz-Castañeda, de León-González y Solana-Arellano, 2014; Díaz-Castañeda y de León-González, 2007; Díaz-Castañeda y Harris, 2004; Díaz-Castañeda y San Martín, 2001; Díaz-Castañeda et al., 2005). En el presente estudio se determina la composición taxonómica de la fauna de poliquetos, los cambios espaciales a lo largo de la plataforma continental de la zona de estudio, así como las variaciones espaciales de la densidad y las afinidades faunísticas entre las localidades de muestreo, evaluando la diversidad alfa y determinando sus variaciones geográficas.
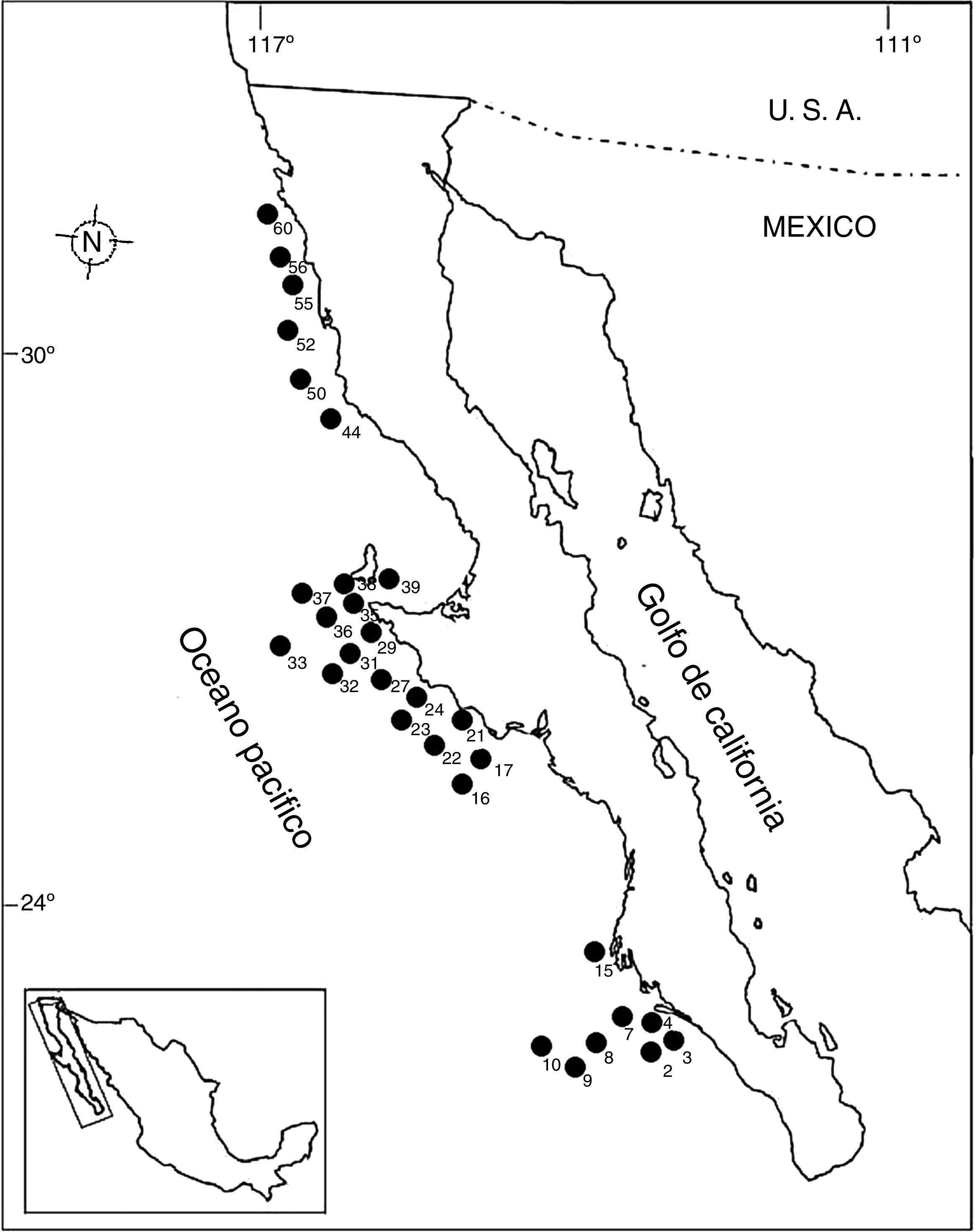
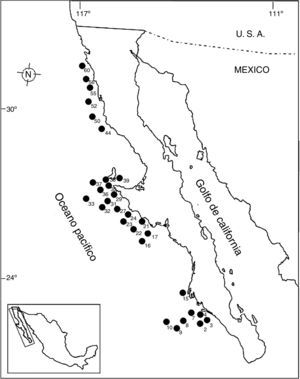
Materiales y métodosEn octubre de 1995, dentro del marco del proyecto SIMSUP VIII «Sistemas Marinos de Surgencias y su relación con Pelágicos menores» realizado en la costa occidental de la península de Baja California a bordo del buque oceanográfico «El Puma», fueron recolectadas muestras de fondos blandos en 60estaciones por medio de una draga Smith-McIntyre (0.1m2). Las estaciones se dividieron en zona norte: desde punta Colonet hasta punta San Antonio; zona centro: desde punta Eugenia hasta San Hipólito, y zona sur: en la boca de bahía Magdalena (fig. 1). En la tabla 1 se muestran las coordenadas de las 30estaciones positivas referentes en este trabajo. Cada transecto se dividió batimétricamente en 4intervalos de profundidad: de 0-49m, de 50-99m, de 100-149m y de 150-200m, tal como ha sido sugerido por Hernández-Alcántara (2002); McConnaughey (1978) y Ross (1977). La cuantificación de organismos recolectados se llevó a cabo por especie y su registro en las tablas respectivas se presenta en términos de densidad (orgs/0.1m2), que es el área de muestreo de la draga Smith-McIntyre utilizada en la toma de muestras. La representación y análisis de la distribución espacial de la densidad y el número de especies se realizó por medio de mapas de distribución. Para esto, se incluyeron diversos índices y tratamientos estadísticos tales como: diversidad alfa, equitatividad de Pielou y dominancia de Simpson. Con la finalidad de analizar las variaciones norte-sur de la fauna de poliquetos y comparar las diferencias en la composición de especies a lo largo del margen peninsular, se evaluó la diversidad Beta (Gray, 2000). La utilización de la diversidad Beta en la costa occidental de la península de Baja California permitió detectar cambios bióticos en sentido norte-sur, por medio del índice propuesto por Wilson y Shmida (1984). Para seleccionar adecuadamente las especies representativas de una comunidad se determinaron las especies dominantes tanto en las localidades de muestreo como en las diferentes regiones geográficas mediante la dominancia específica.
Estaciones y posición geográfica establecidas dentro del margen del muestreo.
| Zona | Estación | Latitud N | Longitud O |
|---|---|---|---|
| 2 | 23°57′00.00″ | 111°49′00.01″ | |
| 3 | 24°10′00.01″ | 111°40′00.01″ | |
| 4 | 24°16′59.99″ | 111°54′00.00″ | |
| Sur | 7 | 24°25′59.99″ | 112°06′18.00″ |
| 8 | 24°15′00.00″ | 112°13′30.00″ | |
| 9 | 24°04′00.01″ | 112°22′00.01″ | |
| 10 | 24°10′59.99″ | 112°33′18.00″ | |
| 15 | 24°48′00.00″ | 112°25′00.01″ | |
| 16 | 26°16′00.01″ | 114°05′17.99″ | |
| 17 | 26°28′18.01″ | 113°55′00.01″ | |
| 21 | 26°52′00.01″ | 113°55′00.01″ | |
| 22 | 26°38′17.99″ | 114°02′17.99″ | |
| 23 | 26°40′59.99″ | 114°25′00.01″ | |
| 24 | 26°51′00.00″ | 114°28′59.99″ | |
| 27 | 27°01′00.01″ | 114°43′00.01″ | |
| Centro | 29 | 27°27′00.00″ | 114°43′00.01″ |
| 31 | 27°00′00.00″ | 115°07′00.01″ | |
| 32 | 27°12′00.00″ | 115°17′26.99″ | |
| 33 | 27°34′41.28″ | 115°43′33.39″ | |
| 35 | 27°49′18.01″ | 115°09′00.00″ | |
| 36 | 27°37′00.01″ | 115°19′59.99″ | |
| 37 | 27°49′18.01″ | 115°30′00.00″ | |
| 38 | 28°00′00.00″ | 115°19′59.99″ | |
| 39 | 28°00′00.00″ | 115°03′00.00″ | |
| 44 | 29°46′00.01″ | 115°12′01.80″ | |
| 50 | 29°55′00.01″ | 116°10′59.99″ | |
| 52 | 30°19′59.99″ | 116°06′00.00″ | |
| Norte | 55 | 30°32′17.99″ | 116°10′59.99″ |
| 56 | 30°46′59.99″ | 116°16′18.01″ | |
| 60 | 31°16′00.01″ | 116°31′00.01″ |
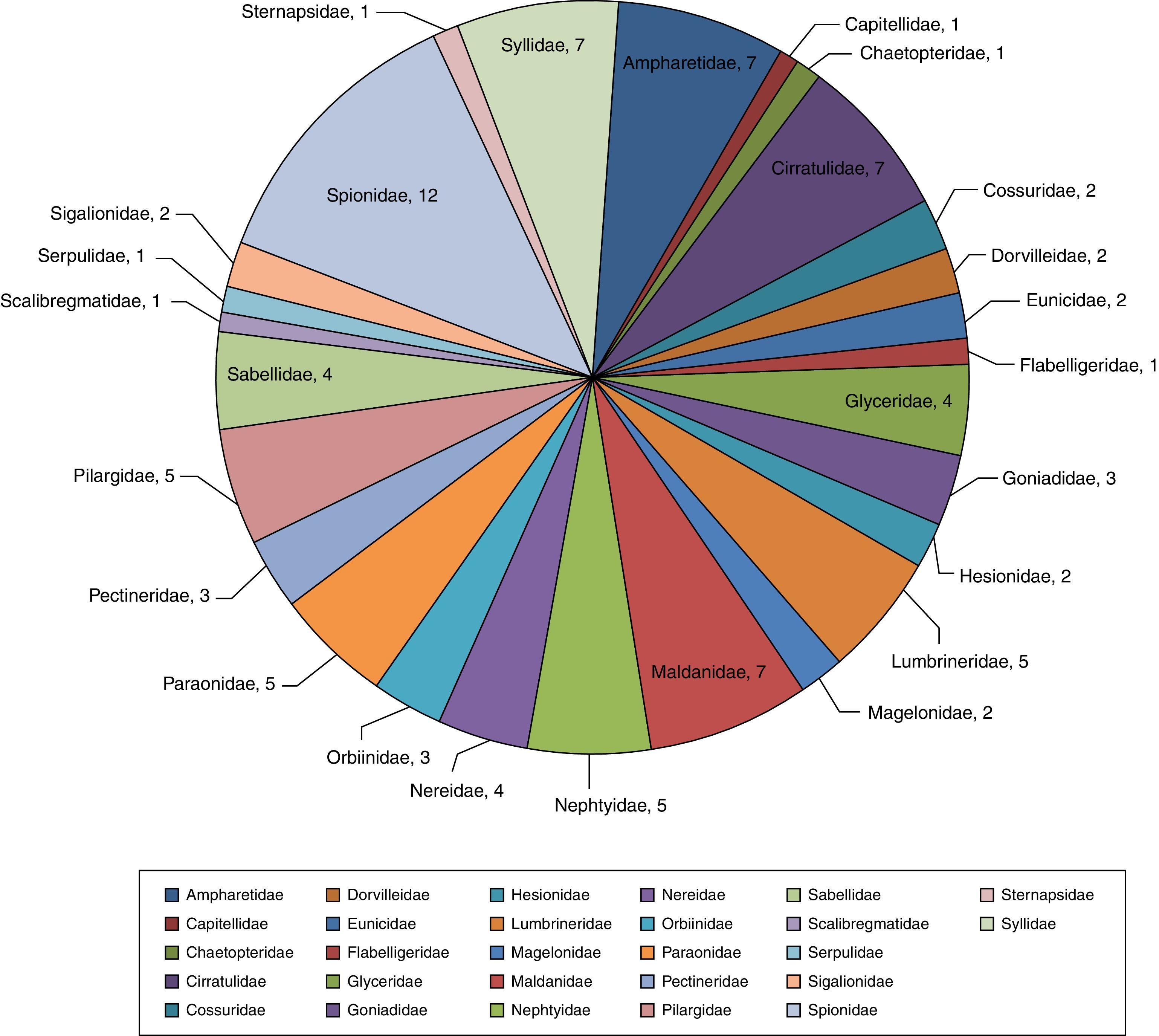
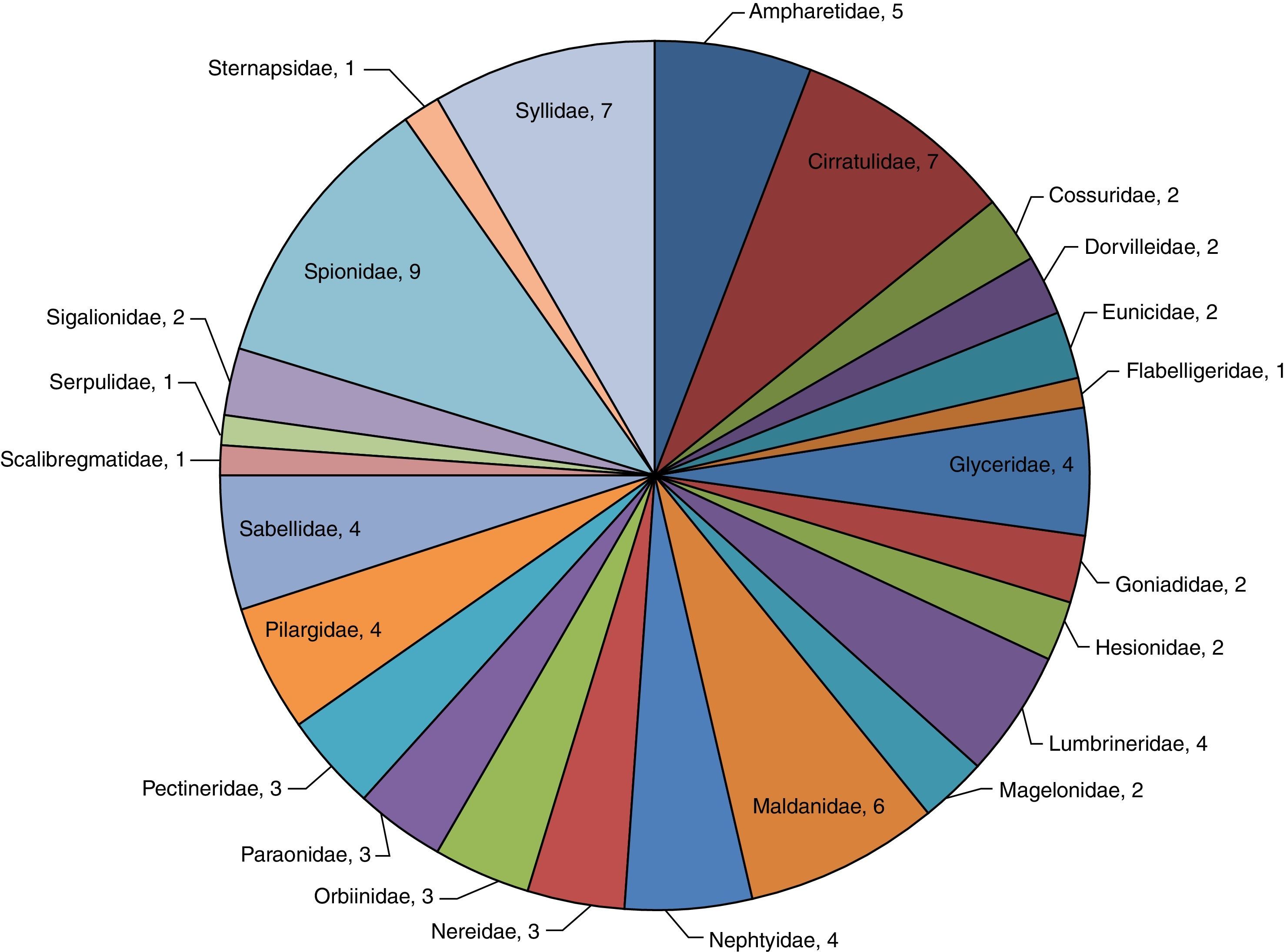
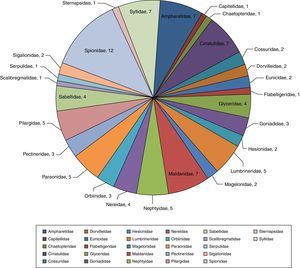
Se examinaron un total de 3,709organismos incluidos en 62géneros y 99especies (Anexo 1). La familia Spionidae presentó la mayor riqueza, constituida por 12especies y 4géneros: Minuspio cirrifera, Minuspio perkinsi, Paraprionospio alata, Paraprionospio pinnata, Prionospio cristata, Prionospio dubia, Prionospio jubata, Prionospio malmgreni, Prionospio vermillionensis, Spiophanes bombyx, Spiophanes kroeyeri y Spiophanes wigleyi, las mismas que componen el 12.2% de la diversidad global y el 42.7% de la abundancia relativa (1,583organismos). Las familias Syllidae (Exogone dispar, Opisthosyllis brunnea, Opisthosyllis japonica, Syllis caeca, Syllis gracilis, Trypanosyllis aeolis y Trypanosyllis zebra), Ampharetidae (Amphicteis scaphobranchiata, Eclysippe trilobata, Lysippe labiata, Melinna oculata, Melinna tentaculata, Melinnampharete gracilis y Paralysippe annectens), Cirratulidae (Aphelochaeta monilaris, Aphelochaeta parvus, Caulleriella gracilis, Chaetozone corona, Chaetozone setosa, Monticellina serratiseta y Monticellina tesselata) y Maldanidae (Clymenella complanata, Clymenella mucosa, Clymenura gracilis, Maldane sarsi, Praxillella gracilis, Praxillella pacifica y Rhodine bitorquata) agrupan el 28.2% del total de especies y 24.0% de abundancia —889organismos— (fig. 2). Las familias que mostraron la menor diversidad específica fueron Capitellidae (Capitella sp.), Chaetopteridae (Spiochaetopterus costarum), Flabelligeridae (Pherusa neopapillata), Scalibregmatidae (Scalibregma inflatum), Serpulidae (Hydroides gracilis), Sternapsidae (Sternaspis fossor), todas con una sola especie, englobando el 7.7% (287) de abundancia del total de individuos.
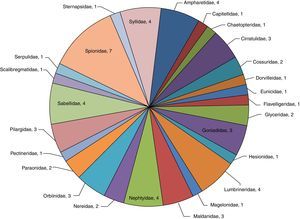
Análisis de la riqueza específica en la zona surDe las muestras obtenidas en esta zona se identificaron 788organismos (21.2%), representando 26familias y 61especies (61.6%), donde 7 de estas corresponden a Spionidae (M. cirrifera, M. perkinsi, P. alata, P. pinnata, P. malmgreni, S. bombyx y S. kroeyeri), constituyendo el 11.5% de la diversidad específica y el 35.9% de abundancia relativa —283organismos— de la zona, mientras que Syllidae (E. dispar, S. caeca, S. gracilis y T. aeolis), Ampharetidae (E. trilobata, M. tentaculata, M. gracilis y P. annectens), Lumbrineridae (Lumbrinereis crassidentata, Lumbrinereis erecta, Lumbrinereis latreilli y Ninoe longibranchiata) y Sabellidae (Euchone incolor, Megalomma pigmentum, Paradialychone ecaudata y Pseudopotamilla reniformis) equivalen al 26.2% de la riqueza en la zona y 17.9% de abundancia relativa —141organismos—. Asimismo, Cirratulidae (A. parvus, C. setosa y M. tesselata), Goniadidae (Glycinde polygnatha, Goniada brunnea y Goniada maculata), Maldanidae (M. sarsi, P. gracilis y P. pacifica), Orbiinidae (Leitoscoloplos kerguelensis, Leitoscoloplos pugettensis y Scoloplos treadwelli) y Pilargidae (Ancistrosyllis jonesi, Sigambra bassi y Sigambra tentaculata) constituyen el 24.6% en el número de especies y 22.7% de abundancia relativa —179organismos—. Sternapsidae (S. fossor), Capitellidae (Capitella sp.), Chaetopteridae (S. costarum), Dorvilleidae (Schistomeringos annulata), Eunicidae (Eunice vittata), Flabelligareidae (P. neopapillata), Hesionidae (Hesione intertexta), Magelonidae (Magelona pacifica), Pectineridae (Amphictene auricoma), Scalibregmatidae (S. inflatum) y Serpulidae (H. gracilis) corresponden al 17.9% de la riqueza específica y 13.1% del número de organismos —103organismos— (fig. 3).
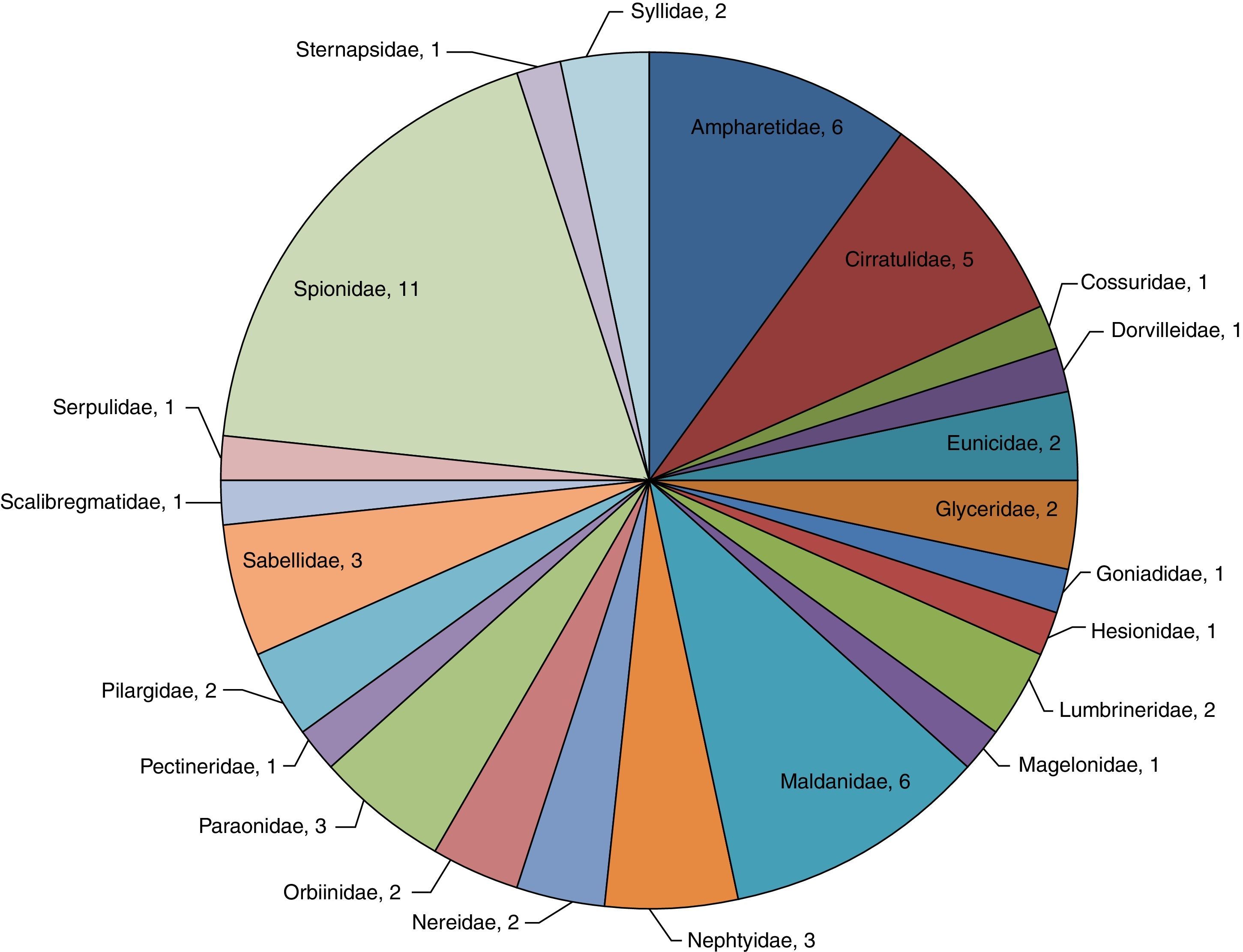
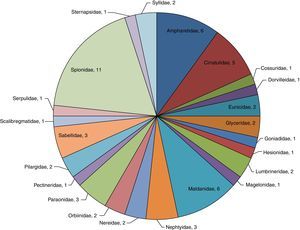
Análisis de la riqueza específica en la zona norteEn la zona norte se identificaron un total de 592organismos (16%) pertenecientes a 23familias y 60especies, donde la familia Spionidae representa el 18.3% de la riqueza específica de la zona (M. cirrifera, P. alata, P. pinnata, P. cristata, P. dubia, P. jubata, P. malmgreni, P. vermillionensis, S. bombyx, S. kroeyeri y S. wigleyi). Ampharetidae (A. scaphobranchiata, E. trilobata, L. labiata, M. oculata, M. gracilis y P. annectens) y Maldanidae (C. complanata, C. mucosa, C. gracilis, M. sarsi, P. pacifica y R. bitorquata), concentran el 20.0% de la riqueza y el 11.3% de la abundancia —67organismos—.La familia Cirratulidae engloba 5especies (A. monilaris, A. parvus, C. gracilis, C. setosa y M. tesselata), significando el 8.3% de la riqueza y el 10.8% de la abundancia —64organismos—. Sternapsidae (S. fossor), Dorvilleidae (S. annulata), Hesionidae (Podarkeopsis glabra), Magelonidae (Magelona suculata), Pectineridae (Pectinaria californiensis), Scalibregmatidae (S. inflatum), Cossuridae (Cossura brunnea), Goniadidae (G. maculata) y Serpulidae (H. gracilis) resultaron con una sola especie presente en esta zona, lo que representa el 14.94% de la riqueza y el 17.1% de la abundancia —101organismos— (fig. 4).
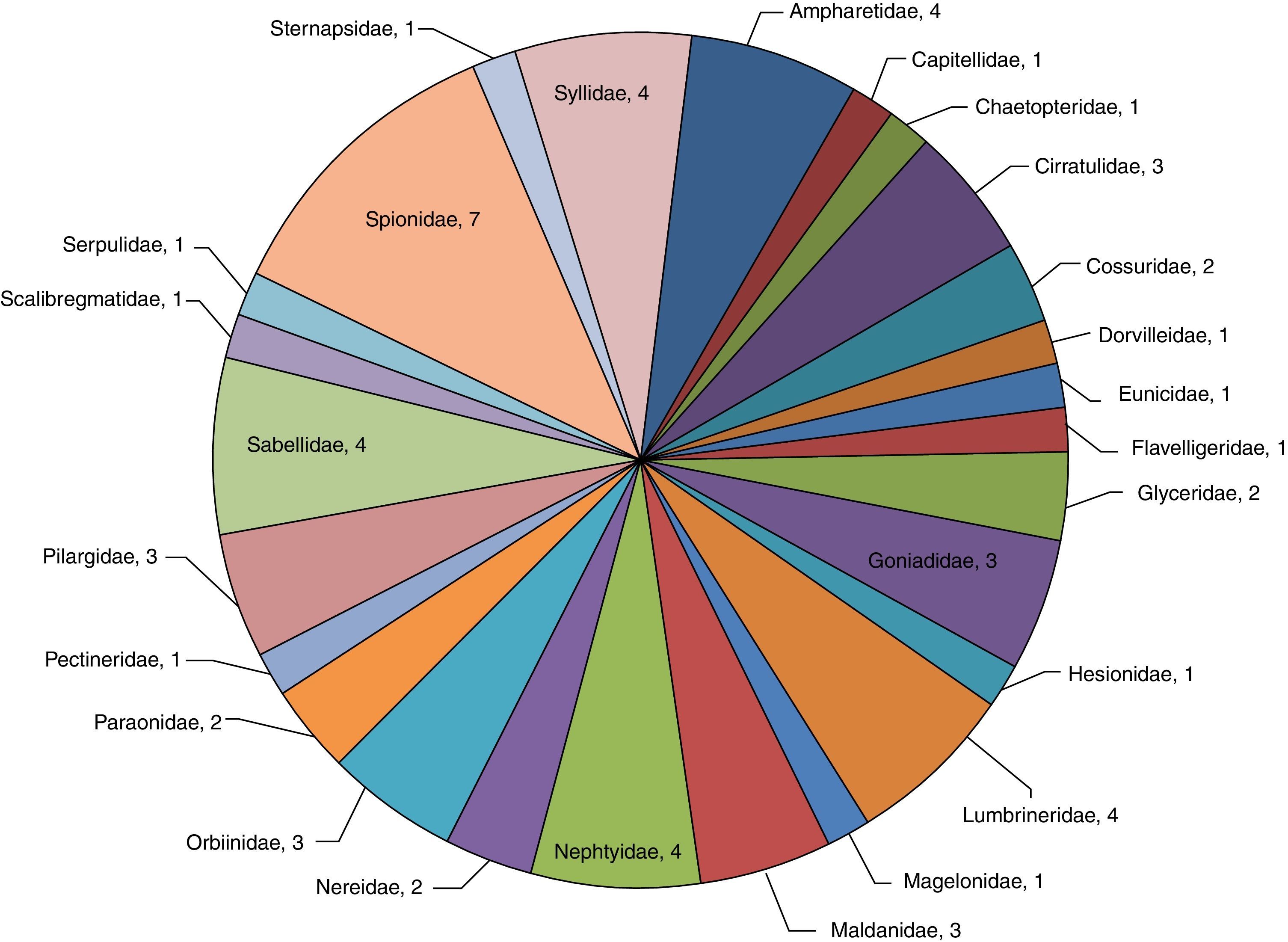
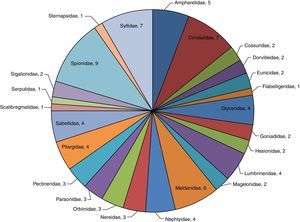
Análisis de la riqueza específica en la zona centroDe esta zona se identificaron un total de 2,329organismos (62.8%) pertenecientes a 25familias y 82especies (82.8%). La familia Spionidae, igual que en las otras zonas, fue la mejor representada con 9 especies (M. cirrifera, M. perkinsi, P. alata, P. pinnata, P. malmgreni, P. vermillionensis, S. bombyx, S. kroeyeri y S. wigleyi) equivalentes al 11.0% de la riqueza total de la zona y el 46.8% de la abundancia —1,089organismos—. Syllidae (E. dispar, O. brunnea, O. japonica, S. caeca, S. gracilis, T. aeolis y T. zebra) y Cirratulidae (A. monilaris, A. parvus, C. gracilis, C. corona, C. setosa, M. serratiseta y M. tesselata) están constituidas por 7especies cada una, ambas equivalentes al 17.1% de la riqueza y 15.2% de la abundancia —354organismos—. Maldanidae con 6especies (C. complanata, C. mucosa, C. gracilis, M. sarsi, P. pacifica y R. bitorquata), lo que representa 7.3% de la riqueza y 7.5% de la abundancia —174organismos—. Las familias Sternapsidae (S. fossor), Flabelligeridae (P. neopapillata), Scalibregmatidae (S. inflatum) y Serpulidae (H. gracilis) resultaron con una sola especie presente en esta zona, lo que representa 4.9% del total de la riqueza y 9.1% de la abundancia —212organismos— (fig. 5).
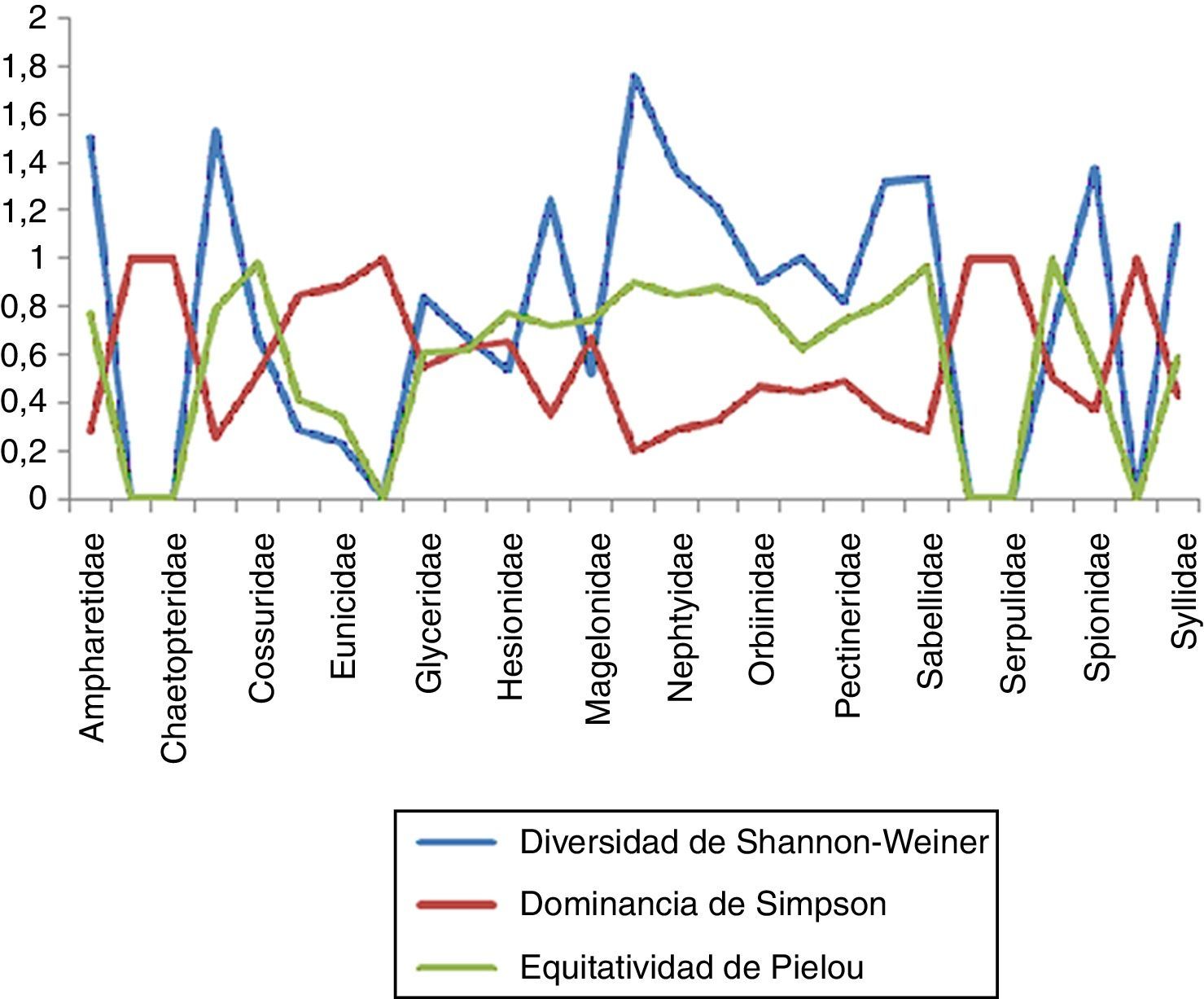
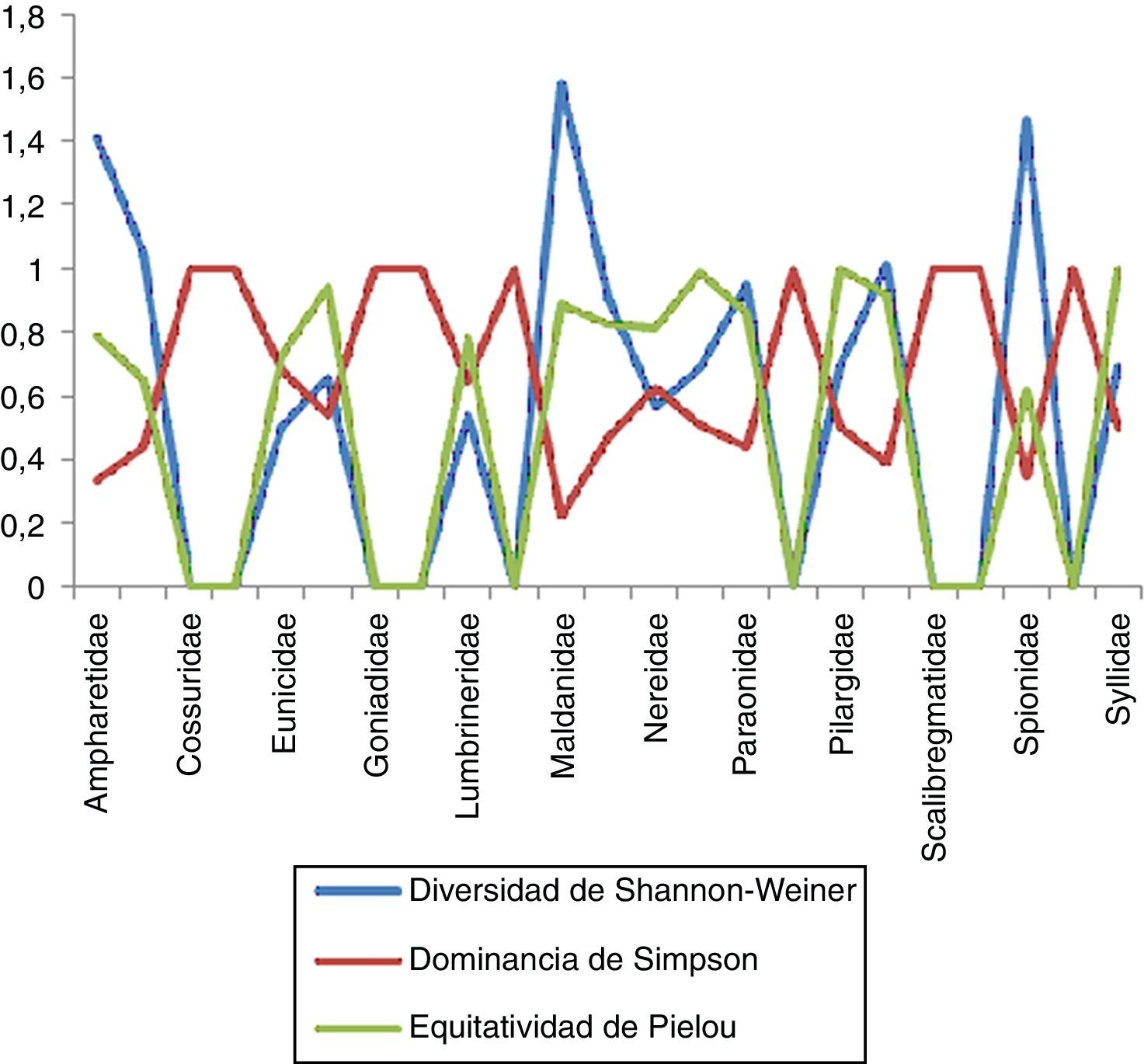
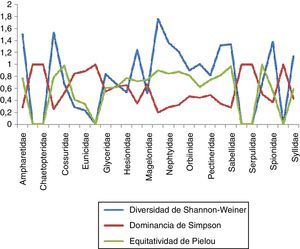
Estimación global de índices con importancia biológica específicaLos resultados indican que la familia Maldanidae presentó la mayor diversidad de Shannon-Wiener con un valor de 1.76, mismo que contrasta con la obtención de un dato bajo de dominancia (0.194) y corroborado por un alto valor de equitatividad correspondiente a 0.9032. Otras familias donde también se observan datos sobresalientes de diversidad y equitatividad son Cirratulidae, Spionidae, Nephtyidae y Sabellidae. De la misma forma, las familias con valores bajos de diversidad y equitatividad, así como una alta dominancia son Dorvilleidae y Eunicidae, tal como se observa en la (fig. 6).
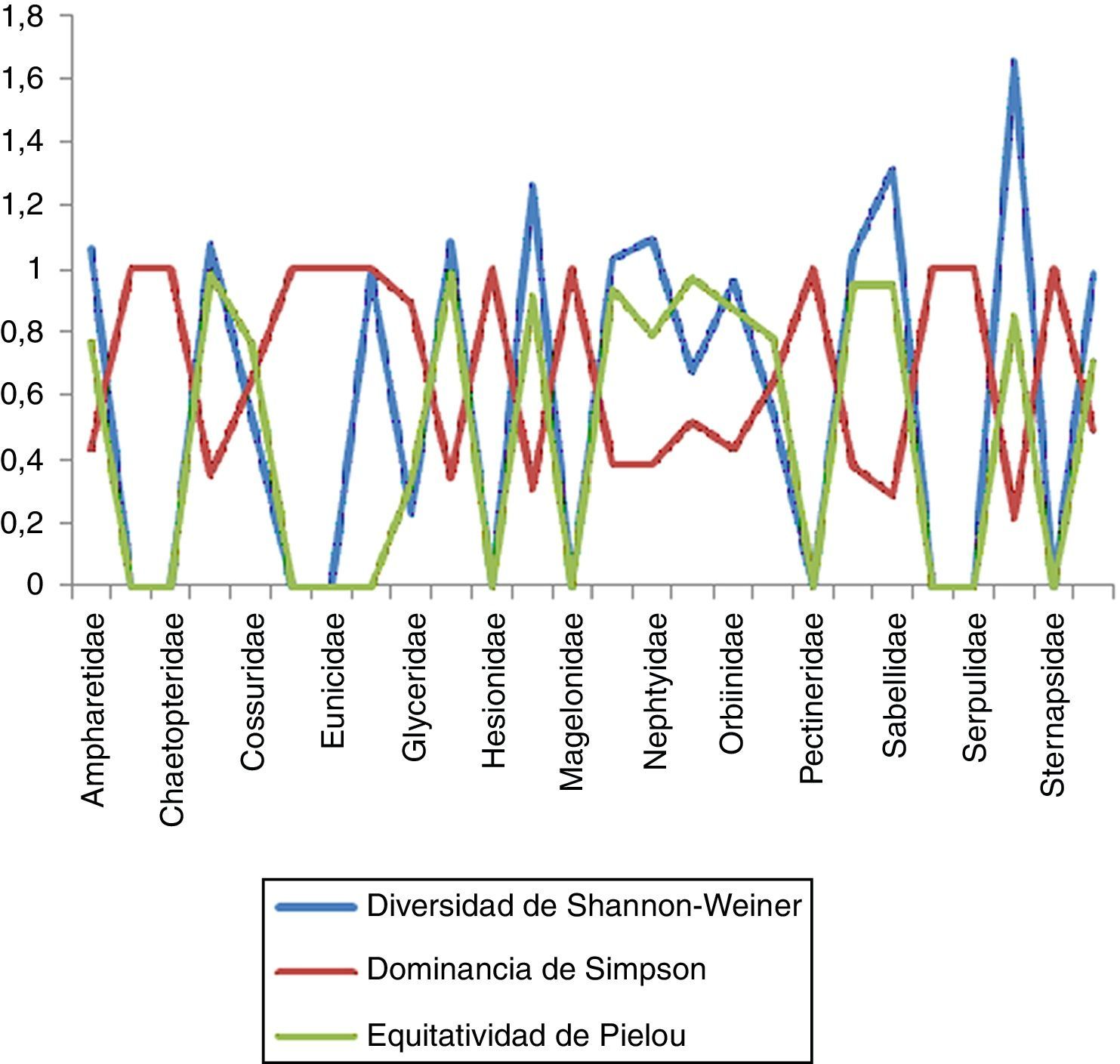
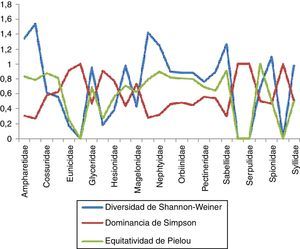
Estimación de índices con importancia biológica en la zona surEn la zona sur se recolectaron un total de 26familias, de las cuales Spionidae resultó la más diversa, con un total de 7 especies, y presentó un valor de 1.652, lo que nos indica una equitatividad elevada (0.849) en las 7estaciones en las que estuvo presente y una dominancia menor (0.214). En el caso de la familia Sabellidae comprendió un total de 4especies en 4estaciones, evidenciando que es la segunda familia con valores de diversidad y equitatividad mayores (1.316 y 0.949, respectivamente) y una dominancia menor (0.286). Dentro de las familias que presentaron la menor diversidad se encuentran Nereididae con 2especies en 3estaciones, con un valor de 0.673 y una equitatividad igualmente baja (0.52); sin embargo, esto nos muestra que existe una alta dominancia entre las especies presentes (0.917). En el caso de Capitellidae, Chaetopteridae, Dorvilleidae, Eunicidae, Hesionidae, Magelonidae, Pectineridae, Scalibregmatidae, Serpulidae y Sternapsidae se obtuvieron niveles tanto de diversidad como de equitatividad iguales a 0 y una dominancia igual a 1, lo que nos indica que solo se cuenta con una sola especie para cada caso (fig. 7).
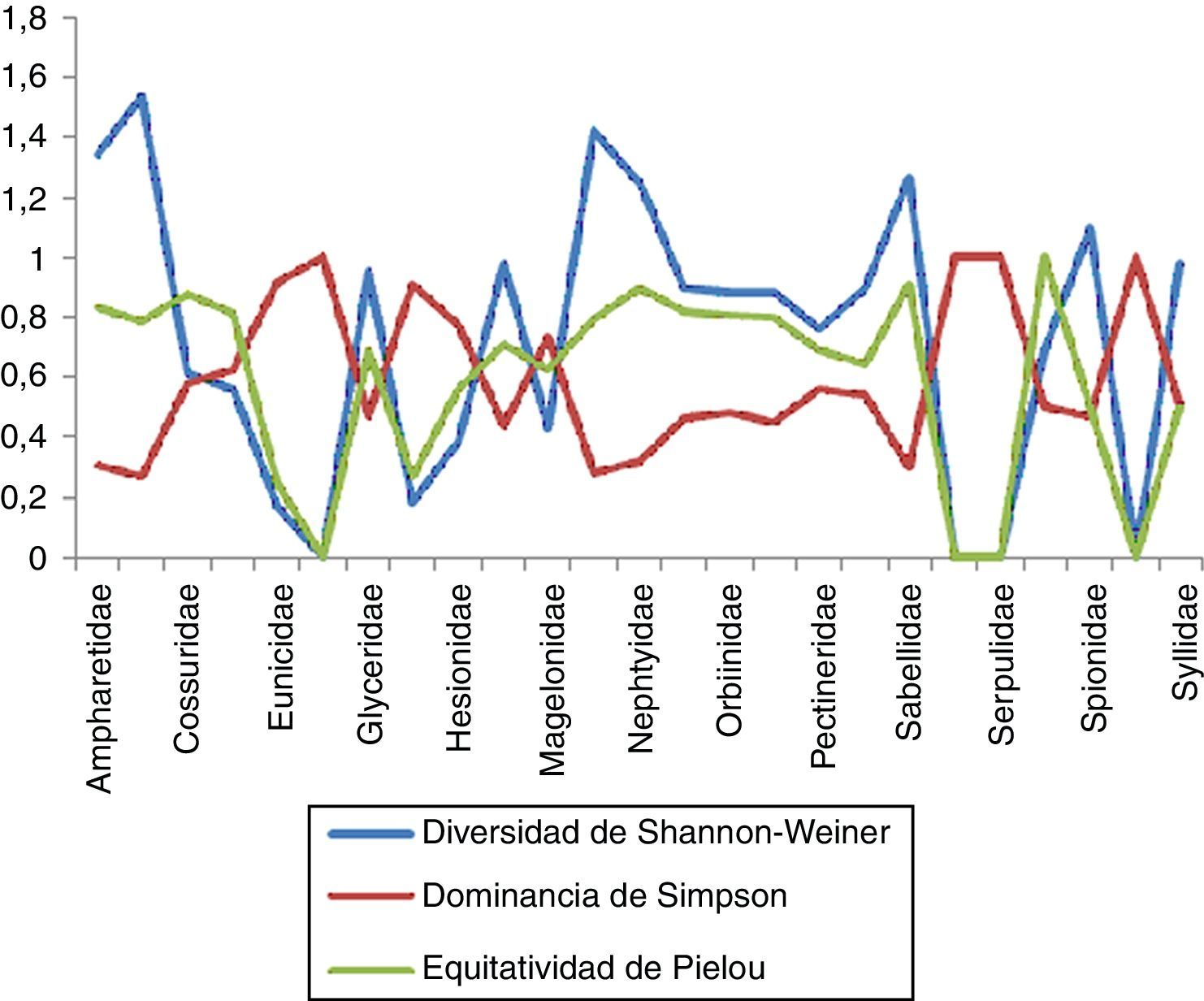
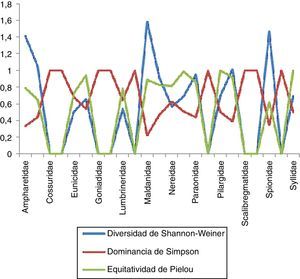
Estimación de índices con importancia biológica en la zona centroEn la zona centro se encontraron un total de 25familias, de las cuales Cirratulidae resultó la más diversa con un valor de 1.537 y un total de 7especies en 9estaciones, lo que nos indica una equitatividad elevada (0.79) y una dominancia menor (0.266). En el caso de Maldanidae presentó un total de 6especies en 8estaciones para esta zona, mostrando que es la segunda familia con valores de diversidad y equitatividad mayores (1.421 y 0.793, respectivamente) y una dominancia menor (0.284). Dentro de las familias que presentaron la menor diversidad se encuentran Eunicidae con 2especies en 5estaciones, con un valor de 1.732 y una equitatividad igualmente baja (0.249); sin embargo, esto nos muestra que existe una alta dominancia entre las especies presentes (0.9201), ya que una de sus 2especies presenta una mayor cantidad de organismos en esta zona (fig. 8). En el caso de Flabelligeridae, Scalibregmatidae, Serpulidae y Sternapsidae se obtuvieron niveles tanto de diversidad como de equitatividad iguales a 0 y una dominancia igual a 1, lo que nos indica que solo se cuenta con una sola especie de organismo para cada caso.
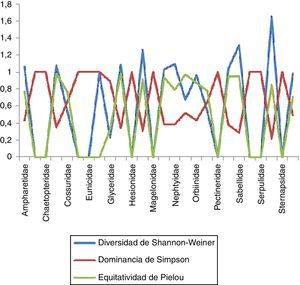
Estimación de índices con importancia biológica en la zona norteEn la zona norte se encontraron un total de 23familias, de las cuales Maldanidae resultó la más diversa con un valor de 1.589 y un total de 6especies en 4estaciones, lo que nos indica una equitatividad elevada (0.886) y una dominancia menor (0.218). En el caso de Spionidae, arrojó un total de 11especies en 5estaciones para esta zona, mostrando que es la segunda familia con valores de diversidad y equitatividad mayores (1.466 y 0.611, respectivamente) y una dominancia menor (0.341), debido a que 3 de estas especies presentan una mayor abundancia con respecto al resto. Dentro de las familias que presentaron la menor diversidad se encuentran Eunicidae con 2especies en 2estaciones, con un valor de 0.500 y una equitatividad alta (0.721); sin embargo, esto nos muestra que existe una alta dominancia entre las especies presentes (0.680). En el caso de Cossuridae, Dorvilleidae, Goniadidae, Hesionidae, Magelonidae, Pectineridae, Scalibregmatidae, Serpulidae y Sternapsidae se obtuvieron niveles tanto de diversidad como de equitatividad iguales a 0 y una dominancia igual a 1, lo que nos indica que solo se cuenta con una sola especie de organismo para cada caso (fig. 9).
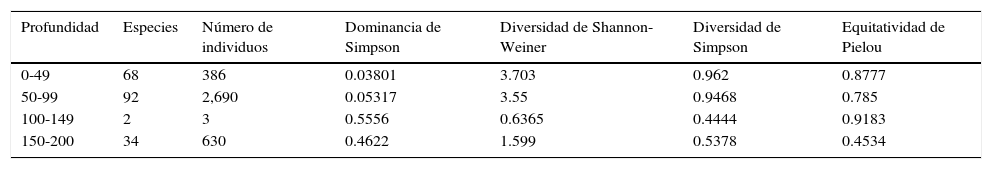
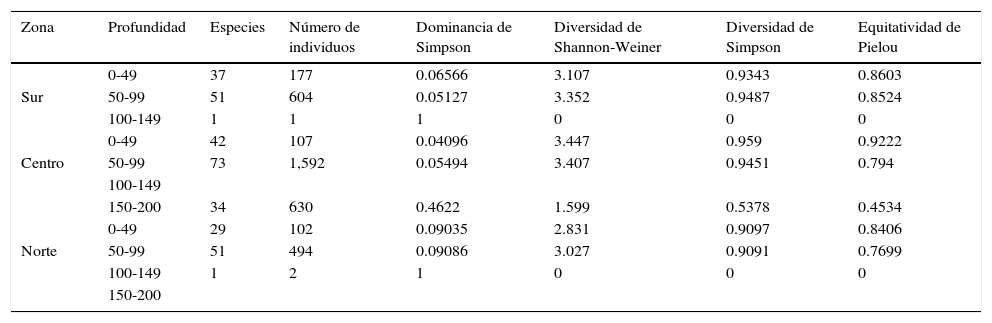
Análisis batimétrico con base en la estimación de índices de importancia biológicaDe las 60estaciones de muestreo durante el crucero SIMSUP VIII, en 30 se obtuvo por lo menos un ejemplar de poliqueto, donde el 53.3% corresponden a la zona centro, el 26.7% a la sur y el 20% a la norte. Asimismo, la mayor riqueza (85.9%) y abundancia (62.8%) fueron producto de recolectas realizadas en la zona centro. Cabe señalar que estas diferencias con respecto a las otras 2 zonas podrían atribuirse a que el 56% de las estaciones muestreadas fueron en esta área. En el estudio realizado por Rodríguez-Valencia (1994), equivalente a la zona centro y comparado con el de Hernández-Guevara (1994), correspondiente a la zona norte, también fue superior en riqueza específica y abundancia, tal como sucedió en el presente estudio (tabla 2). Batimétricamente, el intervalo 50-99m para el área total y para las 3 zonas presentó la mayor riqueza y abundancia específica (tabla 3), así como la mayor diversidad estimada con base en el índice Shannon-Wiener y Simpson.
Análisis batimétrico con base en la estimación de índices de importancia biológica.
| Profundidad | Especies | Número de individuos | Dominancia de Simpson | Diversidad de Shannon-Weiner | Diversidad de Simpson | Equitatividad de Pielou |
|---|---|---|---|---|---|---|
| 0-49 | 68 | 386 | 0.03801 | 3.703 | 0.962 | 0.8777 |
| 50-99 | 92 | 2,690 | 0.05317 | 3.55 | 0.9468 | 0.785 |
| 100-149 | 2 | 3 | 0.5556 | 0.6365 | 0.4444 | 0.9183 |
| 150-200 | 34 | 630 | 0.4622 | 1.599 | 0.5378 | 0.4534 |
Análisis batimétrico por zona con base en la estimación de índices de importancia biológica.
| Zona | Profundidad | Especies | Número de individuos | Dominancia de Simpson | Diversidad de Shannon-Weiner | Diversidad de Simpson | Equitatividad de Pielou |
|---|---|---|---|---|---|---|---|
| 0-49 | 37 | 177 | 0.06566 | 3.107 | 0.9343 | 0.8603 | |
| Sur | 50-99 | 51 | 604 | 0.05127 | 3.352 | 0.9487 | 0.8524 |
| 100-149 | 1 | 1 | 1 | 0 | 0 | 0 | |
| 0-49 | 42 | 107 | 0.04096 | 3.447 | 0.959 | 0.9222 | |
| Centro | 50-99 | 73 | 1,592 | 0.05494 | 3.407 | 0.9451 | 0.794 |
| 100-149 | |||||||
| 150-200 | 34 | 630 | 0.4622 | 1.599 | 0.5378 | 0.4534 | |
| 0-49 | 29 | 102 | 0.09035 | 2.831 | 0.9097 | 0.8406 | |
| Norte | 50-99 | 51 | 494 | 0.09086 | 3.027 | 0.9091 | 0.7699 |
| 100-149 | 1 | 2 | 1 | 0 | 0 | 0 | |
| 150-200 |
La costa occidental de Baja California hasta mediados de 1980 concentraba aproximadamente 236especies de poliquetos (Salazar-Vallejo, de León-González y Salaices-Polanco, 1989). Barbosa-López (2008) llevó a cabo la revisión de las bases de datos de los registros realizados entre 1901 y 2004 en la plataforma continental de la costa occidental de Baja California, registrando un total de 491especies, por lo que el listado elaborado en el presente estudio corresponde al 20.2% de tales especies (Anexo 1). En estudios de ciclos cortos, Rodríguez-Valencia (1994) identificó un total de 20familias en el área correspondiente a bahía de San Juanico, en la costa occidental de Baja California Sur, de las cuales el 85% de ellas son las mismas a las encontradas en el presente trabajo. Asimismo, Hernández-Guevara (1994) identificó 23familias de poliquetos en la bahía Sebastián Vizcaíno, donde el 88% también están presentes en esta investigación. Con el trabajo de De León-González (1994a) se obtuvo un traslape del 85% de las familias documentadas en ambos estudios.
El 64.5% de las especies de poliquetos identificadas en el presente estudio pertenecen a 10familias: Spionidae, Maldanidae, Ampharetidae, Syllidae, Cirratulidae, Nephtyidae, Paraonidae, Pilargiidae, Lumbrineridae y Nereididae, las cuales, en su mayoría, son dominantes en sustratos blandos. Rodríguez-Valencia (1994) obtiene una estimación del 62.2% en las 10familias con mayor riqueza, donde 7 de ellas aparecen en ambos listados, y Hernández-Guevara (1994) obtiene el 67.3% con 5familias muestreadas en ambos trabajos. En la misma área de estudio, Barbosa-López (2008) registra que Spionidae, Paraonidae, Ampharetidae, Cirratulidae, Nereidae y Syllidae contribuyen con el 32.8% de las especies. Hernández-Alcántara (2002), en el golfo de California, también señala dentro de las primeras 10familias con la mayor riqueza y número de organismos a Spionidae, Lumbrineridae, Nereididae, Paraonidae y Cirratulidae, mismas que representan el 27.6% de las especies.
De las 27familias, Capitellidae, Sternapsidae, Serpulidae, Flabelligeridae, Chaetopteridae y Scalibregmatidae estuvieron representadas por una sola especie; sin embargo, Sternapsidae presentó 198organismos y el resto, menos de 20. Comparativamente, otros estudios llevados a cabo por Rodríguez-Valencia (1994) arrojaron un total de 55% de similitud, lo que equivale a 11familias con una sola especie. Hernández-Guevara (1994) mostró una similitud del 60%, lo equivalente a 15familias, las cuales solo presentaron una especie. De León-González (1994a) documenta para el área de punta Eugenia hasta la punta de Cabo Falso una similitud de 39.4% o lo equivalente a 13familias. Hernández-Alcántara (2002) igualmente registra a Sternapsidae, Serpulidae y Chaetopteridae con una sola especie para el golfo de California.
Uno de los resultados preponderantes del análisis de la poliquetofauna fueron los datos sobresalientes de riqueza y abundancia que representa la familia Spionidae, debido a que constituye el 12.2% de las 99especies identificadas y el 42.7% de los 3,709organismos. Información similar fue documentada por De León-González (1994a), contabilizando 10.6 y 37.8% de riqueza y abundancia, respectivamente. Igualmente, Hernández-Guevara (1994) identificó 5especies (10.9%) de 171organismos de esta familia (25.8%). Asimismo, Rodríguez-Valencia (1994) examinó 712ejemplares (66.4%) pertenecientes a 4especies. Cabe destacar que la mayor presencia de esta familia está fundamentada en la diversidad de hábitat que ocupa tanto latitudinal como batimétricamente en la plataforma continental, dominando ampliamente los fondos blandos de aguas someras y profundas, tal como es señalado por Hernández-Valdez (2008).
P. pinnata es la especie más abundante, frecuente y dominante entre las familias de poliquetos obtenidas en este estudio y representa el 24.2% del número total de organismos. En los estudios realizados por De León-González (1994a), Donath-Hernández y Loya-Salinas (1989), Encalada-Fleites y Millán-Núñez (1990) y Rodríguez-Valencia (1994), también se identificó a P. pinnata como la especie más abundante.
Del total de especies identificadas en la zona sur, la familia Spionidae fue la más diversa, así como en el trabajo de De León-González (1994a) que menciona a estos organismos sedimentívoros subsuperficiales como los más abundantes y con mayor riqueza de especies en la plataforma continental de la costa oeste de Baja California, sobre todo en sustratos blandos. La zona centro comprendió un total de 85especies de Spionidae; nuevamente es la mejor representada, seguida por Cirratulidae. Eunicidae en esta área resultó la familia con una menor diversidad de especies. Rodríguez-Valencia (1994) menciona que esta zona presenta una acumulación de materia orgánica formando fondos blandos en su mayor parte, haciéndola homogénea y logrando el enriquecimiento del sustrato, favoreciendo así el desarrollo de un mayor número de especies con hábitos sedentarios, las cuales van desapareciendo en los estratos más profundos. En la zona norte se identificaron un total de 60especies, de las cuales 11 pertenecen a la familia Spionidae; esta presenta la mayor diversidad al igual que en el estudio realizado por Hernández-Guevara (1994) para el área de punta María a punta Eugenia, quien menciona que el indicador de la magnitud en que los sustratos son favorables a una especie o de la adaptación de la especie a ese sustrato es la densidad de organismos por unidad de muestreo.
AgradecimientosEl primer autor agradece al Conacyt el apoyo financiero por medio de una beca doctoral durante el desarrollo de este trabajo. Asimismo, Agradecemos al personal técnico del B/O El Puma por el apoyo en la obtención del material registrado en este trabajo. Agradecemos los comentarios y sugerencias de 2 revisores anónimos que mejoraron el manuscrito.
| Phylum Annelida | |||
| Clase Polychaeta | |||
| Orden Orbiinida | |||
| Familia Orbiinidae Hartman, 1942 | |||
| Leitoscoloplos pugettensis Pettibone, 1957 | |||
| Leitoscoloplos kerguelensis McIntosh, 1885 | |||
| Scoloplos treadwelli Eisig, 1914 | |||
| Familia Paraonidae Cerruti, 1909 | |||
| Aricidea (Aricidea) minima Strelov, 1914 | |||
| Aricidea minuta Southward, 1956 | |||
| Aricidea rubra Hartman, 1963 | |||
| Aricidea simplex Day, 1963 | |||
| Levinsenia gracilis (Tauber, 1879) | |||
| Orden Cossurida | |||
| Familia Cossuridae Day, 1963 | |||
| Cossura brunnea Fauchald, 1972 | |||
| Cossura soyeri Laubier, 1964 | |||
| Orden Spionida | |||
| Superorden Spioniformia | |||
| Familia Spionidae Grube, 1850 | |||
| Minuspio cirrifera (Wirén, 1883) | |||
| Minuspio perkinsi (Maciolek, 1985) | |||
| Paraprionospio alata (Moore, 1923) | |||
| Paraprionospio pinnata (Ehlers, 1901) | |||
| Prionospio cristata Foster, 1971 | |||
| Prionospio dubia Day, 1964 | |||
| Prionospio jubata Blake, 1996 | |||
| Prionospio malmgreni Claparède, 1870 | |||
| Prionospio vermillionensis Fauchald, 1972 | |||
| Spiophanes bombyx (Claparède, 1870) | |||
| Spiophanes kroeyeri Grube, 1860 | |||
| Spiophanes wigleyi Pettibone, 1961 | |||
| Familia Magelonidae Cunningham y Ramage, 1888 | |||
| Magelona pacifica Monro, 1933 | |||
| Magelona sacculata Hartman, 1961 | |||
| Superorden Chaetopteriformia | |||
| Familia Chaetopteridae Audouin y Milne-Edwards, 1833 | |||
| Spiochaetopterus costarum (Claparède, 1869) | |||
| Superorden Cirratuliformia | |||
| Familia Cirratulidae Ryckholt, 1851 | |||
| Aphelochaeta parvus Berkeley, 1929 | |||
| Aphelochaeta monilaris (Hartman, 1960) | |||
| Caulleriella gracilis Hartman, 1969 | |||
| Chaetozone corona Malmgren, 1867 | |||
| Chaetozone setosa Malmgren, 1867 | |||
| Monticellina serratiseta (Banse y Hobson, 1968) | |||
| Monticellina tesselata (Hartman, 1960) | |||
| Orden Capitellida | |||
| Familia Capitellidae Grube, 1862 | |||
| Capitella sp. | |||
| Familia Maldanidae Malmgren, 1867 | |||
| Clymenella complanata Hartman, 1969 | |||
| Clymenella mucosa (Andrews, 1891) | |||
| Clymenura gracilis Hartman, 1969 | |||
| Maldane sarsi Malmgren, 1865 | |||
| Praxillella gracilis (Sars, 1861) | |||
| Praxillella affinis pacifica Berkeley, 1929 | |||
| Rhodine bitorquata Malmgren, 1865 | |||
| Orden Opheliida | |||
| Familia Opheliidae Malmgren, 1867 | |||
| Polyophthalmus pictus (Dujardin, 1839) | |||
| Familia Scalibregmatidae Malmgren, 1867 | |||
| Scalibregma inflatum Rathke, 1843 | |||
| Orden Phyllodocida | |||
| Superorden Aphroditiformia | |||
| Superfamilia Aphroditacea | |||
| Familia Sigalionidae Kinberg, 1856 | |||
| Sthenelanella uniformis Moore, 1910 | |||
| Sigalion spinosus (Hartman, 1939) | |||
| Superorden Nereidiformia | |||
| Familia Hesionidae Grube, 1850 | |||
| Hesione intertexta Grube, 1978 | |||
| Podarkeopsis glabra (Hartman, 1971) | |||
| Familia Pilargidae de Saint-Joseph, 1899 | |||
| Ancistrosyllis jonesi Pettibone, 1966 | |||
| Hermundura ocularis (Emerson y Fauchald, 1971) | |||
| Sigambra bassi (Hartman, 1947) | |||
| Sigambra tentaculata (Treadwell, 1941) | |||
| Sigambra setosa Fauchald, 1972 | |||
| Familia Syllidae Grube, 1850 | |||
| Exogone dispar (Webster, 1879) | |||
| Opisthosyllis brunnea Langerhans, 1879 | |||
| Opisthosyllis japonica Imajima, 1966 | |||
| Syllis caeca (Katzmann, 1973) | |||
| Syllis gracilis Grube, 1840 | |||
| Trypanosyllis zebra (Grube, 1860) | |||
| Trypanosyllis aeolis Langerhans, 1879 | |||
| Familia Nereididae Blainville, 1818 | |||
| Ceratocephale papillata De León-Gonzalez y Góngora-Garza, 1992 | |||
| Neanthes micromma Harper, 1979 | |||
| Nereis pelagica Linnaeus, 1758 | |||
| Rullierinereis fauchaldi De León-Gonzalez y Solís-Weiss, 2000 | |||
| Superorden Glyceriformia | |||
| Familia Glyceridae Grube, 1850 | |||
| Glycera americana Leidy, 1855 | |||
| Glycera capitata Öersted, 1843 | |||
| Glycera oxycephala Ehlers, 1887 | |||
| Glycera tesselata Grube, 1863 | |||
| Familia Goniadidae Kinberg, 1866 | |||
| Glycinde polygnatha Hartman, 1950 | |||
| Goniada brunnea Treadwell, 1906 | |||
| Goniada maculata Öersted, 1843 | |||
| Familia Nephtyidae Grube, 1850 | |||
| Aglaophamus verrilli (McIntosh, 1885) | |||
| Bipalponephtys cornuta (Berkeley y Berkeley, 1945) | |||
| Nephtys caecoides Hartman, 1938 | |||
| Nephtys ferruginea Hartman, 1940 | |||
| Nephtys magellanica Augener, 1912 | |||
| Orden Eunicida | |||
| Superfamilia Eunicea | |||
| Familia Eunicidae Berthold, 1827 | |||
| Eunice americana Hartman, 1944 | |||
| Eunice vittata (Delle Chiaje, 1828) | |||
| Familia Lumbrineridae Schmarda, 1861 | |||
| Lumbrinereis crassidentata Fauchald, 1970 | |||
| Lumbrinereis cruzensis Hartman, 1944 | |||
| Lumbrinereis erecta (Moore, 1904) | |||
| Lumbrinereis latreilli Audouin y Milne-Edwards, 1834 | |||
| Ninoe longibranchiata Fauchald, 1972 | |||
| Familia Dorvilleidae Chamberlin, 1919 | |||
| Protodorvillea kefersteini (McIntosh, 1869) | |||
| Schistomeringos annulata (Moore, 1906) | |||
| Orden Sternapsida | |||
| Familia Sternapsidae Carus, 1863 | |||
| Sternaspis fossor Stimpson, 1854 | |||
| Orden Flabelligeridae | |||
| Familia Flabelligeridae de Saint Joseph, 1894 | |||
| Pherusa neopapilata Hartman, 1961 | |||
| Orden Terebellida | |||
| Familia Pectinariidae de Quatrefages, 1866 | |||
| Pectinaria (Amphictene) auricoma (O.F. Müller, 1776) | |||
| Pectinaria hartmanae (Reish, 1968) | |||
| Pectinaria californiensis Hartman, 1941 | |||
| Familia Ampharetidae Malmgren, 1866 | |||
| Amphicteis scaphobranchiata Moore, 1906 | |||
| Lysippe labiata Malmgren, 1866 | |||
| Eclysippe trilobata (Hartman, 1969) | |||
| Melinna oculata Hartman, 1969 | |||
| Melinna tentaculata Fauchald, 1972 | |||
| Melinnampharete gracilis Hartman, 1969 | |||
| Paralysippe annectens (Moore, 1923) | |||
| Orden Sabellida | |||
| Familia Sabellidae Latreille, 1825 | |||
| Paradialychone ecaudata (Moore, 1903) | |||
| Euchone incolor Hartman, 1965 | |||
| Megalomma pigmentum Reish, 1963 | |||
| Pseudopotamilla reniformis (Müller, 1771) | |||
| Familia Serpulidae Rafinesque, 1815 | |||
| Hydroides gracilis (Bush, 1905) | |||
La revisión por pares es responsabilidad de la Universidad Nacional Autónoma de México.