Se presenta el registro de las diatomeas epilíticas de los ríos Dolores y Laja, localizados en la cuenca alta del río Laja, Guanajuato, México. Las muestras se recolectaron en las temporadas seca-fría (enero) y lluviosa (octubre) del 2011. Se identificaron 173 taxa infragenéricos, de los cuales 7 son nuevos registros para México: Fallacia monoculata, Hantzschia abundans, Navigiolum uruguayense, Neidium bisulcatum, Nitzschia solita, Planothidium incuriatum y Sellaphora bacilloides; cabe mencionar que Navigiolum es nuevo registro a nivel genérico. Además, 3 especies son nuevos registros para el estado de Guanajuato: Gomphonema laticollum, G.subclavatum y Gomphosphenia lingulatiformis. Se encontraron formas teratológicas en 6 especies con abundancias relativas que variaron de 0.8 a 8.3%, siendo estas formas más abundantes en los sitios con mayores concentraciones de nutrientes.
This study investigates the epilithic diatoms from the Dolores and Laja Rivers, located within the Upper Laja River Basin, Guanajuato, Mexico. The samples were collected during the cold-dry (January) and rainy (October) seasons of 2011. One-hundred seventy three infrageneric taxa were identified, 7 of which are new records for Mexico: Fallacia monoculata, Hantzschia abundans, Navigiolum uruguayense, Neidium bisulcatum, Nitzschia solita, Planothidium incuriatum and Sellaphora bacilloides; it is worth mentioning that Navigiolum is a new record at the genus level. Furthermore, 3 species are new records for the state of Guanajuato: Gomphonema laticollum, G.subclavatum and Gomphosphenia lingulatiformis. Teratological forms of 6 species were also found in the sampling sites with higher nutrient concentrations, with relative abundances varying from 0.8 to 8.3%.
Las diatomeas (Bacillariophyta) son organismos unicelulares, eucariontes, autótrofos, que se caracterizan por tener una pared celular de sílice. Su taxonomía está basada principalmente en la estructura y arreglo de los poros de esta cubierta silícea llamada frústulo, formado por 2 valvas. Es el grupo algal más diverso, y se encuentra tanto en ambientes marinos como continentales (Mann, 1999; Round, Crowford y Mann, 1990).
Las diatomeas de ambientes lóticos presentan formas celulares adaptadas al flujo de agua y pueden crecer en un amplio intervalo de valores de pH, temperatura, salinidad, concentración de nutrientes y contaminantes orgánicos e inorgánicos (Bellinger y Sigee, 2010; Stevenson, Pan y van Dam, 2010). Debido a su respuesta a perturbaciones ambientales mediante cambios en la estructura y la dinámica de la comunidad, hay creciente interés en su empleo como bioindicadores, ya que se ha demostrado que son una buena herramienta para determinar el estado trófico y la calidad del agua en ríos (Hering et al., 2006; Kelly et al., 2012; Potapova y Charles, 2007).
Además de cambios a nivel comunitario, cuando se les expone a diversos tipos de estrés ambiental durante la etapa reproductiva puede haber cambios bioquímicos que alteran la forma natural o normal de las células y los patrones de estriado, arreglo del conjunto de poros (Falasco, Bona, Badino, Hoffmann y Ector, 2009a; Morin, Coste y Hamilton, 2008a). A las formas que presentan tales alteraciones se las conoce como teratológicas, las cuales están siendo incorporadas como métrica en valoraciones de calidad del agua (Debenest, Silvestre, Coste, Delmas y Pinelli, 2008; Dziengo-Czaja, Koss y Matuszak, 2008; Falasco et al., 2009a). Las teratologías pueden derivarse de condiciones estresantes crónicas relacionadas con factores físicos y químicos, por ejemplo, debido al contacto entre células por encontrarse en altas densidades, valores por encima de los intervalos de tolerancia en radiación solar y pH, deficiencias en sílice, altas concentraciones de nutrientes como nitrógeno y fósforo, presencia de plaguicidas y metales pesados (Debenest et al., 2008; Falasco et al., 2009a; Morin et al., 2008a).
No obstante la evidencia de la utilidad de las diatomeas como indicadores de cambios ambientales y calidad del agua en ríos (Kelly, 1998; Potapova y Charles, 2002; Smol y Stoermer, 2010), en México aún son pocos los estudios sobre diatomeas de ríos, los cuales se han enfocado en zonas relativamente puntuales de las cuencas de México, Pánuco, Balsas y Papaloapan (Cantoral-Uriza, 1997; Cantoral-Uriza, Carmona-Jiménez y Montejano, 1997; Bojorge-García, 2006; Bojorge-García y Cantoral-Uriza, 2007; Bojorge-García, Carmona y Ramírez, 2014; Ramírez-Vázquez y Cantoral-Uriza, 2003; Ramírez-Vázquez et al., 2001; Tavera, Elster y Marvan, 1994; Valadez-Cruz, Carmona-Jiménez y Cantoral-Uriza, 1996; Vázquez, Aké-Castillo y Favila, 2011). La aseveración anterior es bien ejemplificada por los nuevos registros de diatomeas para el país, documentados recientemente por Abarca-Mejía (2010) y Segura-García (2011) para el río Lerma y algunos de sus tributarios.
Unas de las limitantes en el uso aplicado de las diatomeas en México, y en general para el trópico, es que prácticamente todas las monografías de identificación fueron generadas para Europa, lo que implica aceptar el supuesto de que las diatomeas son cosmopolitas. Identificaciones basadas en la ultraestructura, genética y reproducción han demostrado que existen diatomeas de amplia distribución o cosmopolitas, otras que son compartidas entre regiones con condiciones ambientales parecidas, pero también existe evidencia de especies endémicas a determinadas regiones (Abarca, Jahn, Zimmermann y Enke, 2014; Kociolek y Spaulding, 2000; Rimet, 2012; Trobajo et al., 2009; Van de Vijver y Beyens, 1999; Vanormelingen, Verleyen y Vyverman, 2008).
Considerando que son relativamente pocos los trabajos actuales publicados sobre diatomeas que se han llevado a cabo en México, es probable que se incrementen los nuevos registros de especies para el país, así como las diatomeas nuevas para la ciencia. Por lo tanto, es necesario dar continuidad a los estudios sobre diatomeas de México para que estudios futuros sean basados en monografías propias del país.
Trabajos en curso sobre la flora diatomológica de cuerpos de agua temporales y permanentes en la cuenca alta del río Laja por los autores del presente estudio indican que existen aún potenciales nuevos registros para el país. Bajo esta premisa, el presente estudio da continuidad al registro de la diversidad de diatomeas del Alto Laja.
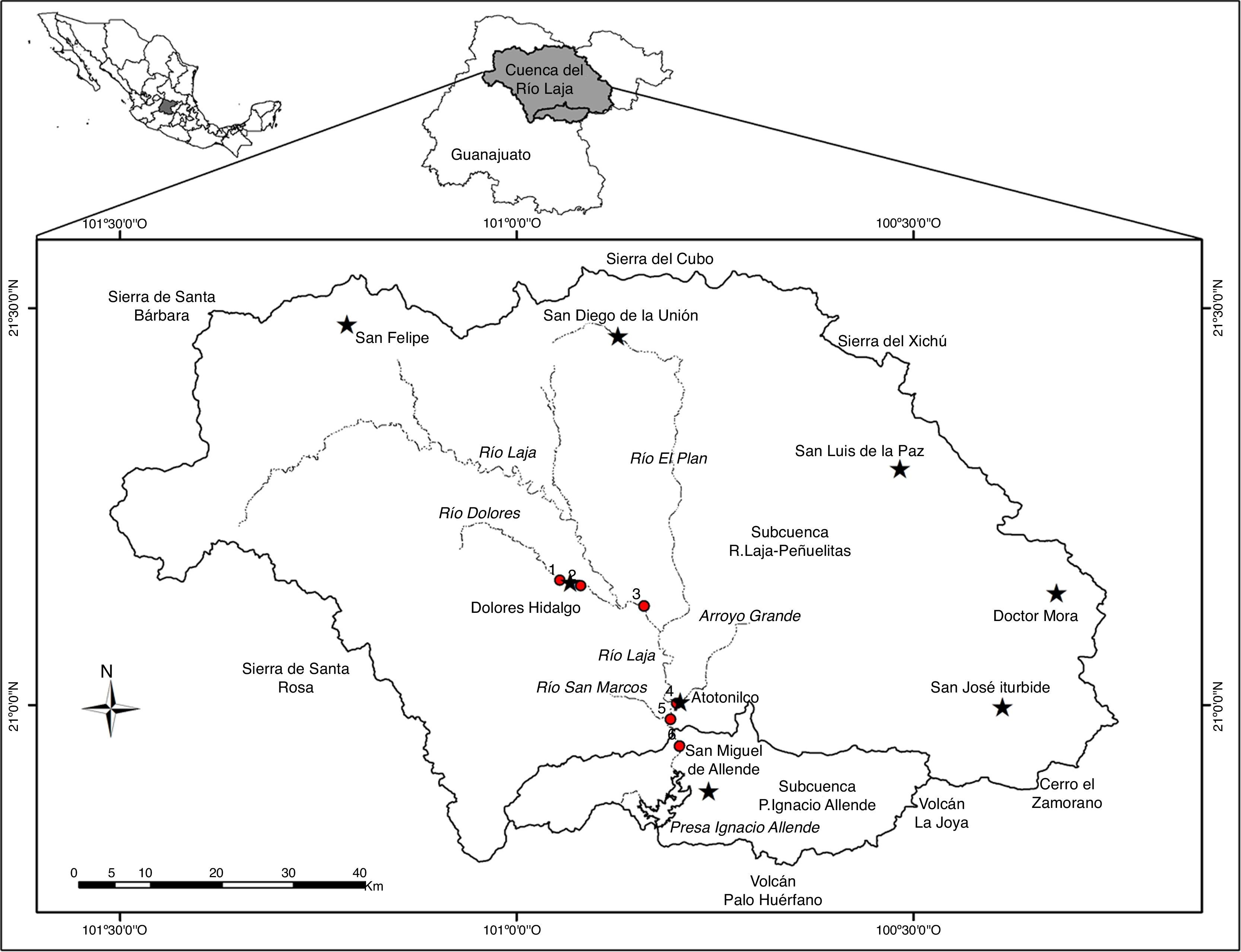
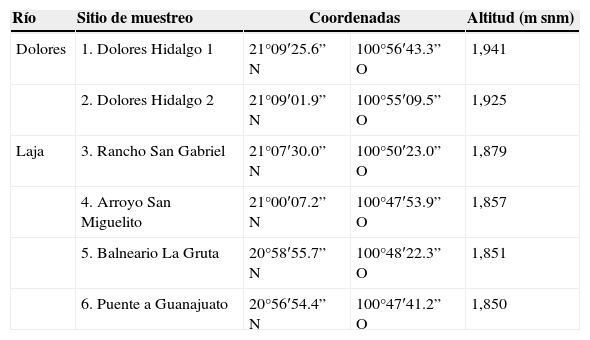
Materiales y métodosLa cuenca alta del río Laja o cuenca de la Independencia se encuentra al noreste del estado de Guanajuato, México, formando parte del Sistema Hidrológico Lerma-Chapala, el más importante de México económicamente. Dentro de este sistema, la cuenca alta del río Laja es una de las más importantes del sistema, no solo por su extensión, sino también por el volumen de descarga que aporta al río Lerma (Aparicio, 2001; Ortega-Guerrero et al., 2002). La cuenca alta del río Laja cubre un área de 6,840km2, con altitudes que van de los 1,850-1,900msnm en la salida de la cuenca y el valle, a 2,850msnm en las tierras altas (Mahlknecht, Gárfias-Solis, Aravena y Tesch, 2006; Ortega-Guerrero et al., 2002). El clima es semiárido, templado, con lluvias en verano, BS1kw(w) (e)g. La precipitación media anual es de 556mm, distribuida mayormente de mayo a octubre. La temperatura media anual es de 17.1°C (García, 1988; Mahlknecht, Steinich y Navarro de León, 2004; Mahlknecht et al., 2006).
Se hicieron 2 muestreos durante las temporadas contrastantes del año 2011: seca-fría (enero) y lluvias (octubre). Los 6 sitios estudiados se encuentran en la parte baja de la cuenca de estudio (1,850-1,941msnm), los sitios1 y 2 en el río Dolores y los sitios3-6 en el río Laja (tabla 1 y fig. 1). Las muestras de diatomeas de cada sitio se obtuvieron mediante el raspado con navaja de la cara superior de 3 a 5 rocas sumergidas con crecimientos de diatomeas —evidentes por el color pardo y por ser mucilaginosos y en un área toral de 100 cm2— para formar muestras compuestas (Kelly et al., 1998). En cada sitio de muestreo se midieron in situ las siguientes variables físicas y químicas del agua (tabla 2): conductividad específica, pH y temperatura con un potenciómetro Conductronic PC 18 (Puebla, México); el oxígeno disuelto con un oxímetro YSI (Ohio, EE.UU.). También se tomaron muestras de agua para la determinación de fósforo total y nitrógeno total, de acuerdo con las normas mexicanas NMX-AA-029-SCFI-2001 (Semarnat, 2001a) y NMX-AA-026-SCFI-2001 (Semarnat, 2001b), respectivamente.
Localización de los sitios de muestreo en la cuenca alta del río Laja.
| Río | Sitio de muestreo | Coordenadas | Altitud (m snm) | |
|---|---|---|---|---|
| Dolores | 1. Dolores Hidalgo 1 | 21°09′25.6” N | 100°56′43.3” O | 1,941 |
| 2. Dolores Hidalgo 2 | 21°09′01.9” N | 100°55′09.5” O | 1,925 | |
| Laja | 3. Rancho San Gabriel | 21°07′30.0” N | 100°50′23.0” O | 1,879 |
| 4. Arroyo San Miguelito | 21°00′07.2” N | 100°47′53.9” O | 1,857 | |
| 5. Balneario La Gruta | 20°58′55.7” N | 100°48′22.3” O | 1,851 | |
| 6. Puente a Guanajuato | 20°56′54.4” N | 100°47′41.2” O | 1,850 | |
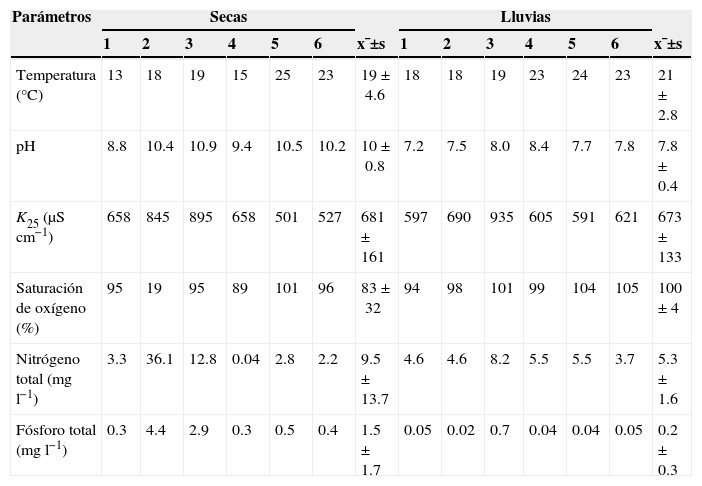
Parámetros registrados durante las 2 temporadas de muestreo (seca-fría: enero 2011; lluvias: octubre 2011) en la cuenca alta del río Laja.
| Parámetros | Secas | Lluvias | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | x¯±s | 1 | 2 | 3 | 4 | 5 | 6 | x¯±s | |
| Temperatura (°C) | 13 | 18 | 19 | 15 | 25 | 23 | 19±4.6 | 18 | 18 | 19 | 23 | 24 | 23 | 21±2.8 |
| pH | 8.8 | 10.4 | 10.9 | 9.4 | 10.5 | 10.2 | 10±0.8 | 7.2 | 7.5 | 8.0 | 8.4 | 7.7 | 7.8 | 7.8±0.4 |
| K25 (μScm−1) | 658 | 845 | 895 | 658 | 501 | 527 | 681±161 | 597 | 690 | 935 | 605 | 591 | 621 | 673±133 |
| Saturación de oxígeno (%) | 95 | 19 | 95 | 89 | 101 | 96 | 83±32 | 94 | 98 | 101 | 99 | 104 | 105 | 100±4 |
| Nitrógeno total (mgl−1) | 3.3 | 36.1 | 12.8 | 0.04 | 2.8 | 2.2 | 9.5±13.7 | 4.6 | 4.6 | 8.2 | 5.5 | 5.5 | 3.7 | 5.3±1.6 |
| Fósforo total (mgl−1) | 0.3 | 4.4 | 2.9 | 0.3 | 0.5 | 0.4 | 1.5±1.7 | 0.05 | 0.02 | 0.7 | 0.04 | 0.04 | 0.05 | 0.2±0.3 |
K25: conductividad específica a 25°C.
El número de los sitios corresponde al nombre citado en la tabla 1.
El procesamiento de las muestras en el laboratorio se hizo por el método del peróxido caliente descrito por Kelly et al. (2001), aunque la centrifugación se hizo a 1,500rpm para evitar romper las valvas delgadas y alargadas. La preparación de laminillas se hizo de acuerdo con Kelly et al. (2001) y Sterrenburg (2011), y se montaron con resina Naphrax (Brunel Microscopes, Chippenham, Reino Unido). Las observaciones se hicieron con un microscopio fotónico (MF) Olympus BX51 con contraste interferencial (Tokio, Japón), y el registro de las especies con una cámara digital Olympus-DP12. Para la observación en microscopio electrónico de barrido (MEB), los cubreobjetos con las muestras fueron recubiertos con oro durante 40segundos y observados con un microscopio Carl Zeiss EVO-50 (Jena, Alemania).
La identificación taxonómica se basó en la consulta de bibliografía especializada de: Europa (Krammer, 1997, 2000, 2002; Krammer y Lange-Bertalot, 1986, 1988, 1991a,b; Lange-Bertalot, 2001; Lange-Bertalot y Metzeltin, 1996; Lange-Bertalot, Cavacini, Tagliaventi y Alfinito, 2003; Werum y Lange-Bertalot, 2004); Sudamérica (Metzeltin y Lange-Bertalot, 1998; Metzeltin, Lange-Bertalot y García-Rodríguez, 2005; Piccinini, 2006); Estados Unidos de América (Patrick y Reimer, 1966, 1975; Spaulding, Lubinski y Potapova, 2010); Canadá (Lavoie, Hamilton, Campeau, Grenier y Dillon, 2008) y México (Abarca-Mejía, 2010; Cantoral-Uriza, 1997; Novelo, Tavera e Ibarra, 2007; Segura-García, 2011; Segura-García, Israde-Alcántara y Maidana, 2010). Asimismo, en artículos específicos para determinados taxones que se citan en las descripciones correspondientes. En caso de no poder asignar con relativa confianza un grupo de ejemplares a un taxón infragenérico descrito, se dejó a nivel de género. Cuando las observaciones apuntaban a un taxón en particular, pero no se observó algún carácter determinante para separarlo de otros muy parecidos, se utilizó la abreviatura aff., del latín affinis, para indicar afinidad.
Además del listado taxonómico, se presenta la descripción morfológica de las especies más abundantes (abundancia relativa igual o mayor al 5%) y de los nuevos registros. Para el cálculo de las abundancias relativas se contabilizaron un mínimo de 500 valvas en transectos por preparación permanente (Pan, Hill, Husby, Hall y Kaufmann 2006), aunque los conteos se hicieron por triplicado para evitar el posible sesgo en los valores resultantes al solo contabilizar una laminilla, lo que resultó en un total de 19,450 valvas contabilizadas. Para el cálculo de las abundancias relativas, el número de valvas de un determinado taxón se dividió entre el número total de valvas para el sitio, y el resultado se expresa en porcentaje. Además de las diatomeas identificadas durante los conteos, las laminillas permanentes fueron revisadas en su totalidad para encontrar especies raras o con muy baja abundancia.
ResultadosComo resultado de los conteos se encontraron 140 taxones infragenéricos (especies, variedades y formas) en 47 géneros. Se registraron 33 taxones adicionales como resultado de la revisión de las laminillas después de los conteos, lo que eleva la riqueza a 173 taxones infragenéricos en 54 géneros. Los géneros mejor representados fueron Nitzschia (29), Navicula (17) y Gomphonema (15). En contraste, 27 géneros estuvieron representados por una sola especie (tabla 3). Siete especies son nuevos registros para México: Fallacia monoculata, Hantzschia abundans, Navigiolum uruguayense, Neidium bisulcatum, Nitzschia solita, Planothidium biporomum y Sellaphora bacilloides. Cabe mencionar que Navigiolum es nuevo registro a nivel genérico para el país. Y para el estado de Guanajuato se documentan 3 nuevos registros: Gomphonema laticollum, G.subclavatum y Gomphosphenia lingulatiformis.
Listado de los 173 taxones infragenéricos de diatomeas identificados en la cuenca alta del río Laja, ordenados alfabéticamente por género. Distribución geográfica: cosmopolita (C), pantropical (P) y desconocida (D).
| Nombre del taxón | Distribución |
|---|---|
| Achnanthes inflata (Kützing) Grunow | P |
| Achnanthidium exiguum (Grunow) Czarnecki | C |
| Achnanthidium minutissimum (Kützing) Czarnecki | C |
| Amphipleura aff. pellucida (Kützing) Kützing | C |
| Amphora copulata (Kützing) Schoeman et Archibald | C |
| Amphora ovalis (Kützing) Kützing | C |
| Amphora pediculus (Kützing) Grunow | C |
| Amphora veneta Kützing | C |
| Amphora sp. | D |
| Anomoeoneis sphaerophora (Ehrenberg) Pfitzer | C |
| Aulacoseira granulata (Ehrenberg) Simonsen | C |
| Biremis circumtexta (Meister ex Hustedt) Lange-Bertalot et Witkowski | C |
| Caloneis schumanniana (Grunow) Cleve | C |
| Caloneis sp. 1 | D |
| Caloneis sp. 2 | D |
| Caloneis sp. 3 | D |
| Caloneis sp. 4 | D |
| Cocconeis pediculus Ehrenberg | C |
| Cocconeis placentula Ehrenberg var. placentula | C |
| Cocconeis placentula var. euglypta (Ehrenberg) Grunow | C |
| Cocconeis placentula var. lineata (Ehrenberg) van Heurck | C |
| Craticula accomoda (Hustedt) D. G. Mann | C |
| Craticula ambigua (Ehrenberg) D. G. Mann | D |
| Craticula citrus (Krasske) Reichardt | C |
| Craticula cuspidata (Kützing) D. G. Mann | C |
| Craticula sp. | D |
| Cyclostephanos invisitatus (Hohn et Hellermann) Theriot, Stoermer et Håkansson | C |
| Cymatopleura elliptica (Brébisson) W. Smith | C |
| Cymatopleura solea (Brébisson) W. Smith | C |
| Cymbella mexicana (Ehrenberg) Cleve | P |
| Cymbella tumida (Brébisson) van Heurck | P |
| Cymbella sp. | D |
| Denticula kuetzingii Grunow | C |
| Denticula valida (Pedicino) Grunow | C |
| Diadesmis confervacea Kützing | C |
| Discostella pseudostelligera (Hustedt) Houk et Klee | C |
| Encyonema minutum (Hilse) D. G. Mann | C |
| Encyonema silesiacum (Bleisch) D. G. Mann | C |
| Encyonema triangulum (Ehrenberg) Kützing | D |
| Encyonema sp. 1 | D |
| Encyonema sp. 2 | D |
| Encyonema sp. 3 | D |
| Encyonopsis microcephala (Grunow) Krammer | C |
| Eolimna minima (Grunow) Lange-Bertalot | C |
| Eolimna subminuscula (Manguin) Moser, Lange-Bertalot et Metzeltin | C |
| Eolimna tantula Hustedt | C |
| Epithemia adnata (Kützing) Brébisson | C |
| Epithemia sorex Kützing | C |
| Epithemia turgida (Ehrenberg) Kützing | C |
| Eunotia sp. | D |
| *Fallacia monoculata (Hustedt) D. G. Mann | C |
| Fallacia pygmaea (Kützing) Stickle et D. G. Mann | C |
| Fistulifera sp. | D |
| Fragilaria capucina Desmazières | C |
| Frustulia vulgaris (Thwaites) De Toni | C |
| Geissleria decussis (Østrup) Lange-Bertalot et Metzeltin | C |
| Gomphoneis sp. | D |
| Gomphonema acuminatum Ehrenberg | C |
| Gomphonema affine Kützing | C |
| Gomphonema clavatum Ehrenberg | C |
| Gomphonema gracile Ehrenberg | C |
| Gomphonema lagenula Kützing | P |
| + Gomphonema laticollum Reichardt | P |
| Gomphonema mexicanum Grunow | P |
| Gomphonema parvulum (Kützing) Kützing | C |
| Gomphonema parvulum var. exilissimum Grunow | C |
| Gomphonema parvulum var. parvulum f. saprophilum Lange-Bertalot et Reichardt | C |
| Gomphonema pumilum (Grunow) Reichardt et Lange-Bertalot | C |
| + Gomphonema subclavatum (Grunow) Grunow | C |
| Gomphonema aff. truncatum Ehrenberg | C |
| Gomphonema sp. 1 | D |
| Gomphonema sp. 2 | D |
| + Gomphosphenia lingulatiformis (Lange-Bertalot et Reichardt) Lange-Bertalot | C |
| Gyrosigma aff. acuminatum | C |
| Gyrosigma aff. scalproides | C |
| *Hantzschia abundans Lange-Bertalot | C |
| Hantzschia amphioxys (Ehrenberg) Grunow | C |
| Hippodonta capitata (Ehrenberg) Lange-Bertalot, Metzeltin et Witkowski | C |
| Lemnicola hungarica (Grunow) Round et Basson | C |
| Luticola goeppertiana (Bleisch) D. G. Mann | C |
| Luticola kotschyi (Kützing) D. G. Mann | C |
| Luticola mutica (Kützing) D. G. Mann | C |
| Luticola nivalis (Ehrenberg) D. G. Mann | C |
| Luticola sp. | D |
| Mayamaea atomus var. permitis (Hustedt) Lange-Bertalot | C |
| Melosira varians Agardh | C |
| Navicula antonii Lange-Bertalot | C |
| Navicula capitatoradiata Germain | C |
| Navicula cryptocephala Kützing | C |
| Navicula cryptotenella Lange-Bertalot | C |
| Navicula erifuga Lange-Bertalot | C |
| Navicula gregaria Donkin | C |
| Navicula libonensis Schoeman | C |
| Navicula radiosa Kützing | C |
| Navicula riediana Lange-Bertalot et Rumrich | P |
| Navicula rostellata Kützing | C |
| Navicula symmetrica Patrick | C |
| Navicula trivialis Lange-Bertalot | C |
| Navicula veneta Kützing | C |
| Navicula sp. 1 | D |
| Navicula sp. 2 | D |
| Navicula sp. 3 | D |
| Navicula vilaplanii (Lange-Bertalot et Sabater) Lange-Bertalot et Sabater | D |
| *Navigiolum uruguayense Metzeltin, Lange-Bertalot et García-Rodríguez | P |
| Neidium affine (Ehrenberg) Pfitzer | C |
| Neidium ampliatum (Ehrenberg) Krammer | C |
| *Neidium bisulcatum (Lagerstedt) Cleve | C |
| Nitzschia acicularis (Kützing) W. Smith | C |
| Nitzschia agnita Hustedt | C |
| Nitzschia amphibia Grunow | C |
| Nitzschia capitellata Hustedt | C |
| Nitzschia clausii Hantzsch | C |
| Nitzschia communis Rabenhorst | C |
| Nitzschia desertorum Hustedt | C |
| Nitzschia dissipata (Kützing) Rabenhorst | C |
| Nitzschia fonticola (Grunow) Grunow | C |
| Nitzschia frustulum (Kützing) Grunow | C |
| Nitzschia gracilis Hantzsch | C |
| Nitzschia inconspicua Grunow | C |
| Nitzschia intermedia Hantzsch | C |
| Nitzschia linearis (Agardh) W. Smith | C |
| Nitzschia microcephala Grunow | C |
| Nitzschia palea (Kützing) W. Smith | C |
| Nitzschia palea var. tenuirostris Grunow | C |
| Nitzschia rautenbachiae Cholnoky | P |
| Nitzschia sigma (Kützing) W. Smith | C |
| Nitzschia sinuata var. delognei (Grunow) Lange-Bertalot | C |
| *Nitzschia solita Hustedt | C |
| Nitzschia umbonata (Ehrenberg) Lange-Bertalot | C |
| Nitzschia aff. hantzschiana Rabenhorst | C |
| Nitzschia aff. paleacea (Grunow) Grunow | C |
| Nitzschia aff. recta Hantzsch | C |
| Nitzschia sp. 1 | D |
| Nitzschia sp. 2 | D |
| Nitzschia sp. 3 | D |
| Nitzschia sp. 4 | D |
| Pinnularia acrosphaeria W. Smith | C |
| Pinnularia borealis Ehrenberg | C |
| Pinnularia brebissonii (Kützing) Rabenhorst | C |
| Pinnularia gibba Ehrenberg | C |
| Pinnularia viridis (Nitzsch) Ehrenberg | C |
| Pinnularia sp. 1 | D |
| Pinnularia sp. 2 | D |
| Placoneis placentula (Ehrenberg) Heinzerling | C |
| Placoneis sp. 1 | D |
| Placoneis sp. 2 | D |
| Planothidium frequentissimum (Lange-Bertalot) Lange-Bertalot | C |
| *Planothidium incuriatum C. E. Wetzel, Van de Vijver et Ector | C |
| Pleurosira laevis (Ehrenberg) Compère | C |
| Rhoicosphenia abbreviata (Agardh) Lange-Bertalot | C |
| Rhopalodia gibba (Ehrenberg) O. Müller | C |
| Rhopalodia aff. brebissonii Krammer | C |
| Rhopalodia aff. gibberula (Ehrenberg) O. Müller | C |
| *Sellaphora bacilloides (Hustedt) Levkov, Krstic et Nakov | C |
| Sellaphora laevissima (Kützing) D. G. Mann | C |
| Sellaphora pupula (Kützing) Mereschkowsky | C |
| Sellaphora seminulum (Grunow) D. G. Mann | C |
| Sellaphora sp. | D |
| Stauroneis sp. | D |
| Staurosira venter (Ehrenberg) H. Kobayasi | C |
| Stephanocyclus meneghiniana (Kützing) Skabitschevsky | C |
| Surirella angusta Kützing | C |
| Surirella minuta var. peduliformis Frenguelli | P |
| Surirella ovalis Brébisson | C |
| Surirella tenera W. Gregory | C |
| Surirella sp. | D |
| Thalassiosira weissflogii (Grunow) Fryxell et Hasle | C |
| Tryblionella apiculata Gregory | C |
| Tryblionella calida (Grunow) D. G. Mann | C |
| Tryblionella hungarica (Grunow) Frenguelli | C |
| Ulnaria acus (Kützing) Aboal | C |
| Ulnaria goulardii (Brébisson) Lange-Bertalot | P |
| Ulnaria ulna (Nitzsch) Compère | C |
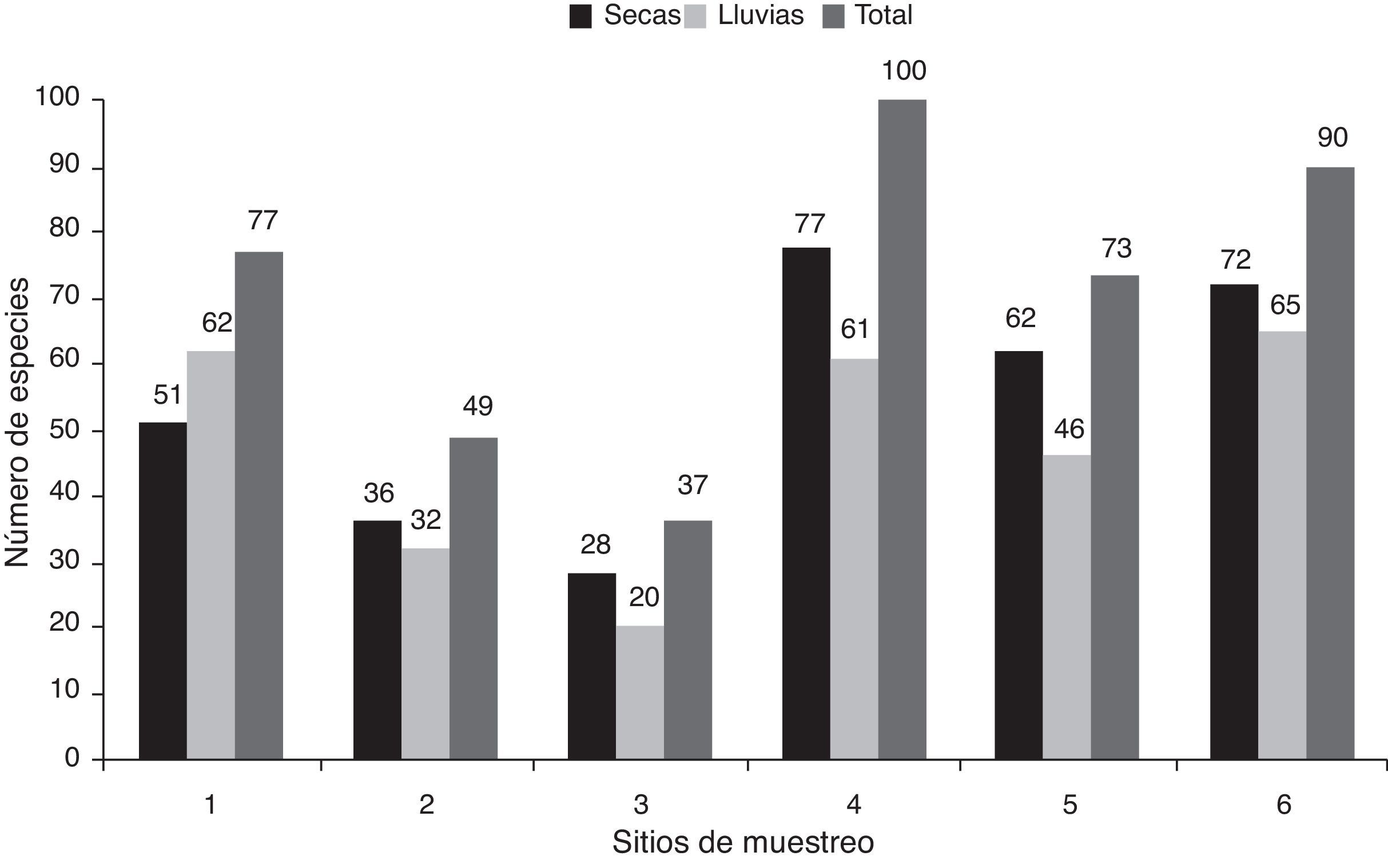
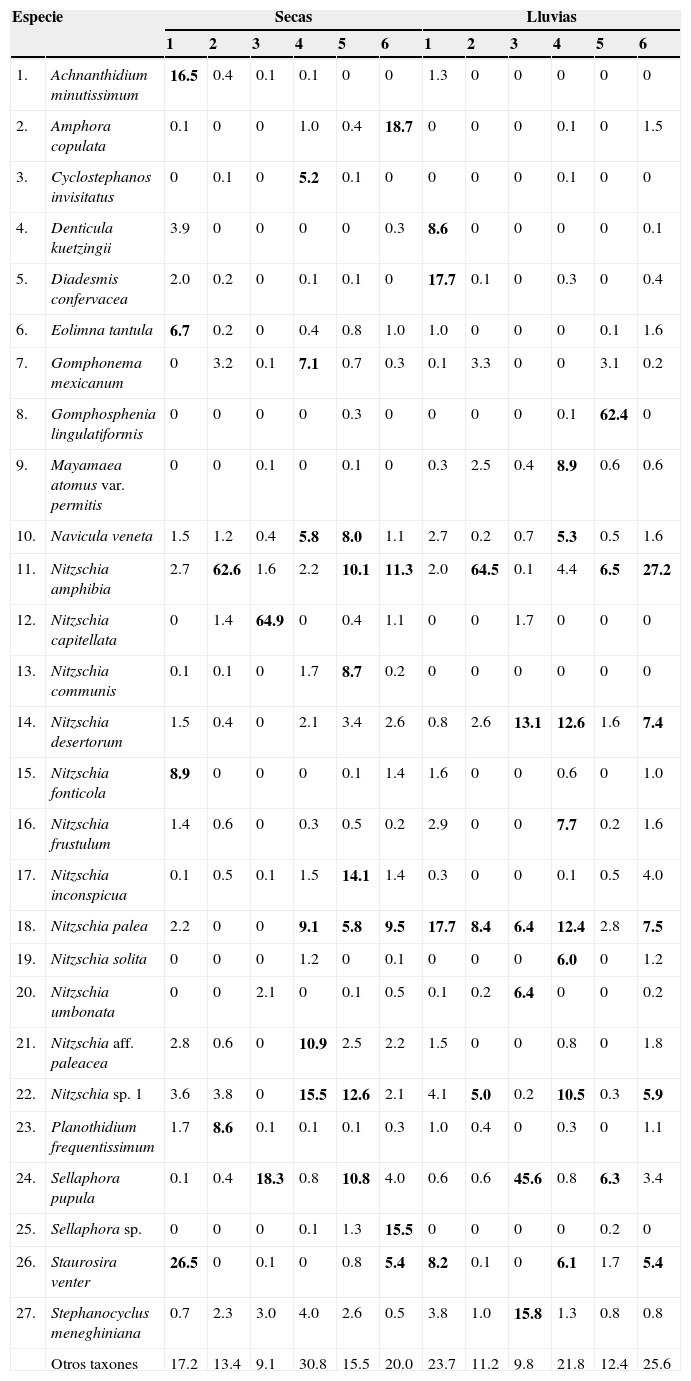
Durante la temporada seca se encontraron 115 taxones. Los sitios 4 y 6 presentaron la mayor riqueza, con 77 y 72 taxones, respectivamente. Por otro lado, los sitios 2 y 3 tuvieron la menor riqueza, con 36 y 28 taxones, respectivamente (fig. 2). Diez especies se encontraron en los 6 sitios de muestreo: Amphora veneta, Eolimna subminuscula, Gomphonema parvulum, Navicula veneta, Nitzschia amphibia, N.inconspicua, Planothidium frequentissimum, Sellaphora pupula, Stephanocyclus meneghiniana y Ulnaria ulna. En lluvias también se encontraron 115 taxones. Los sitios 1, 4 y 6 estuvieron mejor representados, con 62, 61 y 65 taxones, respectivamente. En contraste, el sitio 3 presentó la menor riqueza, con 20 (fig. 2). Nueve especies se encontraron en los 6 sitios de muestreo: Eolimna subminuscula, Mayamaea atomus var. permitis, Navicula veneta, Nitzschia amphibia, N.desertorum, N.palea, Nitzschia sp. 1, Sellaphora pupula y Stephanocyclus meneghiniana.
En cuanto a la riqueza total por sitio de ambas temporadas, los sitios 4 y 6 presentaron la mayor riqueza, con 100 y 90 taxones, respectivamente. Por otro lado, la menor riqueza se encontró en los sitios 2 y 3, con 49 y 37 taxones, respectivamente (fig. 2). Cinco especies se encontraron en todos los sitios de muestreo para ambas temporadas: Eolimna subminuscula, Navicula veneta, Nitzschia amphibia, Sellaphora pupula y Stephanocyclus meneghiniana. Se encontró que los sitios 2 y 3, con las concentraciones más altas de nutrientes para ambas temporadas, presentaron la menor riqueza específica (fig. 2), además de estar dominados por un par de especies. Por ejemplo, el sitio 2 por Nitzschia amphibia con 62.6% de la abundancia relativa durante la temporada seca y 64.5% en lluvias. El sitio 3 estuvo dominado por Nitzschia capitellata (64.9%) en secas y por Sellaphora pupula (45.6%) en lluvias (tabla 4). Por el contrario, los sitios con menor concentración de nutrientes presentaron la mayor riqueza específica, esto es, los sitios 4 y 6 durante secas (fig. 2). Además, la abundancia relativa no se concentró en un solo taxón, por ejemplo Nitzschia sp. 1 con 15.5% para el sitio 4 y Amphora copulata con 18.7% para el sitio 6 (tabla 4).
Listado de los taxones más abundantes por temporada y sitios de muestreo.
| Especie | Secas | Lluvias | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 1 | 2 | 3 | 4 | 5 | 6 | ||
| 1. | Achnanthidium minutissimum | 16.5 | 0.4 | 0.1 | 0.1 | 0 | 0 | 1.3 | 0 | 0 | 0 | 0 | 0 |
| 2. | Amphora copulata | 0.1 | 0 | 0 | 1.0 | 0.4 | 18.7 | 0 | 0 | 0 | 0.1 | 0 | 1.5 |
| 3. | Cyclostephanos invisitatus | 0 | 0.1 | 0 | 5.2 | 0.1 | 0 | 0 | 0 | 0 | 0.1 | 0 | 0 |
| 4. | Denticula kuetzingii | 3.9 | 0 | 0 | 0 | 0 | 0.3 | 8.6 | 0 | 0 | 0 | 0 | 0.1 |
| 5. | Diadesmis confervacea | 2.0 | 0.2 | 0 | 0.1 | 0.1 | 0 | 17.7 | 0.1 | 0 | 0.3 | 0 | 0.4 |
| 6. | Eolimna tantula | 6.7 | 0.2 | 0 | 0.4 | 0.8 | 1.0 | 1.0 | 0 | 0 | 0 | 0.1 | 1.6 |
| 7. | Gomphonema mexicanum | 0 | 3.2 | 0.1 | 7.1 | 0.7 | 0.3 | 0.1 | 3.3 | 0 | 0 | 3.1 | 0.2 |
| 8. | Gomphosphenia lingulatiformis | 0 | 0 | 0 | 0 | 0.3 | 0 | 0 | 0 | 0 | 0.1 | 62.4 | 0 |
| 9. | Mayamaea atomus var. permitis | 0 | 0 | 0.1 | 0 | 0.1 | 0 | 0.3 | 2.5 | 0.4 | 8.9 | 0.6 | 0.6 |
| 10. | Navicula veneta | 1.5 | 1.2 | 0.4 | 5.8 | 8.0 | 1.1 | 2.7 | 0.2 | 0.7 | 5.3 | 0.5 | 1.6 |
| 11. | Nitzschia amphibia | 2.7 | 62.6 | 1.6 | 2.2 | 10.1 | 11.3 | 2.0 | 64.5 | 0.1 | 4.4 | 6.5 | 27.2 |
| 12. | Nitzschia capitellata | 0 | 1.4 | 64.9 | 0 | 0.4 | 1.1 | 0 | 0 | 1.7 | 0 | 0 | 0 |
| 13. | Nitzschia communis | 0.1 | 0.1 | 0 | 1.7 | 8.7 | 0.2 | 0 | 0 | 0 | 0 | 0 | 0 |
| 14. | Nitzschia desertorum | 1.5 | 0.4 | 0 | 2.1 | 3.4 | 2.6 | 0.8 | 2.6 | 13.1 | 12.6 | 1.6 | 7.4 |
| 15. | Nitzschia fonticola | 8.9 | 0 | 0 | 0 | 0.1 | 1.4 | 1.6 | 0 | 0 | 0.6 | 0 | 1.0 |
| 16. | Nitzschia frustulum | 1.4 | 0.6 | 0 | 0.3 | 0.5 | 0.2 | 2.9 | 0 | 0 | 7.7 | 0.2 | 1.6 |
| 17. | Nitzschia inconspicua | 0.1 | 0.5 | 0.1 | 1.5 | 14.1 | 1.4 | 0.3 | 0 | 0 | 0.1 | 0.5 | 4.0 |
| 18. | Nitzschia palea | 2.2 | 0 | 0 | 9.1 | 5.8 | 9.5 | 17.7 | 8.4 | 6.4 | 12.4 | 2.8 | 7.5 |
| 19. | Nitzschia solita | 0 | 0 | 0 | 1.2 | 0 | 0.1 | 0 | 0 | 0 | 6.0 | 0 | 1.2 |
| 20. | Nitzschia umbonata | 0 | 0 | 2.1 | 0 | 0.1 | 0.5 | 0.1 | 0.2 | 6.4 | 0 | 0 | 0.2 |
| 21. | Nitzschia aff. paleacea | 2.8 | 0.6 | 0 | 10.9 | 2.5 | 2.2 | 1.5 | 0 | 0 | 0.8 | 0 | 1.8 |
| 22. | Nitzschia sp. 1 | 3.6 | 3.8 | 0 | 15.5 | 12.6 | 2.1 | 4.1 | 5.0 | 0.2 | 10.5 | 0.3 | 5.9 |
| 23. | Planothidium frequentissimum | 1.7 | 8.6 | 0.1 | 0.1 | 0.1 | 0.3 | 1.0 | 0.4 | 0 | 0.3 | 0 | 1.1 |
| 24. | Sellaphora pupula | 0.1 | 0.4 | 18.3 | 0.8 | 10.8 | 4.0 | 0.6 | 0.6 | 45.6 | 0.8 | 6.3 | 3.4 |
| 25. | Sellaphora sp. | 0 | 0 | 0 | 0.1 | 1.3 | 15.5 | 0 | 0 | 0 | 0 | 0.2 | 0 |
| 26. | Staurosira venter | 26.5 | 0 | 0.1 | 0 | 0.8 | 5.4 | 8.2 | 0.1 | 0 | 6.1 | 1.7 | 5.4 |
| 27. | Stephanocyclus meneghiniana | 0.7 | 2.3 | 3.0 | 4.0 | 2.6 | 0.5 | 3.8 | 1.0 | 15.8 | 1.3 | 0.8 | 0.8 |
| Otros taxones | 17.2 | 13.4 | 9.1 | 30.8 | 15.5 | 20.0 | 23.7 | 11.2 | 9.8 | 21.8 | 12.4 | 25.6 | |
En negritas se señalan los taxones con un mínimo de 5% de la abundancia relativa por sitio.
El número de los sitios corresponde al nombre citado en la tabla 1.
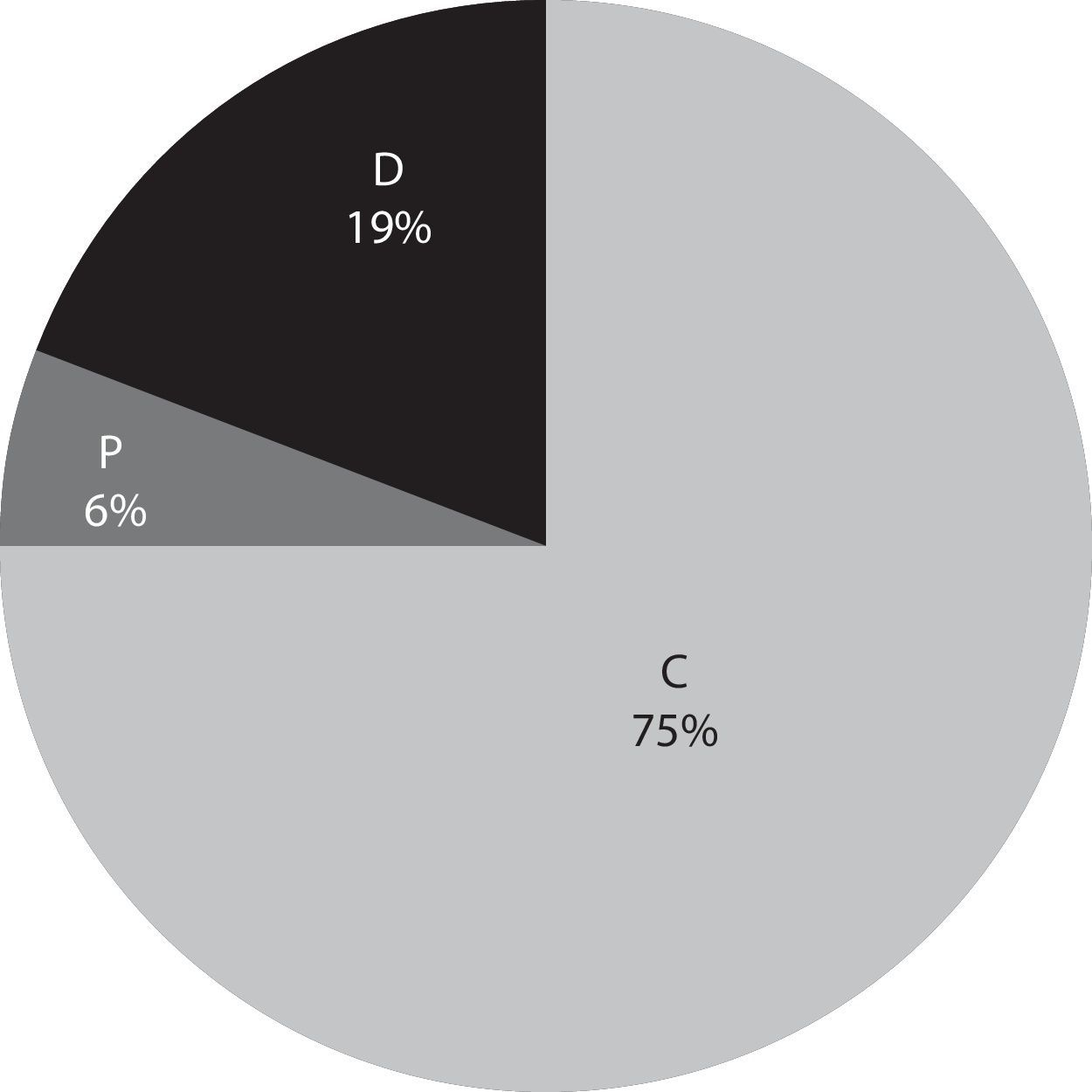
De acuerdo con su distribución geográfica, tres cuartas partes de la flora diatomológica registrada está conformada por taxones cosmopolitas, aunque también se encontró que el 6% de las especies están restringidas a los trópicos (pantropical). De los taxones restantes se desconoce la amplitud de su distribución, ya que no fueron identificados a nivel de especie (tabla 3 y fig. 3)
Descripciones* Nuevo registro para México.
+ Nuevo registro para Guanajuato.
Achnanthidium minutissimum (Kützing) Czarnecki (figs. 4-6,7). Frústulos monorrafídeos, con una valva cóncava (con rafe) y la otra convexa (sin rafe). Las valvas son linear-lanceoladas a lineares, con ápices subrostrados a rostrados. Rafe filiforme, recto. En ambas valvas el área axial es estrecha, ligeramente ensanchada en el centro, formando el área central. Estrías radiales; mayor distanciamiento de los pares de estrías centrales en la valva con rafe. Largo 12.2-22.4 (15.4±2.8)μm; ancho 3-3.7 (3.3±0.2)μm; estrías 25-29 (26.7±1.7)/10μm. n=19. En MEB se observó que las estrías son uniseriadas.
4-6, Achnanthidium minutissimum: 4, valva con rafe; 5, valva sin rafe; 6, frústulo en vista cingular; 7, Amphora copulata; 8-9, Cyclostephanos invisitatus; 10-11, Denticula kuetzingii; 12-13, Diadesmis confervacea; 14-15, Eolimna tantula; 16-17, Fallacia monoculata; 18-19, Gomphonema laticollum; 20-21, G. mexicanum; 22-23, G. subclavatum; 24-26, Gomphosphenia lingulatiformis: 26, frústulos en vista cingular; 27, Hantzschia abundans; 28-30, Mayamaea atomus var. permitis; 31-32, Navicula veneta; 33-34, Navigiolum uruguayense; 35-36, Neidium bisulcatum; 37-38, Nitzschia amphibia; 39-40, N. capitellata; 41, N. communis; 42-43, N. desertorum; 44-45, N. fonticola; 46-47, N. frustulum; 48-49, N. inconspicua; 50-51, N. palea; 52-53, N. solita; 54, N. umbonata; 55, Nitzschia aff. paleacea; 56-57, Nitzschia sp. 1; 58-59, Planothidium incuriatum: 58, valva con rafe; 59 valva sin rafe; 60-62, P. frequentissimum: 60-61, valvas sin rafe; 62, valva con rafe; 63-64, Sellaphora bacilloides; 65-66, S. pupula; 67-68, Sellaphora sp.; 69-70, Staurosira venter: 70, frústulos en vista cingular; 71-72, Stephanocyclus meneghiniana. Barra de escala 10μm.
Amphora copulata (Kützing) Schoeman y Archibald (fig. 7). Valvas semielípticas con el margen dorsal convexo y el ventral ligeramente cóncavo; ápices agudamente redondeados. Rafe curvado, con extremos proximales curvados hacia el dorso. Área axial estrecha; la central es asimétrica, mayormente en la porción ventral. Área hialina en la porción dorsal, rectangular. Las estrías dorsales son radiales a ligeramente convergentes en los ápices, las cuales están divididas en segmentos desiguales; las ventrales son radiales en el centro y convergentes en los ápices. Largo 23.9-59.7 (33.5±7.5)μm; ancho 5.7-11.3 (7.4±1.1)μm; estrías ventrales 12-14 (13.1±0.8)/10μm; estrías dorsales 12-16 (14.4±0.8)/10μm. n=36.
Cyclostephanos invisitatus (Hohn y Hellermann) Theriot, Stoermer y Håkansson (figs. 8-9). Valvas circulares, onduladas concéntricamente. Estrías radiales, extendiéndose del margen al centro aproximadamente 1/2-3/4 del radio, muy marcadas en el margen y poco evidentes hacia el centro. Diámetro 8-9.4 (8.7±0.4)μm; estrías 14-18 (16.1±1.3)/10μm. n=12.
Denticula kuetzingii Grunow (figs. 10-11). Valvas lanceoladas a linear-lanceoladas con ápices agudamente redondeados. Rafe excéntrico, marginal; fíbulas extendiéndose a la mitad de la valva o hasta el margen opuesto. Estrías formadas por poros discernibles en microscopia óptica (MO). Largo 13.8-44.1 (29.2±8.7)μm; ancho 5-6.7 (5.9±0.4)μm; fíbulas 5-9 (6.7±0.9)/10μm; estrías 14-16 (15.5±0.6)/10μm; poros 15-19 (16.8±1)/10μm. n=37. En MEB se confirmó que las estrías son uniseriadas.
Diadesmis confervacea Kützing (figs. 12-13, 74-75). Frústulos solitarios o formando cadenas. Valvas lanceoladas con ápices redondeados. Rafe recto, con los extremos proximales expandidos. Área axial lanceolada a rómbica y área central amplia. Presencia de un nódulo central cóncavo evidente en vista valvar y conspicuo en vista cingular. Estrías radiales formadas por poros en algunos casos discernibles. Largo 14.4-22.7 (16.8±2)μm; ancho 5.5-7.8 (6.5±0.6)μm; estrías 18-23 (21.2±1.1)/10μm. n=30. En MEB se encontró que las estrías son uniseriadas, lineoladas (alargadas transapicalmente). Los frústulos de la figura 75 se consideraron como D.aff.confervacea, ya que no se observaron las espinas marginales de unión que permiten la formación de cadenas; los casos en que no se encuentran espinas son en las valvas de separación (Aponte, Maidana y Lange-Bertalot, 2005; Torgan y dos Santos, 2008).
73, Achnanthidium minutissimum; 74-75, Diadesmis confervacea; 76, Gomphonema laticollum; 77, Nitzschia fonticola; 78, Planothidium frequentissimum; 79, Sellaphora sp.; 80-82, Staurosira venter; 83-84, Stephanocyclus meneghiniana. cap: campo apical de poros; em: espinas marginales; fp: fultopórtula; rp: rimopórtula. Barras de escala: 72-75, 78, 80, 82, 89 representa 2μm; 76, 79 representa 5μm; 77, 81, 83 representa 1μm.
Eolimna tantula Hustedt (figs. 14-15). Valvas linear-elípticas, con ápices redondeados. Rafe filiforme, recto. Área axial linear y la central rectangular a asimétrica, por el acortamiento diferencial de las estrías centrales. Estrías radiales. Largo 7.8-13.9 (10.7±1.5)μm; ancho 3.2-4.2 (3.8±0.3)μm; estrías 24-30 (28.1±1.9)/10μm. n=20.
* Fallacia monoculata (Hustedt) D. G. Mann (figs. 16-17). Valvas elípticas con ápices ampliamente redondeados. Rafe filiforme, con extremos proximales expandidos y curvados hacia el mismo lado. Área axial estrecha y la central no discernible. Estrías radiales. A ambos lados del área axial hay una línea hialina, paralela hacia los ápices y convexa al centro de la valva, que aparentemente interrumpe el estriado. Largo 7.7-14.6 (10.9±1.8)μm; ancho 4.1-5.4 (4.6±0.4)μm; estrías 20-25 (22.2±1.4)/10μm. n=16.
+ Gomphonema laticollum Reichardt (figs. 18-19, 76). Valvas clavadas, con una ligera constricción entre el polo apical y el centro de la valva. Polo apical ampliamente redondeado y el basal subrostrado. Área hialina en el polo basal. Rafe lateral, sinuoso, con extremos proximales levemente expandidos y curvados hacia el lado donde se encuentra el estigma. Área axial linear y la central asimétrica por acortamiento diferencial de los 3 pares de estrías centrales. Un estigma en el área central. Estrías radiales conspicuamente areoladas. Largo 34.4-47.6 (41.6±3.3)μm; ancho 10-12.4 (11.1±0.6)μm; estrías 9-12 (10.5±0.7)/10μm; areolas 21-25 (23.3±1.4)/10μm. n=35. En MEB se observó que las estrías son uniseriadas. Diferencias con taxones similares: G.truncatum Ehrenberg tiene estrías biseriadas y es más acentuada la constricción entre el polo apical y el centro de la valva. En G.capitatum Ehrenberg es muy acentuada la constricción entre el polo apical y el centro de la valva (Reichardt, 2001; Tremarin, Bertolli, Faria, Costin y Ludwig, 2009). Nuevo registro para Guanajuato. Registrado en México para Jalisco (Abarca-Mejía, 2010).
Gomphonema mexicanum Grunow (figs. 20-21). Valvas clavadas, con el polo apical subrostrado y el basal agudamente redondeado. Área hialina en el polo basal. Rafe filiforme, recto, con extremos proximales ligeramente expandidos. Área axial linear y la central asimétrica —por el acortamiento de la estría central opuesta al estigma—. Un estigma en el área central, con un evidente desfasamiento entre las aperturas externa e interna. Estrías radiales, formadas por areolas discernibles en MO. Largo 28.1-45.8 (36.1±5.3)μm; ancho 9-10.8 (9.9±0.5 μm; estrías 9-12 (10.8±0.9)/10μm; areolas 20-24 (21.8±1.9)/10μm. n=18. En MEB, en vista interna de la valva, se observaron estrías uniseriadas, extremos proximales del rafe curvados hacia el lado donde está el estigma y el estigma alargado.
+ Gomphonema subclavatum (Grunow) Grunow (figs. 22-23). Valvas clavadas, con el polo apical ampliamente redondeado y el basal rostrado. Área hialina en el polo basal. Rafe lateral, sinuoso, con extremos proximales ligeramente expandidos. Área axial amplia y la central rectangular a asimétrica —por el acortamiento de la estría central opuesta al estigma—. Un estigma en el área central. Estrías radiales. Largo 28.4-44.2 (35.6±4.2μm; ancho 7.1-9.8 (8.1±0.7)μm; estrías 10-12 (10.8±0.6)/10μm. n=30. En 4 individuos se contaron areolas 25-28/10μm. En MEB se observó que las estrías son uniseriadas y que los extremos proximales del rafe están curvados en forma de gancho hacia el lado donde se encuentra el estigma. Nuevo registro para Guanajuato, documentado por Abarca-Mejía (2010) para Jalisco.
Gomphosphenia lingulatiformis (Lange-Bertalot y Reichardt) Lange-Bertalot (figs. 24-26). Valvas clavadas a linear-clavadas, con un ensanchamiento en el área central en los individuos más grandes, con ápices agudamente redondeados. Rafe filiforme, recto, con los extremos proximales ligeramente expandidos. Nódulo central circular en vista valvar y en vista cingular detectable como una hendidura. Área axial linear-lanceolada y la central indistinguible de la axial. Estrías radiales. Largo 13.2-49 (29.5±9.2)μm; ancho 4.3-6.8 (5.2±0.5)μm; estrías 17-20 (18.4±0.7)/10μm. n=40. Nuevo registro para Guanajuato, documentado por Abarca-Mejía (2010) para el río Lerma entre los estados de Michoacán y Jalisco.
* Hantzschia abundans Lange-Bertalot (fig. 27). Valvas lineares semiarqueadas, con el margen fibulado cóncavo y el margen opuesto convexo; ápices agudamente rostrados. Rafe excéntrico, marginal; el par de fíbulas centrales más separadas que el resto. Estrías radiales, excepto cerca de los ápices, donde son paralelas a ligeramente convergentes. Largo 79.5-94.9 (86±3.7)μm; ancho 9.8-11.7 (10.7±0.5)μm; fíbulas 5-8 (7.2±0.8)/10μm; estrías 14-18 (16.9±1)/10μm. n=22. Esta especie es más grande, más ancha y tiene una densidad de estrías menor que Hantzschia amphioxys (Ehrenberg) Grunow [largo 23.4-47 (33.7±6.7)μm; ancho 4.5-7.7 (5.9±1)μm; fíbulas 6-8 (7.2±0.8)/10μm; estrías 19-26 (23.4±2)/10μm. n=16]. Además, H.amphioxys tiene ápices rostrados a subcapitados, proporcionalmente más anchos que los de H.abundans.
Mayamaea atomus var. permitis (Hustedt) Lange-Bertalot (figs. 28-30). Valvas elípticas con ápices redondeados. Esternón muy silicificado, recto, con el nódulo central y los polares claramente distinguibles. Estrías no visibles en MO. Largo 7.6-8.6 (8±0.3)μm; ancho 3.3-3.8 (3.5±0.2)μm. n=12. La variedad nominal es más larga y más ancha, y además las estrías son menos densas, por lo que es posible observarlas en MO (Lange-Bertalot, 2001).
Navicula veneta Kützing (figs. 31-32). Valvas lanceoladas con ápices subrostrados. Rafe filiforme, recto, con extremos proximales ligeramente expandidos y los distales curvados hacia el lado secundario de la valva (donde se encuentra la discontinuidad de Voigt). Área axial linear, estrecha; la central es rectangular a elíptica. Estrías radiales, excepto en los ápices, donde son convergentes. Largo 18.4-30.6 (24.5±3.1)μm; ancho 4.7-7.2 (5.8±0.6)μm; estrías 13-16 (14.4±0.7)/10μm. n=21.
* Navigiolum uruguayense Metzeltin, Lange-Bertalot y García-Rodríguez (figs. 33-34). Valvas linear-lanceoladas con los ápices cuneados. Rafe filiforme, escasamente curvado, con los extremos proximales ligeramente expandidos. Área axial amplia, lanceolada; la central no se distingue de la axial. Estrías radiales, excepto las de los ápices, que pueden ser paralelas. Al centro de la valva hay una alternancia de estrías cortas y largas; las largas son ligeramente sinuosas. Largo 16.6-17.8 (17.1±0.6)μm; ancho 5.4-5.8 (5.6±0.2)μm; estrías 14-17 (15.7±1.5)/10μm. n=3.
* Neidium bisulcatum (Lagerstedt) Cleve (figs. 35-36). Valvas lineares con ápices redondeados. Al lado de cada margen hay una línea hialina. Rafe filiforme, recto, con los extremos proximales curvados en dirección opuesta. Área axial linear, estrecha; la central es elíptica. Estrías ligeramente radiales a paralelas, formadas por areolas discernibles en MO. Largo 39.3-43.8 (41.5±3.2)μm; ancho 7.9-8.7 (8.3±0.6)μm; estrías 22-23 (22.6±0.6)/10μm; areolas 19-20 (19.5±1.3)/10μm. n=2.
Nitzschia amphibia Grunow (figs. 37-38). Valvas lanceoladas a linear-lanceoladas con ápices agudamente redondeados. Rafe excéntrico, marginal; fíbulas prácticamente equidistantes, excepto en algunos ejemplares, donde el par central se observa ligeramente más separado que el resto. Estrías formadas por poros fácilmente discernibles en MO. Largo 16.5-35.9 (25.7±3.9)μm; ancho 4-5.2 (4.6±0.3)μm; fíbulas 7-10 (8±0.7)/10μm; estrías 16-18 (16.9±0.5)/10μm; poros 20-24 (21.8±1.5)/10μm. n=25.
Nitzschia capitellata Hustedt (figs. 39-40). Valvas linear-lanceoladas ligeramente constreñidas en el centro con ápices subrostrados a rostrados. Rafe excéntrico, marginal; par de fíbulas centrales más distanciadas que el resto. Estrías muy finas, apenas detectables en MO. Largo 26.4-54.8 (38.5±7.2)μm; ancho 4.1-5.2 (4.6±0.3)μm; fíbulas 10-14 (12±1.3)/10μm. n=30.
Nitzschia communis Rabenhorst (fig. 41). Valvas lineares con márgenes paralelos en el centro de la valva y con ápices ampliamente redondeados. Rafe excéntrico, marginal; fíbulas equidistantes. Estrías muy finas, no detectables en MO. Largo 24.9-35 (30.7±3)μm; ancho 4-4.7 (4.4±0.2)μm; fíbulas 10-12 (10.4±0.8)/10μm. n=12. En MEB se encontró una valva con 33 estrías en 10μm.
Nitzschia desertorum Hustedt (figs. 42-43). Valvas lanceoladas con ápices rostrados, agudamente redondeados. Rafe excéntrico, marginal; fíbulas equidistantes, aunque en algunos casos el par central está escasamente más distanciado que el resto. Estrías detectables en MO. Largo 14.4-19.7 (17.4±1.9)μm; ancho 3.9-4.6 (4.2±0.2)μm; fíbulas 11-15 (12.9±1.2)/10μm; estrías 23-26 (24.6±1)/10μm. n=15.
Nitzschia fonticola (Grunow) Grunow (figs. 44-45, 77). Valvas linear-lanceoladas con ápices subrostrados a subcapitados. Rafe excéntrico, marginal; par de fíbulas centrales más distantes que el resto, aunque en algunos casos no fue tan evidente esta separación. Estrías finas, pero detectables en MO. Largo 25.2-43.2 (31.4±4.9)μm; ancho 3.1-4.3 (3.6±0.3)μm; fíbulas 8-11 (9.4±0.9)/10μm; estrías 27-28 (27.5±0.3)/10μm. n=15. En MEB se observó que las estrías son uniseriadas, formadas por poros redondos. Del lado del canal rafidiano las estrías son biseriadas. Estas observaciones coinciden con lo descrito por Trobajo, Mann, Chepurnov, Clavero y Cox (2006) en la tipificación de esta especie.
Nitzschia frustulum (Kützing) Grunow (figs. 46-47). Valvas linear-lanceoladas con ápices agudamente redondeados. Rafe excéntrico, marginal; fíbulas prácticamente equidistantes, excepto el par central, que presenta una mayor separación. Estrías detectables en MO. Largo 10.7-25.3 (16.2±3.7)μm; ancho 2.5-3.3 (2.8±0.2)μm; fíbulas 10-15 (12±1.3)/10μm; estrías 22-29 (23.4±1.7)/10μm. n=24.
Nitzschia inconspicua Grunow (figs. 48-49). Valvas lanceoladas con ápices cuneados. Rafe excéntrico, marginal; par de fíbulas centrales más espaciadas que el par central. Estrías finas, pero detectables en MO. Largo 6.4-16.1 (8.9±2)μm; ancho 2.4-3.8 (3±0.3)μm; fíbulas 9-15 (12.2±1.5)/10μm; estrías 24-30 (26.2±2)/10μm. n=28.
Nitzschia palea (Kützing) W. Smith (figs. 50-51). Valvas lanceoladas a linear-lanceoladas con ápices rostrados a subcapitados. Rafe excéntrico, marginal; fíbulas equidistantes, incluyendo el par central. Estrías muy finas, prácticamente invisibles en MO. Largo 22.8-41 (32±4.4)μm; ancho 4-5.3 (4.6±0.4)μm; fíbulas 10-14 (12±1.2)/10μm. n=23.
* Nitzschia solita Hustedt (figs. 52-53). Valvas linear-lanceoladas con ápices subrostrados a rostrados. Rafe excéntrico, marginal; fíbulas alargadas, prácticamente equidistantes unas de otras, incluyendo el par central. Estrías visibles en MO. Largo 19.7-34 (25.5±4)μm; ancho 4.5-5.2 (4.8±0.2)μm; fíbulas 10-15 (12.4±1.3)/10μm; estrías 24-27 (25.7±0.6)/10μm. n=23.
Nitzschia umbonata (Ehrenberg) Lange-Bertalot (fig. 54). Valvas lineares con ápices subrostrados a rostrados. El margen donde se encuentran las fíbulas está ligeramente constreñido en el centro y el otro es prácticamente recto. Rafe excéntrico, marginal; par de fíbulas centrales más espaciadas que el resto. Estrías visibles en MO. Largo 37.8-79.1 (57.6±11.7)μm; ancho 6.9-8 (7.6±0.3)μm; fíbulas 6-11 (8.1±1.2)/10μm; estrías 22-27 (25±1.3)/10μm. n=30.
Nitzschia aff. paleacea (Grunow) Grunow (fig. 55). Valvas lineares, aciculares, con ápices subrostrados. Rafe excéntrico, marginal; fíbulas equidistantes, excepto el par central, que está más distanciado. Estrías indetectables en MO. Largo 33.4-53 (42.7±6.2)μm; ancho 2.1-3.1 (2.6±0.2)μm; fíbulas 11-15 (13.8±1)/10μm. n=15. Difiere del mínimo de fíbulas en 10μm documentado por Cox (1996) y Krammer y Lange-Bertalot (1988), ya que estos autores lo registran en 14, con un intervalo de 14 a 19.
Nitzschia sp. 1 (figs. 56-57). Valvas lanceoladas con ápices rostrados a subcapitados. Rafe excéntrico, marginal; todas las fíbulas equidistantes. Estrías no detectables en MO. Largo 11.5-17.6 (14.8±1.7)μm; ancho 2.9-3.8 (3.3±0.3)μm; fíbulas 15-18 (15.8±0.7)/10μm. n=19.
Planothidium frequentissimum (Lange-Bertalot) Lange-Bertalot (figs. 60-62, 78). Frústulos monorrafídeos. Valvas elípticas a linear-elípticas con ápices ampliamente redondeados. Rafe filiforme, recto, con los extremos proximales expandidos. La valva con rafe tiene un área axial muy estrecha y el área central es elíptica a asimétrica. La valva sin rafe tiene un área axial linear, estrecha, y la central es un cavum. Estrías radiales. Largo 10.9-16.1 (12.8±1.4)μm; ancho 4.6-5.7 (5.2±0.3)μm; estrías 12-16 (13.7±1)/10μm. n=30 (valvas sin rafe).
* Planothidium incuriatum C.E. Wetzel, van de Vijver y Ector (figs. 58-59). Frústulos monorrafídeos. Valvas lanceoladas con ápices rostrados a subcapitados. Rafe filiforme, recto, con extremos proximales expandidos. La valva con rafe tiene un área axial muy estrecha y la central es rectangular o elíptica. La valva sin rafe tiene un área axial linear, estrecha; la central es una depresión con «techo» en forma de U, expandida hacia un lado de la valva (cavum). Estrías radiales. Largo 16.1-22.6 (21.2±1.5)μm; ancho 6-7.5 (6.8±0.3)μm; estrías 12-14 (13.4±0.5)/10μm. n=20 (valvas sin rafe). Se diferencia de P.biporomum (Hohn et Hellerman) Lange-Bertalot por el contorno de la valva con ápices más rostrados en vez de capitados (Wetzel, van de Vijver, Hoffmann y Ector, 2013).
* Sellaphora bacilloides Hustedt (figs. 63-64). Valvas elípticas con ápices redondeados. Rafe filiforme, recto, con los extremos proximales expandidos y ligeramente curvados hacia el mismo lado. Área axial estrecha y la central elíptica, formada por el acortamiento de las estrías centrales. Estrías radiales, ligeramente más separadas en el centro. Largo 30-32.4 (31.3±0.9)μm; ancho 11-12 (11.2±0.4)μm; estrías 21-22 (21.6±0.5)/10μm. n=5.
Sellaphora pupula (Kützing) Mereschkowsky (figs. 65-66). Valvas elípticas a linear-elípticas con ápices subrostrados a subcapitados, ampliamente redondeados. Barras transversales hialinas en ambos ápices (barras polares). Rafe filiforme, recto, con los extremos proximales expandidos y los distales curvados hacia el mismo lado. Área axial linear, muy estrecha; el área central tiene forma deltoide. Estrías radiales, ligeramente sinuosas hacia los ápices. Largo 12.8-30.6 (22.3±4)μm; ancho 5.9-8 (7.3±0.4)μm; estrías 18-22 (20.3±1.4)/10μm. n=22. Los ejemplares observados comprenden una amplia variedad de formas, lo cual requiere estudios a detalle, ya que está comprobado que las diferentes variedades y formas que conforman S.pupula son un complejo de varias especies, las cuales están siendo validadas mediante caracteres morfológicos, citológicos, reproductivos, genéticos y ecológicos (Mann, 2001; Mann et al., 2004; Poulíčková, Špačkova, Kelly, Duchoslav y Mann, 2008).
Sellaphora sp. (figs. 67-68, 79). Valvas linear-elípticas con ápices subcapitados, ampliamente redondeados. Área hialina en los ápices, de forma más o menos triangular alrededor del rafe. Rafe filiforme, ligeramente sinuoso, con extremos proximales ligeramente expandidos y curvados en dirección opuesta a donde se curvan los extremos distales. Área axial linear, estrecha; la central es elíptica a rombo-elíptica. Estrías radiales, ligeramente sinuosas cerca de los ápices. Largo 20-40.1 (27±6.1)μm; ancho 6.9-8.4 (7.5±0.4)μm; estrías 20-22 (20.8±0.8)/10μm. n=28. En MEB se observó que las estrías son uniseriadas. Se diferencia del complejo S.pupula porque los extremos proximales del rafe están ligeramente curvados, no presenta las características barras hialinas transversales en los ápices, el área axial es ligeramente más ancha y porque el área central no tiene forma deltoide.
Staurosira venter (Ehrenberg) H. Kobayasi (figs. 69-70, 80-82). Frústulos solitarios o formando cadenas. Valvas elípticas con ápices ampliamente redondeados. Área axial elíptica a lanceolada. Estrías alternas y radiales. Largo 6-8.4 (7.4±0.7)μm; ancho 3.2-4.8 (4.3±0.4)μm; estrías 13-15 (14.1±0.5)/10μm. n=15. De acuerdo con Morales (2001) y Morales, Siver y Trainor (2001), en MO este taxón puede ser confundido con Staurosira elliptica (Schumann) Williams et Round, Staurosirella pinnata (Ehrenberg) Williams et Round, y con Pseudostaurosira brevistriata (Grunow) Williams et Round. Las observaciones en MEB confirmaron la identidad de este taxón, ya que tiene poros en los ápices de la valva, las areolas son ovales a ligeramente lineoladas; además, las espinas se encuentran entre las estrías y son espatuladas con digitaciones que se conectan a las areolas de la valva adyacente, lo cual coincide con lo descrito por Morales (2010) como Staurosira construens var. venter (Ehrenberg) Hamilton.
Stephanocyclus meneghiniana Kützing (figs. 71-72, 83-84). Valvas circulares, onduladas concéntricamente. Estrías marginales, gruesas, radiales, extendiéndose del margen hacia el centro, aproximadamente un cuarto del radio. En el área central hay de 1-3 fultopórtulas. Diámetro 8.1-14.7 (12.7±1.9)μm; estrías 7-9 (7.8±0.6)/10μm. n=30. En MEB, en vista externa, se observaron espinas marginales interrumpiendo las estrías y gránulos de sílice distribuidos por toda la valva. En vista interna se observaron fultopórtulas entre las estrías en relación 1:1 y una rimopórtula en la interestría.
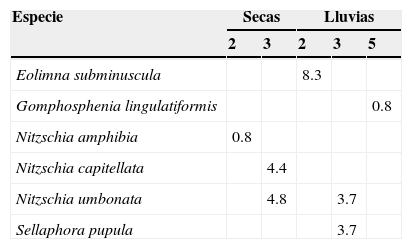
Formas teratológicasSe encontraron formas teratológicas en 6 especies. Estas alteraciones se encontraron en los sitios 2 y 3 en ambas temporadas y en el sitio 5 en lluvias. Su abundancia relativa por especie varió de 0.8 a 8.3% (tabla 5):
- 1.
Eolimna subminuscula: presenta un contorno valvar deforme (figs. 85-91). Los posibles agentes causales de esta teratología son metales pesados, principalmente cadmio, además de plomo, cobre y zinc (Falasco et al., 2009b). Formas teratológicas de esta especie fueron registradas para el Alto Lerma por Segura-García (2011), aunque en menor abundancia (cercano al 4%).
Figuras 85-117.85-91, Eolimna subminuscula: 85-87, formas normales; 88-91, formas teratológicas; 92-97, Gomphosphenia lingulatiformis: 92-94, formas normales; 95-97, formas teratológicas; 98-103, Nitzschia amphibia: 98-100, formas normales; 101-103, formas teratológicas; 104-109, Nitzschia capitellata: 104-105, formas normales; 106-109, formas teratológicas; 110-111, Nitzschia umbonata: 110, forma normal; 111, forma teratológica; 112-117, Sellaphora pupula: 112-114, formas normales; 115-117, formas teratológicas. Barra de escala 10μm.
(0.38MB). - 2.
Gomphosphenia lingulatiformis: presenta deformación del contorno valvar (fig. 92-97). No hay registro previo de los posibles agentes causales de esta teratología.
- 3.
Nitzschia amphibia: presenta contorno valvar deforme, desplazamiento del rafe y cambio en el patrón de estriado (figs. 98-103). Los posibles agentes causales de las deformaciones del contorno valvar son metales pesados en la columna de agua como: cadmio, arsénico, plomo y mercurio; y en sedimentos: cadmio, cobre, mercurio, plomo y zinc (Peres-Weerts, 2000). No hay referencias de las causas de desplazamientos del rafe ni de cambios en el patrón de estriado.
- 4.
Nitzschia capitellata: se observaron valvas con deformidades en el contorno y desplazamientos del rafe (figs. 104-109). No hay registros de los posibles agentes causales de estas teratologías.
- 5.
Nitzschia umbonata: presenta desplazamiento del rafe y cambio en el patrón de estriado (figs. 110-111). Los posibles agentes causales son metales pesados: níquel, cobre y plomo (Gómez, Sierra, Cortelezzi, Rodrigues-Capítulo, 2008).
- 6.
Sellaphora pupula: presenta deformaciones del contorno valvar (figs. 112-117). No hay registros de los posibles agentes causales de esta teratología.
Abundancia relativa (%) de las formas teratológicas de 6 especies en la cuenca alta del río Laja. Los sitios que presentaron estas alteraciones morfológicas fueron el 2 (salida Dolores Hidalgo) y 3 (rancho San Gabriel) en ambas temporadas y el 5 (La Gruta) en lluvias.
| Especie | Secas | Lluvias | |||
|---|---|---|---|---|---|
| 2 | 3 | 2 | 3 | 5 | |
| Eolimna subminuscula | 8.3 | ||||
| Gomphosphenia lingulatiformis | 0.8 | ||||
| Nitzschia amphibia | 0.8 | ||||
| Nitzschia capitellata | 4.4 | ||||
| Nitzschia umbonata | 4.8 | 3.7 | |||
| Sellaphora pupula | 3.7 | ||||
La presente investigación aporta 138 nuevos registros para la cuenca alta del río Laja. Siete especies son nuevos registros para México, siendo Navigiolum nuevo registro de género para el país, además de 3 nuevos registros para el estado de Guanajuato, lo cual representa una contribución importante al conocimiento de las diatomeas de esta cuenca y de México, base para cualquier estudio aplicado que utilice a las diatomeas, ya sea ecológico, biogeográfico o de monitoreo ambiental. A pesar de que la cuenca Lerma-Chapala es una de las cuencas mejor estudiadas de México en cuanto a diatomeas (Abarca-Mejía, 2010; Cantoral-Uriza y Mora-Hernández, 2012; Segura-García, 2011), estos 7 nuevos registros enfatizan la necesidad de continuar los estudios de la diversidad de diatomeas en esta cuenca y en otras zonas poco exploradas del país, ya que incluso zonas relativamente bien trabajadas aún aguardan diversidad por conocer.
La identificación de los taxones encontrados en este estudio se hizo mediante caracteres morfológicos, en los que se basa gran parte de la diversidad descrita para este grupo de algas, aunque es necesaria la incorporación de más caracteres para su identificación, ya que la morfología de la valva no siempre es suficiente para la distinción entre especies (Alverson, 2008; Mann, 1999).
En este estudio se encontraron varias dificultades al asignar nombres a los ejemplares observados. En casos como Achnanthidium minutissimum, Cocconeis placentula, Gomphonema parvulum, Nitzschia palea y Sellaphora pupula se trabajaron a nivel de complejo, aunque es creciente la evidencia de las múltiples especies o variedades que los integran, conforme se van redefiniendo los criterios para la delimitación de especies al incorporar más herramientas para su identificación; por ejemplo, caracteres moleculares e información ambiental (Abarca et al., 2014; Jahn, Kusber y Romero, 2009; Kermarrec, Bouchez, Rimet y Humbert, 2013; Mann, Thomas y Evans, 2008; Potapova y Hamilton, 2007; Romero y Jahn, 2013; Rose y Cox, 2014; Trobajo et al., 2009; Wojtal et al., 2011; Zimmermann et al., 2014). A esto hay que sumar la escasez de monografías de identificación propias del trópico.
Aunque los sitios de muestreo son ambientes lóticos, se encontraron diatomeas centrales, características de ambientes lénticos: Aulacoseira granulata, Cyclostephanos invisitatus, Discostella pseudostelligera, Stephanocyclus meneghiniana y Thalassiosira weissflogii, alcanzando abundancias relativas tan altas como el 15.8% para el caso de S.meneghiniana en el sitio 3 durante la temporada de lluvias. La revisión del material vivo, previo a la preparación de las laminillas permanentes, confirmó la presencia de estas especies, descartando la posibilidad de que fuesen células acarreadas por la corriente de algunas de las represas que se encuentran en el río. Por lo tanto, la explicación más plausible es la presencia de una comunidad metafítica —crecimiento asociado a otras algas—, como lo documentado en México para Aulacoseira granulata (Oliva-Martínez, Ramírez-Martínez, Garduño-Solórzano, Cañetas-Ortega y Ortega, 2005) y Stephanocyclus meneghiniana (Valadez-Cruz et al., 1996). Las 5 especies antes mencionadas también han sido registradas en ambientes lóticos por Abarca-Mejía (2010), Cox (1996), Lowe (1974), Ramírez-Vázquez et al. (2001) y Segura-García (2011).
Respecto a los valores de pH registrados, todos alcalinos, la flora diatomológica lo confirma, ya que los taxones son característicos de aguas alcalinas, especies alcalífilas y alcalibiónticas; por ejemplo, Amphora copulata, Diadesmis confervacea y las especies encontradas de Nitzschia. También se encontraron especies sin un óptimo aparente (indiferentes), pero ninguna acidófila o acidobióntica (De Wolf, 1982 y Van Dam, Mertens y Sinkeldam, 1994).
Por sus concentraciones de nutrientes —esto es, fósforo y nitrógeno totales—, el estado trófico de los sitios estudiados va de meso a eutrófico (Dodds, Jones y Welch, 1998). Nuevamente la flora diatomológica confirma esto; por ejemplo, Amphora copulata, Eolimna tantula, Nitzschia fonticola y Staurosira venter son registradas como indicadoras de aguas mesotróficas. Diadesmis confervacea, Nitzschia inconspicua, N.frustulum y N.aff.paleacea son registradas como afines a ambientes eutróficos (Cox, 1996; Besse-Lototskaya, Verdonschot, Coste y van de Vijver, 2011; Licursi y Gómez, 2003; Lowe, 1974; Segura-García, Cantoral-Uriza, Israde y Maidana, 2012; Van Dam et al., 1994). Y en el caso de Navicula veneta, Nitzschia capitellata, N.palea, N.umbonata, Sellaphora pupula y Stephanocyclus meneghiniana son ampliamente registradas como afines a ambientes eutróficos e hipertróficos, e incluso muy tolerantes a contaminación por descargas de aguas domésticas e industriales (Abarca-Mejía, 2010; Besse-Lototskaya et al., 2011; Lange-Bertalot, 2001; Licursi y Gómez, 2003; Potapova y Charles, 2007; Segura-García et al., 2012; Van Dam et al., 1994).
De acuerdo con su distribución geográfica, el 75% de la flora es de amplia distribución o cosmopolita, similar a lo encontrado por Abarca-Mejía (2010) y Segura-García (2011) para el río Lerma. Únicamente el 6% de las especies presenta una clara distribución pantropical, algo que parecería contradictorio para un estudio en el trópico, aunque este número seguramente se vería incrementado por 2 motivos: a)con los taxones no identificados a nivel de especie, posiblemente de distribución pantropical, ya que no se encontraron especies parecidas en la bibliografía actual, y b)algunos taxones fueron trabajados a nivel de complejos de especies, por lo que la revisión crítica de estos complejos puede contribuir al incremento de especies restringidas al trópico.
Se encontraron 6 especies que presentaron formas teratológicas, el doble de las encontradas por Segura-García (2011) para el Alto Lerma, quien las encontró en abundancias relativas del 2 al 38% por especie. Majewska, Zgrundo, Lemke y de Stefano (2012) encontraron estas alteraciones en intervalos del 1.4 al 40% en varias diatomeas epilíticas y epipsámicas en el estuario del río Vístula en Polonia. Y en las diferentes redes de monitoreo de calidad del agua que emplean a las diatomeas como bioindicadores en Francia se ha encontrado que las teratologías nunca representan más del 2.3% en sedimentos contaminados por metales pesados (Prygiel, 2002).
En la literatura se registra que los posibles agentes causales de las formas teratológicas de 3 (Eolimna subminuscula, Nitzschia amphibia y N.umbonata) de las 6 especies encontradas en el Alto Laja son metales pesados (Falasco et al., 2009b; Gómez et al., 2008; Peres-Weerts, 2000). Aunque no se hizo un análisis de metales pesados del agua ni del sedimento, existe la posibilidad de que haya plomo, utilizado en el vidriado en la alfarería mexicana en forma de óxido de plomo, también conocido como «greta» (Covarruvias-Pérez y Estrada-Sánchez, 2010; Rojas-Navarrete, 1995). Se considera esta posibilidad ya que la ciudad de Dolores Hidalgo es un reconocido centro alfarero en México (Rojas-Navarrete, 1995) y, como se pudo constatar en este estudio, las aguas residuales de la ciudad eran incorporadas sin un aparente tratamiento, previo al sitio de muestreo 2 durante la temporada seca-fría, sitio a partir del cual se detectaron teratologías en diatomeas.
Se encontró que los sitios-temporadas en los que se hallaron formas teratológicas, posiblemente afectados por metales pesados, tuvieron la menor riqueza específica y estuvieron dominados por taxones conocidos por su tolerancia a la contaminación (Nitzschia amphibia, N.capitellata y Sellapora pupula) (Besse-Lototskaya et al., 2011; Segura-García et al., 2012). Lo anterior coincide con lo encontrado por Luís, Teixeira, Almeida, Matos y Ferreira da Silva (2011), quienes concluyen que ante la contaminación por metales pesados, las diatomeas responden mediante cambios en la estructura de la comunidad (disminución de la diversidad e incremento en la abundancia de los taxones más tolerantes) y también mediante alteraciones morfológicas (teratologías).
Como lo indican Dziengo-Czaja et al. (2008), Falasco et al. (2009a), McFarland, Hill y Willingham (1997) y Morin et al. (2008b), las formas teratológicas de diatomeas son una buena métrica a incorporar en el monitoreo de la calidad del agua, ya que son un indicador de perturbaciones crónicas en los sistemas acuáticos. Los hallazgos en el Laja demuestran que son necesarios más estudios de campo acoplados a estudios experimentales para tener una idea más certera de los agentes causales de las anomalías observadas y conocer si los efectos observados están determinados por un agente en particular o son el resultado de la interacción de varios.
Al Posgrado en Ciencias Biológicas de la Universidad Nacional Autónoma de México. Al Conacyt por la beca de maestría otorgada al primer autor (245626). A la UNAM-PAPIIT por el financiamiento para los proyectos IN 211512 e IN 211712. Al Programa de Manejo Integrado de Cuencas de la Universidad Autónoma de Querétaro, por el apoyo para las salidas de campo. A Nora Maidana su ayuda en la identificación taxonómica. A Rocío Ramírez, Mariana Cartagena y Miriam Bojorge su apoyo en laboratorio. A Lucía Tovar y Mahinda Martínez la asistencia en el microscopio electrónico de barrido. A Verónica Aguilar-Zamora por la elaboración del mapa. A Martin Jagodzinski su ayuda en la edición de las figuras. A los 2 revisores anónimos por sus comentarios, que contribuyeron a mejorar este trabajo.
La revisión por pares es responsabilidad de la Universidad Nacional Autónoma de México.