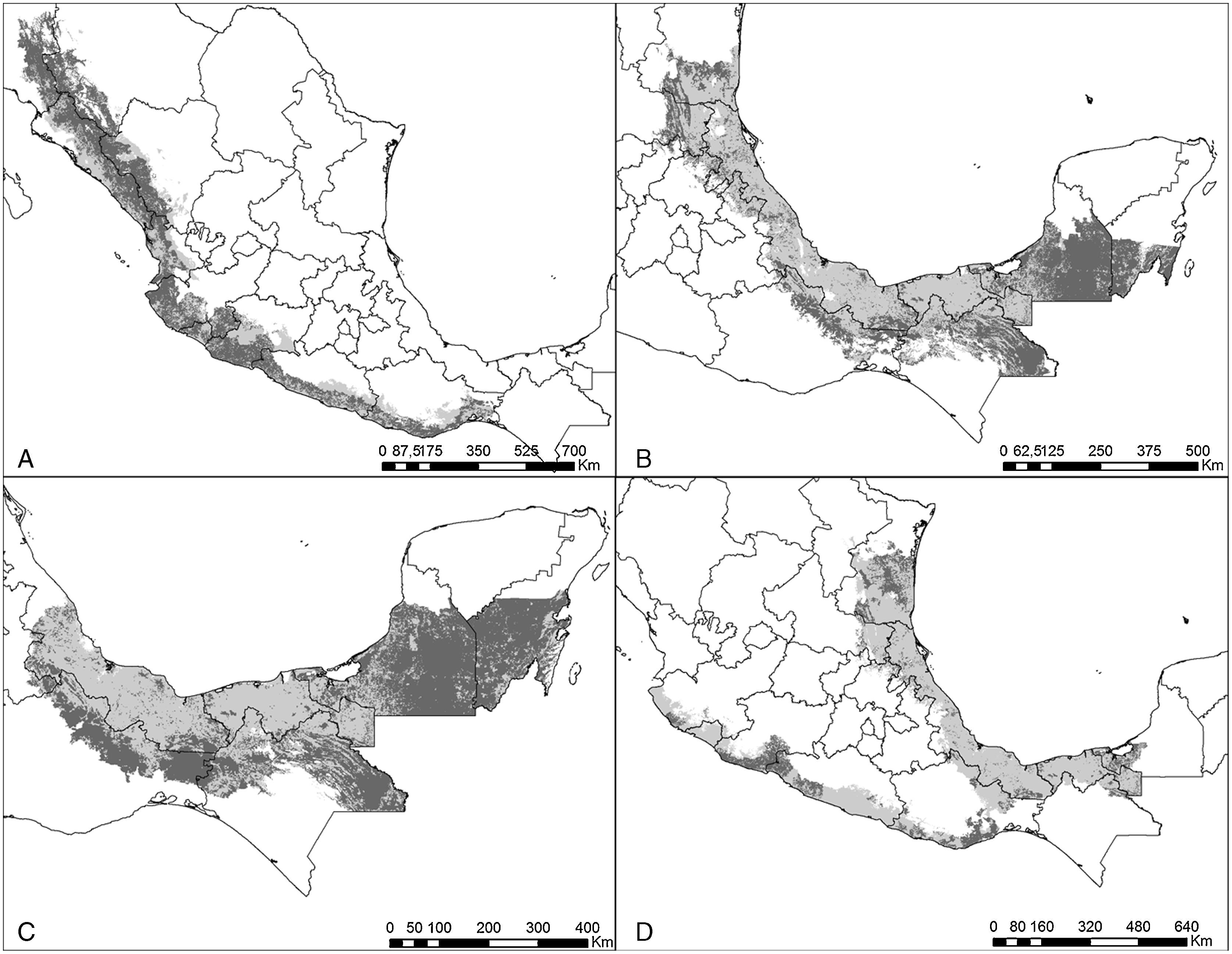
Se estimó la distribución histórica y contemporánea para la familia Psittacidae en México utilizando la mayor base de datos integrada hasta ahora y modelos ecológicos de nicho. Los modelos se generaron mediante el algoritmo MaxEnt. Se utilizaron temperatura y precipitación y se analizó la vegetación disponible y las áreas naturales protegidas decretadas hasta 2015. Los modelos no presentaron errores de omisión y permiten contar con estimaciones actuales para cada especie. La mayor distribución se estima para Amazona albifrons y la menor para Amazona auropalliata. Los resultados indican que todas las especies han perdido hábitat, principalmente Ara macao, Amazona auropalliata y A. oratrix. Aunque los bosques tropicales predominan en su distribución, los bosques templados presentan altos porcentajes para 6 especies. La proporción de superficie protegida es superior a estimaciones del año 2000. La estimación precisa de la distribución de los psitácidos presentes en México tiene implicaciones de conservación a nivel internacional, ya que 6 especies son endémicas y 4 tendrían su mayor distribución potencial en México de acuerdo con cifras de la IUCN. Ante la pérdida de distribución, algunas especies presentan una elevada vulnerabilidad presente y futura, por lo que se debe examinar la relación entre aptitud ambiental de los modelos y patrones de abundancia poblacional. El uso de modelos de nicho ecológico para evaluar cambios en distribución asociados al cambio climático es necesario.
The historic and contemporary distribution for the Psittacidae family in Mexico using the greatest database assembled until now was estimated. The ecological niche models were generated with the MaxEnt algorithm. Temperature and precipitation were used, as well as an analysis of vegetation and availability of protected areas established until 2015. The models did not present omission errors and allow to have updated estimates for each species. The species with the greatest potential distribution was Amazona albifrons, and Amazona auropalliata had the smallest one. The results indicate that all the species have lost suitable habitat area, especially Ara macao, Amazona auropalliata and A. oratrix. Although tropical forests are present on most species distributions, temperate forests had a high cover percentage for 6 species. The proportion of protected area for each species was higher when compared with previous estimates from the year 2000. The precise estimate of the distribution of Mexican Psittacidae has international conservation implications, as 6 species are endemic and 4 species may present their greater potential distribution in Mexico according to IUCN information. Due to habitat loss some species have a high vulnerability, present and future, making it necessary to examine the relationship between environmental suitability and patterns of population abundance. The use of ecological niche models to evaluate distributional changes associated with climate change may be also necessary.
La familia Psittacidae en México y en el Neotrópico presenta un elevado porcentaje de especies en riesgo (Cantú, Sánchez, Grosselet y Silva, 2007; Collar y Juniper, 1992; Juniper y Parr, 1998). En México la familia está representada por 21 especies (American Ornithologists’ Union, 1998; Chesser et al., 2014; Escalante-Pliego, Navarro-Sigüenza y Peterson, 1993; Howell y Webb, 1995), las cuales enfrentan explotación local y regional para el comercio de mascotas, además de altas tasas de deforestación tanto en bosques templados como en bosques tropicales (1976-2000) (Cantú et al., 2007; Mas et al., 2004). La Norma Oficial Mexicana NOM-059-SEMARNAT-2010 incluye 10 especies en peligro de extinción: Amazona auropalliata, A. farinosa, A. finschi, A. oratrix, A. viridigenalis, Ara macao, A. militaris, Pyrilia haematotis, Rhynchopsitta pachyrhyncha, R. terrisi, al igual que 3 subespecies endémicas: Psittacara holochlorus brevipes, P. h. brewsteri y Forpus cyanopygius insularis. Se enlista como amenazadas a 6 especies: Amazona xantholora, Psittacara holochlora, P. strenuus, Bolborhynchus lineola, Brotogeris jugularis y Pionus senilis. El resto de las especies son consideradas como sujetas a protección especial: Amazona albifrons, Eupsittula canicularis, E. nana y Forpus cyanopygius (Semarnat, 2010).
A nivel internacional, la lista roja de la Unión Internacional para la Conservación de la Naturaleza (UICN) incluye 8 especies en alguna categoría de riesgo (IUCN, 2015), y la Convención sobre el Comercio Internacional de Especies Amenazadas de Fauna y Flora Silvestres (CITES) incluye todas las especies en sus apéndices i y ii (CITES, 2015).
Ante el riesgo de extinción que presentan las especies de psitácidos en México, los diagnósticos efectuados hasta ahora se han enfocado en estimaciones de distribución potencial histórica y cambios hipotéticos en su disponibilidad de hábitat primario (bosques) (Ríos-Muñoz y Navarro-Sigüenza, 2009). En México las primeras estimaciones sobre distribución de psitácidos fueron realizadas por Navarro-Sigüenza y Peterson (2007), mediante modelos de nicho ecológico con el algoritmo GARP, variables climáticas de WorldClim y registros históricos de presencia de las especies procedentes de colecciones científicas. En otro estudio, se generaron estimaciones para distintos periodos de tiempo, acotándola para el año 2000 a la vegetación primaria utilizada por los psitácidos (Ríos-Muñoz y Navarro-Sigüenza, 2009). Sin embargo, existen algunas limitaciones en los modelos que no emplean registros de campo recientes, ya que se puede sobreestimar o subestimar de forma muy importante la distribución de los psitácidos; estos pueden ser extirpados de regiones enteras o municipios aun en presencia de una importante cobertura de hábitat primario debido al saqueo y al tráfico ilegal (Monterrubio-Rico et al., 2007). Este fenómeno se ha observado en A. oratrix, que ha sido extirpada de todos los municipios de la costa sur del estado de Guerrero y del estado de Colima (Monterrubio-Rico, Renton, Ortega-Rodríguez, Pérez-Arteaga y Cancino-Murillo, 2010). También puede subestimarse su distribución si se incluye solo hábitat primario, ya que varias especies de psitácidos toleran paisajes fragmentados y áreas agropecuarias, como se ha observado en A. autumnalis, A. oratrix o A. viridigenalis, que toleran y anidan en ambientes agropecuarios mientras persistan árboles con las características necesarias para anidar y se evite el saqueo de nidos (Enkerlin-Hoeflich, 1995).
La pérdida de distribución en áreas con hábitat primario se ha atribuido principalmente al saqueo de nidos y la tala selectiva de árboles maduros, representando hasta un 38% de la pérdida de distribución para una región (Monterrubio-Rico et al., 2007). Las especies de psitácidos carismáticos y de mayor tamaño son las más vulnerables al saqueo de nidos, especies como A. militaris, que fue extirpada de la costa de Michoacán en los años ochenta (Monterrubio-Rico, de Labra-Hernández, Ortega-Rodríguez, Cancino-Murillo y Villaseñor-Gómez, 2011). La extirpación local de especies en áreas de México también ha afectado a comunidades de alta riqueza como la región de Los Tuxtlas en Veracruz (Schaldach y Escalante-Pliego, 1997), donde se han perdido tanto especies carismáticas (A. oratrix o A. macao) como ensambles completos de especies (De Labra-Hernández, Escalante, Monterrubio-Rico y Coates-Estrada, 2010; Schaldach y Escalante-Pliego, 1997).
Algunos estudios han combinado modelos de nicho ecológico y registros de campo recientes, comparando los resultados con estimaciones históricas (Marín-Togo et al., 2012). Sin embargo, ningún estudio había podido incluir en sus análisis una estimación contemporánea para cada especie de psitácido de México, ya que los estudios recientes se limitan a diagnósticos a nivel regional, como la península de Yucatán, la vertiente del Pacífico o sobre especies que utilizan hábitats específicos como las cotorras del género Rhynchopsitta (Marín-Togo et al., 2012; Monterrubio-Rico, Charre-Medellín y Sáenz-Romero, 2015; Monterrubio-Rico et al., 2010; Plasencia-Vázquez, Escalona-Segura y Esparza-Olguín, 2014; Plasencia-Vázquez y Escalona-Segura, 2014). Ante la acumulación de evidencia sobre el aumento en el riesgo que enfrenta la familia Psittacidae en México es necesario proporcionar un panorama actual sobre la distribución de todas las especies, basándose en modelos generados a partir del mayor número posible de registros de campo de los últimos 15 a 20 años (Marín-Togo et al., 2012, Monterrubio-Rico et al., 2007; Papeş y Gaubert, 2007).
En este estudio los objetivos incluyeron generar estimaciones de distribución potencial tanto histórica u original (necesaria para estimar cambios) como contemporánea o actual para la familia Psittacidae mediante datos contemporáneos de campo (1995-2013) y la generación de modelos de nicho ecológico (MaxEnt). También, estimar cambios en la distribución para cada especie, identificando las más amenazadas por pérdida de distribución, así como la disponibilidad de registros contemporáneos, y estimar el porcentaje de distribución con respecto a tipos de vegetación y disponibilidad de superficie protegida actual por el sistema de áreas naturales protegidas (ANP).
Materiales y métodosIntegración y depuración de bases de datosSe integró una base de datos de psitácidos de México denominada PsittaMex, donde se incorporó la información (especie, número de individuos, fecha, localidad, municipio, estado, elevación, coordenadas, hora de registro, tipo de registro, observador, proyecto) disponible sobre presencia actual e histórica de los psitácidos en México. Los registros provienen de proyectos de investigación en campo, registros de especialistas, informes técnicos, datos proporcionados por la Comisión Nacional para el Conocimiento y Uso de la Biodiversidad (Sistema Nacional de Información sobre Biodiversidad; SNIB-Conabio), y bases de datos en línea, además de revisión de literatura científica. Inicialmente se reunieron 52,541 registros; sin embargo, muchos carecían de fecha, localidad o coordenadas. Otros carecían de autor o fuente y muchos registros de especímenes de colecciones científicas eran duplicados. Después de un proceso de depuración, 42,058 registros presentaron suficiente información útil para los análisis a efectuar en este estudio y para futuros análisis, obteniéndose los últimos registros en abril de 2013. Todos los registros fueron desplegados en el espacio geográfico y se revisó que la ubicación de los puntos de cada especie fuese congruente con su distribución histórica reconocida a nivel regional o estatal (Forshaw, 1989; Howell y Webb, 1995; Juniper y Parr, 1998). Para identificar registros fuera de distribución o equivocados, se compararon las coordenadas extremas de registros históricos, se analizó la presencia de hábitats que usan las especies, ya que ocasionalmente loros mantenidos como mascotas escapan y sobreviven en entornos rurales o suburbanos, especialmente cuando se reportaban especies del golfo de México en estados del Pacífico y viceversa. En las áreas donde hubiera una alta concentración de registros de una misma especie, se utilizó solamente un registro por cada km2, con el fin de evitar un sobreajuste de los modelos en áreas intensivamente muestreadas; se eliminaron registros múltiples de la misma especie con las mismas coordenadas. Finalmente, la base de datos resultante dispuso de 3,538 registros con coordenadas únicas, de los cuales el 85.9% fueron obtenidos entre 1995 y 2013 (Monterrubio-Rico y Charre-Medellín, 2015; tabla 1). Para las localidades seleccionadas y validadas de cada especie se extrajo la información ambiental de 19 variables de WorldClim (Hijmans, Cameron, Parra, Jones y Jarvis, 2005), usando Intersect Point Tool de Analysis Tools, de la extensión Hawths Tools en ArcGis 9.3 (ESRI, 2008), con la finalidad de identificar el valor de cada variable correspondiente a cada coordenada de cada especie.
Registros de psitácidos usados para la generación de los modelos de distribución potencial.
| Especie | 1995-2013 | Antes de 1995 | Sin fecha | Total | Porcentaje usado para modelar | Porcentaje usado para validar |
|---|---|---|---|---|---|---|
| Eupsittula nana | 445 | 75 | 10 | 530 | 52.3 | 47.7 |
| Eupsittula canicularis | 460 | 3 | 0 | 463 | 56.6 | 43.4 |
| Ara militaris | 198 | 1 | 0 | 199 | 56.3 | 43.7 |
| Ara macao | 12 | 4 | 1 | 17 | 76.5 | 23.5 |
| Psittacara holochlorus | 128 | 51 | 8 | 187 | 52.4 | 47.6 |
| Psittacara strenuus | 31 | 1 | 0 | 32 | 59.4 | 40.6 |
| Rhynchopsitta pachyrhyncha | 70 | 11 | 29 | 110 | 60 | 40 |
| Rhynchopsitta terrisi | 25 | 4 | 39 | 68 | 54.4 | 45.6 |
| Bolborhynchus lineola | 12 | 12 | 2 | 26 | 53.8 | 46.2 |
| Forpus cyanopygius | 54 | 1 | 0 | 55 | 58.2 | 41.8 |
| Brotogeris jugularis | 80 | 0 | 0 | 80 | 52.5 | 47.5 |
| Pyrilia haematotis | 42 | 11 | 1 | 54 | 50 | 50 |
| Pionus senilis | 189 | 45 | 5 | 239 | 61.5 | 38.5 |
| Amazona albifrons | 365 | 21 | 1 | 387 | 52.5 | 47.5 |
| Amazona xantholora | 94 | 36 | 5 | 135 | 51.9 | 48.1 |
| Amazona viridigenalis | 61 | 28 | 26 | 115 | 60 | 40 |
| Amazona finschi | 285 | 1 | 0 | 286 | 65.7 | 34.3 |
| Amazona autumnalis | 187 | 16 | 4 | 207 | 59.9 | 40.1 |
| Amazona farinosa | 41 | 13 | 2 | 56 | 51.8 | 48.2 |
| Amazona oratrix | 212 | 14 | 1 | 227 | 49.3 | 50.7 |
| Amazona auropalliata | 50 | 15 | 0 | 65 | 52.3 | 47.7 |
| Total | 3,041 | 363 | 134 | 3,538 | 55.8 | 44.2 |
La segunda fuente de información, con un 23.4% de los registros, fue la base de datos Global Biodiversity Information Facility (GBIF, 2013), y la tercera fuente de registros (9.9%) fue el SNIB-Conabio. El menor porcentaje de datos, con el 1.9%, fueron registros de literatura científica e informes técnicos (Almazán-Núñez y Nova-Muñoz, 2006; Arizmendi, 2008; Chávez-Castañeda, Gurrola-Hidalgo y García-López, 1996; Gaucín-Ríos, 1999; Hernández-Castán, Villordo-Galván, Cano-García, Gaspariano-Martínez y Rodríguez-Cantalapiedra, 2012; Howell, 1999; Jiménez-Arcos, Santa Cruz-Padilla, Escalona-López, Arizmendi y Vázquez, 2012; Lammertink, Rojas-Tome, Casillas-Orona y Otto, 1996; Muñiz-Martínez, 2001; Rivera-Ortiz et al., 2013; Russell y Monson, 1998; Sierra-Franco, 2006; Villaseñor y Botello, 2012), y por último, registros de la base de datos proporcionada por Conabio-Averaves (2010).
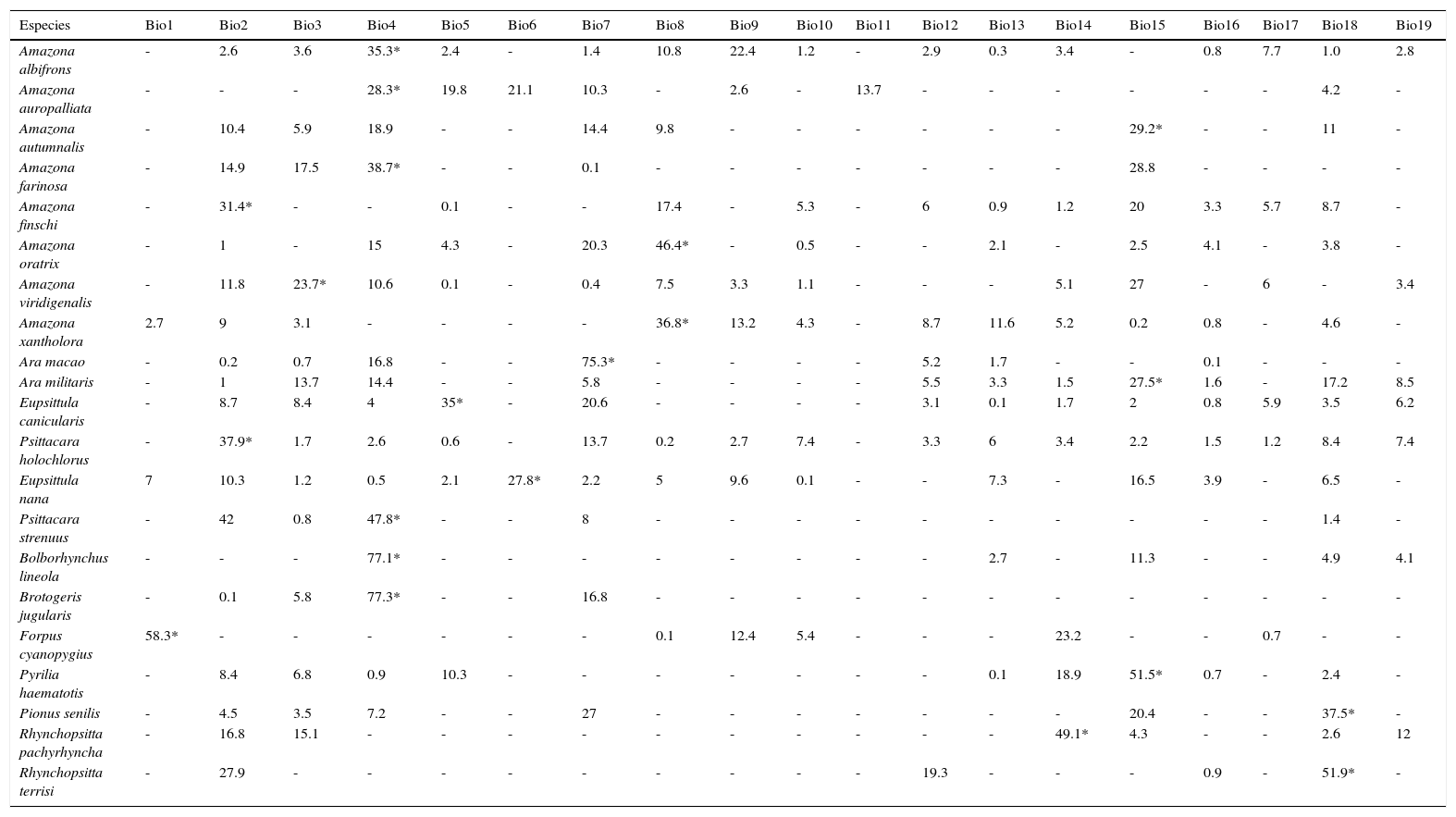
Selección de variablesSe analizaron 19 variables climáticas de temperatura y precipitación de WorldClim del periodo 1950-2000 (Hijmans et al., 2005), seleccionando aquel conjunto de variables para generar el modelo de distribución potencial de cada especie, reduciendo los errores de sobreajuste de los modelos por colinealidad (Dormann et al., 2013). Se identificaron para cada especie las variables más informativas mediante un análisis de coeficiente de determinación (r2), estimando el porcentaje de relación entre variables (Zar, 1996). Los análisis se efectuaron en módulos de JMP versión 8 (SAS Institute Inc., 2008). Con los valores de correlación entre variables se seleccionaron aquellas con menos de un 25% de correlación, exceptuando para las especies P. strenuus y A. auropalliata, en las que se usaron variables con correlación menor a un 30% (Anexo 1). Todas las capas de información contaron con resolución de 30s, que a la latitud de México equivale a 1km2 aproximadamente.
Modelos de distribución potencial históricaEl área a modelar la distribución potencial de cada especie (M) se delimitó seleccionando las cuencas hidrográficas asociadas a límites regionales-biogeográficos, observando la distribución potencial histórica conocida de cada especie disponible en la página de la Conabio (http://www.conabio.gob.mx/informacion/gis/). Estos criterios permiten considerar aspectos históricos que han afectado la distribución de las especies, eliminando así zonas donde se sabe que esta no ha estado y no está actualmente (Illoldi-Rangel y Escalante, 2008). Este criterio fue particularmente útil en especies con distribución discontinua (por ejemplo, Ara militaris, Psittacara holochlorus) o puntual y asociada a ambientes y hábitats determinados, como ocurre en Bolborhynchus lineola (Howell y Webb, 1995).
Utilizando las variables climáticas y los registros de cada especie se generaron los modelos de las 21 especies de psitácidos utilizando el algoritmo MaxEnt, el cual se fundamenta en el concepto de máxima entropía y hace predicciones a partir de información incompleta, y estima la distribución más uniforme en el área estudiada con la restricción de que el valor esperado para cada variable ambiental en una distribución debe concordar con su promedio empírico. Proporciona curvas de respuesta de la especie ante las distintas variables ambientales y estima la importancia de cada una en la distribución de la especie (Phillips, Anderson y Schapire, 2006; Phillips, Dudik y Schapire, 2004), además es considerado un algoritmo con buen desempeño (Elith et al., 2011; Hernández, Graham, Master y Albert, 2006; Phillips et al., 2004, 2006).
Los registros de cada especie se dividieron en bandas latitudinales de 15km, y se seleccionaron los datos en bandas alternadas para modelar, y las de las bandas restantes para validar los modelos externamente (tabla 1). Este procedimiento retó a los algoritmos a predecir en regiones en que no dispone de registros, en vez de interpolar espacios vacíos en un área densamente muestreada, así es posible evaluar la capacidad de los modelos para predecir en amplias regiones no muestreadas (Peterson y Shaw, 2003; Peterson, Papeş y Eaton, 2007). El ancho consideró 15km, que es una distancia de desplazamiento potencial diario de las especies de psitácidos durante la época reproductiva, como la Guacamaya Roja (A. macao) en Costa Rica y la Guacamaya Verde (A. militaris) en México (Bonilla, Reyes y Santiago, 2007; Vaughan, Nemeth y Marineros, 2006), además de que la mayoría de los muestreos en campo efectuados en los últimos años corresponden a registros de la época reproductiva, ya que durante la época no reproductiva las especies suelen presentar conductas nomádicas (Snyder, McGowan, Gilardi y Grajal, 2000).
En MaxEnt se activaron los módulos y opciones «Create response curves», «Make pictures of predictions» y «Do jacknife to measure variable importance». En Settings (Advanced) se desactivó la opción «Do campling» (Papeş y Gaubert, 2007). Se seleccionó el tipo de salida logística de los modelos. Los modelos resultantes se reclasificaron en mapas binarios (presencia/ausencia) usando el umbral «Minimum training presence» debido a que presenta los valores más bajos de omisión y la menor superficie de presencia, lo cual elimina los errores de comisión (Papeş y Gaubert, 2007).
Los modelos de distribución histórica se evaluaron con el método de «ROC parcial», que pondera los errores de omisión, no considera las ausencias y evalúa solo sobre el rango de valores de predicción (Peterson, Papeş y Soberón, 2008). Se usó el programa Tool for Partial-ROC versión 1.0 (Narayani, 2008). Los 2 subconjuntos de datos separados para cada especie (archivos de presencia) fueron contrastados con el modelo reclasificado en probabilidades (MaxEnt) para obtener los valores sobre los que coinciden los puntos (valor de adecuación). También se extrajo el número de objetos asociados a los distintos valores de adecuación, dividido entre el total de objetos del modelo. Los archivos preparados en formato CSV se ingresaron al programa Tool for Partial-ROC versión 1.0. Se usó una proporción de puntos para «Bootstrap» del 50%, el número de muestras con reemplazo fue de 1,000 y el umbral de omisión usado fue del 95%. Se promedió el valor de radio de las 1,000 iteraciones de los datos usados para el entrenamiento y prueba de los modelos, y se calculó la probabilidad de que el valor fuera menor o igual a 1 mediante una prueba de z. Siguiendo a Peterson et al. (2008), los modelos con buen desempeño son aquellos cuyos valores promedio de radio sean mayores de 1 y con probabilidad de 0.
Distribución potencial contemporáneaUsando como base los modelos de distribución potencial histórica de las especies, se delimitaron las áreas de distribución contemporánea considerando los tipos de vegetación de la carta de uso de suelo y vegetación Serie IV (Inegi, 2009), y con base en el análisis de los registros del muestreo de campo y que corresponden a hábitats donde se ha registrado anidando a cada especie. Aunque varias especies aprovechan recursos de cultivos y zonas agropecuarias, se consideró solo la vegetación arbolada natural, que es la que ofrece condiciones óptimas para la anidación de las especies. Por lo tanto, se eliminaron de las estimaciones todas las áreas con pérdida de bosques≥75% (pastizales extensivos, áreas de suelo desnudo, arena, centros urbanos), que son los umbrales a partir de los cuales en estudios regionales, a nivel municipal, se ha observado que se relacionan con la pérdida local de especies (Botello, Sánchez-Cordero y Ortega-Huerta, 2015).
Adicionalmente, para los modelos de A. militaris, A. macao, R. pachyrhyncha, F. cyanopygius, A. albifrons, A. oratrix, A. auropalliata y A. finschi se emplearon criterios adicionales, eliminándose de sus áreas de distribución las superficies de municipios en los que mediante reconocimiento de campo de por lo menos 2 años se documentó extirpación de las especies, aun con presencia de hábitat primario disponible (50 a 75%), y como se ha señalado en estudios regionales (Marín-Togo et al., 2012; Monterrubio-Rico et al., 2010; Monterrubio-Rico, 2012a, 2012b). Posteriormente, se examinó la presencia de ANP (Conanp, 2014) sobre las áreas de distribución potencial contemporánea de las especies, evaluando la disponibilidad de superficie protegida para cada especie.
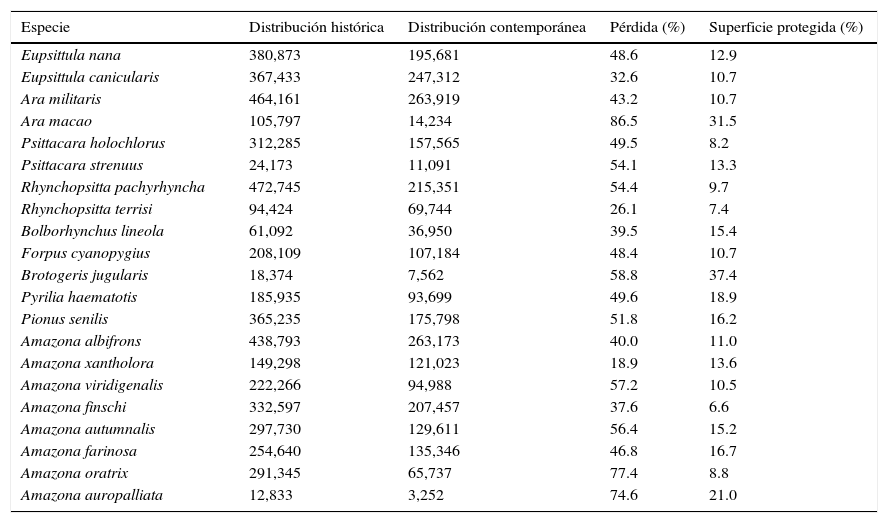
ResultadosModelos de distribución históricaSe obtuvieron modelos de distribución tanto histórica como contemporánea para todas las especies (tabla 2; figs. 1–6). Para los modelos se emplearon 3,538 registros, de los cuales el 85.9% correspondió a registros recientes (1995-2013) y solamente el 10.2% a registros históricos (antes de 1995) (tabla 1). Las especies en las que se dispuso de la mayor cantidad de registros fueron E. nana, E. canicularis y A. albifrons, mientras que para los modelos de P. strennus, B. lineola y A. macao se dispuso de un menor número de registros (tabla 1).
Área estimada de distribución histórica y contemporánea para los psitácidos en México y la disponibilidad potencial de superficie protegida.
| Especie | Distribución histórica | Distribución contemporánea | Pérdida (%) | Superficie protegida (%) |
|---|---|---|---|---|
| Eupsittula nana | 380,873 | 195,681 | 48.6 | 12.9 |
| Eupsittula canicularis | 367,433 | 247,312 | 32.6 | 10.7 |
| Ara militaris | 464,161 | 263,919 | 43.2 | 10.7 |
| Ara macao | 105,797 | 14,234 | 86.5 | 31.5 |
| Psittacara holochlorus | 312,285 | 157,565 | 49.5 | 8.2 |
| Psittacara strenuus | 24,173 | 11,091 | 54.1 | 13.3 |
| Rhynchopsitta pachyrhyncha | 472,745 | 215,351 | 54.4 | 9.7 |
| Rhynchopsitta terrisi | 94,424 | 69,744 | 26.1 | 7.4 |
| Bolborhynchus lineola | 61,092 | 36,950 | 39.5 | 15.4 |
| Forpus cyanopygius | 208,109 | 107,184 | 48.4 | 10.7 |
| Brotogeris jugularis | 18,374 | 7,562 | 58.8 | 37.4 |
| Pyrilia haematotis | 185,935 | 93,699 | 49.6 | 18.9 |
| Pionus senilis | 365,235 | 175,798 | 51.8 | 16.2 |
| Amazona albifrons | 438,793 | 263,173 | 40.0 | 11.0 |
| Amazona xantholora | 149,298 | 121,023 | 18.9 | 13.6 |
| Amazona viridigenalis | 222,266 | 94,988 | 57.2 | 10.5 |
| Amazona finschi | 332,597 | 207,457 | 37.6 | 6.6 |
| Amazona autumnalis | 297,730 | 129,611 | 56.4 | 15.2 |
| Amazona farinosa | 254,640 | 135,346 | 46.8 | 16.7 |
| Amazona oratrix | 291,345 | 65,737 | 77.4 | 8.8 |
| Amazona auropalliata | 12,833 | 3,252 | 74.6 | 21.0 |
El modelo de cada especie fue preciso de acuerdo con la validación y requirió de diferentes variables de acuerdo con el análisis de autocorrelación espacial, difiriendo también en qué variables resultaron más importantes en explicar la distribución (Anexo 1). Las especies que requirieron un mayor número de variables fueron P. holochlorus, A. albifrons y E. nana, con 16, 15 y 14 variables, respectivamente. Por el contrario, en B. jugularis y R. terrisi solamente se usaron 4 variables para generar sus modelos (Anexo 1). Entre las variables significativas, la oscilación diurna de la temperatura estuvo presente en los modelos del mayor número de especies (n=18), seguida de la precipitación del trimestre más cálido y la estacionalidad de la temperatura en los modelos de 16 especies. Sin embargo, la estacionalidad de la temperatura fue la más significativa en el mayor número de modelos, que corresponde a 6 especies de psitácidos (A. albifrons, A. auropalliata, A. farinosa, P. strenuus, B. lineola, B. jugularis) (Anexo 1). Las especies con las estimaciones de mayor extensión para su distribución histórica fueron R. pachyrhyncha, A. militaris y A. albifrons, con predicciones superiores a los 400,000km2, y la menor distribución histórica se estimó para A. auropalliata (tabla 2).
Distribución contemporáneaActualmente, las especies de psitácidos con mayor distribución potencial son A. albifrons, E. canicularis y R. pachyrhyncha (incluyendo distribución invernal) (tabla 2), mientras que A. auropalliata, B. jugularis, P. strenuus y A. macao son las especies de psitácidos con la menor superficie de distribución contemporánea (tabla 2). Al comparar los resultados obtenidos de distribución histórica y contemporánea para cada especie, en todas las estimaciones se observan pérdidas de distribución potencial en promedio de un 51%, estimándose la mayor pérdida en A. macao seguida de A. oratrix y A. auropalliata. Las especies con menor pérdida de distribución son A. xantholora, R. terrisi y E. canicularis, con 18.9, 26.1 y 32.6%, respectivamente (tabla 2).
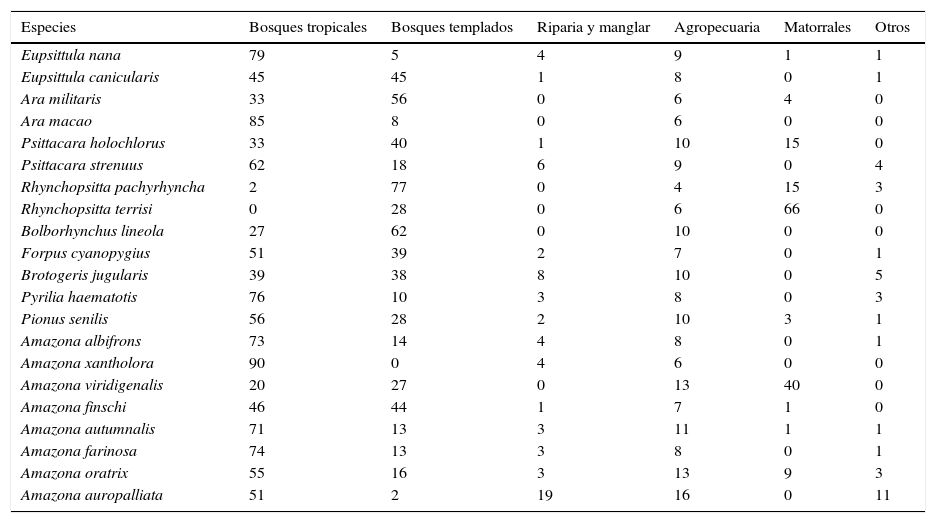
En cuanto a la disponibilidad de vegetación en las áreas y regiones de distribución contemporánea, los bosques de la península de Yucatán y la vertiente del golfo de México representan más el 60% de las áreas con distribución potencial de 7 especies, incluyendo: A. xantholora, A. macao, E. nana, P. haematotis, A. farinosa, A. albifrons, A. autumnalis y, en menor medida, P. senilis. Por el contrario, los bosques templados predominan en la distribución potencial de R. pachyrhyncha, seguida de B. lineola.
La vegetación riparia y de manglar presentan la mayor proporción de superficie en la distribución de las 3 especies con presencia limitada a la costa de Chiapas: A. auropalliata, B. jugularis y P. strenuus. Los matorrales presentan una cobertura importante en el noreste de México, en áreas de distribución potencial de R. terrisi y A. viridigenalis. Tanto los bosques tropicales como los templados presentan porcentajes de importancia similares en 3 especies de distribución para la vertiente del Pacífico: A. finschi, E. canicularis y F. cyanopygius (tabla 3).
Vegetación presente (%) en áreas de distribución de aptitud ambiental para la presencia potencial actual de las especies de psitácidos.
| Especies | Bosques tropicales | Bosques templados | Riparia y manglar | Agropecuaria | Matorrales | Otros |
|---|---|---|---|---|---|---|
| Eupsittula nana | 79 | 5 | 4 | 9 | 1 | 1 |
| Eupsittula canicularis | 45 | 45 | 1 | 8 | 0 | 1 |
| Ara militaris | 33 | 56 | 0 | 6 | 4 | 0 |
| Ara macao | 85 | 8 | 0 | 6 | 0 | 0 |
| Psittacara holochlorus | 33 | 40 | 1 | 10 | 15 | 0 |
| Psittacara strenuus | 62 | 18 | 6 | 9 | 0 | 4 |
| Rhynchopsitta pachyrhyncha | 2 | 77 | 0 | 4 | 15 | 3 |
| Rhynchopsitta terrisi | 0 | 28 | 0 | 6 | 66 | 0 |
| Bolborhynchus lineola | 27 | 62 | 0 | 10 | 0 | 0 |
| Forpus cyanopygius | 51 | 39 | 2 | 7 | 0 | 1 |
| Brotogeris jugularis | 39 | 38 | 8 | 10 | 0 | 5 |
| Pyrilia haematotis | 76 | 10 | 3 | 8 | 0 | 3 |
| Pionus senilis | 56 | 28 | 2 | 10 | 3 | 1 |
| Amazona albifrons | 73 | 14 | 4 | 8 | 0 | 1 |
| Amazona xantholora | 90 | 0 | 4 | 6 | 0 | 0 |
| Amazona viridigenalis | 20 | 27 | 0 | 13 | 40 | 0 |
| Amazona finschi | 46 | 44 | 1 | 7 | 1 | 0 |
| Amazona autumnalis | 71 | 13 | 3 | 11 | 1 | 1 |
| Amazona farinosa | 74 | 13 | 3 | 8 | 0 | 1 |
| Amazona oratrix | 55 | 16 | 3 | 13 | 9 | 3 |
| Amazona auropalliata | 51 | 2 | 19 | 16 | 0 | 11 |
El porcentaje promedio estimado en el interior de ANP de México para la familia Psittacidae es del 14.5% (tabla 2), y la mayor cobertura se estimó para B. jugularis y A. macao, y por el contrario, especies con menores porcentajes (≤10%) incluyeron A. finschi, y otras especies listadas en riesgo como R. terrisi, A. oratrix y R. pachyrhyncha (tabla 2).
DiscusiónEn este estudio se presentan los modelos más actuales y sustentados en el mayor número de registros de campo sobre la distribución potencial tanto histórica como contemporánea para la familia Psittacidae en México. En ellos se seleccionó la información disponible tanto de registros históricos como recientes (1995-2013), registros que se basan en muestreos que incluyeron todas las regiones del país con presencia de poblaciones de psitácidos (tierras bajas de vertiente del Pacífico, Sierra Madre Occidental, Sierra Madre del Sur, tierras bajas de vertiente del golfo, Sierra Madre Oriental, región Huasteca, sur de Veracruz, Chiapas y península de Yucatán). Entre las fortalezas de las hipótesis de distribución que se presentan (modelos), se destaca que son el resultado de procesos de selección de datos, selección y análisis de variables ambientales y procesos de validación externa al algoritmo MaxEnt. Los resultados complementan en algunos casos, y confirman y validan en otros, las estimaciones obtenidas en estudios regionales (península de Yucatán, o vertiente del Pacífico) para especies como A. oratrix, A. albifrons o E. nana, en cuyas proyecciones anteriores no se incluía su distribución completa para México (Marín-Togo et al., 2012; Monterrubio-Rico et al., 2010; Monterrubio-Rico et al., 2015; Plasencia-Vázquez y Escalona-Segura, 2014; Plasencia-Vázquez et al., 2014).
Aunque existen 2 estudios anteriores que han presentado estimaciones sobre la distribución histórica y del hábitat potencial de los psitácidos en México, esos estudios se han basado en otro algoritmo (GARP) (Navarro-Sigüenza y Peterson, 2007; Ríos-Muñoz y Navarro-Sigüenza, 2009). Además, sus estimaciones y modelos se generaron a partir de registros históricos de colecciones científicas, por lo que los resultados de un análisis comparativo entre las estimaciones de este estudio y las estimaciones anteriores tendrían un alcance limitado debido a las múltiples fuentes de variación que producen las diferentes condiciones en que fue desarrollado cada estudio (disponibilidad y dispersión geográfica de datos, cartas de vegetación, etc.). Además, existen diferencias atribuibles al funcionamiento de cada algoritmo (Ortega-Huerta y Peterson, 2008; Peterson et al., 2007), especialmente si se usan diferentes procedimientos de selección de variables ambientales, criterios y restricciones en la selección de datos y procedimientos de validación.
Como parte de proyectos de investigación anteriores, se analizó también la misma base de datos mediante GARP (Monterrubio-Rico y Charre-Medellín, 2015), sin embargo, solo se presentan los resultados obtenidos con MaxEnt por los atributos que le da al algoritmo interpretar con mayor claridad los resultados. Al haberse muestreado intensivamente durante los últimos 10 años las áreas con presencia de cada especie de psitácido en México, se tiene la hipótesis de que la carencia de datos para algunas especies como B. lineola o A. farinosa, posiblemente refleja la situación de declive de sus poblaciones. Una elevada concentración de registros para pocas áreas en pocos hábitats remanentes puede sesgar el modelo de cualquier algoritmo. Finalmente, una validación ideal sería la comprobación en campo de cada área predicha (cuadrantes, municipios, etc.) para todas las especies, especialmente en aquellas con distribución restringida como B. lineola o A. macao.
Afortunadamente, desde la perspectiva de conservación, para 13 especies las estimaciones de distribución potencial actual son superiores a las estimaciones de estudios anteriores, debido principalmente a estimaciones confirmadas de mayor extensión. Por ejemplo, en A. oratrix, para el año 2000 se estimó una distribución de hábitat potencial en 61,980km2 (Ríos-Muñoz y Navarro-Sigüenza, 2009) y para el Pacífico se proyectó para 2010 una distribución en 18,957km2 (Monterrubio-Rico et al., 2010). En este estudio los modelos indican su distribución en 65,737km2, validándose en campo durante los últimos años su distribución en el golfo de México, complementando así las estimaciones existentes (fig. 5d).
Sin embargo, para A. macao y A. auropalliata, nuestra estimación resultó inferior a la registrada en otros estudios basados en GARP tanto a escala nacional como regional (Marín-Togo et al., 2012; Ríos-Muñoz y Navarro-Sigüenza, 2009). También en P. strenuus se obtuvo una estimación inferior a la generada en estudios regionales (Marín-Togo et al., 2012). Las diferencias también pueden deberse a la utilización de modelos de vegetación distintos. En este estudio se empleó la carta de uso de suelo y vegetación Serie IV, que proporciona las estadísticas oficiales actualizadas sobre la vegetación de México (Inegi, 2009), por lo que es posible que en 10 años las áreas de distribución de las especies hayan experimentado deforestación.
En general, los bosques tropicales presentan las mayores extensiones de aptitud climática para la presencia potencial del mayor número de especies de psitácidos (tabla 3). Sin embargo, a diferencia de trabajos anteriores (Marín-Togo et al., 2012; Ríos-Muñoz y Navarro-Sigüenza, 2009), en este estudio los bosques templados presentaron una elevada proporción de cobertura en las distribuciones potenciales de varias especies y puede explicarse por una combinación de factores. Al generarse los modelos para áreas de mayor dimensión que los estudios regionales, se utilizaron registros recientes de zonas montañosas que incluyen áreas de transición y ecotonos con bosques templados. Para A. militaris el bosque templado resultó la vegetación con mayor extensión de superficie en condiciones de aptitud de su modelo con un 56%, siendo el mayor porcentaje entre especies de psitácidos, exceptuando al género Rhynchopsitta y B. lineola (tabla 3). La mayor presencia de bosques templados en los modelos tiene diferentes posibles explicaciones, desde la ubicación de los registros actuales hasta diferencias en la delimitación del área a modelarse o los modelos de vegetación y uso de suelo empleados. Sin embargo, creemos que en el modelo para A. militaris la explicación más probable tiene que ver con la distribución actual de sus poblaciones remanentes. Actualmente, la mayoría de sus registros provienen de zonas montañosas como la Sierra Madre Occidental en Sinaloa y Durango, la Huasteca o la Sierra Gorda en Querétaro. La disponibilidad de registros actuales contrasta con la distribución de los registros históricos provenientes de colecciones científicas, los cuales correspondían a tierras bajas tropicales como la costa de Guerrero o Chiapas (Monterrubio-Rico, 2012b). Además, en estudios recientes se ha documentado el uso de bosques templados de coníferas para anidar y alimentarse (Sierra-Franco, 2006).
Los bosques templados, los bosques mixtos y las áreas transicionales o ecotonos parecen ser utilizados por un mayor número de especies, contrastando con los registros disponibles de colecciones científicas. Especies para las que anteriormente se consideraba su presencia principalmente para bosques tropicales (Forshaw, 1989; Howell y Webb, 1995), como E. canicularis, A. finschi, F. cyanopygius, P. holochlorus o A. oratrix, presentaron ahora porcentajes de bosque templado superiores, entre el 15 y el 45% (tabla 3). El uso de este tipo de bosques por un mayor número de especies puede tener varias causas, había pasado desapercibido quizás por posibles sesgos de muestreo debido a que las áreas montañosas eran inaccesibles en el pasado, limitándose el muestreo a tierras bajas tropicales. Por esta razón, los modelos generados en estudios anteriores (Ríos-Muñoz y Navarro-Sigüenza, 2009) presentaban para la mayoría de las especies una distribución potencial asociada a los bosques tropicales y una escasa presencia en bosques templados o ecotonos. Los modelos basados en registros históricos quizás reflejaron la carencia de registros de zonas montañosas remotas e inaccesibles. Actualmente, en múltiples estudios locales se han observado psitácidos en bosques templados y áreas de transición en sierras o montañas y en algunos casos, como en A. finschi, la mayoría de los registros corresponden a sierras (Marín-Togo et al., 2012). El loro cabeza amarilla es otro ejemplo notable de uso de áreas montañosas de la Sierra Madre del Sur o de la Huasteca, siendo consistente la presencia de A. oratrix en bosques templados de áreas de transición templado tropical (Álvarez-Jara, 2010; Monterrubio-Rico, 2012a).
Una segunda razón es la delimitación de las áreas para generar los modelos en función de la disponibilidad de registros de distribución potencial, ya que en este estudio se delimitó toda la Sierra Madre Occidental a diferencia de estudios a nivel regional. Otra explicación no excluyente es el empleo de diferentes modelos de uso de suelo y vegetación entre estudios, ya que otros autores emplearon el inventario forestal nacional 2000 (Semarnap-UNAM, 2000), mientras que en este estudio se utilizó la carta de uso de suelo y vegetación Serie IV (Inegi, 2009).
El uso de bosques templados en áreas de transición y ecotonos con bosques tropicales debe estudiarse detalladamente; se desconoce si su uso es el resultado de deforestación en tierras bajas o debido a cambios en el clima local. El incremento de temperatura en zonas montañosas se ha registrado en muchas partes del mundo, afectando a las aves de regiones tropicales (Şekercioğlu, Primack y Wormworth 2012; Şekercioğlu, Schneider, Fay y Loarie, 2008). Las áreas de transición o ecotonos entre bosques templados y tropicales pueden constituir áreas importantes para la alimentación y anidación de especies de psitácidos, especialmente si el hábitat apto se reduce en tierras bajas por la extensa deforestación. Por otra parte, se estima que la vegetación en el mundo y en México experimenta migración altitudinal influida por el cambio climático (Lenoir, Gégout, Marquet, de Ruffray y Brisse, 2008; Sáenz-Romero et al., 2010).
Aunque la mayoría de las especies de psitácidos presentes en México son consideradas moderadamente vulnerables al cambio climático por sus rasgos de historia de vida (Foden et al., 2013), la disponibilidad de hábitat y superficie protegida debe evaluarse en el contexto de cambios en la vegetación asociados al cambio climático para el futuro en las especies en mayor riesgo y con menor disponibilidad de hábitat, como se ha estimado para R. pachyrhyncha y R. terrisi (Monterrubio-Rico et al., 2015).
Al analizar la disponibilidad de superficie protegida, para la mayoría de las especies se proyecta un mayor porcentaje de su distribución al interior de las ANP que lo estimado anteriormente. Para el año 2000, Ríos-Muñoz y Navarro-Sigüenza (2009) estimaron una disponibilidad promedio de 10.7% de la distribución al interior de ANP, presentando la menor disponibilidad E. canicularis, E. strenuus y A. finschi, y la mayor disponibilidad, A. macao y P. haematotis. En nuestras estimaciones se observaron algunos patrones regionales que reflejan la asimetría entre regiones en disponibilidad de superficie protegida a nivel nacional. Especies con distribución en tierras bajas de bosques tropicales húmedos de la vertiente del golfo presentan mayor disponibilidad de superficie protegida (A. macao, P. haematotis y A. farinosa) que especies con distribución para el Pacífico (A. finschi, E. canicularis y F. cyanopygius). En nuestras estimaciones, el porcentaje promedio estimado es de 14.5% (tabla 2), aunque el menor porcentaje se estimó para especies endémicas y en peligro de extinción, como A. viridigenalis y A. finschi. En estudios regionales ya se señalaba una baja disponibilidad de superficie protegida para especies de psitácidos en el Pacífico, sobre todo en especies endémicas (Marín-Togo et al., 2012).
Especies con distribución en ambas vertientes (A militaris, A. oratrix, A. albifrons) presentaron porcentajes superiores en cobertura de ANP cuando se comparan con estudios anteriores (Ríos-Muñoz y Navarro-Sigüenza, 2009). El mayor porcentaje actual de área protegida refleja 2 aspectos, el incremento de ANP en el país durante los últimos 15 años (incluyendo una nueva categoría: cuencas hidrológicas prioritarias) y una mayor extensión de las estimaciones de distribución para las especies en los modelos actuales, los cuales dispusieron de mayor cantidad de datos y mayor cobertura geográfica (Stockwell y Peterson, 2002). Ante el declive experimentado por los psitácidos de México después de décadas de deforestación y saqueo de nidos, se recomienda actualizar la distribución de las especies por lo menos cada 10 años, periodo en que se pueden obtener suficientes registros de campo a nivel nacional. En el contexto internacional, delimitar con precisión la distribución de los psitácidos presentes en México tiene implicaciones de conservación importantes, ya que 6 especies son endémicas (A. finschi, A. viridigenalis, A. xantholora, F. cyanopygius, R. pachyrhyncha y R. terrisi) y 4 (A. oratrix, A. militaris, P. holochlora y E. canicularis) tendrían su mayor distribución potencial (≥50%) y quizás poblacional en México, con base en lo estimado en este estudio y lo reportado por la IUCN a nivel global (BirdLife International, 2012, 2013a, 2013b, 2014). En Latinoamérica existen pocos estudios actuales enfocados en conocer la situación actual de la distribución de las especies de la familia Psittacidae. En general, solo existen estudios enfocados a establecer especies prioritarias para conservación, como para los psitácidos en Venezuela y Colombia (Desenne y Strahl, 1991; Velásquez-Tibatá y López-Arévalo, 2004).
Agradecemos el apoyo en campo en proyectos anteriores a los colegas investigadores C. Macías, M. Á. Martínez Morales, P. Escalante-Pliego, M. Grosselet y K. Renton. Esta investigación fue financiada por la Conabio, a través del Proyecto JM018 Distribución potencial de las especies de la familia Psittacidae en México. M. Álvarez-Jara y J. F. Charre-Medellín agradecen al Conacyt la beca de doctorado en el Programa de Doctorado en Ciencias Biológicas (UMSNH). La Facultad de Biología de la UMSNH proporcionó las instalaciones para la preparación de este manuscrito.
BIO1 = temperatura media anual, BIO2 = promedio del rango diurno (promedio mensual (t máx - t min)), BIO3 = isotermalidad, BIO4 = estacionalidad de la temperatura, BIO5 = temperatura máxima de mes más caluroso, BIO6 = temperatura mínima de mes más frío, BIO7 = rango anual de temperatura, BIO8 = temperatura media de trimestre más húmedo, BIO9 = temperatura media de trimestre más seco, BIO10 = temperatura media de trimestre más caluroso, BIO11= temperatura media de trimestre más frío, BIO12 = precipitación anual, BIO13 = precipitación de mes más húmedo, BIO14 = precipitación de mes más seco, BIO15 = estacionalidad de la precipitación (coeficiente de variación), BIO16 = precipitación de trimestre más húmedo, BIO17 = precipitación de trimestre más seco, BIO18 = precipitación de trimestre más caluroso y BIO19 = precipitación de trimestre más frío.
| Especies | Bio1 | Bio2 | Bio3 | Bio4 | Bio5 | Bio6 | Bio7 | Bio8 | Bio9 | Bio10 | Bio11 | Bio12 | Bio13 | Bio14 | Bio15 | Bio16 | Bio17 | Bio18 | Bio19 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Amazona albifrons | - | 2.6 | 3.6 | 35.3* | 2.4 | - | 1.4 | 10.8 | 22.4 | 1.2 | - | 2.9 | 0.3 | 3.4 | - | 0.8 | 7.7 | 1.0 | 2.8 |
| Amazona auropalliata | - | - | - | 28.3* | 19.8 | 21.1 | 10.3 | - | 2.6 | - | 13.7 | - | - | - | - | - | - | 4.2 | - |
| Amazona autumnalis | - | 10.4 | 5.9 | 18.9 | - | - | 14.4 | 9.8 | - | - | - | - | - | - | 29.2* | - | - | 11 | - |
| Amazona farinosa | - | 14.9 | 17.5 | 38.7* | - | - | 0.1 | - | - | - | - | - | - | - | 28.8 | - | - | - | - |
| Amazona finschi | - | 31.4* | - | - | 0.1 | - | - | 17.4 | - | 5.3 | - | 6 | 0.9 | 1.2 | 20 | 3.3 | 5.7 | 8.7 | - |
| Amazona oratrix | - | 1 | - | 15 | 4.3 | - | 20.3 | 46.4* | - | 0.5 | - | - | 2.1 | - | 2.5 | 4.1 | - | 3.8 | - |
| Amazona viridigenalis | - | 11.8 | 23.7* | 10.6 | 0.1 | - | 0.4 | 7.5 | 3.3 | 1.1 | - | - | - | 5.1 | 27 | - | 6 | - | 3.4 |
| Amazona xantholora | 2.7 | 9 | 3.1 | - | - | - | - | 36.8* | 13.2 | 4.3 | - | 8.7 | 11.6 | 5.2 | 0.2 | 0.8 | - | 4.6 | - |
| Ara macao | - | 0.2 | 0.7 | 16.8 | - | - | 75.3* | - | - | - | - | 5.2 | 1.7 | - | - | 0.1 | - | - | - |
| Ara militaris | - | 1 | 13.7 | 14.4 | - | - | 5.8 | - | - | - | - | 5.5 | 3.3 | 1.5 | 27.5* | 1.6 | - | 17.2 | 8.5 |
| Eupsittula canicularis | - | 8.7 | 8.4 | 4 | 35* | - | 20.6 | - | - | - | - | 3.1 | 0.1 | 1.7 | 2 | 0.8 | 5.9 | 3.5 | 6.2 |
| Psittacara holochlorus | - | 37.9* | 1.7 | 2.6 | 0.6 | - | 13.7 | 0.2 | 2.7 | 7.4 | - | 3.3 | 6 | 3.4 | 2.2 | 1.5 | 1.2 | 8.4 | 7.4 |
| Eupsittula nana | 7 | 10.3 | 1.2 | 0.5 | 2.1 | 27.8* | 2.2 | 5 | 9.6 | 0.1 | - | - | 7.3 | - | 16.5 | 3.9 | - | 6.5 | - |
| Psittacara strenuus | - | 42 | 0.8 | 47.8* | - | - | 8 | - | - | - | - | - | - | - | - | - | - | 1.4 | - |
| Bolborhynchus lineola | - | - | - | 77.1* | - | - | - | - | - | - | - | - | 2.7 | - | 11.3 | - | - | 4.9 | 4.1 |
| Brotogeris jugularis | - | 0.1 | 5.8 | 77.3* | - | - | 16.8 | - | - | - | - | - | - | - | - | - | - | - | - |
| Forpus cyanopygius | 58.3* | - | - | - | - | - | - | 0.1 | 12.4 | 5.4 | - | - | - | 23.2 | - | - | 0.7 | - | - |
| Pyrilia haematotis | - | 8.4 | 6.8 | 0.9 | 10.3 | - | - | - | - | - | - | - | 0.1 | 18.9 | 51.5* | 0.7 | - | 2.4 | - |
| Pionus senilis | - | 4.5 | 3.5 | 7.2 | - | - | 27 | - | - | - | - | - | - | - | 20.4 | - | - | 37.5* | - |
| Rhynchopsitta pachyrhyncha | - | 16.8 | 15.1 | - | - | - | - | - | - | - | - | - | - | 49.1* | 4.3 | - | - | 2.6 | 12 |
| Rhynchopsitta terrisi | - | 27.9 | - | - | - | - | - | - | - | - | - | 19.3 | - | - | - | 0.9 | - | 51.9* | - |
La revisión por pares es responsabilidad de la Universidad Nacional Autónoma de México.