El conocimiento sobre la flora y la dinámica de la vegetación en los pastizales templados de México es hasta la fecha escaso. Con el fin de paliar esta deficiencia, en este estudio se evaluó la composición florística, diversidad y estructura de un pastizal templado del centro de México. Se registraron 118 especies, 93 géneros y 40 familias. Las familias mejor representadas a nivel genérico y específico son: Poaceae, Asteraceae, Fabaceae y Orchidaceae, esta última con una nueva especie aún no descrita perteneciente al género Cyclopogon. El estrato herbáceo del pastizal es complejo y cubre 98% de la superficie. Se encontró un porcentaje elevado de taxa nativos (20.50) y un índice de diversidad (Simpson y Shannon=3.36) relativamente alto. Muhlenbergia phalaroides fue la especie dominante y a ella correspondió el mayor valor de importancia. Los resultados sugieren que estos pastizales representan un reservorio considerable de especies relevantes para la conservación biológica, a pesar de estar sometidos a disturbios constantes.
Current knowledge of the flora and vegetation dynamics in temperate grasslands of Mexico is still scarce. In order to mitigate this deficiency, in this study the floristic composition, diversity and structure of a temperate grassland of central Mexico were evaluated. A total of 118 species, 93 genera and 40 families were recorded. The best represented families, both at the generic and specific levels are: Poaceae, Asteraceae, Fabaceae and Orchidaceae. The latter including a new species belonging to the genus Cyclopogon. The herbaceous stratum of the grassland is complex, and covers 98% of the surface. A high percentage of native species was found (20.50) and a relatively high diversity index was calculated (Simpson and Shannon=3.36). Muhlenbergia phalaroides was the dominant species and it corresponds to the highest importance value. The results suggest that these grasslands represent a sizable reservoir of species relevant for biological conservation, despite being subjected to frequent disturbances.
Las comunidades donde la cubierta vegetal está dominada por gramíneas reciben el nombre de pastizales (Miranda y Hernández, 1963; Rzedowski, 1978). Este tipo de vegetación desempeña un papel crucial en el mantenimiento y funcionalidad del ecosistema, sobre todo en aquellos hábitats donde no pueden establecerse comunidades arbóreas debido a las limitaciones ambientales. Por ejemplo, los pastizales pueden evitar la erosión del suelo e incrementar las tasas de infiltración de agua (Cruz, 1969); asimismo, estas comunidades revisten importancia para la conservación y el mantenimiento de la biodiversidad aun cuando están sometidas a perturbaciones (Wilson, Peet, Dengler y Pärtel, 2012). En cuanto a su aprovechamiento, los pastizales constituyen el medio natural para el uso pecuario (Rzedowski, 1978), por lo que junto con los bosques templados son posiblemente uno de los ecosistemas más alterados del país (Challenger, 1998). A pesar de su importancia, este tipo de vegetación se encuentra entre los ecosistemas menos protegidos y mayormente amenazados (Conabio, 1998; Coupland, 1979). El conocimiento actual de la flora y la dinámica de la vegetación en estas comunidades es todavía fragmentario, debido en gran medida a que la mayoría de las investigaciones de carácter florístico y ecológico se han efectuado en las zonas semiáridas (Gentry, 1957; Hernández, 1964; Hernández, Tapia y Buller, 1957; Rivas-Manzano, 1984; Rzedowski, 1975; Suárez-Martínez, 1999) y tropicales (López-Olmedo, Pérez-García y Meave, 2006; López-Olmedo, Meave y Pérez-García, 2007; Pérez-García y Meave, 2006; Reyes y Zamora, 1977).
Los pastizales han sufrido transformaciones intensas a causa de la influencia humana, como el fuego y el pastoreo, lo que dificulta establecer su origen. De hecho, se ha sugerido que estos dos factores afectan notablemente la riqueza, composición y estructura de la comunidad (Harrison, Inouye y Safford, 2003; Rivas-Manzano, 1988). También se ha propuesto que estas alteraciones promueven la invasión de especies exóticas (Hobbs y Huenneke, 1992), lo que podría causar el desplazamiento y pérdida de numerosas especies nativas a nivel local en zonas densamente pobladas.
En el Estado de México, que es uno de los más poblados del país, la mayor parte de la vegetación está alterada, lo cual es particularmente cierto para los bosques de pino-encino (González-Plata, 1998; Rivas-Manzano y Vibrans, 2000). Esta situación ha favorecido el establecimiento de pastizales de origen secundario con la intervención de fuegos frecuentes. Además, estos pastizales son utilizados para el forrajeo de animales domésticos. A causa de todos estos factores, muchos pastizales primarios pero intensamente perturbados pueden tener una fisonomía y una composición florística similar a la de algunos pastizales secundarios. Como sucede continuamente, las opiniones de los especialistas difieren en cuanto a la formación de estas comunidades vegetales (López-Olmedo et al., 2006, 2007; Miranda y Hernández, 1963; Pérez-García y Meave, 2006; Rzedowski, 1978). No obstante, cualquiera que pudiese ser su origen, un inventario florístico y la cuantificación de la importancia relativa de cada especie que forme parte del pastizal, es el primer paso para establecer estrategias de aprovechamiento, manejo, conservación y restauración.
Materiales y métodosEl estudio se realizó en la propiedad federal de telecomunicaciones denominada «El Cerrillo Piedras Blancas» (19°25′ y 19°26′ N, 99°39′ y 99°40′ O, a una altitud de 2,593m), municipio de Toluca, Estado de México (fig. 1). A partir de la información registrada en la estación meteorológica «Nueva Santa Elena» (durante 11 años, de 1998-2008), en la Facultad de Ciencias Agrícolas, ubicada a 2km del sitio de estudio, de la Universidad Autónoma del Estado de México (UAEMéx), se estimó una temperatura media del mes más frío de 2.4°C (diciembre) y una temperatura media del mes más cálido de 11.5°C (junio), con temperatura media anual de 8.2°C. La precipitación media anual fue de 738.6mm, con marcada estacionalidad; distinguiéndose una estación seca (noviembre-febrero) y una lluviosa (junio-septiembre). El clima de la región es C (w2) (w) b (i) g, es decir, templado subhúmedo con régimen de lluvias en verano, con oscilación térmica (García, 1973).
Los terrenos, con una superficie de 20ha, presentan una pendiente de entre 2 y 6%. Las rocas dominantes son de tipo volcánico y clástico. Los suelos son de tipo vertisol pélico (Vp) y feozem háplico (Hh), y se caracterizan por ser muy compactos, arcillosos y masivos; asimismo, exhiben grietas anchas y profundas en la época de sequía y muestran una capa de tepetate entre 10 y 50cm de profundidad, lo que constituye una limitante para el uso agrícola. En esta zona existen algunos cuerpos de agua intermitentes, bordos El Charco y La Cruz, cercanos al área de estudio y un cuerpo de agua persistente, la presa Antonio Alzate (Martínez y Hernández, 2000). Estos terrenos se encuentran continuamente sometidos a perturbaciones, tales como incendios, entre 1 y 3 veces por año, y pastoreo a lo largo de todo el año (Álvarez-Lopeztello, 2010).
Durante un año, de julio de 2007 a agosto de 2008, se hicieron prospecciones quincenales a través de recorridos, donde se recolectaron todas las especies de plantas presentes. Posteriormente se determinaron con ayuda de literatura especializada (Dávila et al., 2006; Espinosa-García y Sarukhán, 1997; Rzedowski y Rzedowski, 2005). La nomenclatura taxonómica de las familias sigue a «The Plant List» (www.theplantlist.org) y el nombre científico de las especies y los autores siguen a «Tropicos» (www.tropicos.org). Para determinar las especies introducidas y su posible origen se consultó a Rzedowski y Calderón (1990) y a Villaseñor y Espinosa-García (2004). Los especímenes de respaldo se depositaron en el herbario de la Facultad de Ciencias de la UAEMéx.
La vegetación se evaluó con el método de línea de Canfield (Canfield, 1941). Se trazaron tres líneas paralelas de 100m de longitud, separadas por 20m entre cada una, a lo largo de una pendiente que desemboca en un cuerpo de agua temporal (fig. 1C). La vegetación fue estimada a lo largo de las líneas a intervalos de 10m, a fin de totalizar 5 sitios o unidades muestrales analizadas por línea (0-10, 20-30, 40-50, 60-70 y 90-100m), las cuales sirvieron de base para el análisis general del pastizal y para explorar tanto la posible existencia de un gradiente de humedad como la respuesta de las especies a tal gradiente, por lo que las líneas se trazaron de la parte más alta de la pendiente a la más baja (fig. 1C). Se consideraron como sitios diferentes las unidades muestrales que variaron en la distancia al cuerpo de agua. Para el análisis se asignó el número 1 a los sitios más secos y el 5 a los más húmedos. Cada individuo interceptado por la línea fue incluido en el análisis, en especies amacolladas, se consideró a cada macollo como un solo individuo, y se les midió la altura y la cobertura lineal (cm). El muestreo de la vegetación se llevó a cabo a finales de agosto e inicios de octubre de 2008.
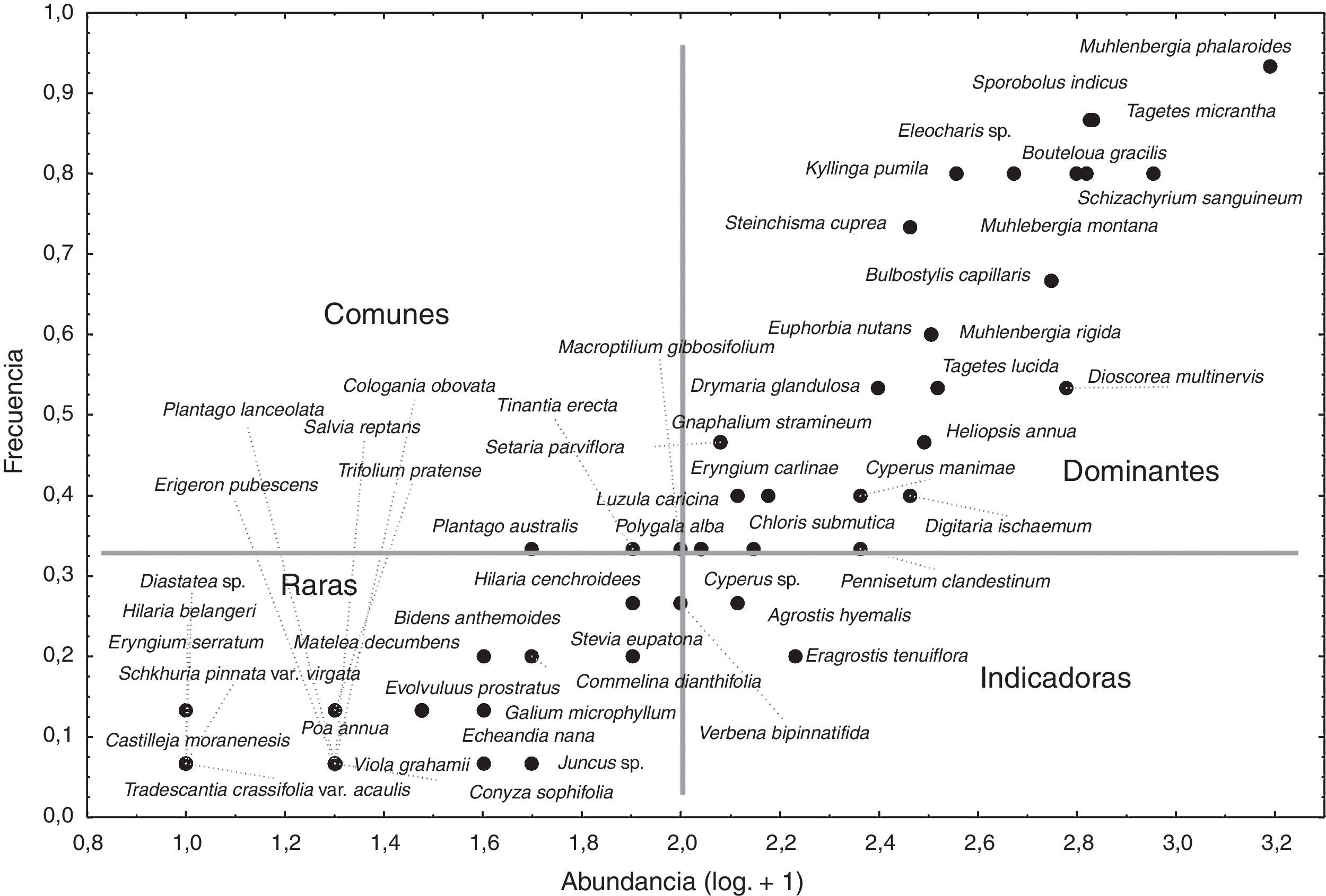
El análisis de diversidad se evaluó mediante el índice de Simpson (ds) al igual que la dominancia (λ) y la equidad (es), adicionalmente se calculó el índice de Shannon-Wiener. La similitud florística entre los distintos sitios muestreados se examinó con los índices de similitud de Morisita y de Jaccard (Moreno, 2001). El análisis estructural incluyó el cálculo de la densidad, cobertura, frecuencia (valores absolutos y relativos), y posteriormente el cálculo del valor de importancia relativo (VIR; suma de los valores relativos) para cada especie presente. Se identificaron las especies dominantes, comunes, raras e indicadoras en el pastizal utilizando sus frecuencias y las abundancias relativas (Sokal y Rohlf, 1979). Se comparó la composición florística entre el pastizal y otras comunidades dominadas por gramíneas a diferentes niveles taxonómicos a partir del cálculo del índice de Sørensen.
ResultadosLa lista florística del pastizal incluye 118 especies, distribuidas en 93 géneros y 40 familias de Angiospermas. Se distribuyen en 2 clases de plantas vasculares: (1) monocotiledóneas con 54 especies (45.8%), las cuales incluyen una nueva especie aún no descrita perteneciente al género Cyclopogon (Orchidaceae), además de 39 géneros (41.9%) y 12 familias (30%), y (2) eudicotiledóneas con 64 especies (54.2%), 54 géneros (58.1%) y 28 familias (70%).
Las familias mejor representadas en cuanto al número de especies son: Poaceae con 25 especies (21.18%), Asteraceae con 15 (12.71%), Fabaceae y Cyperaceae con 7 (5.93%) cada una, Orchidaceae 5 (4.24%), e Iridaceae y Plantaginaceae, con 4 (3.38%) cada una. Estas mismas familias poseen la mayor riqueza de géneros, Poaceae con 18 (19.35%), Asteraceae con 13 (13.68%), Fabaceae con 5 (5.26%) y Cyperaceae y Orchidaceae con 4 (4.21%) cada una, e Iridaceae y Plantaginaceae con 3 (3.15%) cada una.
Los géneros más ricos en especies son: Muhlenbergia con 4 especies, Cyperus, Eragrostis, Sisyrinchium y Cologania, con 3 especies cada uno; en estos 5 géneros se concentra 13.55% de las especies (apéndice). De las especies presentes en el pastizal, 14 (11.86%) son taxa introducidos a México, de los cuales 6 especies son originarias de África, 4 de Eurasia, 3 de Europa, 1 de Sudamérica y una especie de origen incierto (apéndice).
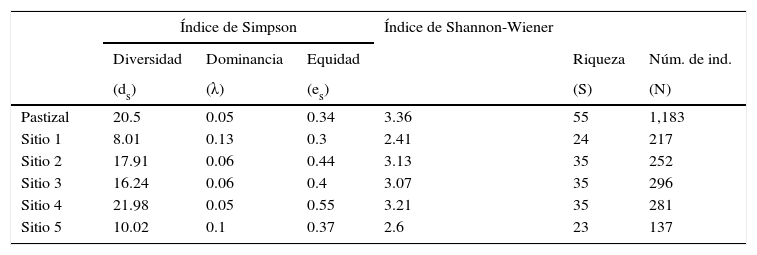
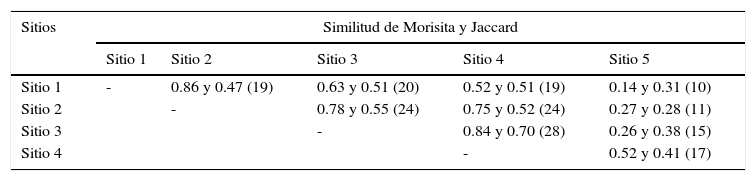
Riqueza, diversidad y similitud florísticaEl índice de diversidad de Simpson del pastizal alcanzó un valor general de 20.50; en contraste, el índice de Shannon-Wiener es de 3.36, mientras que la riqueza total es de 55 especies. Al analizar la vegetación en el gradiente de humedad, los índices de diversidad y la riqueza variaron considerablemente. Los sitios 2, 3 y 4 que son intermedios, tuvieron la misma riqueza específica y valores similares de diversidad y dominancia (tabla 1). Por el contrario, los sitios 1 y 5 que corresponden a los extremos del gradiente, donde 1 es el más seco y 5 el más húmedo, presentaron la menor riqueza específica, valores bajos de diversidad y valores altos de dominancia. La mayor similitud (Morisita) se obtuvo entre los sitios 1 y 2, seguida por los sitios 3 y 4; en contraste, el sitio 5 registró similitudes muy bajas con los otros sitios, en particular con el sitio 1 (tabla 2). Patrones similares ocurren con el índice de Jaccard.
Índices de diversidad, dominancia y equidad de Simpson y de Shannon-Wiener. Riqueza específica y número de individuos para el pastizal y cada uno de los sitios analizados.
| Índice de Simpson | Índice de Shannon-Wiener | |||||
|---|---|---|---|---|---|---|
| Diversidad | Dominancia | Equidad | Riqueza | Núm. de ind. | ||
| (ds) | (λ) | (es) | (S) | (N) | ||
| Pastizal | 20.5 | 0.05 | 0.34 | 3.36 | 55 | 1,183 |
| Sitio 1 | 8.01 | 0.13 | 0.3 | 2.41 | 24 | 217 |
| Sitio 2 | 17.91 | 0.06 | 0.44 | 3.13 | 35 | 252 |
| Sitio 3 | 16.24 | 0.06 | 0.4 | 3.07 | 35 | 296 |
| Sitio 4 | 21.98 | 0.05 | 0.55 | 3.21 | 35 | 281 |
| Sitio 5 | 10.02 | 0.1 | 0.37 | 2.6 | 23 | 137 |
Similitud florística (índices de Morisita –primer valor– y de Jaccard –segundo–) y número de especies comunes (se muestran entre paréntesis) para los distintos sitios analizados en el pastizal.
| Sitios | Similitud de Morisita y Jaccard | ||||
|---|---|---|---|---|---|
| Sitio 1 | Sitio 2 | Sitio 3 | Sitio 4 | Sitio 5 | |
| Sitio 1 | - | 0.86 y 0.47 (19) | 0.63 y 0.51 (20) | 0.52 y 0.51 (19) | 0.14 y 0.31 (10) |
| Sitio 2 | - | 0.78 y 0.55 (24) | 0.75 y 0.52 (24) | 0.27 y 0.28 (11) | |
| Sitio 3 | - | 0.84 y 0.70 (28) | 0.26 y 0.38 (15) | ||
| Sitio 4 | - | 0.52 y 0.41 (17) | |||
0: no hay semejanza; 1: son idénticos.
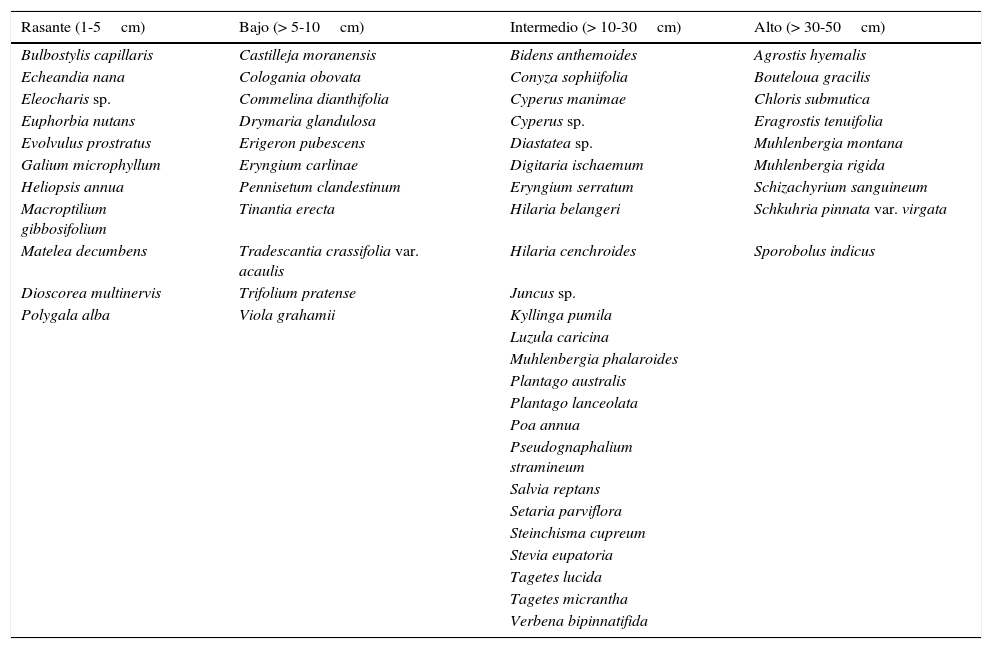
Se registraron 1,183 individuos. La altura total promedio de las especies del pastizal fue de 19.5±0.05cm y la cobertura total promedio de 12.98±0.83cm. El pastizal está formado por una carpeta continua de vegetación que cubre el 98% de la superficie. A pesar de una cierta homogeneidad general, fue posible distinguir 4 estratos (rasante, bajo, intermedio y alto) de acuerdo con la altura de las especies (tabla 3). Los estratos rasante y bajo albergan 11 especies cada uno y contribuyen con el 13.7 y 15.7% de la cobertura, respectivamente; el estrato intermedio presentó 24 especies y aportó el 46.38% de la cobertura; finalmente el estrato alto incluye 9 especies y 24.16% de la cobertura.
Clasificación de las especies presentes en el pastizal (al momento del muestreo) en los distintos estratos (rasante, bajo, intermedio y alto) de acuerdo con su altura.
| Rasante (1-5cm) | Bajo (> 5-10cm) | Intermedio (> 10-30cm) | Alto (> 30-50cm) |
|---|---|---|---|
| Bulbostylis capillaris | Castilleja moranensis | Bidens anthemoides | Agrostis hyemalis |
| Echeandia nana | Cologania obovata | Conyza sophiifolia | Bouteloua gracilis |
| Eleocharis sp. | Commelina dianthifolia | Cyperus manimae | Chloris submutica |
| Euphorbia nutans | Drymaria glandulosa | Cyperus sp. | Eragrostis tenuifolia |
| Evolvulus prostratus | Erigeron pubescens | Diastatea sp. | Muhlenbergia montana |
| Galium microphyllum | Eryngium carlinae | Digitaria ischaemum | Muhlenbergia rigida |
| Heliopsis annua | Pennisetum clandestinum | Eryngium serratum | Schizachyrium sanguineum |
| Macroptilium gibbosifolium | Tinantia erecta | Hilaria belangeri | Schkuhria pinnata var. virgata |
| Matelea decumbens | Tradescantia crassifolia var. acaulis | Hilaria cenchroides | Sporobolus indicus |
| Dioscorea multinervis | Trifolium pratense | Juncus sp. | |
| Polygala alba | Viola grahamii | Kyllinga pumila | |
| Luzula caricina | |||
| Muhlenbergia phalaroides | |||
| Plantago australis | |||
| Plantago lanceolata | |||
| Poa annua | |||
| Pseudognaphalium stramineum | |||
| Salvia reptans | |||
| Setaria parviflora | |||
| Steinchisma cupreum | |||
| Stevia eupatoria | |||
| Tagetes lucida | |||
| Tagetes micrantha | |||
| Verbena bipinnatifida |
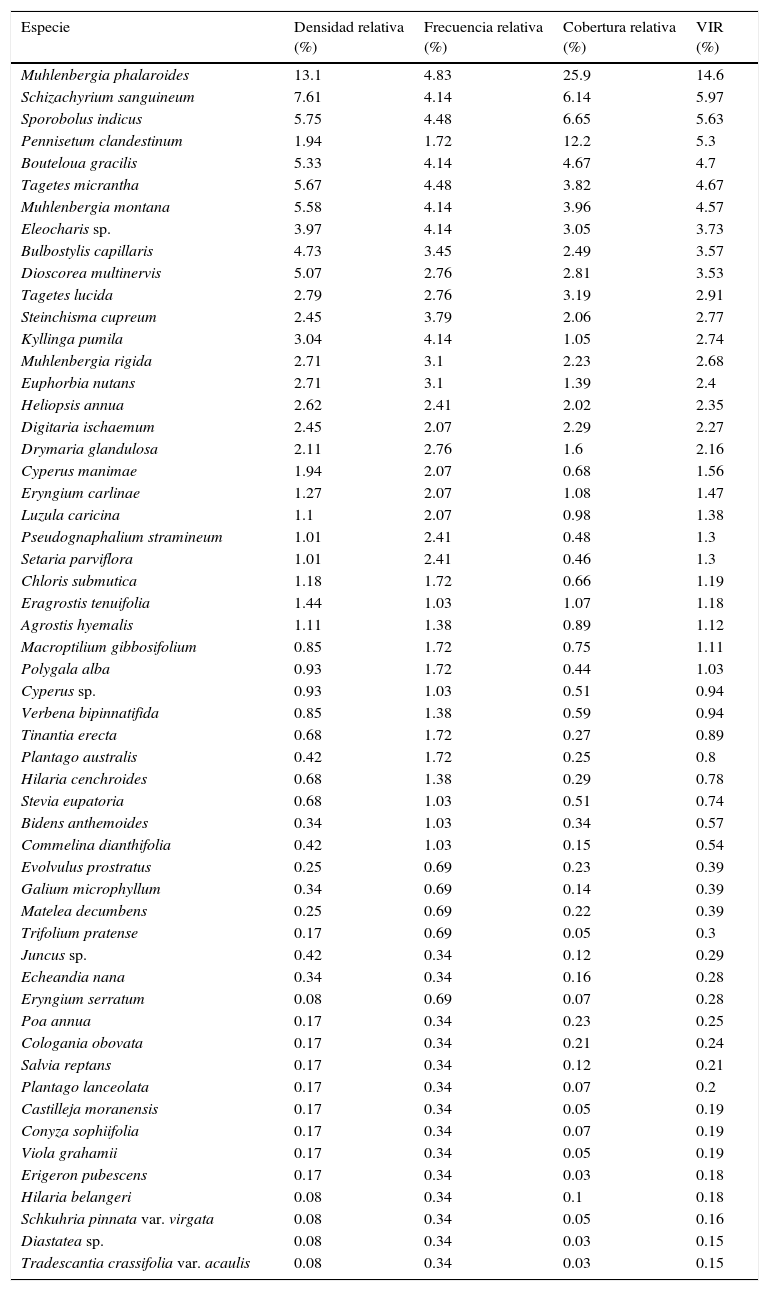
De las 55 especies registradas durante el análisis estructural, 4 de ellas mostraron un VIR mayor al 5%. Las especies dominantes en el pastizal son: M. phalaroides, Schizachyrium sanguineum, Sporobolus indicus y Pennisetum clandestinum (tabla 4), en gran medida por su cobertura relativa; estas 4 especies aportan cerca del 32% de la suma del valor de importancia.
Densidad, frecuencia, cobertura (relativas) y valor de importancia relativa (VIR) de las especies analizadas en el pastizal.
| Especie | Densidad relativa (%) | Frecuencia relativa (%) | Cobertura relativa (%) | VIR (%) |
|---|---|---|---|---|
| Muhlenbergia phalaroides | 13.1 | 4.83 | 25.9 | 14.6 |
| Schizachyrium sanguineum | 7.61 | 4.14 | 6.14 | 5.97 |
| Sporobolus indicus | 5.75 | 4.48 | 6.65 | 5.63 |
| Pennisetum clandestinum | 1.94 | 1.72 | 12.2 | 5.3 |
| Bouteloua gracilis | 5.33 | 4.14 | 4.67 | 4.7 |
| Tagetes micrantha | 5.67 | 4.48 | 3.82 | 4.67 |
| Muhlenbergia montana | 5.58 | 4.14 | 3.96 | 4.57 |
| Eleocharis sp. | 3.97 | 4.14 | 3.05 | 3.73 |
| Bulbostylis capillaris | 4.73 | 3.45 | 2.49 | 3.57 |
| Dioscorea multinervis | 5.07 | 2.76 | 2.81 | 3.53 |
| Tagetes lucida | 2.79 | 2.76 | 3.19 | 2.91 |
| Steinchisma cupreum | 2.45 | 3.79 | 2.06 | 2.77 |
| Kyllinga pumila | 3.04 | 4.14 | 1.05 | 2.74 |
| Muhlenbergia rigida | 2.71 | 3.1 | 2.23 | 2.68 |
| Euphorbia nutans | 2.71 | 3.1 | 1.39 | 2.4 |
| Heliopsis annua | 2.62 | 2.41 | 2.02 | 2.35 |
| Digitaria ischaemum | 2.45 | 2.07 | 2.29 | 2.27 |
| Drymaria glandulosa | 2.11 | 2.76 | 1.6 | 2.16 |
| Cyperus manimae | 1.94 | 2.07 | 0.68 | 1.56 |
| Eryngium carlinae | 1.27 | 2.07 | 1.08 | 1.47 |
| Luzula caricina | 1.1 | 2.07 | 0.98 | 1.38 |
| Pseudognaphalium stramineum | 1.01 | 2.41 | 0.48 | 1.3 |
| Setaria parviflora | 1.01 | 2.41 | 0.46 | 1.3 |
| Chloris submutica | 1.18 | 1.72 | 0.66 | 1.19 |
| Eragrostis tenuifolia | 1.44 | 1.03 | 1.07 | 1.18 |
| Agrostis hyemalis | 1.11 | 1.38 | 0.89 | 1.12 |
| Macroptilium gibbosifolium | 0.85 | 1.72 | 0.75 | 1.11 |
| Polygala alba | 0.93 | 1.72 | 0.44 | 1.03 |
| Cyperus sp. | 0.93 | 1.03 | 0.51 | 0.94 |
| Verbena bipinnatifida | 0.85 | 1.38 | 0.59 | 0.94 |
| Tinantia erecta | 0.68 | 1.72 | 0.27 | 0.89 |
| Plantago australis | 0.42 | 1.72 | 0.25 | 0.8 |
| Hilaria cenchroides | 0.68 | 1.38 | 0.29 | 0.78 |
| Stevia eupatoria | 0.68 | 1.03 | 0.51 | 0.74 |
| Bidens anthemoides | 0.34 | 1.03 | 0.34 | 0.57 |
| Commelina dianthifolia | 0.42 | 1.03 | 0.15 | 0.54 |
| Evolvulus prostratus | 0.25 | 0.69 | 0.23 | 0.39 |
| Galium microphyllum | 0.34 | 0.69 | 0.14 | 0.39 |
| Matelea decumbens | 0.25 | 0.69 | 0.22 | 0.39 |
| Trifolium pratense | 0.17 | 0.69 | 0.05 | 0.3 |
| Juncus sp. | 0.42 | 0.34 | 0.12 | 0.29 |
| Echeandia nana | 0.34 | 0.34 | 0.16 | 0.28 |
| Eryngium serratum | 0.08 | 0.69 | 0.07 | 0.28 |
| Poa annua | 0.17 | 0.34 | 0.23 | 0.25 |
| Cologania obovata | 0.17 | 0.34 | 0.21 | 0.24 |
| Salvia reptans | 0.17 | 0.34 | 0.12 | 0.21 |
| Plantago lanceolata | 0.17 | 0.34 | 0.07 | 0.2 |
| Castilleja moranensis | 0.17 | 0.34 | 0.05 | 0.19 |
| Conyza sophiifolia | 0.17 | 0.34 | 0.07 | 0.19 |
| Viola grahamii | 0.17 | 0.34 | 0.05 | 0.19 |
| Erigeron pubescens | 0.17 | 0.34 | 0.03 | 0.18 |
| Hilaria belangeri | 0.08 | 0.34 | 0.1 | 0.18 |
| Schkuhria pinnata var. virgata | 0.08 | 0.34 | 0.05 | 0.16 |
| Diastatea sp. | 0.08 | 0.34 | 0.03 | 0.15 |
| Tradescantia crassifolia var. acaulis | 0.08 | 0.34 | 0.03 | 0.15 |
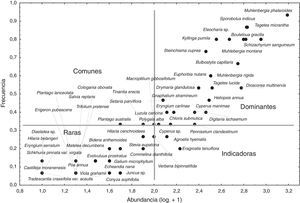
La mayoría de las especies presentes en el pastizal se clasificaron en las categorías de dominantes y raras. En la categoría de especies dominantes se registraron 27 de estas, aunque P. clandestinum, Cyperus sp., Polygala alba y Macroptilium gibbosifolium, están colocadas en el límite entre dominantes e indicadoras. Entre las especies comunes solo se observó a Plantago australis y Tinantia erecta; no obstante, estas también tuvieron una posición marginal entre las comunes y las raras. En la condición de especies raras se localizaron 23 taxa. Finalmente, en la categoría de especies indicadoras únicamente quedaron Agrostis hyemalis, Eragrostis tenuifolia y Verbena bipinnatifida (fig. 2).
DiscusiónLa riqueza y la composición de especies observadas en el área estudiada evidencian que el pastizal tiene potencial para la conservación de la biodiversidad. Merece una mención especial el hallazgo de una nueva especie de orquídea, la cual se ubica en el género Cyclopogon; esto confirma la necesidad de explorar botánicamente el territorio del Estado de México de manera intensa, pues a pesar de contar con un listado de su flora (Martínez y Matuda, 1979), esta deberá actualizarse.
La riqueza específica del pastizal es mayor que la reportada para un pastizal de Bouteloua dactyloides (Cruz, 1969), la consignada para la vegetación arvense de áreas de cultivo del Valle de Toluca (Vieyra-Odilón y Vibrans, 2001) y un campo de cultivo abandonado (> 25 años; González-Plata, 1998), donde se registraron 35, 74 y 85 especies en cada estudio; y menor que la obtenida para un pastizal de Querétaro (Suárez-Martínez, 1999), un pastizal de Hilaria cenchroides del Valle de México (Cruz, 1969) y claros de bosque (pino-encino), caminos y alrededor de cuerpos de agua (pozas y una presa; Rivas-Manzano y Vibrans, 2000) en los cuales se registraron 141, 233 y 300 especies en cada investigación. Otros pastizales evaluados asociados a los bosques templados de la cuenca de México (Silva-Pérez, 1998; Velázquez-Montes y Romero, 1998), muestran una baja diversidad y difieren significativamente en la composición florística con este pastizal. Muchos de estos pastizales inducidos se encuentran inmersos en la vegetación natural correspondiente a bosques templados y otros en potreros establecidos en áreas que originalmente presentaban selva alta perennifolia; además de pastos nativos, en ellos es frecuente encontrar individuos adultos y plántulas de árboles remanentes de selva, lo que contribuye a su diversidad (Guevara, Meave, Moreno-Casasola, Laborde y Castillo, 1994; Lira-Noriega, Guevara, Laborde y Sánchez-Ríos, 2007). La diversidad que presentan estas áreas se debe tanto a la migración de especies de la vegetación original como a la presión de alteración. En contraste, el pastizal estudiado se encuentra aislado de las áreas boscosas que pudieran mantener flujo de especies con este sitio y es evidente la ausencia de árboles y arbustos (fig. 1A). Aunque la presión de la alteración (incendios y pastoreo) es constante, prácticamente no se presenta suelo desnudo y la riqueza de especies es alta. El número de familias (40) y de géneros (93) registrados en la presente investigación es similar a los reportados en estos trabajos. Las familias Poaceae, Asteraceae y Fabaceae fueron las más diversas, en consistencia con estudios florísticos realizados no solo en el Estado de México sino en todo el país (Martínez y Matuda, 1979; Rzedowski, 1991; Villaseñor, 2003, 2004; Villaseñor y Ortiz, 2014). Sin embargo, estas mismas familias incluyeron la mayor riqueza de especies exóticas, en concordancia con el reporte de Villaseñor y Espinosa-García (2004).
La elevada riqueza de especies del pastizal refuerza el trabajo de Wilson et al. (2012), quienes mencionan que los pastizales junto con los bosques tropicales lluviosos son los 2 ecosistemas terrestres con mayor diversidad y que aun cuando los pastizales son ecosistemas sometidos a perturbaciones moderadas, estos pueden albergar una gran diversidad de especies en una superficie muy pequeña (< 100 m2); sin embargo, esta elevada diversidad podría estar relacionada con la heterogeneidad ambiental (Collins y Barber, 1986) por lo que para planes de conservación y diseño de algunas reservas ecológicas habrán de ser tomados en cuenta.
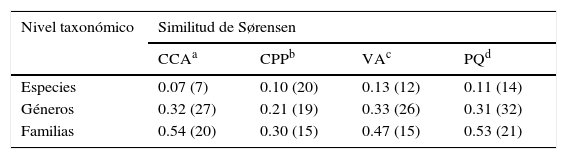
La similitud florística entre el pastizal y otras comunidades de origen secundario dominadas por gramíneas a distintos niveles taxonómicos reveló que un 50% de las familias se comparten entre las distintas comunidades; no obstante, esta similitud es menor a nivel genérico con 30% de los géneros compartidos y a nivel específico la similitud florística es todavía menor con 15% de las especies compartidas (tabla 5). Estas cifras ponen de manifiesto que el pastizal estudiado podría tener un origen distinto a las comunidades con las que fue comparado. Sin embargo, también es evidente el grado de alteración del pastizal, pues muchas de las especies compartidas entre el pastizal y las otras comunidades son ruderales o arvenses, presentes en pastizales secundarios, orilla de caminos, campos de cultivo y sitios perturbados de bosques de pino-encino. Finalmente, algunas otras plantas resultaron ser exóticas, como P. clandestinum, especie conocida por su gran capacidad invasora.
Similitud florística (índice de similitud de Sørensen) a distintos niveles taxonómicos (especies, géneros y familias), entre el pastizal y otras comunidades templadas dominadas por gramíneas.
| Nivel taxonómico | Similitud de Sørensen | |||
|---|---|---|---|---|
| CCAa | CPPb | VAc | PQd | |
| Especies | 0.07 (7) | 0.10 (20) | 0.13 (12) | 0.11 (14) |
| Géneros | 0.32 (27) | 0.21 (19) | 0.33 (26) | 0.31 (32) |
| Familias | 0.54 (20) | 0.30 (15) | 0.47 (15) | 0.53 (21) |
CCA:campos de cultivo abandonado (> 25 años); CPP:caminos alrededor de pozas y una presa; PQ: pastizal queretano;VA:vegetación arvense. El número de especies, géneros y familias en común se muestra entre paréntesis.
La alta incidencia de los disturbios antrópicos y la presencia de especies exóticas en el pastizal, principalmente gramíneas, permiten conjeturar que el pastizal podría tener un origen antrópico, derivado de bosques de pino-encino, como es el caso de muchos pastizales presentes en el Estado de México. Sin embargo, no se tiene información suficiente para dilucidar con precisión su origen; no obstante, cualquiera que este sea, no se puede hacer a un lado la posibilidad de que algunos pastizales templados del centro del país tengan un origen natural (primario), como se ha propuesto para algunos sistemas equivalentes localizados en las regiones tropicales del país (Hernández, 1964; López-Olmedo et al., 2007; Pérez-García y Meave, 2006). Por otra parte, la invasión de especies exóticas en estas comunidades podría ser demasiado rápida, de modo que estas logran desplazar a las nativas debido a su mayor capacidad competitiva. Para poder resolverlo, estudios futuros tendrán que evaluar la dinámica de las especies invasoras, así como la composición de especies en pastizales con exclusión de pastoreo y sin fuego, para establecer su posible origen.
La comparación de los índices de diversidad calculados en este trabajo con un estudio realizado por López-Olmedo et al. (2006) para una sabana de origen primario en la región del sureste del país es similar (3.36 vs. 3.64), aun cuando estos difieren sustancialmente en los métodos de muestreo y condiciones climáticas. Por otra parte, las diferencias entre los diferentes sitios analizados a lo largo de la pendiente pueden estar relacionadas tanto con la abundancia y riqueza de especies, como con efectos diferenciales de los disturbios antrópicos, o incluso con las condiciones microclimáticas donde se realizaron los censos de la vegetación, las cuales podrían estar condicionando la distribución de la especies por algún factor como la variación en la humedad del suelo (Álvarez-Lopeztello, 2010). La similitud florística entre los sitios intermedios (2, 3 y 4), y la disimilitud con los extremos (1 y 5), también apoyan esta posibilidad (tabla 2).
En general, la cobertura del pastizal se extiende sobre casi toda la superficie (98%) del terreno (fig. 1B), lo que sugiere que los disturbios aún no ejercen gran presión sobre la vegetación; sin embargo, esto no es muy claro del todo pues, si se llegase a ejercer se están seleccionando especies de porte intermedio y bajo (tabla 3) que prosperan bajo estas circunstancias. Poaceae fue estructuralmente la familia dominante en el pastizal seguida de Asteraceae y Cyperaceae con más de la mitad de la suma de valores de importancia de las especies del pastizal. Por otra parte, el análisis estructural reveló que M. phalaroides, S. sanguineum, S. indicus y P. clandestinum son las especies dominantes y con el mayor VIR. Es probable que esta dominancia esté relacionada con el hecho de que dichas especies puedan estar adaptadas en cierto grado al fuego y pastoreo. Es importante señalar que aun cuando P. clandestinum está presente, no es la especies más dominante, una posible explicación a esto puede ser su introducción al pastizal en años recientes, por lo tanto aun no ejerce gran capacidad competitiva, con el resto de las especies dominantes a pesar de su amplio rango de tolerancia a condiciones ambientales (Muscolo, Panuccio y Sidari, 2003).
Con respecto a las especies dominantes, comunes, raras e indicadoras en el pastizal, la mayoría de los taxa dominantes pertenecen a las familias Poaceae y Cyperaceae, como es de esperarse para este tipo de vegetación. Además, un gran número de especies se clasificaron en la categoría de raras, lo que pone en evidencia que si bien algunas especies de gramíneas son favorecidas por el fuego y el pastoreo, muchas otras pueden no tolerar estos factores y por lo tanto podrían desaparecer de la comunidad solo con un incremento en la frecuencia de dichos factores.
En síntesis los resultados de este estudio exhiben la necesidad de acrecentar las investigaciones en pastizales templados y de sus equivalentes en las zonas tropicales del territorio nacional. Además, se requieren estudios experimentales a largo plazo con exclusión de fuego y pastoreo en estos ecosistemas, para dilucidar con precisión la naturaleza de muchas de estas comunidades vegetales, aparentemente de origen secundario, con la finalidad de sugerir estrategias adecuadas de conservación, manejo, aprovechamiento racional y restauración.
AgradecimientosAgradecemos a Hilda Flores Olvera y a Blanca Verónica Juárez Jaimes por facilitarnos el acceso a las instalaciones del Herbario Nacional (MEXU) de la Universidad Nacional Autónoma de México para el cotejo de ejemplares; a Gerardo A. Salazar Chávez y Rafael Torres Colín por su ayuda en la determinación taxonómica de algunos ejemplares de las familias Orchidaceae y Dioscoreaceae. Jesús Enrique Soto Ramos facilitó los datos de temperatura y precipitación y Guillermo Enríquez Marín colaboró en el trabajo de campo. Ednita Espinoza Hernández y Ana Mejía Canales facilitaron las imágenes. Finalmente, agradecemos a Jorge A. Meave y José Luis Álvarez Lopeztello, quienes leyeron el manuscrito y contribuyeron con valiosas críticas y sugerencias a fin de mejorar su calidad.
| Familias y especies | Familia y especies |
|---|---|
| Monocotiledoneas | Schiedeella llaveana var. alinae Szlach. |
| Asparagaceae | Schiedeella tenella (L.O. Williams) Burns-Bal. |
| Echeandia flavescens (Schult y Schult.) Cruden | Poaceae |
| Echeandia nana (Baker) Cruden | Agrostis hyemalis (Walter) Britton, Sterns y Poggenb.*5 |
| Commelinaceae | Bouteloua gracilis (Kunth) Lag. ex Griffiths |
| Commelina tuberosa L. | Bouteloua simplex Lag. |
| Tinantia erecta (Jacq.) Schltdl. | Chascolytrum subaristatum (Lam.) Desv. |
| Tradescantia crassifolia var. acaulis (M. Martens y Galeotti) C.B. Clarke | Chloris submutica Kunth |
| Cyperaceae | Cynodon dactylon (L.) Pers.* 1 |
| Bulbostylis capillaris (L.) Kunth ex C.B. Clarke | Digitaria ischaemum (Schreb.) Muhl.* 1 |
| Cyperus esculentus L. * 2 | Echinochloa oplismenoides (E. Fourn.) Hitchc. |
| Cyperus manimae Kunth | Eleusine multiflora Hochst. ex A. Rich.* 1 |
| Cyperus sp. | Eragrostis intermedia Hitchc. |
| Eleocharis elegans (Kunth) Roem y Schult. | Eragrostis sp. |
| Eleocharis sp. | Eragrostis tenuifolia (A. Rich.) Hochst. ex Steud.* 1 |
| Kyllinga pumila Michx. | Hilaria belangeri (Steud.) Nash |
| Dioscoreaceae | Hilaria cenchroides Kunth |
| Dioscorea multinervis Benth. | Muhlenbergia montana (Nutt.) Hitchc. |
| Hypoxidaceae | Muhlenbergia phalaroides (Kunth) P.M. Peterson |
| Hypoxis mexicana Schult y Schult. f. | Muhlenbergia rigida (Kunth) Kunth |
| Iridaceae | Muhlenbergia tricholepis (Torr.) Columbus |
| Nemastylis tenuis (Herb.) S. Watson | Pennisetum clandestinum Hochst. ex Chiov.* 1 |
| Sisyrinchium scabrum Cham. y Schltdl. | Peyritschia pringlei (Scribn.) S.D. Koch |
| Sisyrinchium tenuifolium Humb. y Bonpl. ex Willd. | Poa annua L.* 4 |
| Sisyrinchium tolucense Peyr. | Schizachyrium sanguineum (Retz.) Alston |
| Juncaceae | Setaria parviflora (Poir.) Kerguélen |
| Juncus sp. | Sporobolus indicus (L.) R. Br. |
| Juncus sp. | Steinchisma cupreum (Hitchc y Chase) W.V. Br. |
| Luzula caricina E. Mey. | Pontederiaceae |
| Lilaeaceae | Eichhornia crassipes (Mart.) Solms* 4 |
| Lilaea scilloides (Poir.) Hauman | Eudicotiledoneas |
| Liliaceae | Apiaceae |
| Calochortus barbatus (Kunth) J.H. Painter | Eryngium carlinae F. Delaroche |
| Orchidaceae | Eryngium serratum Cav. |
| Brachystele affinis (C. Schweinf.) Burns-Bal y R. González | Tauschia nudicaulis Schltdl. |
| Cyclopogon sp. nov. | Apocynaceae |
| Sarcoglottis schaffneri (Rchb. f.) Ames | Asclepias glaucescens Kunth |
| Apocynaceae | Gentianaceae |
| Asclepias rzedowskii W.D. Stevens | Gentiana bicuspidata (G. Don.) Briq. |
| Matelea decumbens W.D. Stevens | Hypericaceae |
| Araliaceae | Hypericum formosum Kunth |
| Hydrocotyle ranunculoides L.f. | Lamiaceae |
| Asteraceae | Prunella vulgaris L. |
| Bidens anthemoides (DC.) Sherff | Salvia leucantha Cav. |
| Cirsium vulgare (Savi) Ten.* 3 | Salvia reptans Jacq. |
| Conyza sophiifolia Kunth | Lythraceae |
| Cosmos bipinnatus Cav. | Cuphea procumbens Ortega |
| Erigeron pubescens Kunth | Malvaceae |
| Flaveria trinervia (Spreng.) C. Mohr | Sida abutifolia Mill. |
| Heliopsis annua Hemsl. | Onagraceae |
| Pseudognaphalium stramineum (Kunth) Anderb. | Oenothera rosea L’Hér. ex Aiton |
| Schkuhria pinnata var. virgata (La Llave) Heiser | Oenothera tetraptera Cav. |
| Senecio toluccanus DC. | Orobanchaceae |
| Stevia connata Lag. | Buchnera sp. |
| Stevia eupatoria (Spreng.) Willd. | Castilleja moranensis Kunth |
| Tagetes lucida Cav. | Oxalidaceae |
| Tagetes micrantha Cav. | Oxalis corniculata L. |
| Taraxacum officinale F.H. Wigg.* 3 | Plantaginaceae |
| Boraginaceae | Bacopa sp. |
| Lithospermum distichum Ortega | Mecardonia procumbens (Mill.) Small |
| Brassicaceae | Plantago australis Lam. |
| Brassica napus L.* 2 | Plantago lanceolata L.* 3 |
| Descurainia impatiens O. E. Schulz | Polemoniaceae |
| Campanulaceae | Phlox sp. |
| Diastatea sp. | Phlox sp. |
| Caryophyllaceae | Polygalaceae |
| Drymaria glandulosa Bartl. | Polygala alba Nutt. |
| Convolvulaceae | Polygonaceae |
| Cuscuta glabior (Engelm.) Yunck. | Polygonum punctatum Elliott |
| Evolvulus prostratus B.L. Rob. | Rumex flexicaulis Rech. f. |
| Euphorbiaceae | Rubiaceae |
| Euphorbia nutans Lag. | Galium microphyllum A. Gray. |
| Fabaceae | Scrophulariaceae |
| Cologania angustifolia Kunth. | Limosella aquatica L. |
| Cologania biloba (Lindl) G. Nicholson | Solanaceae |
| Cologania obovata Schltdl. | Physalis philadelphica Lam. |
| Dalea leporina (Aiton) Bullock | Solanum rostratum Dunal |
| Lupinus campestris Cham. y Schltdl. | Verbenaceae |
| Macroptilum gibbosifolium (Ortega) A. Delgado | Verbena bipinnatifida Nutt. |
| Trifolium pratense L.* 2 | Violaceae |
| Viola grahamii Benth. |
Origen de las especies introducidas: 1=África; 2=Europa; 3=Eurasia; 4=Sudamérica; 5=Origen incierto.
La revisión por pares es responsabilidad de la Universidad Nacional Autónoma de México.