El género Phaeoclavulina, agrupa aproximadamente a 41 especies de las cuales, 35 presentan basidiomas ampliamente ramificados. En México, sólo se conocían 3 de estas especies. El presente trabajo planteó el estudio taxonómico de ejemplares recolectados por los autores y de materiales depositados en los herbarios nacionales, así como de material de referencia del herbario TENN. Se describen e ilustran 12 taxones, se incluyen claves para su diferenciación y se discuten aspectos relevantes de su taxonomía y distribución geográfica. Phaeoclavulina argentea, P. articulotela, P. cokeri, P. campoi, P. decurrens, P. gigantea, P. longicaulis, P. roellinii y P. zippelii son nuevos registros para México.
Genus Phaeoclavulina groups together approximately 41 species, of which 35 form ramarioid basidiomes. In Mexico, only 3 of these species were reported previously. In this work, a taxonomic examination of the genus was achieved; reviewing material collected by the authors as well as specimens from several Mexican herbaria and reference materials from TENN herbarium. A total of 12 taxa are described and illustrated along with a key for its determination. In addition, relevant taxonomic and geographic distribution issues are discussed. The species Phaeoclavulina argentea, P. articulotela, P. cokeri, P. campoi, P. decurrens, P. gigantea, P. longicaulis, P. roellinii y P. zippelii are new records for Mexico
En 1897 Brinkmann utilizó el nombre genérico de Phaeoclavulina para hongos ramarioides con esporas espinosas quedando aquí incluidas especies como P. macrospora (= Ramaria broomei (Cott. y Wake.) Petersen, sin embargo, como menciona Petersen (1981), prácticamente no fue reconocido por otros autores. Posteriormente, Corner (1970), agrupó a especies con estas características en Ramaria subgénero Echinoramaria.
De acuerdo con las hipótesis filogenéticas planteadas por Giachini (2004), Hosaka et al. (2006) y Giachini et al. (2010), las especies tradicionalmente agrupadas en el subgénero Echinoramaria del género Ramaria (Corner 1970; Marr y Stuntz 1973; Petersen 1981; Exeter et al. 2006) o en los subgéneros Echinoramaria y Asteroramaria, según Christan (2008), en conjunto con 6 especies de Gomphus (Gomphus africanus, G. grandis, G. guadelupensis, G. retisposus, G. subclaviformis, G. viridis), conforman un grupo monofilético. Considerando que en este clado quedan agrupadas principalmente especies ramarioides con esporas espinosas, Giachini et al. (2010) retoman el nombre genérico de Phaeoclavulina apoyándose en el principio de prioridad establecido en el Código de Viena (McNeill et al., 2006), y formalizan a este taxón el cual es justificado por caracteres morfológicos y moleculares (Giachini y Castellano, 2011).
Morfológicamente Phaeoclavulina es caracterizado por presentar basidiomas ramarioides, unipileados o merismatoides, en coloraciones café en diferentes tonalidades, violetas, grises o anaranjado-amarillento; cuando pileados, éstos son lisos e infundibuliformes o flabeliformes. El himenio es liso, rugoso o con costillas evidentes; las esporas son equinuladas, verrugosas o reticuladas y las hifas presentan fíbulas frecuentes. Su distribución es cosmopolita en vegetación templada y tropical, sin embargo, son más abundantes en los trópicos y subtrópicos. Agrupa a 41 especies, de las cuales 35 presentan basidiomas con crecimiento “ramarioide” y 6 con basidiomas “gomfoides” (Giachini y Castellano 2011).
Para México, sólo han sido reportadas 3 especies de Phaeoclavulina:. P. abietina (como Ramaria abietina) y P. curta (como Ramaria myceliosa) de bosque de coníferas y/o mixtos principalmente del centro del país (Acosta-Pérez y Kong-Luz, 1991; Estrada-Torres, 1994; Herrera et al. 2002; Montoya et al. 2003; Villarruel-Ordaz y Cifuentes 2007) y P. cyanocephala, (como Ramaria cyanocephala) para las regiones tropicales de Quintana Roo y Yucatán (Guzmán, 1983, 2003).
Con base en el estudio de ejemplares recolectados por los autores y la revisión de ejemplares depositados en diferentes colecciones nacionales, en este trabajo se describen e ilustran 12 taxones del género Phaeoclavulina presentes en México.
Materiales y métodosPara este estudio fueron revisados 110 ejemplares depositados en los herbarios. ECOSUR-Unidad San Cristóbal, CHIP, FCME, ENCB, EBUM, IBUG, MEXU, TLXM, UJAT y XAL, contando con el apoyo de materiales de referencia de la colección TENN (Index Herbariorum. http://sweetgum.nybg.org/). La revisión macro y microscópica se realizó de acuerdo con las técnicas de Largent et al. (1980), Petersen (1981, 1988) y Basso (2005). Las anotaciones del código de color de la forma “10YR4/5” corresponden con Munsell (1992) y las codificadas como “3B2” con Kornerup y Wanscher (1978). Los estadísticos de las esporas están basados en al menos 30 mediciones en KOH al 5% por ejemplar, bajo las siguientes abreviaturas. E_;= intervalo entre la relación del largo y ancho, E_;m= cociente medio entre largo y ancho, L_;m= media del largo y A_;m= media del ancho. Debido a la forma cónica de los esterigmas, el ancho se midió en la base. Las observaciones de microscopía electrónica de barrido (MEB) se realizaron con un microscopio JEOL modelo JSM – 2310LV. Las fotografías indicadas con (*) corresponden con el catálogo fotográfico del Dr. Joaquín Cifuentes Blanco de la Facultad de Ciencias, UNAM.
La clasificación adoptada en este trabajo para agrupar a las especies en Phaeoclavulina corresponde con las propuestas de Giachini et al. (2010) y Giachini y Castellano (2011), considerando que es acorde con la hipótesis filogenética más robusta hasta ahora planteada. La descripción de los taxones se presenta en orden alfabético.
DescripcionesPhaeoclavulina abietina (Pers.) Giachini, Mycotaxon 115: 193 (2011)
≡ Clavaria abietina Pers., Neues Mag. Bot. 1: 117 (1794) [sanctioned name; non “Clavaria abietina” sensu Fr. 1821].
= Clavaria ochraceovirens Jungh., Linnaea 5: 407 (1830).
≡ Ramaria abietina (Pers.) Quél., Fl. Mycol. France. 467 (1888).
≡ Ramaria virescens (Gramberg) Hennig, in Michael, Führ. Pilzfr. 3: 320 (1927).
≡ Ramaria ochraceovirens (Jungh.) Donk var. ochraceovirens, Meded. Ned. Mycol. Ver. 22: 112 (1933).
= Ramaria ochrochlora Furrer-Ziogas y Schild, in Schild, Fung. Rar. Icon. Color. 5: 17 (1971).
= Ramaria ochraceovirens var. parvispora K.S. Thind, Khurana y S.C. Kaushal, Kavaka 11: 33 (1984).
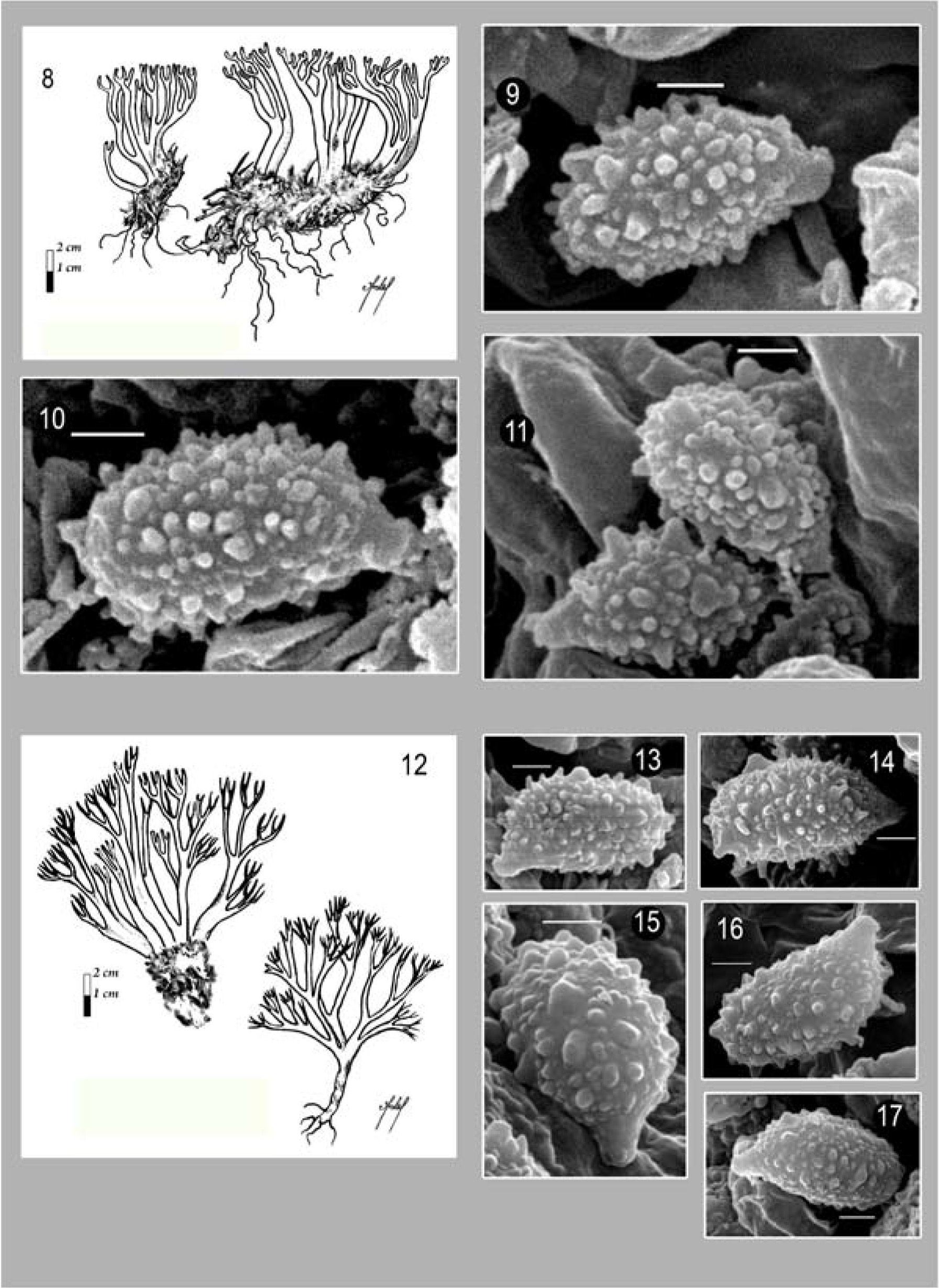
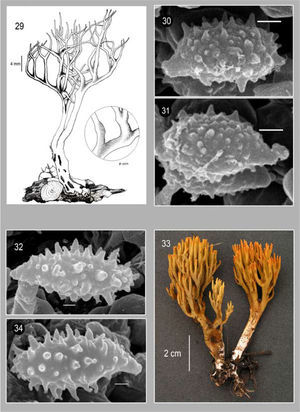
Basidiomas de 30−90×10−64mm; con hasta 5 niveles de ramificación dicotómica a policotómica y generalmente en un patrón que disminuye gradualmente. Ramas cilíndricas, color amarillo-anaranjado pálido a café cenizo (5F8) con tonos café oliváceo en la parte media; axilas redondeadas o agudas. Ápices agudos de color amarillo-café, amarillo verdoso (1A8), amarillo grisáceo (1B6) o café (5E8). Estípite generalmente inmerso en el sustrato, de 12−40×3−18mm, cilíndrico a ligeramente atenuado hacia la base, sinuoso, blanquecino con tonos de color café hollín (5F5) o amarillo-anaranjado (3B5). La superficie del basidioma cambia al maltrato y/o madurez a color verde o azul verdoso oscuro. Micelio basal abundante, blanco con una apariencia algodonosa y numerosos cordones miceliares, delgados y extensos de color blanco. Contexto gris o verde grisáceo (5E3, 26B14). Consistencia carnosafibrosa. Olor inapreciable o ligeramente a hongo, sabor amargo o astringente. Con FeCl3, el himenio cambia a verde oscuro de manera inmediata.
Himenio anfígeno y engrosado, ausente en las axilas. Basidios de 20.8−50.4×3.5−9.3μm, subcilíndricos a subclavados, hialinos, multigutulados, con 4 esterigmas rectos de 3.1−8.4×1.4−2.6μm. Esporas de (6.3−) 6.8−11.2×2−5.2 (−5.6)μm (E=1.6−3.2, E_;m=2.0,L_;m=8.2μm y A_;m=3.9 μm), sublacriformes, con pared delgada, finamente equinuladas. Con MEB, se observa que la ornamentación presenta maduración asincrónica, quínulas no mayores a 0.5μm en longitud y con ápices subredondeados; apéndice hilar sublateral, confluente de 1.4−2.8μm de longitud.
Subhimenio con hifas generativas, entremezcladas, hialinas, con pared delgada, de 1.4−5.6μm de diámetro. Contexto con hifas generativas en disposición paralela, de 1.4−8.4μm de diámetro, escasas conexiones en “H”, fíbulas frecuentes y conexiones ampuliformes ocasionales de hasta 11.2μm de diámetro; hifas gleopleróticas escasas, de 1.4−2.8μm de diámetro. Cristales esteliformes o de formas irregulares distribuidos irregularmente en la superficie de las hifas. Micelio basal monomítico, con hifas de 1.4−4.2μm en diámetro, fíbulas frecuentes, conexiones ampuliformes de hasta 12.6μm de diámetro y abundantes cristales esteliformes.
Resumen taxonómicoHábito y hábitat. Gregario a subgregario, humícola, desarrollándose en bosques de Abies, Abies-Juniperus, Pinus, Pseudotsuga, mezclas de ellos o con Quercus y Arbutus, a una altitud de 2 400 a 3 000m.
Material examinado. México: Chihuahua, Garibay Origel R. 24 (FCME 9296); Estado de México, Gaso Prado M.I. y Alvarado, agosto 1984, Pérez Silva E., Aguirre Acosta E. y Chinchilla E. 12 de agosto de 1981, Herrera Suárez T., Zenteno M. y Hernández Ramírez, 1 de octubre de 1961, Calderón A. y Sánchez E. 10 de agosto de 1986, Pérez Silva E. y Lamothe Argumedo R., 4 de agosto de 1974 (MEXU 18238, MEXU 19250, MEXU 2642, MEXU 20442, MEXU 11330), Hernández y Sánchez 430, Nava Mora 25 de septiembre de 1988, Colmenero J. 6, Estrada-Torres 1381, 1638, 1903, 1631, 1597 (TLXM); Hidalgo, R. Hirata 448 (ENCB), Cifuentes 895 y Rodríguez G. 2839 (TLXM); Jalisco, Rodríguez O. 1343 (IBUG); Michoacán, Pérez-Corona y Villarruel-Ordaz 644, Patiño Conde V. 28, Valencia Flores I. y Villarruel Ordaz J. L. 792, Ávila y Cifuentes J. 4070 (FCME 15089, FCME 17245, FCME 17420, FCME 17057) Chávez Mercedes 21 (EBUM 18506); Tlaxcala, Estrada-Torres 2884, 3389 Kong Luz 4383, Hernández Díaz 34 (TLXM). Estados Unidos: Minnesota, Jenkins 26 de agosto de 1971 (TENN 36222), California, Petersen R. 2961(TENN 33323)
Comentarios taxonómicos. Caracteres distintivos de Phaeoclavulina abietina son. un cambio evidente de coloración a verde oscuro en los basidiomas, la presencia de abundante micelio blanco en la base y esporas no mayores a 11μm de longitud, siendo esta última característica la que principalmente la diferencia de especies como P. glauco-aromatico (R.H. Petersen) Giachini, P. echinovirens (Corner, K.S. Thind y Dev) Giachini y P. mutabilis (Schild y R.H. Petersen) Giachini, con las que comparte caracteres como color y su cambio en los basidiomas. El tamaño de los basidiomas en Phaeoclavulina abietina es variable; Petersen (1981) los menciona de hasta 75mm de longitud, no obstante, en este trabajo se estudiaron ejemplares de hasta 90mm y Estrada-Torres (1994) registró ejemplares de hasta 105mm. Los datos macro y micromorfológicos de los ejemplares revisados en este trabajo, son concordantes con los materiales de referencia solicitados al herbario TENN (36222 y 33323) y las descripciones de Petersen (1981), Franchi y Marchetti (2001), Exeter (2003), Exeter et al. 2006) y Christan (2008).
Ésta es la especie del género Phaeoclavulina que presenta la distribución más amplia hasta ahora conocida. Se ha ubicado en los bosques de coníferas del hemisferio norte, principalmente en Europa y Estados Unidos. En México es una especie frecuente en los bosques de coníferas, que se desarrollan a altitudes de hasta 3 000m. Había sido previamente citada (como Ramaria abietina) para los estados de Hidalgo, Estado de México, Tlaxcala y D. F. (Estrada-Torres, 1994; Villarruel-Ordaz y Cifuentes, 2007; Montoya, et al., 2003). En este trabajo se amplía su distribución a Chihuahua y Michoacán, además de adicionar datos relevantes en torno a la ornamentación de las esporas.
Phaeoclavulina argentea (R.H. Petersen) Giachini, Mycotaxon 115: 189 (2011).
≡ Ramaria argentea R. H. Petersen, Biblthca. Mycol. 79: 111 (1981).
= Ramaria incognita R.H. Petersen, Biblthca. Mycol. 79: 145 (1981).
= Ramaria incongrua R.H. Petersen, Biblthca. Mycol. 79: 147 (1981).
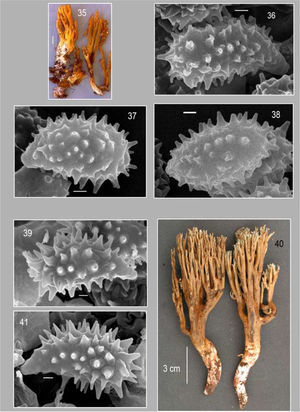
Basidiomas solitarios u ocasionalmente fasciculados de 14−80×9−30mm, con hasta 4 niveles de ramificación, mas o menos laxas y dicotómicas que disminuyen gradualmente. Ramas primarias cilíndricas a aplanadas de hasta 5mm en diámetro, de color amarillento claro a café muy pálido (10YR7/4). Ramas secundarias cilíndricas de color amarillento claro. Axilas redondeadas. Ápices agudos a subagudos, de color amarillo (10YR8/6), con cambio a color café-amarillo oscuro (10YR4/6) o café grisáceo al maltrato. Estípite poco evidente de 3−10×210mm, cilíndrico, superficie lisa a finamente tomentosa, blanquecina a café muy pálido (10YR7/4). Los basidiomas cambian a color café claro (10YR 4/4) con el maltrato y/o la maduración. Micelio basal abundante, blanco, con cordones miceliares de hasta 1mm de diámetro. Contexto blanquecino en el estípite y café amarillento pálido (10YR 6/4) en las ramificaciones. Consistencia subcorreosa. Sabor amargo, olor inapreciable.
Himenio anfígeno. Basidios de 32.2−49×4.9−7μm, subclavados, hialinos, multigutulados, tetraspóricos, con esterigmas rectos a ligeramente curvados, de 3.5−7×1.4−2.1μm. Esporas de 4.9−8.4×2.8−4.2 (−4.9)μm (E_;=1.5−2.5,E_;m=2,L_;m=6.7 y μm y A_;m=3.2 y μm), sub-elípticas, con una ornamentación que al observarse en MEB son en forma de verrugas redondeadas de diferente tamaño lo que probablemente indique diferente estado de madurez, distribuidas homogéneamente, y alcanzando una longitud no mayor a 0.5μm. Apéndice hilar sublateral, acuminado, de 0.4 a 0.8μm de longitud.
Subhimenio monomítico, con hifas entremezcladas, de 1.4−5.6μm de diámetro, hialinas, con pared delgada. Contexto con 2 diferentes tipos de hifas. 1) generativas en disposición paralela, hialinas, de 2.1−9.8μm en diámetro, fíbulas frecuentes y con escasas conexiones ampuliformes, de hasta 12.6μm en diámetro, y 2) gleopleróticas escasas, inmersas entre las hifas generativas, de 1.4−2.8μm. Micelio basal monomítico, con hifas de pared delgada, de 1.4−2.1μm de diámetro, fíbulas frecuentes, conexiones ampuliformes de hasta 11.2μm de diámetro; presencia de diminutos cristales de formas irregulares distribuidos indistintamente en la superficie de las hifas.
Resumen taxonómicoHábito y hábitat. Subgregario, humícola, desarrollándose en bosques mixtos de Abies, Pinus y Quercus, mesófilos de montaña y bosques de galería con Alnus, Buddleja, Schinus, Salix, Juniperus y Quercus, a una altitud de hasta 2 700m.
Material examinado. México: Tlaxcala, Estrada-Torres 2680 y 3592 (TLXM). Jalisco, Rubio S., 9 de agosto de 1996 (IBUG). Estados Unidos: Nuevo México, M. J. 17 de agosto de 1968 (TENN 34601).
Comentarios taxonómicos. El color pálido de los basidiomas que se manchan de color café, aunado a un tamaño pequeño de esporas, permiten la diferenciación de esta especie. No obstante, ni Petersen (1981), Giachini (2004) o Exeter et al. (2006) mencionan la presencia de hifas gloeopleróticas en el contexto de los basidiomas, característica que fue observada en los ejemplares mexicanos y en los de referencia (34601) del herbario TENN. La forma, tamaño y color de los ápices del basidioma, la hacen similar a Phaeoclavulina abietina y P. curta (Fr.) Giachini; de la primera se diferencia por el carácter virescente, en tanto la segunda tiene esporas más pequeñas (3.5−) 4.5−6.5 (−8)×2.5−4μm) a las de P. argentea (Franchi y Marchetti, 2001Giachini 2004 y Exeter et al., 2006).
Phaeoclavulina argentea es una especie conocida de las zonas templadas de América del Norte, particularmente en Arizona, Nevada, Texas y los estados del este de Estados Unidos, además de Canadá y Suecia, en bosques de Abies, Cupressus, Populus y Pseudotsuga. En México, además de los bosques de coníferas, su distribución se extiende hacia los bosques mesófilos de montaña. Éste es el primer registro de la especie para México.
Phaeoclavulina articulotela (R.H. Petersen) Giachini, Mycotaxon 115: 189 (2011)
≡ Ramaria articulotela R. H. Petersen, Biblthca. Mycol. 79: 115 (1981)
Basidiomas de 20−50×6−24mm, con hasta 4 niveles de ramificación dicotómica, en un patrón que disminuye gradualmente. Ramas subcilíndricas y aplanadas hacia las axilas, divergentes hacia la parte media y paralelas hacia el ápice, color amarillo-café (10YR7/6), ligeramente más claro hacia las axilas; ápices agudos a subagudos, color amarillo pardusco (10YR6/6) o concoloros con la parte media, oscureciéndose al irse deshidratando. Estípite bien diferenciado, inmerso en el sustrato hasta la parte media o más, de 8−17×1−2.8mm, subcilíndrico, ligeramente sinuoso en la base y aplanado hacia el ápice; con algunas zonas de la parte media blancas por la presencia de micelio felposo y el resto liso y de color amarillo-café [10YR7/6], con algunos tonos café rojizos [2.5YR4/4]; cordones miceliares abundantes, blancos en la base. Contexto fibroso-carnoso, blanquecino.
Himenio anfígeno en la parte apical del estípite y tercio superior de las ramificaciones, unilateral en el resto debido a una amplia zona estéril con apariencia de “red” en la cara interna de las axilas. Basidios de 28−46×4.9−7μm, subcilíndricos, hialinos, multigutulados, la mayoría tetraspóricos, con esterigmas de 4−7×1.4−2.1μm. Esporas de 5−7 (8.4)×2.835μm (E_;=1.3−2.7,E_;m_;=1.8,L_;m_;=6.8μm yA_;m_;=4.5μm), sublacriformes, con una ornamentación que vista al MEB es densa, compuesta por espinas con puntas redondeadas y menores a una micra; apéndice hilar excéntrico, confluente de hasta 1μm de largo.
Subhimenio monomítico; hifas entremezcladas, de 2.1−5.6μm de diámetro, hialinas, con pared delgada y fibuladas. Contexto con hifas generativas en disposición paralela, hialinas, con pared delgada, de 2.1−7.7μm de diámetro, conexiones en “H” poco frecuentes, con fíbulas frecuentes y conexiones ampuliformes de hasta 12.6μm. Micelio basal monomítico, con hifas hialinas con pared delgada, de 1.4−2.8μm de diámetro, fibuladas, con conexiones ampuliformes de hasta 7μm de diámetro y conexiones en “H” ocasionales; presencia de diminutos cristales esteliformes distribuidos irregularmente en la superficie de las hifas.
Resumen taxonómicoHábito y hábitat. Subgregario, desarrollándose en madera degradada en selvas medianas, a una altitud de hasta 300m.
Material examinado. México: Campeche, García Sandoval 2002–28 (FCME 19871); Quintana Roo, Guzmán G. 2140 (XAL); Veracruz, Guzmán G. 19471 (XAL).
Comentarios taxonómicos. Los basidiomas de Phaeoclavulina articulotela son delgados, frágiles y con limitado número de ramificaciones que característicamente presentan una amplia zona estéril hacia las axilas; es de las pocas especies género Phaeoclavulina que se desarrollan en madera, atributo que comparte con P. camelli (Corner) Giachini, diferenciándose porque esta última desarrolla basidiomas ampliamente ramificados, de color rosa y esporas de 7−9.5×3.1−4.5μm. P. articulotela sólo se conocía de Bolivia y Brasil (Petersen, 1981 como Ramaria articulotela).
Phaeoclavulina campoi (Speg.) Giachini, Mycotaxon 115: 190 (2011)
≡ Clavaria campoi Speg. Fungi Fuegiani 25: 28 (1921).
≡ Ramaria campoi (Spreg.) R. H. Petersen, Biblthca. Mycol. 79: 119 (1981)
Basidiomas de 40−53×15−33mm, con hasta 7 niveles de ramificación, disminuyendo abruptamente; ramificaciones de dicotómicas a policotómicas, con una disposición laxa. Ramas cilíndricas o ligeramente aplanadas, las primarias de 2−3mm de diámetro, de color anaranjado pálido (5A3), las secundarias de color amarillo-café (5A3; 2.5Y7/6), con tonos anaranjado-café (10Y7/6–8); axilas redondeadas; ápices cortos, cuspidados o agudos, de color amarillo brillante (2.5Y7-8/6) o concoloros con las ramas secundarias. Estípite bien diferenciado, desapareciendo dentro del sustrato, de 15×40mm, cilindrico, blanquecino en la base por la presencia de micelio y el resto de color anaranjado pálido; micelio algodonoso en la base, blanco, con numerosos cordones miceliares. Los basidiomas se manchan de color café rojizo oscuro (5YR3/2) en su superficie al maltrato. Contexto blanquecino. La superficie del himenio cambia de inmediato a verde oscuro al aplicar FeCl3.
Himenio anfígeno aunque ausente en las axilas. Basidios de 20.8−31.2×3.6−5.2μm, clavados a subclavados, hialinos, multigutulados, predominantemente tetraspóricos, con esterigmas delgados, rectos, de 3.1−4.2×1−1.6μm. Esporas de (5.7−) 6.2−7.3 (−7.8)×3.1−4.2μm (E_;m=2.1,E=1.75-2.33, L_;m=6.9μm y A_;m=3.3μ), sublacriformes, con pared delgada, vistas al MEB la ornamentación se distribuye homogéneamente en forma de verrugas redondeadas, ocasionalmente unidas por la base y quínulas truncadas de hasta 0.5μm de longitud; apéndice hilar sublateral, acuminado, de 1.4−2.1μm de longitud.
Subhimenio y contexto monomíticos, con hifas hialinas con pared delgada y fíbulas escasas; en el primero están entremezcladas, de 2−4.7μm de diámetro; en el contexto la disposición es paralela de 1.6−11.2μm de diámetro, con escasas conexiones en “H”. Micelio basal con hifas generativas, hialinas, con pared delgada, de 1.4−2.8μm de diámetro, con pequeños cristales esteliformes alrededor de las hifas, fíbulas frecuentes, escasas conexiones ampuliformes de 7.8–12.6μm de diámetro y conexiones en “H” ocasionales.
Resumen taxonómicoHábito y hábitat. Subgregario, humícola, desarrollándose en bosque de Juniperus, a una altitud de 2 200m.
Material examinado. México: Tlaxcala, E. Altamirano 575 (TLXM).
Comentarios taxonómicos. Aunque el espécimen aquí estudiado no pudo ser comparado con los ejemplares tipo de P. campoi (no disponibles en TENN), tiene gran similitud macro- y micromorfológicamente con esta especie, de acuerdo con las descripciones de Petersen (1981) y Giachini (2004). El único aspecto no concordante es el hábitat, ya que P. campoi fue descrita de un bosque de Nothofagus de Argentina (como Ramaria campoi), aunque posteriormente fue también recolectada en Brasil por Singer (sin precisar el tipo de vegetación), en donde no existe Nothofagus, por lo que Petersen (1981) sugirió que su rango de distribución es más amplio, aspecto que fue considerado en este trabajo para reconocer su distribución en México.
Phaeoclavulina campoi es parcialmente similar a P. abietina y P. curta, de las cuales puede diferenciarse por la ausencia de tonos verdosos, la brunescencia de los basidiomas y el tamaño de sus esporas.
Phaeoclavulina cokeri (R.H. Petersen) Giachini, Mycotaxon 115: 190 (2011).
≡ Clavaria echinospora Henn., Monsunia 1: 141 (1899), nom. illegit. [non C. echinospora Berk. y Broome 1873].
≡ Ramaria fragillima (Sacc. y Syd.) Corner, Ann. Bot. Mem. 1: 588 (1950).
≡ Ramaria cokeri R.H. Petersen, Dist. Hist. Biota S. Appalachians 4: 291 (1976).
Basidiomas de 53−91×16−37mm, con hasta 4 niveles de ramificación en un patrón de disminución abrupta; ramificaciones de dicotómicas a policotómicas, con disposición más o menos paralela, cilíndricas, de hasta 3mm de diámetro, color amarillo-café (2.5Y6/3) con tonos rojo claro (2.5Y6/6) hacia la base y café amarillento (10YR5/6) con evidentes tintes oliváceos en la parte media; ápices subredondeados, color café amarillento (10YR5/8, 7.5YR5/8) o amarillo pardusco (10YR6/8), con tonos anaranjados o amarillo-anaranjados evidentes; la superficie de las ramificaciones se mancha lentamente de color café rojizo (5YR3/4, 2.5YR3/4) o café muy oscuro al maltratarse. Estípite bien diferenciado de 20−55×6−44mm, cilíndrico, ocasionalmente subradicante y sinuoso, liso, blanquecino en la base por la presencia de micelio a café amarillo (10YR7/8) en la parte media y apical, vinescente; abundante micelio basal felposo con escasos cordones miceliares blancos. Contexto carnosofibroso, blanquecino. Olor inapreciable, sabor amargo. Con FeCl3 el himenio vira de inmediato a color verde oscuro.
Himenio anfígeno, con una zona estéril en las axilas. Basidios de 36−57×7−9μm, subcilíndricos a subclavados, hialinos, multigutulados, predominantemente tetraspóricos, con esterigmas de 4−8.4μm de longitud y de 1.4−3μm. Esporas de 10.5−14.4×3.5−5.6 (−6.3)μm (E_;=2.1−3.2,E_;m_;=2.7, L_;m_;=12.7μm y A_;m_;=4.7μm), cortamente elípticas a subcílindricas con una ornamentación que vista al MEB es en forma de quínulas de diferente longitud que quizás indique un desarrollo asincrónico, con ápices agudos y distribución homogénea en la superficie de la espora y hasta 1.3μm en longitud; apéndice hilar sublateral, de hasta 1.5μm y ampliamente confluente.
Subhimenio monomítico, hifas entremezcladas de 1.4−4.2μm de diámetro, hialinas, con pared delgada y fíbulas frecuentes. Contexto conformado por 2 tipos de hifas. a) generativas, en disposición paralela, hialinas, con pared delgada, de 3−7μm de ancho, fibuladas, con escasas conexiones ampuliformes y conexiones en “H” ocasionales; b) hifas gleopleróticas escasas, entremezcladas con las generativas, de 1.4−3μm de diámetro. Micelio monomítico, con hifas hialinas, pared delgada y septos muy espaciados.
Resumen taxonómicoHábito y hábitat. Solitario, terrícola, desarrollándose en bosque mesófilo de montaña y selvas medianas subperennifolias, a una altitud de 300 a 1 900m.
Material examinado. México: Campeche, García Sandoval Ricardo 2001−56, 2001−55, 2001−58 (FCME 19882, 19885 y 19886); Hidalgo, Kong-Luz 5184 (TLXM); Tamaulipas, (FCME 22245); Veracruz, Bandala 1772 (XAL)
Comentarios taxonómicos. Aunque el concepto de esta especie ha sido ambiguo debido a la ausencia de un ejemplar tipo, la opinión adoptada en este trabajo sobre su circunscripción se basa en Petersen (1981), quien señala que la coloración café con tonos oliváceos es característica de los basidiomas de Ramaria cokeri (= Phaeoclavulina cokeri), además de ser vinescentes y tener esporas con tamaño no mayor a 15μm de longitud. Si bien existen otras especies como P. apiahyana (Speg.) Giachini y P. macrospora Brinkmann con color similar, sobre todo en el ápice de las ramificaciones, aunado al hecho de que la segunda también es vinescente, ambas especies carecen de tonalidades oliváceas y la dimensión de sus esporas es superior a los 18μm. Es una especie con distribución pantropical que ha sido reportada de Java, Ceylán, Sri Lanka y Malasia (Corner, 1950 como Ramaria cokeri), Papúa Nueva Guinea, Islas Salomón, parte baja del sureste de las montañas Apalaches, América Central y del Sur (Petersen, 1981 como Ramaria cokeri), siendo éstos los primeros registros para México.
Phaeoclavulina curta (Fr.) Giachini, Mycotaxon 115: 190 (2011)
≡ Clavaria curta Fr., Öfvers. Forh. Kongl. Svenska Vetensk.-Akad. 18: 31 (1861).
= Clavaria myceliosa Peck, Bull. Torrey Bot. Club 31(4): 182 (1904).
≡ Ramariopsis curta (Fr.) Corner, Ann. Bot. Mem. 1: 639 (1950).
≡ Ramaria myceliosa (Peck) Corner var. myceliosa, Ann. Bot. Mem. 1: 607 (1950).
= Ramaria pusilla var. australis (Coker) Corner, Ann. Bot. Mem. 1: 618 (1950).
= Ramaria pusilla Corner var. pusilla, Ann. Bot. Mem. 1: 617 (1950).
≡ Ramaria decurrens var. australis (Coker) R.H. Petersen, Bibl. Mycol. 79: 127 (1981).
≡ Ramaria curta (Fr.) Schild, Z. Mykol. 60(1): 125 (1994).
≡ Ramaria myceliosa var. microspora R.H. Petersen, Bibl. Mycol. 79: 157 (1981).
= Ramaria subdecurrens var. burnhamii R.H. Petersen, Bibl. Mycol. 79: 171 (1981).
Basidiomas de 30−90×10−60mm; con hasta 8 niveles de ramificación, de dicotómicas a policotómicas, con una disposición paralela. Ramas primarias cilíndricas, frecuentemente fusionadas entre si y tomentosas, de color amarillo ocre [10YR7/6] con ligeros tintes oliváceos; ramas secundarias cilíndricas o ligeramente aplanadas, de color amarillo ocre [10YR7/6] a amarillo-oliváceo o café amarillento [10YR6/8] hacia las axilas las cuales son generalmente agudas; ápices agudos de color amarillo claro [2.5Y7/8] a amarillo grisáceo; la superficie del basidioma cambia a color café claro [7.5YR5/4] u oscuro [7.5YR4/4] al maltrato o secado. Estípite diferenciado o casi inconspicuo, inmerso en el sustrato, de 3−14×1−12mm, de color café pálido [10YR8/4] o café amarillento claro [10YR6/4], cambiando a café oscuro [7.5YR4/6] con la edad o al maltrato, base cubierta con abundante micelio felposo, blanco y con cordones miceliares finos. Contexto correoso, higrófano, de color café amarillento [10YR]. Sabor ligeramente amargo, olor inapreciable. La superficie de las ramas se torna verde oscuro inmediatamente después de aplicar FeCl3.
Himenio anfígeno a ocasionalmente unilateral. Basidios de 20.8−49×3.1−7μm, clavados a subclavados, hialinos, multigutulados, predominatemente tetraspóricos, con esterigmas rectos, de 2.1−7.3×1.4−2.8μm. Esporas de (3.5−) 4.2−7 (−7.7)×2.1−3.5 (−4.2)μm (E=2.1−3.0, E_;m=1.8, L_;m_;=5.6. μm y A_;m_;=2.8 μm), elipsoides y con pared delgada. Vista al MEB, la ornamentación es en forma de verrugas redondeadas a espinas de diferente tamaño y hasta 0.4μm de longitud, distribuidas homogéneamente, con ápices redondeados; apéndice hilar acuminado de hasta 0.5μm de longitud.
Subhimenio monomítico, con hifas entremezcladas, hialinas, con pared delgada, de 1.4−4.9μm de diámetro. Contexto con hifas generativas paralelas entre sí, hialinas, con pared delgada, de 1.4−9.8μm de diámetro, con fíbulas frecuentes y conexiones ampuliformes ocasionales de hasta 16.6μm. Micelio basal dimítico, con hifas generativas, hialinas, con pared delgada, de 1.4−4.9μm de diámetro, con fíbulas y conexiones ampuliformes frecuentes de hasta 12.6μm de diámetro; hifas gleopleróticas de 1.4−2.8μm de diámetro, poco frecuentes; cristales esteliformes frecuentes alrededor de las hifas.
Resumen taxonómicoHábito y hábitat. Gregario, humícola, desarrollándose en bosques de Abies, Quercus, Juniperus, Pinus o mezclas de ellos, a una altitud de hasta 3 200m.
Material examinado. México: Coahuila, Estrada-Torres 1985 (TLXM); Distrito Federal, Guzmán 8390 (TLXM), González-Ávila 102, 103 y 104 (FCME 26156, 26157, 26158); Estado de México, Pérez-Silva 28 (MEXU 17990), Estrada-Torres 1422 (TLXM), Estrada-Torres 1329, 1704, 1694 (ENCB); Hidalgo, E. Fanti 394 (IBUG), González-Ávila 51 (FCME 26159); Jalisco, M. Castañeda Macías 18 (IBUG); Tlaxcala, Estrada-Torres 2274, 2838, 3346 3454, 3480; Lourdes Ixtlapole, 11 de agosto de 1994 (TLXM); Veracruz, Estrada-Torres 3511 (TLXM), López A, 1422, Montoya L. 393. (XAL). Estados Unidos: Idaho, Petersen R.1681 (TENN 31916).
Comentarios taxonómicos. Existe una amplia concordancia de los caracteres morfológicos aquí reseñados e ilustrados, con las descripciones de P. curta presentadas por Corner (1950, 1970), Petersen (1981), Estrada-Torres (1994)Franchi y Marchetti (2001), Giachini (2004), Exeter el al. (2003) y Christan (2008), así como con el material de referencia estudiado (TENN 31916). El desarrollo de esta especie se restringe a bosques templados con predominancia de coníferas, con una distribución en Canadá (Ottawa), Estados Unidos (Nueva York, Carolina de Norte y Oregon), Europa y La India. Aunque la mayoría de los ejemplares estudiados en este trabajo pertenecen al Eje Volcánico Transmexicano, el espécimen de Coahuila nos indica que su distribución en México posiblemente sea más amplia que la aquí reportada.
Phaeoclavulina cyanocephala (Berk. y M.A. Curtis) Giachini, Mycotaxon 115: 191 (2011)
≡ Clavaria cyanocephala Berk. y M.A. Curtis, J. Linn. Soc., Bot. 10: 338 (1868).
= Clavaria grandis Peck, Bull. Torrey Bot. Club 29(2): 73 (1902).
≡ Ramaria cyanocephala (Berk. y M.A. Curtis) Corner, Ann. Bot. Mem. 1: 568 (1950).
≡ Ramaria grandis (Peck) Corner f. grandis, Ann. Bot. Mem. 1: 595 (1950).
≡ Ramaria grandis f. cyanocephala (Berk. y M.A. Curtis) R.H. Petersen, Bibl. Mycol. 79: 71 (1981).
≡ Ramaria zippelii f. grandis (Peck) R.H. Petersen, Taxonomy of Fungi, (Proc. int. Symp. Madras, 1973) Part 2: 569 (1984).
Basidiomas de 130−160×30−80mm en material deshidratado; con hasta 5 niveles de ramificación en un patrón que disminuye gradualmente, las cuales son de dicotómicas a policotómicas, suberectas. Ramificaciones cilíndricas de color café amarillento [4/510YR], manchándose irregularmente de vináceo oscuro al maltratarse; ápices redondeados a subredondeados, de color turquesa grisáceo a verde opaco [24-25E3] o en coloración más clara a las ramificaciones. Estípite bien diferenciado de 70−95×9−25mm, atenuándose ligeramente hacia la base, de color blanco amarillento a anaranjado pálido [4A2–5A3] con ligeros tonos vináceos al maltrato. Consistencia subcarnosa a poco correosa la cual se torna muy dura al deshidratarse; contexto de color anaranjado pálido hacia la base y parte media del basidioma y anaranjado blanquecino con tonos verdosos hacia el ápice, cambia a vináceo oscuro al exponerse o maltratarse. Olor dulce similar al anís; sabor amargo.
Himenio anfígeno, con excepción de una evidente zona estéril en la parte interna de las axilas. Basidios de 37–63×7–14μm, clavados o subclavados, con contenido homogéneo y refringente de color amarillo-ocre en KOH, bispóricos con esterigmas cónicos, de 5.5−11.9μm de longitud y 4−7μm. Esporas de (13.5−) 14−21×(5.6−) 6.2−9.1 (−9.5)μm (E_;=1.6−2.6, E_;m_;=1.9, L_;m_;=16.2 μm yA_;m_;=7.4 μm), de color café-ocre oscuro en masa, lacriformes, con una pronunciada ornamentación en forma de quínulas. Al MEB, las quínulas presentan un desarrollo sincrónico, con una distribución homogénea en la superficie de la espora, claramente separadas entre sí y sólo ocasionalmente unidas por la base, de ampliamente cónicas a lageniformes, de 1.4−2.8μm de alto; apéndice hilar curvado, sublateral, confluente, de hasta 6μm de longitud.
Subhimenio y contexto monomíticos; el primero con hifas entremezcladas, hialinas, con pared delgada, de 1.4−3μm de diámetro y fibuladas; contexto con hifas en disposición paralela, hialinas, con pared delgada de 2.8−8.4μm de diámetro, con septos espaciados, fíbulas y conexiones ampuliformes.
Resumen taxonómicoHábito y hábitat. Solitario, terrícola, desarrollándose en bosque mesófilo de montaña, selva alta perennifolia, caducifolia y subperennifolia perturbada, a una altitud de 10−2 400m.
Material examinado. México: Chiapas, Guzmán Huerta 30725 (XAL); Hidalgo, González Pérez 26 de agosto de 1978 (FCME 629), Kong-Luz 5186 y 5173 (TLXM); Guerrero, Villegas Ríos M.1691 (FCME 7764); Jalisco, Soltero R. 558, Guzmán Dávalos 6119 y Hernández Magaña 10964 (IBUG); Morelos, Chacón 662 (ENCB); Quintana Roo, Guzmán G. 21000 y 21001 (ENCB), Gutiérrez 161 (XAL), García Jiménez 6198 (FCME 26160); Veracruz, Cedillo R. 9 de octubre de 1967 (MEXU). Estados Unidos: Georgia, Petersen R. 15 de agosto de 1971 (TENN 36164). Tennessee, PDO 19 de septiembre de 1966 (TENN 32324).
Comentarios taxonómicos. De acuerdo con el esquema clasificatorio adoptado en este trabajo, Phaeoclavulina cyanocephala equivale a lo que Petersen (1981) reconoció como Ramaria grandis f. cyanocephala. Esta especie es similar en su morfología externa a P. zippelii, donde también Petersen (1981) diferenció a una forma con ápices azules (Ramaria zippelii f aeruginosa), por lo que a menudo son confundidas. En este trabajo se pudo constatar que no obstante la coloración azul de los ápices, estos taxones pueden diferenciarse porque en el caso de P. cyanocephala los basidiomas son de mayor tamaño, su consistencia es más carnosa y al deshidratarse pierden parte de su forma y se endurecen notoriamente, además de que la esporada es de color ocre intenso, con esporas que presentan una longitud hasta 21μm y el apéndice hilar es curvado. En P. zippelii, por el contrario, los basidiomas tienden a ser de menor longitud, correosos, su esporada es de color ocre claro, la longitud de las esporas ≤17μm y con apéndice hilar subcurvado. Los especímenes aquí estudiados, fueron comparados con 2 ejemplares de referencia del herbario TENN (36164 y 32324), coincidiendo claramente en sus características.
De las especies aquí estudiadas, ésta es una de las que hasta ahora presentan amplia distribución en México, desarrollándose tanto en bosques tropicales como subtropicales principalmente de la Península de Yucatán y Faja Volcánica Transmexicana, en un gradiente de altitud amplio.
Phaeoclavulina flaccida (Fr.) Giachini, Mycotaxon 115: 190 (2011).
≡ Clavaria flaccida Fr., Syst. Mycol. 1: 471 (1821).
≡ Ramaria flaccida (Fr.) Bourdot var. flaccida, Rev. Sci. Bourb. 11: 235 (1898).
≡ Ramaria crispula (Fr.) Quél., Fl. Mycol. France: 464 (1888).
≡ Ramaria flaccida var. crispula (Fr.) Schild, Hoppea 61: 317 (2000).
≡ Ramaria decurrens (Pers.) R.H. Petersen var. decurrens, Bibl. Mycol. 79: 124 (1981).
≡ Ramaria corrugata (P. Karst.) Schild, Schweiz. Z. Pilzk. 53: 130 (1975).
≡ Ramaria subdecurrens (Coker) Corner var. subdecurrens, Ann. Bot. Mem. 1: 626 (1950).
= Ramaria fuscobrunnea Corner, in Balfour-Browne, Bull. Brit. Mus. Nat. Hist. 1: 200 (1955).
= Ramaria flaccida var. longiramosa Corner, Beih. Nova Hedwigia 33: 250 (1970).
= Ramaria perfluopunicea R.H. Petersen, New Zealand DSIR Bull. 236: 100 (1988).
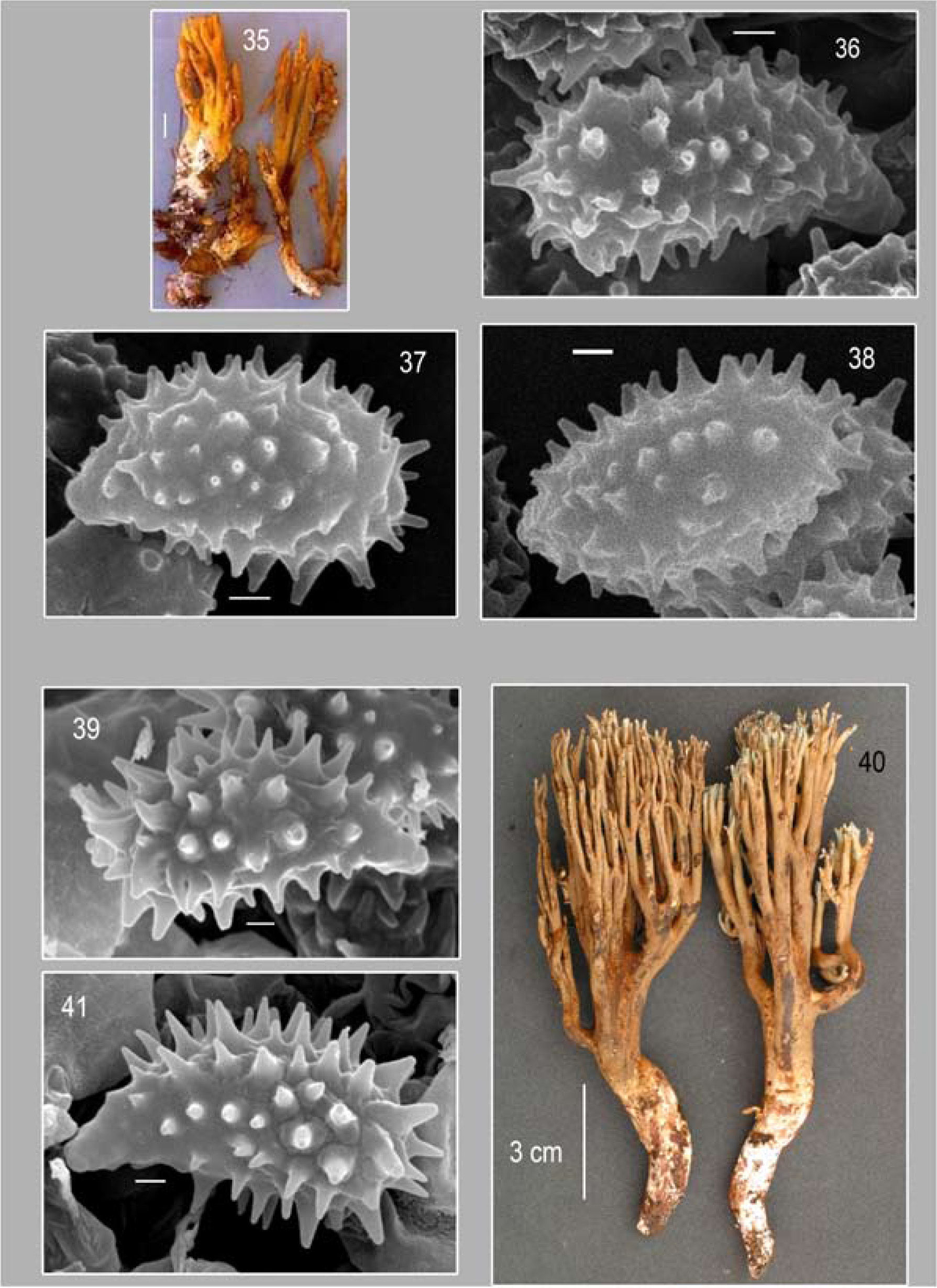
18–23, Phaeoclavulina flaccida. 18, basidioma. 19–21, imágenes al MEB de esporas. 22, imagen al MEB de esporas adheridas a esterigmas. 23, imagen MEB de cristales superficiales a las hifas del basidioma. 24–28, P. curta. 24–25, basidiomas (Fotos Sierra 2008–128* y 2008–129*). 26–28, imágenes al MEB de esporas. Barra= 1μm.
Basidiomas de 30−35×11−20mm en material deshidratado; con hasta 4 niveles de ramificación disminuyendo gradualmente; ramificaciones dicotómicas, con disposición más o menos laxa, cilíndricas de hasta 2mm de diámetro en material deshidratado, color blanco amarillento [4A2] y axilas agudas; ápices agudos o subagudos, de color ámbar [6D8]; las ramificaciones se manchan lentamente de color café amarillento [5D8] al maltrato y/o secado; en material deshidratado se observan tonos oliváceos en el basidioma. Estípite bien diferenciado, disminuyendo gradualmente hacia la base, radicante, de 2−4×14−16mm en material deshidratado, liso, blanquecino a blanco-anaranjado [5A2], al maltrato cambia a color canela [6D6], con micelio de color blanco distribuido homogéneamente en su superficie de la base del estípite.
Himenio claramente unilateral en ramificaciones basales y medias, anfígeno en las ramas terminales. Basidios de 26−35×5.6−7μm, subclavados, hialinos, multigutulados, tetraspóricos, con esterigmas rectos de 4.2−5.6μm×1.4−2.1μm. Esporas de 6.3−8.4×2.8−3.5μm (E=2-2.7,E_;m=2.3, L_;m=7.1 μm yA_;m=3 μm), sublacriformes y con pared delgada. Vistas al MEB, se observan con una ornamentación en forma verrugas redondeadas ocasionalmente unidas entre sí a espinas truncadas de hasta 0.6μm de longitud distribuidas homogéneamente; apéndice hilar sublateral, acuminado, de hasta 0.75μm de longitud.
Subhimenio y contexto monomíticos, con hifas hialinas con pared delgada, entremezcladas en el primero, de 1.4−3.5μm de diámetro; el segundo con hifas en disposición paralela, fibuladas, de 2.1−7μm de diámetro. Micelio monomítico, con hifas con pared delgada a ligeramente engrosadas, de 1.4−2.8μm de diámetro, hialinas, con fíbulas escasas y abundantes conexiones ampuliformes, de hasta 9.8μm en diámetro; presencia de pequeños cristales de formas irregulares entre las hifas.
Resumen taxonómicoHábito y hábitat. Subgregario, terrícola, desarrollándose en bosque mesófilo de montaña, a una altitud de hasta 1 300m.
Material examinado. México: Hidalgo, Kong-Luz 5188 (TLXM). Estados Unidos, Petersen R. 24 de septiembre de 1970 (TENN 36538).
Comentarios taxonómicos. Esta especie se diferencia macroscópicamente por desarrollar basidiomas brunescentes, con ramificaciones laxas de color amarillo claro en las ramas y ápices color ámbar, además de ser una de las pocas especies con himenio claramente unilateral en las ramificaciones basales; sin embargo, hay discrepancia entre los diferentes autores respecto al tamaño de las esporas, con una variación de: 5.2−6.7×3−4μm (Petersen, 1981), 4.5−7.1×2.7−4μm (Christan, 2008), 4−4.6−7.2(−8)×(2.4)−2.6−4.4μm (Franchi y Marchetti, 2001) y 6.3−8.4×2.8−3.5μm en el ejemplar mexicano; no obstante, las medidas de las esporas de este último coinciden con las del material de referencia (36538) del herbario TENN, que corresponde con uno de los incluidos en Petersen (1981) como Ramaria decurrens y estudiado también por Giachini (2004), lo que nos indica que el tamaño real de las esporas es en torno a 8μm de longitud, dato que puede indicar una probable variación fenotípica dentro de la especie.
Phaeoclavulina gigantea (Pat.) Giachini, Mycotaxon 115: 193 (2011)
≡ Lachnocladium giganteum Pat., J. Bot. (Morot) 3: 34 (1889).
≡ Ramaria gigantea (Pat.) R.H. Petersen f. gigantea, Bibl. Mycol. 79: 66 (1981).
= Ramaria zippelii var. gracilis Corner, Ann. Bot. Mem. 1: 635, 700 (1950).
= Ramaria gigantea f. tenuispora R.H. Petersen, New Zealand DSIR Bull. 236: 97 (1988).
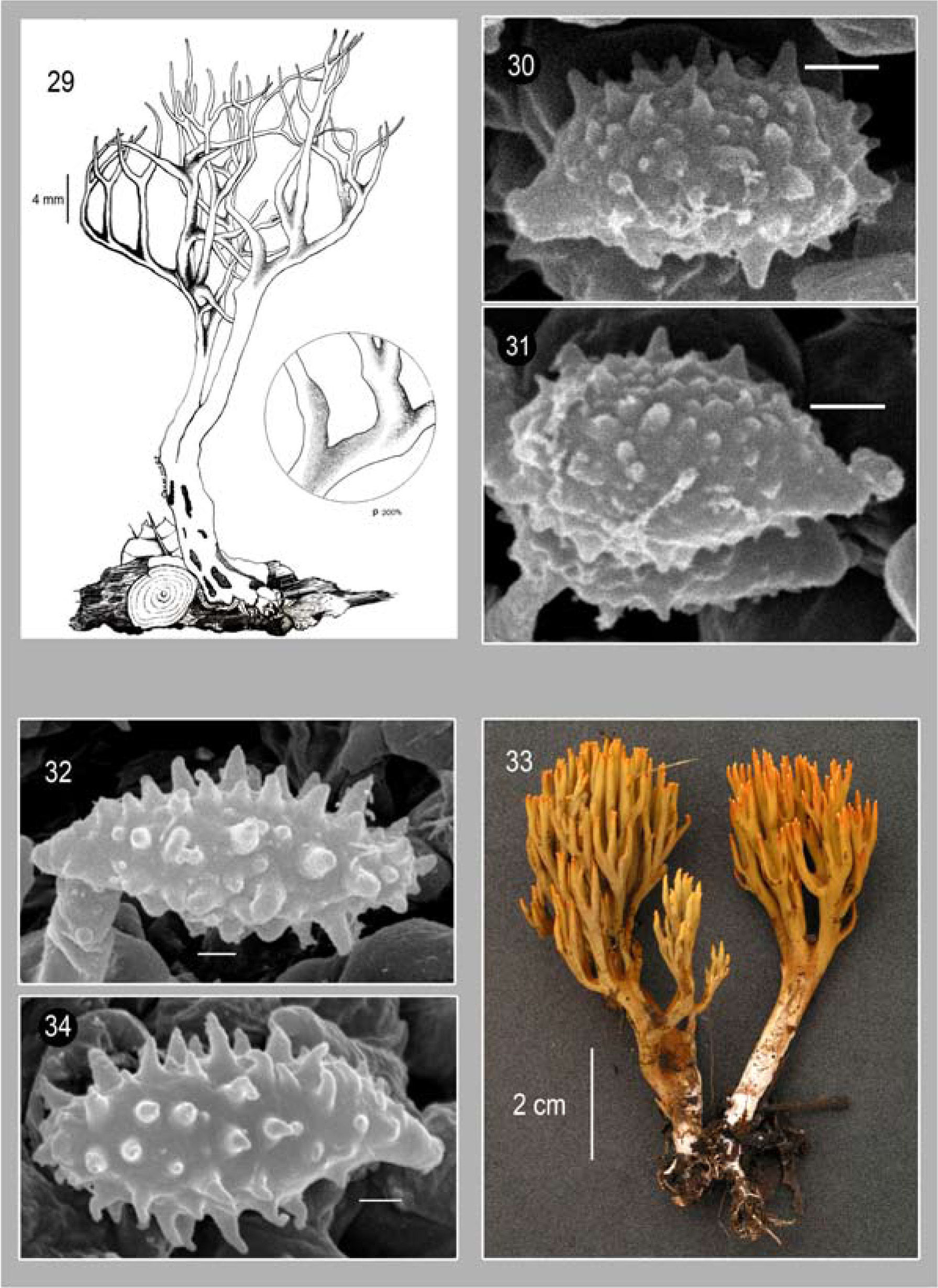
Basidiomas de 90–105×18−26mm, con hasta 3 niveles de ramificación en un patrón que disminuye gradualmente, predominantemente dicotómicas, con una disposición más o menos paralela. Parte media del basidioma con ramas cilíndricas de 5−6mm de diámetro, color canela (5C5) cuando joven, café rojizo (6E7-8) con tonos anaranjados en la madurez; ápices redondeados, cuando jóvenes de color anaranjado (5B8) y café rojizo (6E7-8) en la madurez. Estípite bien diferenciado, ligeramente radicante, de 45−55×6−12mm, cilíndrico, liso, blanquecino con tonos anaranjados o amarillo-anaranjado; micelio felposo no abundante, de color blanco y cordones miceliares escasos; la superficie se mancha lentamente de color café oscuro al maltratarse. Contexto blanco, que vira irregularmente a color gris-café al exponerse. Olor inapreciable, sabor amargo. Con FeCl3 la superficie se torna de inmediato a verde muy oscuro.
Himenio anfígeno y sólo estéril en un área restringida de las axilas. Basidios de 80−100×7−11μm, de 2 tipos: a) predominantemente bispóricos, de clavados a subclavados, robustos, con contenido amarillo-ocre distribuido homogéneamente y refringentes en KOH; esterigmas robustos y cortos; b) tetraspóricos, subclavados, hialinos, multigutulados, con esterigmas rectos, de 5.6−10μm de longitud. Esporas de (10.4−) 11.5−13.5×(4.7−) 5.2−6.2 (−7.3)μm (E_;=1.8−2.6, E_;m_;=2.1, L_;m_;=12.2 μm y A_;m_;=5.3 μm), cortamente elípticas o subcílindricas, con pared ligeramente engrosada, con una pronunciada ornamentación en forma de quínulas, en MEB las quínulas muestran una distribución homogénea en la superficie de la espora, frecuentemente anastomosadas por la base, de ampliamente cónicas a lageniformes, con ápices subredondeados, de hasta 1.3μm en longitud; apéndice hilar pequeño (no mayor a 1.6μm en long.), ligeramente sublateral y confluente.
Subhimenio monomítico, con hifas que en conjunto muestran un color amarillo claro, entremezcladas, de hasta 3μm en diámetro y fibuladas. Contexto con hifas generativas con pared delgada, hialinas, en disposición paralela, de hasta 7μm de diam, con septos espaciados, con fíbulas y conexiones ampuliformes presentes; hifas gleopleróticas escasas, entremezcladas con las generativas, de 4μm de diámetro. Micelio basal monomítico, con hifas hialinas con pared delgada, de 4μm de diámetro, con fíbulas simples y ampuliformes.
Resumen taxonómicoHábito y hábitat. Subgregario, terrícola, desarrollándose en selva mediana, a una altitud de 250m.
Material examinado. México: Campeche, Villegas Ríos 2191 (FCME 19887).
Comentarios taxonómicos. Aunque similar en hábitat, coloración del basidioma y tamaño de esporas a Phaeoclavulina cokeri, P. gigantea se diferencia por ser hasta ahora la única especie del género que presenta 2 tipos de basidios claramente diferenciables entre sí (bispóricos con contenido refringente y tetraspóricos hialinos), los cuales además son de gran longitud (hasta 100μm), de ahí el nombre de esta especie. Se conocía para las regiones tropicales en Borneo, Gabón, Malasia, Martinica, Nueva Zelandia, Singapur, Estados Unidos, Guayana Francesa, Brasil y Puerto Rico, siendo éste su primer registro para México en el estado de Campeche.
Phaeoclavulina longicaulis (Peck) Giachini, Mycotaxon 115: 193 (2011)
≡ Clavaria longicaulis Peck, Bull. Torrey Bot. Club 25: 371 (1898)
≡ Ramaria longicaulis (Peck) Corner, Monograph ofClavaria and allied genera (Annals of Botany Memoirs No. 1): 600 (1950).
Basidiomas de 50−90×7−25mm; con hasta 5 niveles de ramificación, disminuyendo gradualmente, dicotómicas, con disposición paralela, axilas redondeadas o agudas. Ramas cilíndricas de hasta 3mm de diámetro, color café dorado con tonos anaranjados, (5C4) a topacio [5C5]; ápices de redondeados a subredondeados, concoloros con las ramas a color café amarillento [5D8]; la superficie de las ramificaciones se mancha lentamente de color gris pardo [6F8] o café muy oscuro al maltratarse. Estípite bien diferenciado, la mayor parte inmerso en el sustrato, liso, de 30−60×3−5mm, radicante y sinuoso, de color ámbar [6D8] con partes blanquecinas.
Himenio unilateral en las ramificaciones basales y anfígeno en el resto. Basidios de 29.4−42×4.2−9.8μm, subcilíndricos a subclavados, hialinos, multigutulados, tetraspóricos, con esterigmas rectos y sólo ligeramente curvados en la punta, de 4.2−7μm de longitud y de 1.4−2.8μm. Esporas de 8.4−12.6×4.2.−5.6μm (E_;=1.3−2.6, E_;m_;=1.8, L_;m_;=10.3 μm yA_;m_;=5.3 μm), de color amarillo-café en KOH, sublacriformes, con pared ligeramente engrosada; al MEB, las quínulas son de hasta 1.4μm de longitud, con un desarrollo asincrónico en donde las de la base tienen mayor tamaño y conforme se acerca a los ápices éstas van disminuyendo; apéndice hilar sublateral, de hasta 2.1μm.
Subhimenio monomítico, con hifas entremezcladas, de 2.1−4.9μm de diámetro, hialinas, con pared delgada y fibuladas. Contexto dimítico, con hifas generativas en disposición paralela, hialinas, con pared delgada, de 1.4−7μm de diámetro; con hifas gleopleróticas escasas, de 1.4−2.8μm de diámetro.
Resumen taxonómicoHábito y hábitat. Subgregario, terrícola, desarrollándose en bosque mesófilo de montaña, a una altitud de hasta 1 300m.
Material examinado. México: Hidalgo, Kong-Luz 5180, 5171 y 5168 (TLXM).
Comentarios taxonómicos. De acuerdo con Petersen (1981) y Giachini (2004), los basidiomas delgados con coloración marrón pálido, ramas paralelas y el estípite radicante, son caracteres diferenciables de Phaeoclavulina longicaulis, datos concordantes con los ejemplares aquí estudiados. No obstante, el tamaño de esporas descrito para esta especie es variable: 7.8− 9.6×5.2−5.9μm (Petersen, 1981 como Ramaria longicaulis), 7.5−11×4.5−7μm basándose en el ejemplar tipo (Giachini, 2004) y 8.4−12.6×4.2.−5.6μm en los ejemplares aquí estudiados. La coloración de los basidiomas de P. longicaulis es similar a P. eumorpha (P. Karst.) Giachini de la cual puede diferenciarse porque esta última desarrolla un micelio basal abundante y sus esporas son menores a 9μm de largo y 4μm de ancho.
Se ha citado previamente de bosques de coníferas y caducifolios del este de Estados Unidos y éste es el primer registro para México en el Eje Volcánico Transmexicano.
Phaeoclavulina roellinii (Schild) Giachini, Mycotaxon 115: 194 (2011)
≡ Ramaria roellinii Schild, Schweiz. Z. Pilzk 56: 97 (1978)
Basidiomas de hasta 62×40mm; la mayoría con 3 niveles de ramificación, disminuyendo gradualmente, dicotómicas, con disposición generalmente laxa, axilas frecuentemente agudas. Ramas cilíndricas, color amarillo claro [2.5Y7/6] a café-amarillo [10YR5/6], la superficie de las ramificaciones se mancha lentamente de color café oscuro al maltratarse; ápices de agudos a subagudos, concoloros con las ramificaciones. Estípite bien diferenciado de hasta 22×4mm, cilíndrico, subradicante y sinuoso, liso, blanquecino, inmerso en el sustrato. Contexto carnoso-fibroso de color gris claro [10YR7/2].
Himenio anfígeno. Basidios de 30−42×4.9−7μm, subclavados, hialinos, multigutulados, tetraspóricos, con esterigmas rectos, de 4.2−7×1.4−2.1μm. Esporas de 6.3−8.4 (9.1)×2.8−4.2μm (E=1.6−2.5, E_;m_;=2, L_;m_;=7.2 μm y A_;m_;=3.4 μm), subelípticas, con pared delgada. Vista al MEB, la ornamentación es en forma de verrugas a espinas de diferente tamaño con puntas redondeadas, las de mayor tamaño de hasta 0.5μm de longitud; apéndice hilar confluente de hasta 0.5μm de longitud.
Subhimenio y contexto monomíticos; el primero con hifas entremezcladas, de 1.4−7μm de diámetro, hialinas, con pared delgada; contexto con hifas en disposición paralela, hialinas, con pared delgada, de 2.1−11.2μm de diámetro, conexiones en “H” poco frecuentes. Micelio basal dimítico con hifas generativas con pared delgada, de 1.4−2.8μm hialinas, con cristales pequeños de forma irregular en la superficie; hifas gleopleróticas escasas de 1.4−2.8μm.
Resumen taxonómicoHábito y hábitat. Subgregrario, humícola, desarrollándose en bosque de Pinus y mesófilo de montaña, a una altitud de hasta 1 100m.
Material examinado. México: Chiapas, Guzmán 23344 (XAL); VERACRUZ, Roble L. 364 (XAL). Italia: Trentino-Alto Adige, Petersen R. 20 de septiembre de 1972 (TENN 36804).
Comentarios taxonómicos. Aunque esta especie es considerada de talla no mayor a 35mm de longitud, en este trabajo se evidenciaron ejemplares de hasta 62mm, no obstante, los demás caracteres macro y micromorfológicos mostrados en las descripciones de Petersen (1981), Franchi y Marchetti (2001), Giachini (2004), Christan (2008), son concordantes con los ejemplares mexicanos, al igual que la comparación con el material de referencia (TENN 36804). Éste es el primer registro de la especie para México, previamente ha sido reportada de Alemania, Italia, Suiza y noreste de los Estados Unidos (Giachini 2004).
Phaeoclavulina zippelii (Lév.) Overeem, Bull. Jard. Bot. Buitenzorg, ser. 3, 5: 276 (1923).
≡ Clavaria zippelii Lév., Ann. Sci. Nat., Bot. sér. 3, 2: 215 (1844).
≡ Ramaria zippelii (Lév.) Corner f. zippelii, Ann. Bot. Mem. 1: 632 (1950).
≡ Ramaria guadelupensis (Lév.) Corner, Ann. Bot. Mem. 1: 596 (1950).
≡ Ramaria zippellii var. aeruginosa (Pat.) R.H. Petersen, Bibl. Mycol. 79: 96. 1981.
Basidiomas de 130−140×30−60mm en material deshidratado, con hasta 6 niveles de ramificación dicotómica, con disposición predominantemente paralela, en un patrón que va disminuyendo gradualmente. Ramas cilíndricas de color café claro con tonos rojizos; ápices agudos, subredondeados a subagudos, color azul opaco (21D4) cuando joven y turquesa (24B3) o azul-verdoso, amarillo-café o blanco en la madurez. Estípite de 10−20×5−10mm en material deshidratado, atenuándose ligeramente hacia la base, blanquecino, con escaso micelio felposo de color blanco en la base. Consistencia subcorreosa a correosa. Olor no característico, sabor amargo.
Himenio anfígeno con excepción de un área reducida en las axilas. Basidios de 25−65.8×5−14μm, clavados a subclavados, con contenido refringente de color amarilloocre en KOH distribuido homogéneamente, bispóricos; esterigmas cortos, robustos, cónicos, de 1−4×2−6.2μm. Esporas de 11.3−16.8×6.2−9.8μm (E_;=1.3−2.5, E_;m_;=1.9, L_;m_;=14.8 μm y A_;m_;=7.5 μm), color café ferruginoso claro en masa, elípticas a subcilíndricas, con una pronunciada ornamentación en forma de quínulas que vistas al MEB muestran desarrollo sincrónico, de ampliamente cónicas a lageniformes, de 1.4−2.8μm de longitud, distribuidas homogéneamente en la superficie de la espora; apéndice hilar sublateral, confluente, no mayor a 2.8μm de longitud.
Subhimenio y contexto monomíticos; el primero con hifas entremezcladas, hialinas, con pared delgada, de 3−5.6μm de diámetro y fíbulas frecuentes; contexto con hifas generativas en disposición paralela, hialinas, con pared delgada, de 4.2−6.3μm de diámetro, fíbulas y conexiones ampuliformes frecuentes. Micelio basal con hifas generativas, hialinas, de 1.5−4μm de ancho, con fíbulas y conexiones ampuliformes de hasta 7μm de diámetro.
Resumen taxonómicoHábito y hábitat. Solitario o subgregrario, terrícola, desarrollándose en selva mediana subperenifolia perturbada, baja caducifolia, alta perennifolia, bosque de Liquidambar y bosque mesófilo de montaña, a una de altitud de 20 hasta 1 500m.
Material examinado. México: Campeche, García-Sandoval 2001–54 (FCME 19875), Villegas Ríos 2185 (FCME 19867); Chiapas, Gallegos 25 (FCME 874), Robledo 20 A y 20 B (FCME 899, 884), Chonuna F., 3 de agosto del 2003 (CHIP), Andrade-Gallegos 1628 (TLXM 2247); Guerrero, Martínez (FCME 12000); Quintana Roo, Guzmán 34532: (XAL) Aldana G. 27 (XAL); Hidalgo, Guevara A. 115 (FCME 628); Tabasco, Contreras 507 (UJAT); Quintana Roo, Torres Barragán A. Julio 1997 (FCME 23262), Guzmán 2101 (ENCB), Chay-Casanova 389 (XAL), Guzmán-Dávalos 8359 (XAL). González Guevara, 19 de enero de 1986 (ITCV).
Comentarios taxonómicos: como se mencionó en Phaeoclavulina cyanocephala, Petersen (1981) reconoció las formas zippelii y aeruginosa para Ramaria zippelii (actualmente Phaeoclavulina zippelii), las cuales son diferenciadas de acuerdo con el color de los ápices; en la primera éstos son blancos, crema o grises y en la segunda son de color azul a azul-verdoso. No obstante, a diferencia de P. cyanocephala, en P. zippelii los basidiomas conservan la forma del material fresco además de que sus características microscópicas logran diferenciarla claramente. Debido a que la clasificación de Giachini y Castellano (2011) está basada en un estudio filogenético, no reconocen el nivel jerárquico de forma. Tomando en cuenta este aspecto, en este trabajo, tampoco se hace la diferenciación infraespecífica por lo que la descripción incluye tanto a los ejemplares con ápices blancos como los que presentan coloración azul. La distribución geográfica de ejemplares con una u otra coloración en los ápices es similar, coexistiendo incluso en algunos ecosistemas, no obstante, los que presentan ápices azules han llegado a localizarse en bosques subtropicales que alcanzan una altitud de hasta 1 500m.
Éste es el primer registro de Phaeoclavulina zippelli en México, misma que se desarrolla prácticamente en los mismos hábitats que P. cyanocephala, por lo que su distribución es similar, difiriendo en que la primera de estas especies hasta ahora no ha sido localizada por arriba de los 1 500m de altitud.
Clave para las especies mexicanas de Phaeoclavulina
- 1A)
Esporas de color café ferruginoso a café oscuro, con quínulas prominentes. Se desarrollan preferentemente en vegetación tropical……2
- 1B)
Esporas de color café ocre a café claro, con quínulas pequeñas. Se desarrollan preferentemente en zonas templadas……7
- 2A)
Basidios predominantemente bispóricos, refringentes y con contenido de color amarillo-ocre……3
- 2B)
Basidios predominantemente tetraspóricos, no refringentes y generalmente hialinos……5
- 3A)
Basidios de hasta 100μm de longitud. Basidiomas con evidentes tonos anaranjado brillantes. Esporas de 11.5−13.5×5.2−6.2μm……P. gigantea
- 3B)
Basidios menores a 70μm de longitud. Basidiomas de color café……4
- 4A)
Esporas de hasta 21μm de longitud. Basidiomas subcarnosos con ápices de color turquesa-grisáceo a verde opaco o en tonos más claros a las ramificaciones……P. cyanocephala
- 4B)
Esporas menores a 17μm de longitud. Basidiomas correosos con ápices de blancos a color amarillo-café o azul turquesa……P. zippelii
- 5A)
Esporas menores a 8μm de longitud. Basidiomas frágiles menores a 60mm de longitud y desarrollándose en madera degradada……P. articulotela
- 5B)
Esporas mayores a 8μm de longitud. Basidiomas mayores a 60mm de longitud y desarrollándose en suelo……6
- 6A)
Basidiomas amarillo-café con ápices de color anaranjado brillante. Esporas de 10.5−14.7×3.5−5.6μm…….P. cokeri
- 6B)
Basidiomas de color café dorado; estípite radicante inmerso en el sustrato. Esporas de 8.4−11×4.2−5.6μm……P. longicaulis
- 7A)
Basidiomas que viran a azul-verdoso en diferentes tonalidades al manipularse y/o con la madurez. Esporas de 6.8−11.2×2−5.2μm……P. abietina
- 7B)
Basidiomas que no viran a azul-verdoso con el maltrato o madurez. Esporas menores a 10μm de longitud……8
- 8A)
Himenio unilateral en las ramificaciones basales y medias. Esporas de 6.3−8.4×2.8−3.5μm……P. flaccida
- 8B)
Himenio predominantemente anfígeno en ramificaciones basales y medias……9
- 9A)
Basidiomas con coloración anaranjado pálido. Esporas de 6.2−7.3×3.1−4.2μm……P. campoi
- 9B)
Basidiomas con coloración amarillo claro a café amarillento u ocre……10
- 10A)
Basidiomas de color amarillo claro a café pálido. Presencia de hifas gleopleróticas en el contexto. Esporas de 4.9−8.4×2.8−4.2μm……P. argentea
- 10B)
Ausencia de hifas gloeopleróticas en el contexto……11
- 11A)
Basidiomas de color amarillo ocre. Presencia de hifas ampuliformes en el contexto y micelio. Esporas de 4.2−7×2.1−3.5μm……P. curta
- 11B)
Basidiomas de color amarillo claro. Ausencia de hifas ampuliformes en el contexto y micelio. Esporas de 6.3−8.4×2.8−4.2μm……P. roellinii
La clasificación del género Ramaria fue considerada tradicionalmente con base en la morfología de los basidiomas, diferenciando entre 4 y 5 subgéneros (Corner 1950, 1970;Marr y Stuntz 1973; Petersen 1981, 1988; Exeter et al., 2006; Christian, 2008). Hipótesis filogenéticas con datos moleculares (Humpert et al. 2001 y Hosaka et al., 2006) han mostrado que el género es polifilético con una relación cercana al género Gomphus. Nueva evidencia filogenética presentada por Giachini et al. (2010), mostró en forma robusta que lo que se venía nombrando como Ramaria subgénero Echinoramaria junto con 6 especies de Gomphus conforman un grupo monofilético, al cual caracterizaron morfológica y genéticamente, reconociéndolo como Phaeoclavulina (Giachini y Castellano 2011). Debido a que este planteamiento clasificatorio es hasta ahora el más fuertemente sustentado con diferentes tipos de datos, fue el adoptado en este trabajo.
Los 12 taxones determinados en este estudio, corresponden con formas ramarioides de Phaeoclavulina, no localizándose hasta ahora ninguna forma gomfoide de este género en el país, y representan sólo el 29 % de las especies descritas a nivel mundial. Actualmente Phaeoclavulina abietina, P. curta, P. cyanocephala y P. zippelli han sido ubicadas en 6 a 7 estados de nuestro país y el resto sólo en uno a 3 estados, pero es P. abietina la que más frecuentemente ha sido recolectada. Tomando en cuenta el número de materiales que se obtuvo en la revisión de las diferentes colecciones de macromicetos nacionales, su procedencia y el nivel de exploración que han tenido los diferentes tipos de vegetación, es evidente que existen amplias zonas del país, sobretodo las que corresponden con la zona norte de México, que han sido poco o nada exploradas, lo que hace probable que el número de especies de Phaeoclavulina y su distribución conocida se incrementen en el futuro.
Ninguna de las especies aquí estudiadas es considerada comestible, en tanto Phaeoclavulina abietina, P. flaccida y P. zippelii han sido consideradas como ectomicorrizógenas (Sims et al.,1997; Dong-Hun et al., 2003; Mleczko, 2004; Norvell y Exeter, 2004). El periodo de desarrollo de basidiomas de las especies estudiadas es dejulio a noviembre, acentuándose en septiembre y agosto, no existiendo diferenciación entre especies tropicales y templadas.
Los datos obtenidos en este trabajo, indican que taxones como P. articulotela y P. gigantea se han localizado únicamente en zonas tropicales a altitudes no mayores a los 800 m, mientras otros como P. abietina P. campoi y P. curta sólo se presentan en zonas templadas a altitudes entre los 2 500 y 3 500m. Varias especies se distribuyen desde zonas evidentemente tropicales hasta los bosques mesófilos de montaña (P zippelii, P. cokeri, y P. cyanocephala) o desde zonas templadas a bosques mesófilos de montaña (P. argentea, P. flaccida y P. roellinii). El bosque mesófilo de montaña representa una condición híbrida entre la vegetación tropical y la templada, definida por una mezcla de elementos con afinidades boreales y meridionales y que se desarrolla en un intervalo altitudinal entre los 600 y los 3 200m, siendo más común entre los 900 y los 2 000m snm (Rzedowski, 1978; Luna-Vega et al. 1994). Estos datos, nos llevan a considerar que las características tan particulares de este tipo de vegetación, permiten el desarrollo de la mayor cantidad de especies de Phaeoclavulina hasta ahora conocidas en México, favoreciendo además una distribución particular que difiere de la reportada en otros países. Futuros estudios centrados prioritariamente en el bosque mesófilo de montaña y las selvas tropicales, serán necesarios para profundizar en el conocimiento de la diversidad y distribución de especies de este género.
Agradecemos a los curadores de los herbarios MEXU, EBUM, FCME, IBUG, ENCB, TLXM y XAL. A la Dra. Silvia Espinoza Matías por su asesoría en la toma de fotografías al MEB. Al Biól. Arturo Delgado Fuentes por la elaboración de imágenes de algunas especies y al Dr. Joaquín Cifuentes por el acceso a su catálogo fotográfico. El primer y segundo autores agradecemos el apoyo financiero otorgado por proyecto PAPIIT IN203009-3 para la realización de este trabajo. Al Posgrado de Ciencias Biológicas de UNAM y la beca otorgada por CONACYT con número 207211.