Se estudió la abundancia, riqueza y diversidad de la fauna de Scarabaeoidea en el cerro Chacateca, Zapotitlán, Puebla. Se realizaron muestreos en la época de sequía y de lluvias, en 3 sitios ubicados en diferentes cotas altitudinales, con vegetación y textura de suelo particulares. Mediante el uso de necrotrampas, coprotrampas, trampas de fruta, trampas de luz y recolecta directa se registró un total de 1,300 individuos de 16 géneros y 25 especies. Se registraron cambios significativos en la abundancia y diversidad entre las 2 épocas de recolecta, encontrando mayor diversidad en la época de secas. La similitud de la comunidad de escarabajos entre épocas fue baja. La abundancia de los escarabajos copronecrófagos fue significativamente diferente entre sitios. El sitio de menor altitud mostró menor similitud en la composición de especies en relación con los sitios de mayor altitud. Los escarabajos fitófagos fueron analizados únicamente en los sitios con menor y mayor altitud, donde presentaron diferencias significativas en su abundancia y diversidad, además de una baja similitud en la composición de especies.
Abundance, richness and diversity of Scarabaeoidea in the cerro Chacateca, Zapotitlán, Puebla was studied. Samples of beetles in the dry and rainy seasons in 3 sites with different altitude levels, particular vegetation and soil texture were collected. A total of 1,300 individuals belonging to 16 genera and 25 species were recorded, using traps for coprophagous, necrophagous, and phytophagous beetles and captured by hand. Significant changes in the abundance and diversity of beetles between the 2 collected seasons were recorded, finding greater diversity in the dry season. The similarity of the community of beetles between seasons was low. The abundance of copronecrophagous beetles was significantly different between sites. In the lower altitude site the similarity in species composition was significantly lower than in the sites with higher altitude. Only in the sites of lowest and highest altitude the phytophagous beetles were analyzed and we found that the communities have significant differences in their abundance and diversity and low similarity in species composition.
Durante los últimos 36 años se han realizado estudios faunísticos y ecológicos a lo largo de la República Mexicana (Anduaga, 2000; Bustos-Santana y Rivera-Cervantes, 2003; Carrillo-Ruiz y Morón, 2003; Delgado y Márquez, 2006; Deloya, Morón y Lobo, 1995; Deloya, Parra-Tabla y Delfín-González, 2007; García de Jesús, Morón y Aragón, 2013; García-Montiel, Rivera-Cervantes y Morón, 2003; Lobo, 1996; Lugo-García et al., 2011a; Morón, 2013a; Morón-Ríos y Morón, 2001; Pacheco, Castro, Morón y Gómez, 2008; Pacheco, Deloya y Cortés, 2006; Ramírez-Ponce, Allende-Canseco y Morón, 2009; Reyes y Morón, 2005; Sánchez-Ramos, Lobo, Lara y Reyes-Castillo, 1993; Trevilla-Rebollar, Deloya y Padilla-Ramírez, 2010), que han permitido conocer la distribución y hábitos de gran parte de las especies de coleópteros Scarabaeoidea; sin embargo, existen lugares en México donde se desconocen las especies que los habitan. Morón (2013a) calcula que faltan aproximadamente 400 especies de Scarabaeoidea por recolectarse en el país. En el estado de Puebla la mayoría de los estudios de Scarabaeoidea se han concentrado en regiones con climas templados, cálidos y semicálidos y con vegetación de encino, pino, pino-encino, bosque mesófilo de montaña, bosque tropical caducifolio, pastizal y zonas agrícolas (e.g. Carrillo-Ruiz y Morón, 2003; Chacón-Aguayo, Aragón y Morón, 2013; Cuate-Mozo, Aragón y Morón, 2013; Delgado-Solano, Aragón y Morón, 2013; Muñoz-Hernández, Morón y Aragón, 2008; Percino-Figueroa y Morón, 2013; Ramírez-Domínguez, 2010; Rodríguez, Aragón y Morón, 2013; Salamanca-Calixto, Aragón y Morón, 2013; Sánchez-Velázquez, Carrillo-Ruiz, Morón y Rivas-Arancibia, 2012; Yanes-Gómez y Morón, 2010), de matorral xerófilo y climas áridos o semiáridos existen pocos estudios. Además, los Scarabaeoidea han sido estudiados con frecuencia por taxónomos y ecólogos, por ejemplo, los Scarabaeinae han sido utilizados para estudios de biodiversidad como indicadores de los ambientes en donde se distribuyen (Favila y Halffter, 1997; Nichols et al., 2007). Sin embargo, existen aspectos de la ecología de los Scarabaeoidea poco conocidos. Se sabe que la composición y estructura de las comunidades de escarabajos están relacionadas con factores bióticos y abióticos, ya que al ser un grupo preponderantemente termófilo e higrófilo, la temperatura y la humedad condicionan su diversidad, por lo que se ha registrado una mayor abundancia y riqueza de especies en zonas cálido-húmedas (Morón, 2004). Asimismo, Nájera-Rincón y Jackson (2010) mostraron que existe una correlación entre las comunidades vegetales y la precipitación mensual, y cómo algunas especies de Scarabaeoidea se alimentan de la descomposición de la hojarasca y del follaje durante la época de lluvias, por lo que la precipitación afecta indirectamente a estas especies. Otros trabajos muestran la importancia que tienen las características de la vegetación y el tipo de suelo para estos coleópteros (Arriaga, Halffter y Moreno, 2012; Escobar, 2000; Halffter y Edmonds, 1982; Nájera-Rincón y Jackson, 2010), debido a que permanecen gran parte de su ciclo biológico en el interior del suelo. Además, debido a su sensibilidad al cambio de hábitat, la composición de los ensambles de estos coleópteros también puede variar en diferentes cotas altitudinales (Deloya et al., 2007; Esparza-León y Amat-García, 2007; Lobo, 1992; Lobo y Halffter, 2000; Morón, 2004; Werenkraut, 2010). Por ello, el estudio de la diversidad de los escarabajos en un gradiente altitudinal, como es un cerro, resulta interesante, ya que en este tipo de escenarios se pueden presentar cambios en el tipo de suelo y vegetación a distancias relativamente cortas, lo que nos puede permitir generar conocimiento sobre la relación de estos factores y la distribución de las especies de la superfamilia.
Se planificó realizar el presente trabajo en el cerro Chacateca, ubicado en el valle de Zapotitlán, Puebla, México, que es una zona caracterizada por matorral xerófilo con clima semiárido. El valle de Zapotitlán tiene gran importancia ecológica, ya que los endemismos y la biodiversidad son altos (Montoya, Padilla y Stanford, 2003); sin embargo, aún se desconoce gran parte de las especies de Scarabaeoidea que se distribuyen en la zona, por lo que los objetivos de este estudio fueron determinar la estructura y composición de las comunidades de los Scarabaeoidea durante 2 épocas del año: lluviosa y seca, así como determinar la estructura y composición de los escarabajos copronecrófagos y fitófagos en un gradiente altitudinal en el cerro Chacateca.
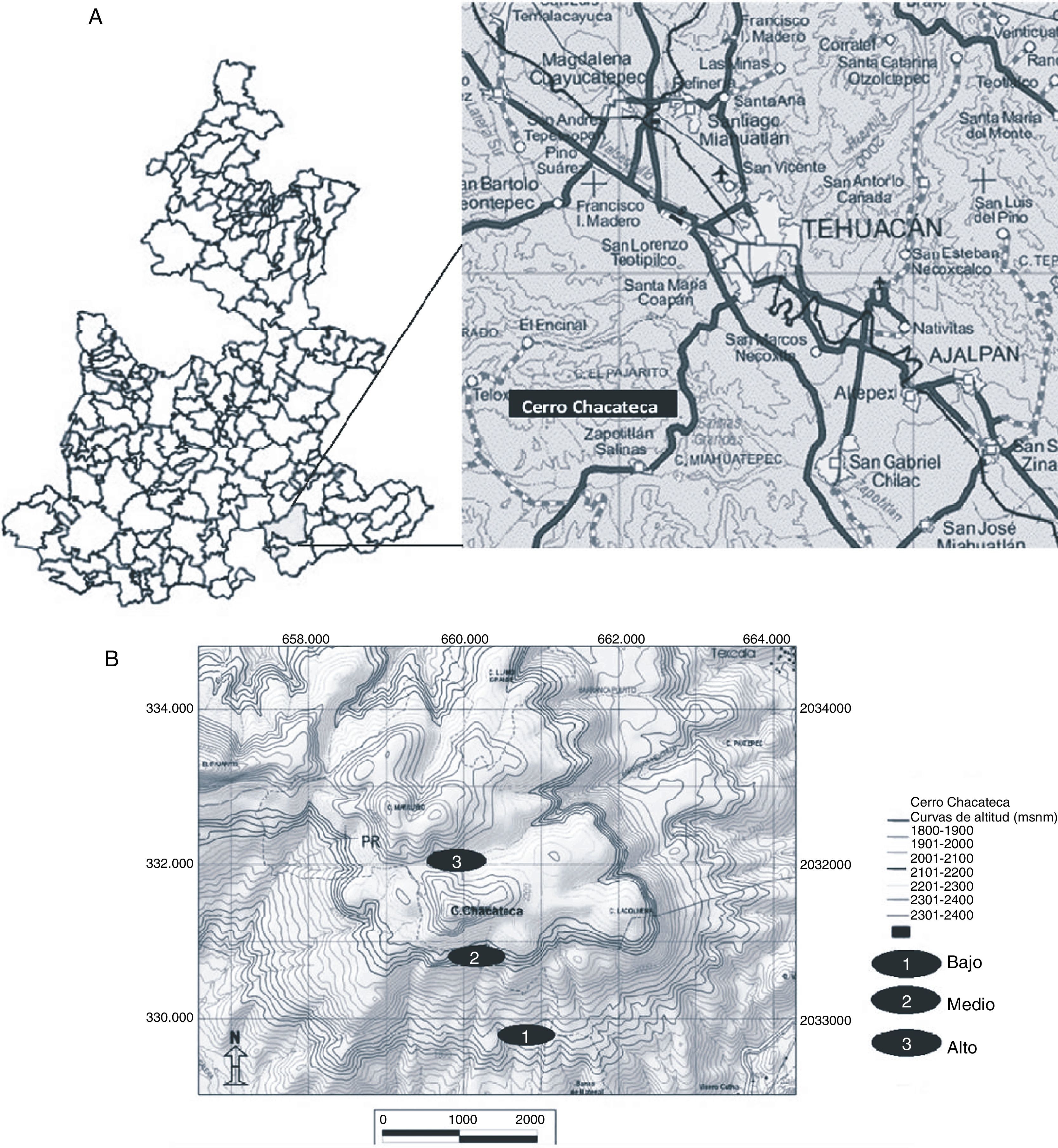
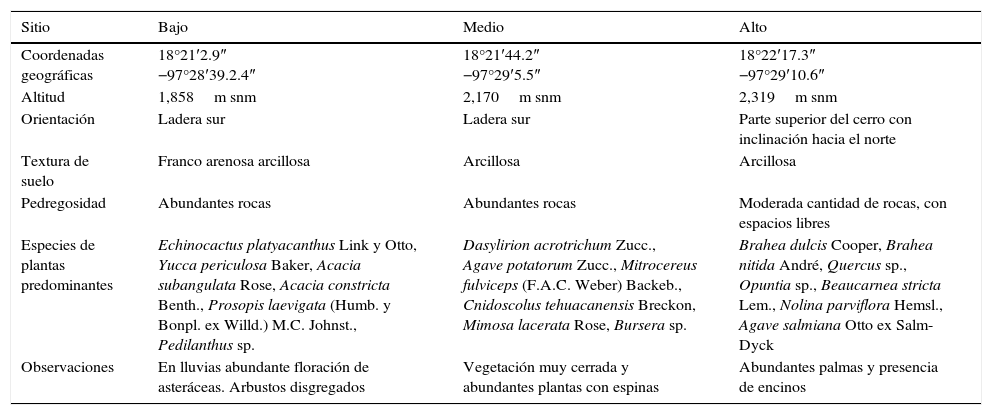
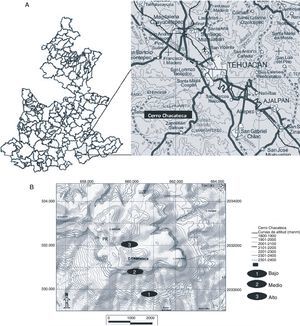
Materiales y métodosEl cerro Chacateca se encuentra en el valle de Zapotitlán, el cual pertenece a la Reserva de la Biosfera de Tehuacán-Cuicatlán al sureste del estado de Puebla (18°20¿N, 97°28¿O; fig. 1A). Su altitud va de 1,600 a 2,440m snm (Pavón, Hernández-Trejo y Rico-Gray, 2000). Presenta un clima semiárido o seco, con una temperatura media anual de 21.2°C y una precipitación anual de 380mm. La época de lluvia se presenta de mayo a septiembre, con una canícula bien definida a mitad de este periodo; mientras que la época seca ocurre de octubre a abril. El tipo de suelo es comúnmente de yeso y caliza, muchas veces con altos contenidos de sales (Arias, Valverde y Reyes, 2001). La vegetación del valle se ha caracterizado como matorral xerófilo (Rzedowski, 1978) y se pueden distinguir distintos grupos y asociaciones vegetales (Valiente-Banuet et al., 2000). Para el presente estudio se eligieron 3 sitios entre 1,858 y 2,319m snm (fig. 1B). Cada sitio fue elegido de acuerdo con las diferentes características de la vegetación, el tipo de suelo y la altitud (tabla 1). Los sitios bajo y medio se ubican sobre la ladera suroeste, y el sitio alto se ubica en la parte superior del cerro con inclinación hacia la ladera norte.
Caracterización de los sitios de muestreo en el cerro Chacateca, Puebla.
| Sitio | Bajo | Medio | Alto |
|---|---|---|---|
| Coordenadas geográficas | 18°21′2.9″ −97°28′39.2.4″ | 18°21′44.2″ −97°29′5.5″ | 18°22′17.3″ −97°29′10.6″ |
| Altitud | 1,858m snm | 2,170m snm | 2,319m snm |
| Orientación | Ladera sur | Ladera sur | Parte superior del cerro con inclinación hacia el norte |
| Textura de suelo | Franco arenosa arcillosa | Arcillosa | Arcillosa |
| Pedregosidad | Abundantes rocas | Abundantes rocas | Moderada cantidad de rocas, con espacios libres |
| Especies de plantas predominantes | Echinocactus platyacanthus Link y Otto, Yucca periculosa Baker, Acacia subangulata Rose, Acacia constricta Benth., Prosopis laevigata (Humb. y Bonpl. ex Willd.) M.C. Johnst., Pedilanthus sp. | Dasylirion acrotrichum Zucc., Agave potatorum Zucc., Mitrocereus fulviceps (F.A.C. Weber) Backeb., Cnidoscolus tehuacanensis Breckon, Mimosa lacerata Rose, Bursera sp. | Brahea dulcis Cooper, Brahea nitida André, Quercus sp., Opuntia sp., Beaucarnea stricta Lem., Nolina parviflora Hemsl., Agave salmiana Otto ex Salm-Dyck |
| Observaciones | En lluvias abundante floración de asteráceas. Arbustos disgregados | Vegetación muy cerrada y abundantes plantas con espinas | Abundantes palmas y presencia de encinos |
Se realizaron 2 muestreos, uno en la época de lluvias —del 20 al 22 de septiembre de 2011— y otro en la época seca —del 28 al 30 de abril de 2012—. Si bien la mayoría de los estudios realizados en este grupo de insectos se ha llevado a cabo durante todo un año, un muestreo más exhaustivo, en cuanto a tiempo, no implica necesariamente una mayor detección de la diversidad (Romero-Samper, 2009). En México se han publicado trabajos faunísticos y ecológicos en donde el muestreo es menor a un año y han mostrado resultados eficientes con respecto a la detección de la diversidad de los Scarabaeoidea (Arriaga et al., 2012; Delgado, Castro-Ramírez, Morón y Ruiz-Montoya, 2012; Lugo-García et al., 2011a; Lugo-García et al., 2011b; Lugo-García et al., 2013; Lugo-García et al., 2014). Además, la selección de estos meses se decidió en función de los registros de precipitación de la estación climatológica de Zapotitlán Salinas (Díaz, Medina, Silva y Serrano, 2007).
En cada sitio y en cada época de muestreo se diseñaron 3 transectos lineales separados por 250m. El primer transecto tuvo una distancia de 300m, en donde se distribuyeron 10 necrotrampas cebadas con calamar y separadas entre sí por 30m. El segundo transecto tuvo una distancia de 120m y se colocaron 5 trampas de fruta separadas por 30m, cebadas con una mezcla de plátano fermentado, azúcar, cerveza y vainilla. El tercer transecto tuvo una distancia de 200m y se colocaron 5 coprotrampas de caída, cebadas con excremento vacuno, separadas 50m una de la otra (Favila y Halffter, 1997; Halffter y Favila, 1993; Villarreal et al., 2006). Todas las trampas estuvieron activas durante 3 días. Además, en cada sitio se realizó recolecta manual en sitios aledaños a los transectos, revisando el follaje de las plantas, la hojarasca, tallos podridos, en las flores, bajo piedras y en excrementos, con un esfuerzo de 8h/hombre por día, en un horario de 10:00 a. m. a 14:00 p. m. y de 15:00 p. m. a 19:00 p. m. Por dificultades logísticas las recolectas nocturnas con trampa de luz tipo pantalla (Morón y Terrón, 1988) se realizaron únicamente en 2 sitios: bajo y alto, funcionando durante 3h continuas cada noche (20:00-23:00h).
Para determinar las características del suelo por sitio en cada transecto se tomaron 3 submuestras de suelo de 30cm de profundidad. Las submuestras se mezclaron para formar una muestra compuesta y determinar su textura (Semarnat, 2002). El sitio bajo presentó 45.04% de arena, 25% de limo y 29.96% de arcilla, siendo su textura franco arenosa-arcillosa. El sitio medio tuvo 28.04% de arena, 18% de limo y 53.96% de arcilla, su textura fue arcillosa. Por último, el sitio alto presentó 22.76% de arena, 19.28% de limo y 57.96% de arcilla, siendo su textura arcillosa.
Los individuos capturados fueron identificados siguiendo los criterios de Cherman y Morón (2014) y Morón (2010, 2013b). Los ejemplares se encuentran depositados en la Colección del Instituto de Ecología, A. C., Xalapa (IEXA).
Análisis de datosSe obtuvo la riqueza específica y la abundancia por época para todos los Scarabaeoidea en el cerro Chacateca. Se agruparon las especies como copronecrófagas (Arriaga et al., 2012; Morón, 2013a) y fitófagas (Deloya, 2003; García-Atencia y Martínez-Hernández, 2015; García-López, Micó, Numa y Galante, 2010; Pacheco et al., 2006), y solo para estos grupos se obtuvo la riqueza específica y la abundancia por sitio de muestreo. Para analizar diferencias de riqueza específica y abundancia entre épocas de recolecta se utilizó una prueba de χ2 para la superfamilia (Escobar, 2000). Asimismo, se aplicó esta prueba para analizar diferencias de riqueza específica y abundancia de los escarabajos copronecrófagos y fitófagos por sitios de muestreo. El análisis se realizó con el programa Past 3.0 (Hammer, Harper y Ryan, 2013). Además, se realizaron diagramas de rango-abundancia (Favila y Halffter, 1997) por sitio para los escarabajos copronecrófagos y fitófagos.
La eficiencia de muestreo de escarabajos copronecrófagos y fitófagos fue evaluada por sitio, mediante curvas de acumulación de especies (Jiménez-Valverde y Hortal, 2003). Para el análisis se utilizaron 2 estimadores no paramétricos: Chao 1 y Bootstrap, ya que estos no se ajustan a un modelo matemático determinado. Para obtener los estimadores se utilizó el programa EstimateS V. 9.1.0 (Colwell, 2013), con el fin de eliminar el efecto del orden en que son agregadas las muestras y del que se engloban las diferentes técnicas de muestreo se realizaron 100 aleatorizaciones (Pineda y Verdú, 2013). En el caso de los escarabajos copronecrófagos el esfuerzo de muestreo se tomó como el número de coprotrampas y necrotrampas colocadas en las 2 épocas de muestreo; además, se incorporaron el número total de horas de recolecta directa de cada época, así como 2 muestras más, dado que las horas de recolecta directa por época suman 24h/hombre en cada sitio, ya que se realizaron de manera sistemática (Escobar, 2000; Villarreal et al., 2006). Para los escarabajos fitófagos el esfuerzo de muestreo se tomó como el número de días, y cada unidad —cada uno de los días— englobó las 5 trampas de fruta, así como las 3h de actividad de la trampa de luz y las horas de recolecta directa en cada periodo.
La diversidad alfa se estimó para la superfamilia Scarabaeoidea por época y por sitio para copronecrófagos y fitófagos; para ello se obtuvo el número efectivo de especies, con la diversidad verdadera de orden 1, con un intervalo de confianza del 95% se determinó si existían diferencias significativas en la diversidad (Moreno, Barragán, Pineda y Pavón, 2011). Estos valores se calcularon con el programa SPADE (Chao y Shen, 2010). El grado de similitud de la fauna entre épocas y entre sitios se calculó con el índice de Jaccard basado en abundancias (Jabd), ya que incorpora los efectos de las especies compartidas no observadas (Chao, Chazdon, Colwell y Shen, 2005); este índice se calculó con el programa SPADE (Chao y Shen, 2010). A partir de los valores encontrados de similitud (s) se calcularon los de disimilitud (d) entre las muestras usando la fórmula: d=1-s (Moreno, 2001). Para clasificar los hábitos de los escarabajos copronecrófagos se determinó el tipo de nidificación, de acuerdo con lo propuesto por Halffter y Edmonds (1982), en el cual las especies se clasifican en: telecópridas (rodadoras), paracópridas (cavadoras) y endocópridas (residentes).
ResultadosAbundancia y riqueza total de Scarabaeoidea en el cerro ChacatecaSe recolectaron 1,300 individuos adultos, que representan a 25 especies incluidas en 16 géneros y 6 familias de Scarabaeoidea: Scarabaeidae, Melolonthidae, Cetoniidae, Trogidae, Passalidae y Geotrupidae. La mayor riqueza la presentó la familia Scarabaeidae con 10 especies, seguida de Melolonthidae y Cetoniidae con 6 especies cada una. Las familias Trogidae (Omorgus mictlensis), Passalidae (Ptichopus angulatus) y Geotrupidae (Bolborhombus sallaei sallaei) con una especie cada una. Las familias con mayor abundancia fueron Scarabaeidae (n=1,091), Cetoniidae (n=173) y Melolonthidae (n=21), seguidas de Passalidae (n=10), Geotrupidae (n=4) y Trogidae (n=1).
Se encontraron 10 nuevos registros para el valle de Zapotitlán, Canthon (Canthon) humectus sayi, Phanaeus quadridens, Agrylinus azteca, Planolinellus vittatus y Blackburneus saylorea (Scarabaeidae); Euphoria canescens, Euphoria dimidiata y Euphoria leucographa (Cetoniidae) y Diplotaxis tarsalis y Golofa (Golofa) tepaneneca (Melolonthidae).
Abundancia y riqueza de Scarabaeoidea por época del añoEn la época de lluvias se registraron 6 familias de Scarabaeoidea: 50% de Scarabaeidae, 27.7% de Cetoniidae y de Melolonthidae, Trogidae, Passalidae y Geotrupidae 5.5% cada una. En la época seca se registraron 4 familias: 55% de las especies de Melolonthidae, 27% de Scarabaeidae y Cetoniidae y Passalidae 9% cada una. En la época de lluvias se registraron 18 especies y 1,237 individuos, mientras que en la época seca se registró una menor riqueza y abundancia —11 especies y 63 individuos— (tabla 2). De acuerdo con la prueba Chi cuadrado la riqueza de especies no fue significativamente diferente entre épocas (χ2=1.689, p=0.193), pero la abundancia de Scarabaeoidea sí fue significativamente diferente (χ2=1060.2, p<0.001).
Abundancia de las especies de Coleoptera Scarabaeoidea en las épocas de lluvias y secas en el cerro Chacateca, Puebla. En la parte inferior se muestra la abundancia y riqueza total por época.
| Especie/época | Lluvias | Secas |
|---|---|---|
| Familia Melolonthidae | ||
| Phyllophaga (Listrochelus) sp. 1a | 2 | 1 |
| Phyllophaga (L.) cuicateca (Morón y Aragón, 1997) | 0 | 1 |
| Diplotaxis tarsalis (Schaeffer, 1907) | 0 | 6 |
| Diplotaxis angularis (LeConte, 1856) | 0 | 5 |
| Diplotaxis mexcala (Vaurie, 1960) | 0 | 5 |
| Golofa (Golofa) tepaneneca (Morón, 1995) | 0 | 1 |
| Familia Cetoniidae | ||
| Euphoria subtomentosa (Mannerheim, 1837) | 128 | 0 |
| Euphoria canescens (Gory y Percheron, 1833) | 13 | 0 |
| Euphoria leucographa (Gory y Percheron, 1833) | 2 | 0 |
| Euphoria basalis (Gory y Percheron, 1833) | 5 | 0 |
| Euphoria dimidiata (Gory y Percheron, 1833) | 1 | 0 |
| Chlorixanthe flavoviridis (Thomson, 1860) | 0 | 24 |
| Familia Scarabaeidae | ||
| Onthophagus durangoensis (Balthasar, 1950)a | 150 | 3 |
| Onthophagus mexicanus (Bates, 1887)a | 857 | 8 |
| Onthophagus lecontei (Harold, 1871) | 37 | 0 |
| Euoniticellus intermedius (Reiche, 1850) | 2 | 0 |
| Canthon (Canthon) humectus sayi (Robinson, 1948) | 7 | 0 |
| Phaneus quadridens (Say, 1835) | 7 | 0 |
| Labarrus pseudolividus (Balthasar, 1950) | 0 | 1 |
| Planolinellus vittatus (Say, 1825) | 16 | 0 |
| Agrilinus azteca (Harold, 1863) | 1 | 0 |
| Blackburneus saylorea (Robinson, 1940) | 2 | 0 |
| Familia Trogidae | ||
| Omorgus mictlensis (Deloya, 1995) | 1 | 0 |
| Familia Geotrupidae | ||
| Bolborhombus sallaei sallaei (Bates, 1887) | 4 | 0 |
| Familia Passalidae | ||
| Ptichopus angulatus (Percheron, 1835)a | 2 | 8 |
| Número total de individuos | 1,237 | 63 |
| Riqueza de especies | 18 | 11 |
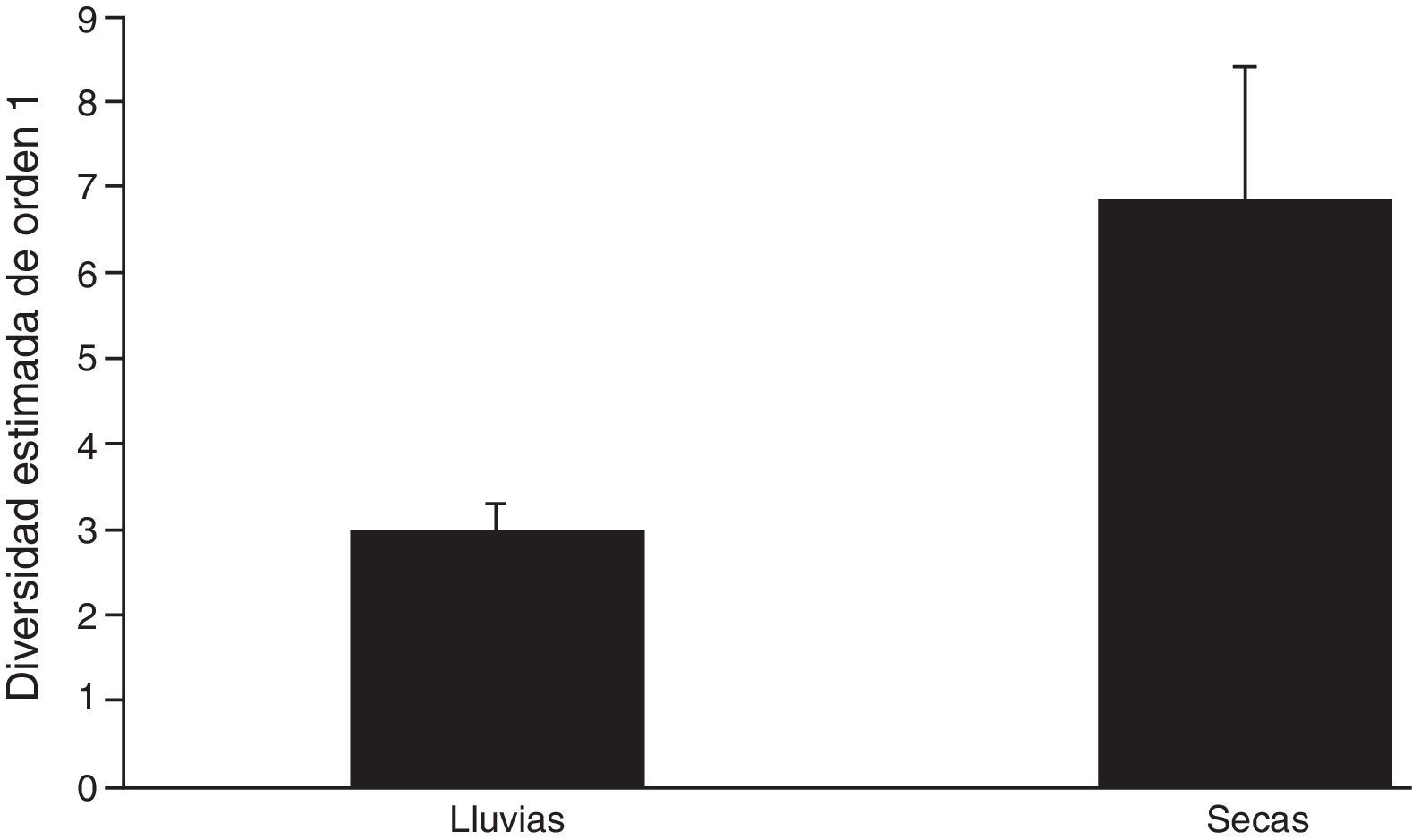
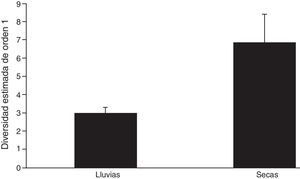
Al analizar la diversidad verdadera de orden 1, la mayor diversidad se registró durante la época seca, con 6.86 especies efectivas, mientras que la época de lluvias solo registró 3.07 especies efectivas. Es decir, la época seca registró más del doble, 2.23 veces más, de la diversidad de Scarabaeoidea que la época de lluvias. Los intervalos de confianza al 95% no se solapan, lo cual indica que existe diferencia significativa entre la diversidad de ambas épocas (fig. 2). El índice de Jaccard mostró una alta disimilitud (0.71). Se compartieron 4 especies entre épocas (tabla 2).
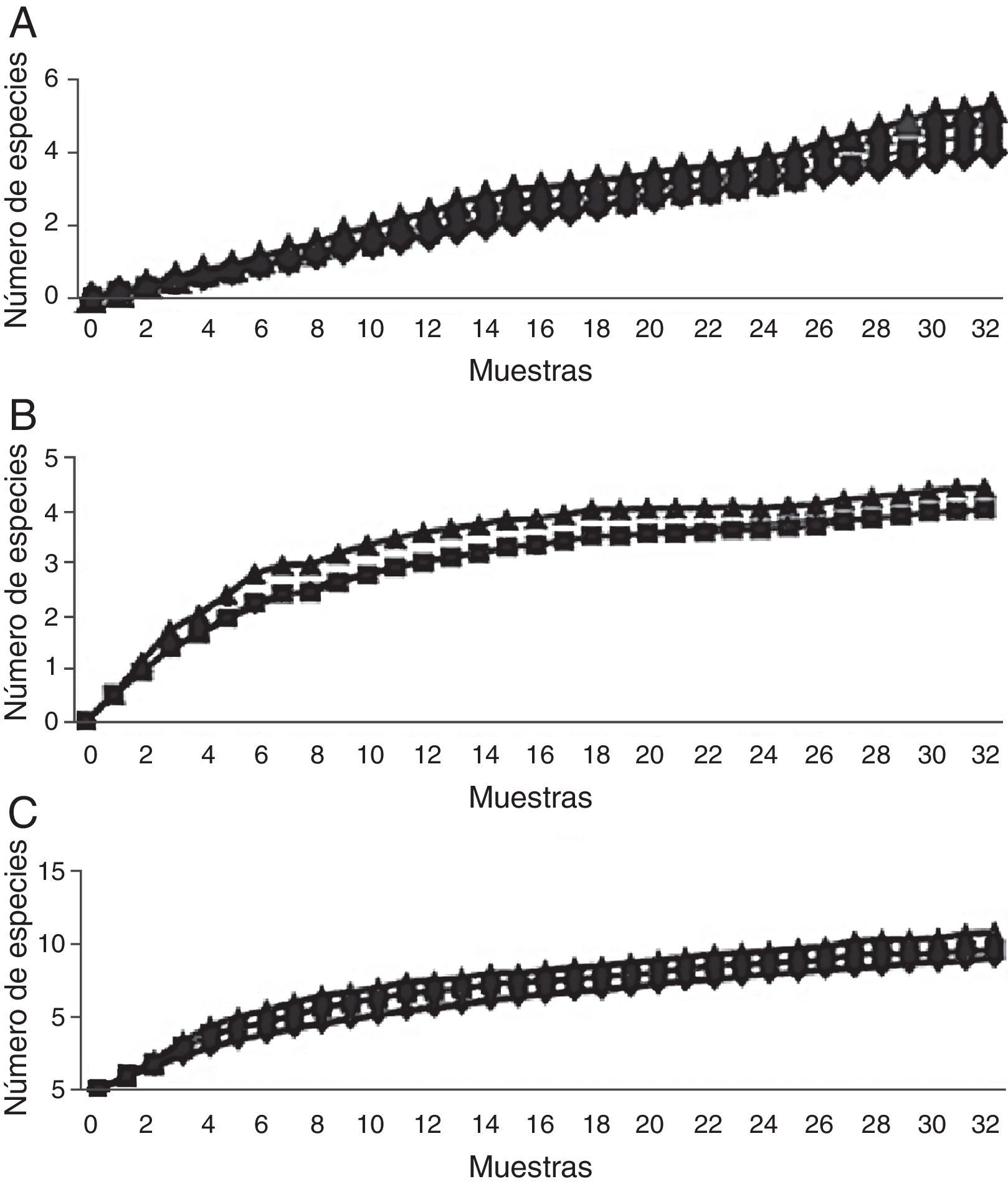
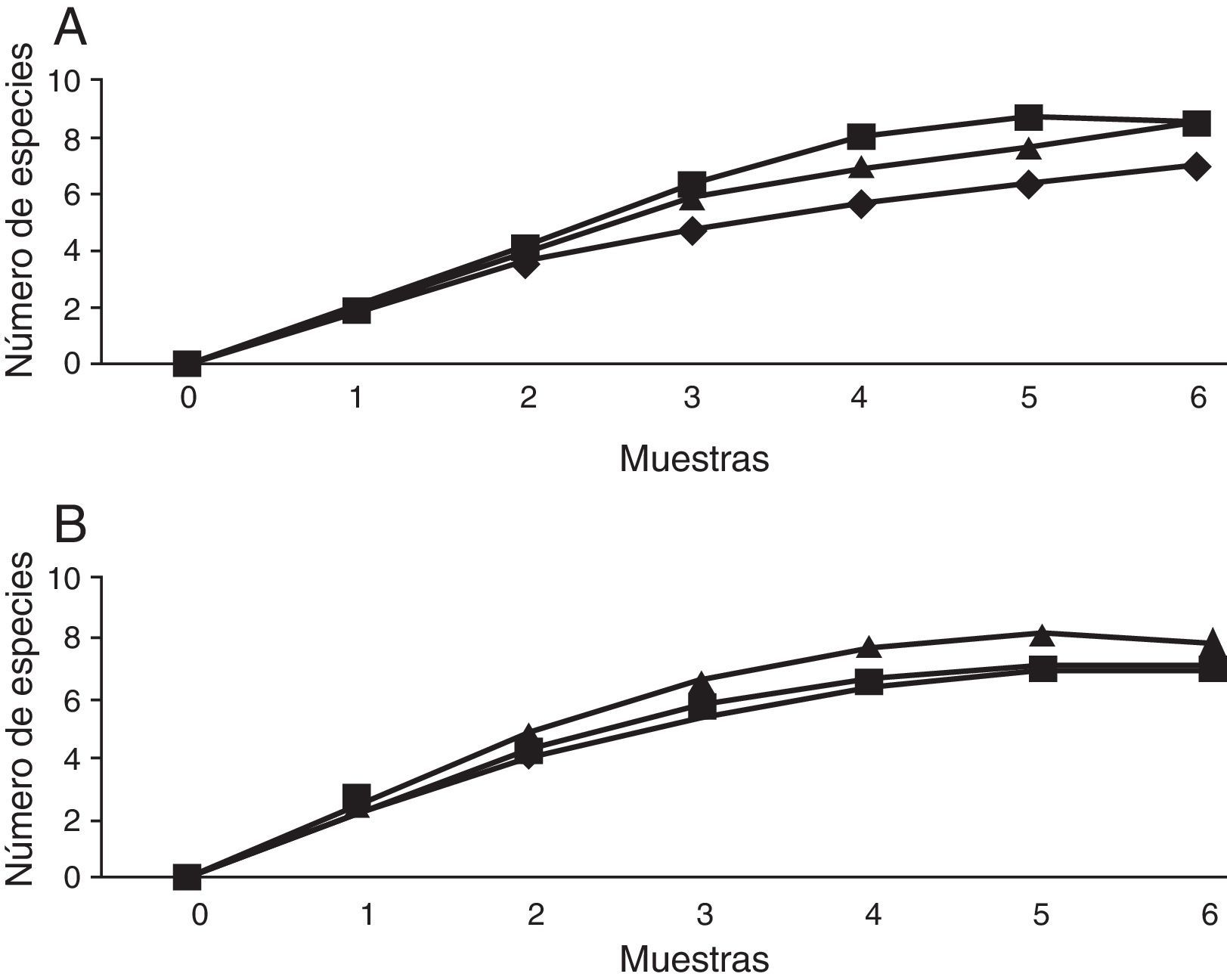
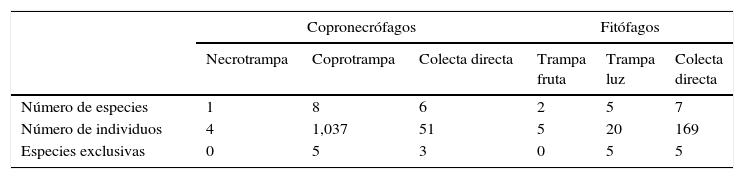
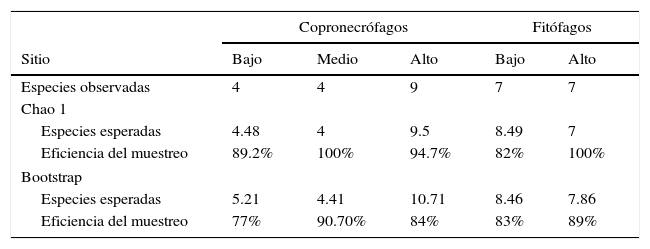
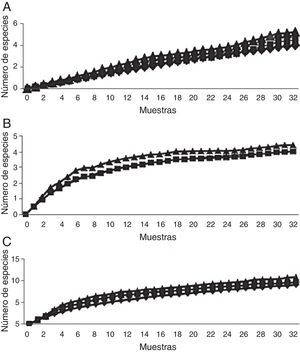
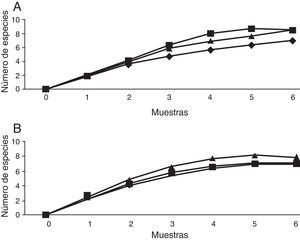
Escarabajos copronecrófagos (Scarabaeidae y Trogidae) por sitioSe obtuvieron 11 especies, 9 géneros y 1,092 individuos; Onthophagus Latreille tuvo 3 especies y los demás géneros una especie cada uno. El mayor número de capturas se registró en coprotrampas, con 72.72% de las especies y el 94.70% de individuos, y 5 especies se capturaron exclusivamente con coprotrampas: Canthon (C.) humectus, P. quadridens, P. vittatus, A. azteca y B. saylorea; mientras que O. mictlensis, Euoniticellus intermedius y Labarrus pseudolividus se capturaron únicamente por recolecta directa; por otro lado, ninguna especie fue exclusiva de las necrotrampas y la única especie que se recolectó fue Onthophagus lecontei (tabla 3). Los estimadores Chao 1 y Bootstrap mostraron que en todos los sitios faltan entre una y 2 especies por capturar y, en general, la eficiencia del muestreo para cada sitio está por encima del 80% (tabla 4; fig. 3).
Efectividad y especies exclusivas de las diferentes técnicas de muestreo utilizadas en la captura de escarabajos copronecrófagos y fitófagos en el cerro Chacateca, Puebla.
| Copronecrófagos | Fitófagos | |||||
|---|---|---|---|---|---|---|
| Necrotrampa | Coprotrampa | Colecta directa | Trampa fruta | Trampa luz | Colecta directa | |
| Número de especies | 1 | 8 | 6 | 2 | 5 | 7 |
| Número de individuos | 4 | 1,037 | 51 | 5 | 20 | 169 |
| Especies exclusivas | 0 | 5 | 3 | 0 | 5 | 5 |
Valores de riqueza esperados y eficiencia de muestreo de escarabajos copronecrófagos y fitófagos por sitios en el cerro Chacateca, Puebla, mediante estimadores no paramétricos.
| Copronecrófagos | Fitófagos | ||||
|---|---|---|---|---|---|
| Sitio | Bajo | Medio | Alto | Bajo | Alto |
| Especies observadas | 4 | 4 | 9 | 7 | 7 |
| Chao 1 | |||||
| Especies esperadas | 4.48 | 4 | 9.5 | 8.49 | 7 |
| Eficiencia del muestreo | 89.2% | 100% | 94.7% | 82% | 100% |
| Bootstrap | |||||
| Especies esperadas | 5.21 | 4.41 | 10.71 | 8.46 | 7.86 |
| Eficiencia del muestreo | 77% | 90.70% | 84% | 83% | 89% |
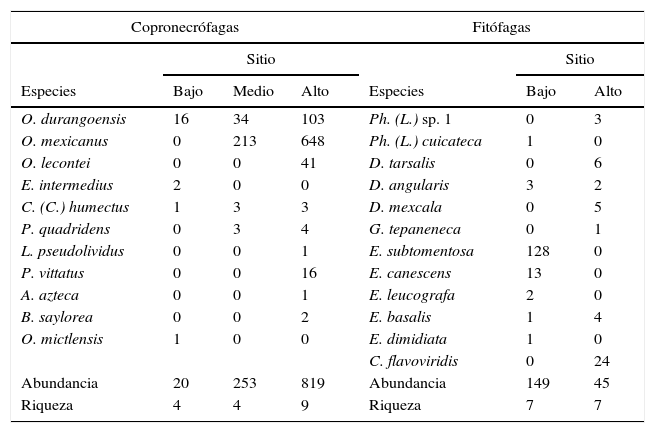
En el sitio bajo se recolectaron 20 ejemplares, 4 especies de 3 géneros de Scarabaeidae y un género de Trogidae. En el sitio medio se recolectaron 253 individuos de 4 especies y de 3 géneros de Scarabaeidae. Por último, en el sitio alto se encontraron 819 individuos de 9 especies y 7 géneros de Scarabaeidae, siendo este sitio el que presentó una mayor abundancia y riqueza de especies (tabla 5). De acuerdo con la prueba de χ2 hubo diferencias significativas en la abundancia entre los sitios de muestreo (χ2=927.7, p<0.001); sin embargo, no ocurrió lo mismo con la riqueza de especies (χ2=2.978, p=0.225).
Abundancia de las especies copronecrófagas y fitófagas en cada sitio muestreado en el cerro Chacateca, Puebla. En la parte inferior se muestra la abundancia y riqueza total.
| Copronecrófagas | Fitófagas | |||||
|---|---|---|---|---|---|---|
| Sitio | Sitio | |||||
| Especies | Bajo | Medio | Alto | Especies | Bajo | Alto |
| O. durangoensis | 16 | 34 | 103 | Ph. (L.) sp. 1 | 0 | 3 |
| O. mexicanus | 0 | 213 | 648 | Ph. (L.) cuicateca | 1 | 0 |
| O. lecontei | 0 | 0 | 41 | D. tarsalis | 0 | 6 |
| E. intermedius | 2 | 0 | 0 | D. angularis | 3 | 2 |
| C. (C.) humectus | 1 | 3 | 3 | D. mexcala | 0 | 5 |
| P. quadridens | 0 | 3 | 4 | G. tepaneneca | 0 | 1 |
| L. pseudolividus | 0 | 0 | 1 | E. subtomentosa | 128 | 0 |
| P. vittatus | 0 | 0 | 16 | E. canescens | 13 | 0 |
| A. azteca | 0 | 0 | 1 | E. leucografa | 2 | 0 |
| B. saylorea | 0 | 0 | 2 | E. basalis | 1 | 4 |
| O. mictlensis | 1 | 0 | 0 | E. dimidiata | 1 | 0 |
| C. flavoviridis | 0 | 24 | ||||
| Abundancia | 20 | 253 | 819 | Abundancia | 149 | 45 |
| Riqueza | 4 | 4 | 9 | Riqueza | 7 | 7 |
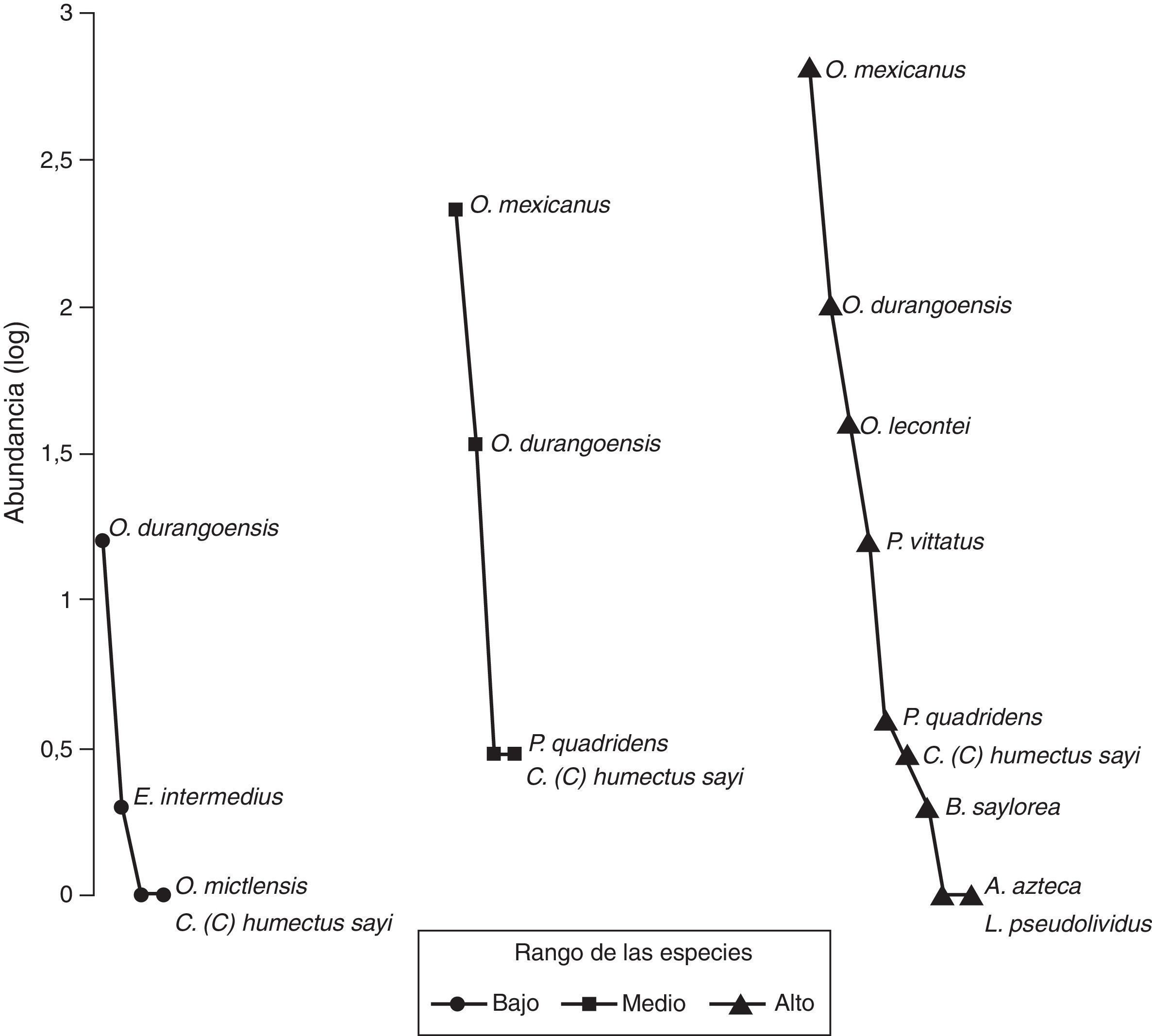
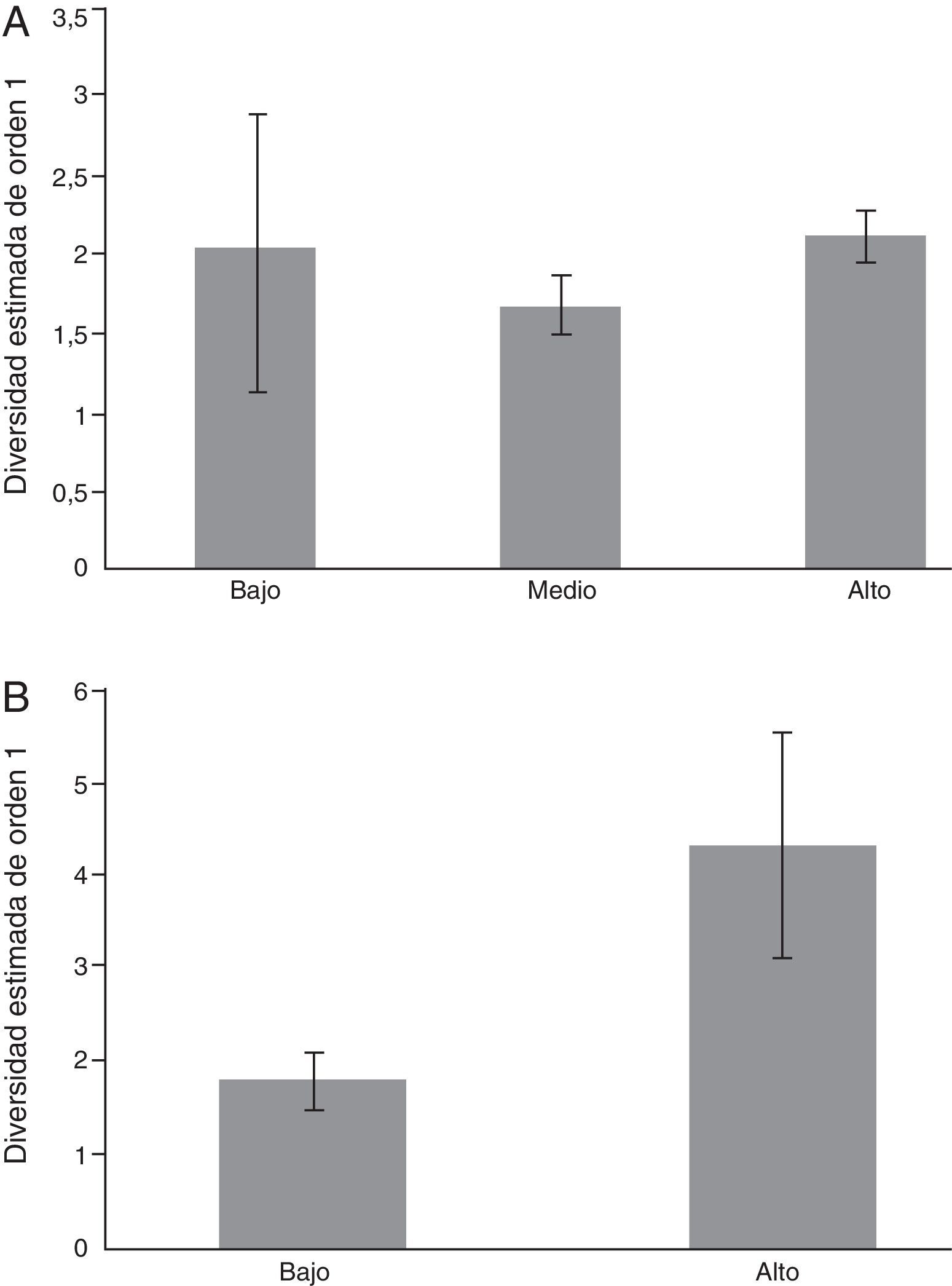
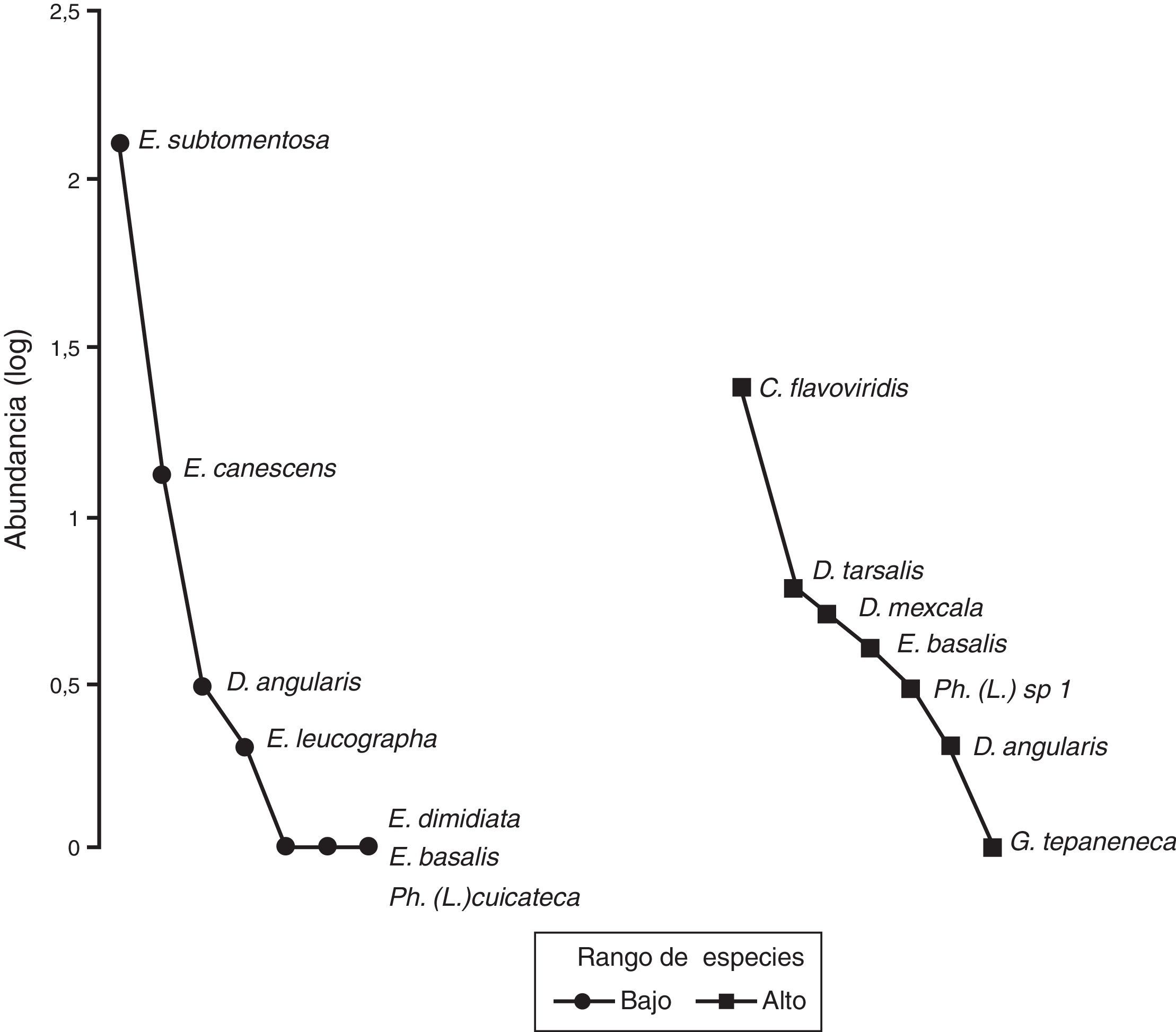
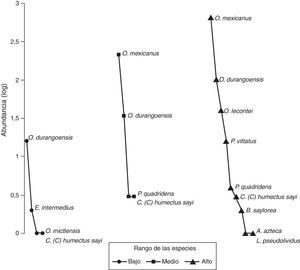
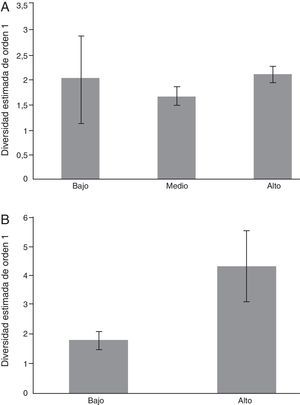
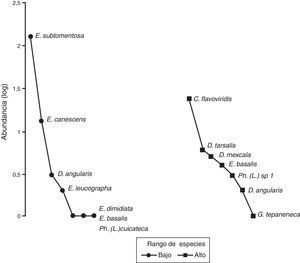
El gráfico de rango-abundancia (fig. 4) mostró que en el sitio bajo la especie Onthophagus durangoensis es dominante: 16 individuos; mientras que las demás especies fueron más equitativas en la distribución de sus abundancias. En los sitios medio y alto la especie dominante fue Onthophagus mexicanus con 213 y 648 individuos, respectivamente, seguida de O. durangoensis con 14 y 103 individuos, respectivamente; las otras especies en el sitio medio: P. quadridens y C. (C.) humectus, presentaron la misma abundancia. En general, en los 3 sitios de muestreo se encontró que las especies del género Onthophagus fueron las dominantes. Al analizar la diversidad verdadera de orden 1 no se encontraron diferencias significativas entre el sitio bajo —2.03 especies efectivas— con respecto a los sitios medio —1.68 especies efectivas— y alto —2.12 especies efectivas—. La diversidad del sitio medio fue significativamente menor que la del sitio alto, con 79.2% de la diversidad que tiene el sitio alto (fig. 5A). Respecto a la diversidad beta, los valores más altos de disimilitud se presentan cuando se compara el sitio bajo con los sitios medio y alto. Por otro lado, la mayor similitud se presenta entre los sitios medio y alto (tabla 6), ya que todas las especies del sitio medio se encontraron en el sitio alto y solo difieren en sus abundancias. Solamente 2 especies: Onthophagus durangoensis y C. (C.) humectus estuvieron presentes en los 3 sitios. Las especies encontradas únicamente en el sitio bajo fueron: Euoniticellus intermedius y O. mictlensis, mientras que las especies encontradas únicamente en el sitio alto fueron: Onthophagus lecontei, P. vittatus, A. azteca, B. saylorea y L. pseudolividus.
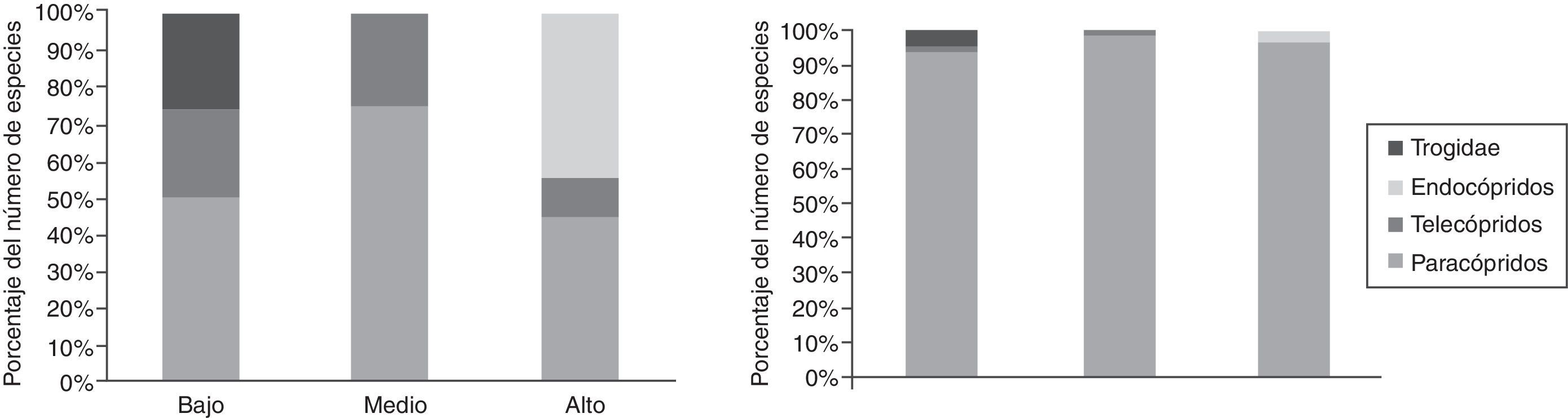
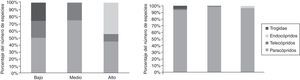
Al clasificar los hábitos de los escarabajos copronecrófagos se encontró que de las 11 especies recolectadas solo una es telecóprida: C. (C.) humectus sayi; 5 son paracópridas: Euoniticellus intermedius, O. durangoensis, O. mexicanus, O. lecontei, P. quadridens; y 4 son endocópridas: Labarrus pseudolividus, P. vittatus, A. azteca, B. saylorea. Se encontró que para los 3 sitios la proporción del número de individuos paracópridos es la más alta, el hábito telecóprido es el mismo en los 3 sitios y las especies endocópridas solo están presentes en el sitio alto (fig. 6).
Escarabajos fitófagos (Melolonthidae y Cetoniidae) por sitiosLa comparación se realizó entre los sitios bajo y alto, debido a que la trampa de luz solo pudo ser colocada en estos sitios. En total se recolectaron 12 especies, 5 géneros y 194 individuos. Por recolecta directa se capturó el 87.11% de los individuos, con trampa de luz 10.30% y con trampa de fruta 2.57%. De Melolonthidae, los géneros Diplotaxis y Phyllophaga fueron exclusivos de la trampa de luz, y G. tepaneneca fue exclusiva por recolecta directa. La mayoría de cetónidos se capturaron por recolecta directa y solo Euphoria basalis y E. leucographa se recolectaron por trampa de fruta (tabla 3). Los estimadores no paramétricos mostraron que faltan por capturar 2 especies para el sitio bajo y una especie para el sitio alto (tabla 4; fig. 7).
En el sitio bajo se recolectaron 149 individuos, 7 especies de 2 géneros de Melolonthidae y un género de Cetoniidae. En el sitio alto se encontraron 45 individuos de 7 especies de 3 géneros de Melolonthidae y 2 géneros de Cetoniidae (tabla 5), siendo la abundancia significativamente diferente entre sitios (χ2=55.753, p<0.001). El gráfico de rango-abundancia mostró que en el sitio bajo existe dominancia de Euphoria subtomentosa con 128 individuos, y el resto de las especies tiene un número muy reducido en sus abundancias. El sitio alto presentó una mayor equitatividad, donde el 86% de las especies osciló entre uno y 6 individuos, y la única especie con una abundancia mayor fue Chlorixanthe flavoviridis, con 24 individuos (fig. 8).
La diversidad de escarabajos fitófagos fue significativamente diferente entre el sitio bajo —1.79 especies efectivas— y el alto —4.33 especies efectivas— (fig. 5B), el sitio alto tiene más del doble de diversidad que el sitio bajo —2.41 veces más diverso—. La similitud de escarabajos fitófagos fue baja entre los sitios bajo y alto (Jabd=0.023), es decir, las comunidades del sitio bajo y alto fueron semejantes en 2.3% y diferentes en 97.7% (d: 0.977). Ambos sitios comparten 2 especies: Euphoria basalis y Diplotaxis angularis, y cada uno presenta 5 especies únicas —sitio bajo: Euphoria subtomentosa, E. canescens, E. leucographa, E. dimidiata y Phyllophaga (Listrochelus) cuicateca; sitio alto: Phyllophaga (Listrochelus) sp. 1., D. tarsalis, Diplotaxis mexcala, G. tepaneneca y C. flavoviridis—.
DiscusiónAbundancia y riqueza total de Scarabaeoidea en el cerro ChacatecaLas familias de Scarabaeoidea con mayor abundancia y riqueza recolectadas en el estado de Puebla han sido Melolonthidae y Scarabaeidae (Cuate-Mozo et al., 2013; Chacón-Aguayo et al., 2013; Delgado-Solano et al., 2013; Muñoz-Hernández et al., 2008; Percino-Figueroa y Morón, 2013; Pérez-Torres, Aragón y Tapia, 2013; Rodríguez et al., 2013; Salamanca-Calixto et al., 2013; Yanes-Gómez y Morón, 2010). Lo anterior concuerda con nuestra zona de estudio, ya que los Scarabaeidae resultaron ser la familia con mayor riqueza específica con 10 especies, seguida de Melolonthidae y Cetoniidae con 6 especies cada una, esto se puede deber a que estas familias aprovechan diversos recursos para alimentarse. En el caso de los Scarabaeidae se alimentan de tejidos vegetales descompuestos o humificados, excrementos y carroña, mientras que los Melolonthidae y Cetoniidae aprovechan las hojas, flores, tallos, frutos, polen, néctar, savia, corteza, detrito vegetal, raíces, humus o xilema (Morón, 2010; Morón, Nogueira, Rojas-Gómez y Arce-Pérez, 2014).
La baja riqueza con una especie y abundancia con 10 individuos de miembros de la familia Passalidae en la zona de estudio puede deberse a que las especies de esta familia son de tendencia higrófila y silvícola (Reyes-Castillo, 2003), y debido a que hay largos periodos de sequía y pérdida de follaje gran parte del año, existen condiciones que provocan una mayor insolación y desecación en la madera. La presencia de P. angulatus en la zona de estudio se debe a que vive y se reproduce únicamente en los depósitos de desperdicios de las hormigas cortadoras del género Atta, lo cual le permite colonizar áreas semidesérticas (Morón, 2004; Reyes-Castillo, 2003).
La familia Geotrupidae solo estuvo representada por B. sallaei sallaei; se sabe que los Bolboceratinae son más frecuentes en ambientes semiáridos (Howden, 2003). De la familia Trogidae se recolectó a O. mictlensis, de hábitos telionecrófagos, el único ejemplar obtenido fue recolectado directamente en excremento de caballo, aunque en la misma reserva fue capturado en necrotrampa cebada con calamar (Jiménez-Sánchez, Quezada-García y Padilla-Ramírez, 2013). Los adultos de la familia Trogidae se han registrado alimentándose de cadáveres secos de vertebrados o de restos orgánicos formados por plumas, pelos y excrementos acumulados dentro de nidos de aves o madrigueras de pequeños mamíferos; también pueden ser atraídos por excrementos de animales carnívoros (Morón et al., 1997). Romero-Samper (2009) menciona que los adultos de los Trogidae se alimentan de residuos queratínicos contenidos en las heces de carnívoros u omnívoros, razón por la cual recolectamos a esta especie en este tipo de sustrato.
Scarabaeoidea durante la época de lluvias y la época seca en el cerro ChacatecaLa mayor riqueza y abundancia de Scarabaeoidea se registró en la época de lluvias, ya que en esta época existe una mayor disponibilidad de recursos alimenticios, una mayor cobertura vegetal que produce sombra, creando microambientes que pudieran ser más propicios para estos organismos, y existen las condiciones de humedad necesarias para que los adultos emerjan y vuelen. Estos resultados concuerdan con lo encontrado en diversos trabajos (Percino-Figueroa y Morón, 2013; Pérez-Torres et al., 2013; Yanes-Gómez y Morón, 2010), donde la mayoría de las especies inician actividades con la temporada de lluvias.
A nivel de familia durante la época de lluvias se registró la mayor riqueza y abundancia de Scarabaeidae, ya que durante la época seca el grado de insolación y la escasez de humedad provocan la desecación rápida del excremento, factor que inhabilita el uso de este recurso (Halffter y Edmonds, 1982); además, la desecación influye en la mortalidad de las larvas (Escobar, 1997; Fincher, 1973). También hubo una mayor abundancia de Cetoniidae durante la época de lluvias, en la que se observó a los adultos aprovechando las partes florales de especies de Asteraceae para su alimentación.
Por otro lado, las especies de Melolonthidae (género Diplotaxis y Phyllophaga) estuvieron mejor representadas en la época seca, tanto en número de especies como de individuos (tabla 2); este resultado podría estar sesgado debido al método de recolecta, ya que todas las especies fueron capturadas con trampa de luz, método que no fue del todo eficiente en la temporada de lluvias debido a la presencia de brisas y viento; esto pudo impedir el vuelo de los insectos, disminuyendo la eficiencia de captura. Sin embargo, otra razón que podría estar explicando estos resultados es que los requerimientos de humedad para que los adultos emerjan varía en función de la especie y la localidad (Hilje, 1993), por lo que no necesariamente todas las especies requieren de la mayor cantidad de humedad presente en la época de lluvias. Así, los resultados de este estudio concuerdan con el de Méndez-Aguilar, Castro-Ramírez, Ramírez-Salinas y López-Anaya (2003), en el que las especies del género Diplotaxis presentaron emergencias antes del periodo de lluvias; Carrillo-Ruiz y Morón (2003) registran la mayor abundancia de Phyllophaga y Diplotaxis en los meses con menor precipitación; Aragón, Pérez-Torres, Morón, López y Tapia-Rojas (2006) también observaron que en el género Phyllophaga algunas especies tienen su mayor actividad antes de la época de lluvias.
Aunque hubo una mayor abundancia y riqueza de Scarabaeoidea durante la época de lluvias, la mayor diversidad se registró en la época seca. Esto se debe a que existe una mayor equidad durante la época seca, mientras que en la época de lluvias existe una alta dominancia de especies como Euphoria subtomentosa, O. durangoensis y O. mexicanus, que representan el 91.77% del número total de individuos. La alta dominancia de pocas especies también ha sido referida en otras zonas áridas del país (Halffter, Verdú, Moreno y Halffter, 2011; Lobo, 1996; Moreno et al., 2007; Verdú et al., 2007).
La similitud entre ambas épocas es baja (Jabd: 0.31), porque solo compartieron 5 especies (P [L.]. sp. 1, G. tepaneneca, O. durangoensis, O. mexicanus y P. angulatus) y el número de individuos es contrastante entre épocas. A pesar de que las especies del género Onthophagus se encuentran en ambas épocas, su abundancia se reduce drásticamente —1,007 individuos en lluvias y 10 individuos en época seca—, esto podría estar ligado con la poca disponibilidad de excremento en la época seca. Por otro lado, P. angulatus presenta una mayor abundancia en la época seca —2 individuos en lluvias y 10 individuos en época seca—, es una especie de amplia distribución y se ha encontrado en diversos hábitats (Reyes-Castillo, 2003), incluso en áreas subxerófilas y xerófilas (Lugo-García et al., 2011a). Golofa tepaneneca es una especie que solo se había recolectado entre los meses de julio y septiembre (Morón, 1995; Pérez-Torres et al., 2013), por ello resulta interesante el registro de un ejemplar en abril (época seca).
Escarabajos copronecrófagos (Scarabaeidae y Trogidae) por sitioLa eficiencia del muestreo en los 3 sitios alcanza más del 80%, por lo cual podemos considerar que el inventario está razonablemente completo en los 3 sitios (Pineda y Verdú, 2013); esto hace que la comparación entre estos sea confiable. La mayor riqueza y abundancia de especies se presentó en el sitio alto, esto podría explicarse por su ubicación hacia la ladera norte, en donde existen mejores condiciones de humedad, lo que estimula que los adultos emerjan (Halffter y Edmonds, 1982) y permite que el alimento esté disponible por más tiempo al evitar su rápida desecación. Por otro lado, los sitios bajo y medio se ubican sobre la ladera sur, por lo que tienen un déficit hídrico y una mayor radiación solar (López-Gómez, Zedillo-Avelleyra, Anaya-Hong, González-Lozada y Cano-Santana, 2012), factores que propician la desecación del excremento.
En cuanto a la textura arcillosa en el suelo del sitio alto, permite el establecimiento de las larvas de escarabeidos, ya que su sobrevivencia es más alta en suelos de textura fina, disminuyendo en número con el aumento de las partículas (Regniere, Rabb y Stinner, 1981); además, existen áreas en el sitio alto donde la cantidad de rocas en el suelo no es tan abundante como en el sitio bajo o en el sitio medio, lo que favorece la anidación de los adultos (Arriaga et al., 2012); también se ha encontrado que en los suelos poco arenosos existe mayor riqueza y abundancia de especies en el estado adulto, en comparación con los suelos arenosos (Escobar, 2000), mientras que en los suelos margos —de arcilla-arena con alto contenido de materia vegetal descompuesta— habita un mayor número de individuos y de especies (Arriaga et al., 2012). La baja diversidad de escarabajos copronecrófagos en los sitios de muestreo se debe a la alta dominancia que presentan. En el sitio alto el 79% de los individuos pertenece a O. mexicanus; en el sitio medio el 84% de los individuos pertenece a esta misma especie, y en el sitio bajo el 80% de los individuos pertenece a O. durangoensis.
Existe una estrecha relación entre la aridez y la dominancia de especies heliófilas; esto ha sido registrado en otras zonas secas de México (Halffter et al., 2011; Lobo, 1996; Moreno et al., 2007; Verdú et al., 2007). Los resultados de este estudio concuerdan con esto, ya que en los 3 sitios de muestreo existe una alta dominancia del género Onthophagus, se sabe que algunas de sus especies están adaptadas a vivir en zonas abiertas o semiabiertas como sabanas, praderas y áreas xéricas, donde existe una alta incidencia de luz (Halffter y Edmonds, 1982; Zunino, 2003). La especie O. mexicanus fue la más abundante en los sitios medio y alto, es una especie común y abundante en terrenos abiertos, bosque de coníferas y encinares, tolerante al pastoreo (Zunino, 2003), lo que nos hace suponer que es resistente a diferentes condiciones ambientales que podrían ser letales para otras especies.
La similitud en la composición de especies entre los sitios medio y alto (Jabd: 0.92) se puede explicar porque ambos tienen la misma textura de suelo (arcillosa), estos comparten especies solo de la subfamilia Scarabaeinae, que generalmente excavan en el suelo para enterrar el excremento, lo que se asemeja a lo encontrado en el sureste del altiplano mexicano (Arriaga et al., 2012), donde las especies P. quadridens, C. (C.) humectus y O. mexicanus se encontraron en el sitio con suelo arcilloso, el cual es más propicio para la excavación de túneles y la supervivencia de las larvas; esto resulta razonable dada la alta desecación en los suelos arenosos (Halffter y Edmonds, 1982).
A pesar de que no se observan diferencias significativas en el número de especies entre los 3 sitios de muestreo, existe una alta disimilitud entre la composición de especies del sitio bajo con respecto a los sitios medio y alto (tabla 6). Esto podría deberse a que las condiciones en el sitio bajo son menos propicias para este grupo de insectos, ya que la textura del suelo con un mayor contenido de arena y rocas impide la anidación de los Scarabaeinae. La especie O. mictlensis se recolectó solo en este sitio, debido probablemente a que los Trogidae no nidifican profundamente, limitándose la hembra a ovopositar en el suelo subyacente al recurso (Arriaga et al., 2012; Romero-Samper, 2009), por lo que el tipo de suelo podría no afectarles.
La especie E. intermedius también se recolectó solo en este sitio, es de origen africano y fue introducida intencionalmente en el estado de Texas, Estados Unidos de América, en 1978 (Favila, 2012; Morales, Ruiz y Delgado, 2004; Morón, Aragón, Tapia-Rojas y Rojas-García, 2000), su presencia en el sitio bajo probablemente se deba a que es una especie adaptada a condiciones edáficas y climáticas extremas, la arquitectura de su nido varía marcadamente con las condiciones climáticas, así, cuando las condiciones son secas construye un nido, de tal manera que este conserva la humedad (Rougon y Rougon, 1982).
Las 4 especies de Aphodiinae únicamente se encontraron en el sitio alto. Su presencia apoya la teoría de que la riqueza de especies de esta subfamilia aumenta con la altitud, por encima de los 2,000m snm, debido a su fisiología que no les permite cruzar ciertos límites climáticos, como el aumento de la temperatura (Halffter y Edmonds, 1982; Lobo y Halffter, 2000), por lo que las especies de estas familias dominan generalmente en áreas templado-frías (Lobo y Halffter, 2000). Los géneros Planolinellus, Agrilinus y Blackburneus suelen encontrarse en mayores altitudes, en zonas de temperaturas moderadamente cálidas y precipitaciones moderadas (Cabrero-Sañudo, Dellacasa, Martínez, Lobo y Dellacasa, 2010), esto explicaría por qué están presentes solo en el sitio alto, donde la temperatura es menor y la cantidad de humedad es mayor.
Solo 2 especies fueron encontradas en los 3 sitios de muestreo. La presencia de C. (C.) humectus en las 3 cotas altitudinales se puede deber a sus estrategias de termorregulación, ya que modifican la tasa de pérdida de calor corporal a medida que aumenta la temperatura (Verdú y Lobo, 2008), lo anterior les permite habitar en un mayor número de ambientes. El patrón de nidificación telecóprido en los 3 sitios de muestreo estuvo representado por esta misma especie, ya que la relocalización horizontal del excremento le pudiera estar permitiendo escapar de la fuerte insolación en las zonas de muestreo. Lo anterior ha sido observado por Escobar (2000) en la sabana colombiana, en donde las especies rodadoras habitaban en áreas abiertas y semiabiertas, donde la incidencia de luz es mayor. El patrón de nidificación paracóprido estuvo mejor representado en el sitio medio y en el sitio alto, en donde la textura es arcillosa y con mayor cantidad de humedad, factores que facilitan la construcción de nidos y evitan la mortalidad de los individuos. El patrón de nidificación endocóprido solo se encontró en el sitio alto y está representado por las especies pertenecientes a la subfamilia Aphodiinae. En este sitio el excremento puede ser usado por más tiempo, ya que se mantiene húmedo, y las larvas y adultos no están tan expuestos a la insolación.
Escarabajos fitófagos (Melolonthidae y Cetoniidae) en los sitios bajo y altoLa eficiencia del muestreo en el sitio bajo y en el sitio alto alcanza más del 80%, lo cual hace más robustas las comparaciones entre ellos. Los sitios bajo y alto presentaron el mismo número de especies, y el sitio bajo presentó un mayor número de individuos, siendo diferentes significativamente. Esto probablemente se debe a la gran abundancia de E. subtomentosa con 128 individuos. Por otro lado, la baja diversidad de este sitio con respecto a la del sitio alto se puede deber a la alta dominancia de esta misma especie, de ella se sabe que tiene una amplia distribución en terrenos abiertos donde existen flores de Asteraceae (Morón et al., 2000), lo cual nos hace pensar que es una especie tolerante a la insolación. Además, su dominancia también ha sido documentada en el estado de Guerrero (Pacheco et al., 2006).
La disimilitud en la fauna de escarabajos entre ambos sitios fue alta (d: 0.97), ya que de las 12 especies encontradas solo comparten Euphoria basalis y D. angularis; la presencia de estas especies en ambos sitios se puede deber a que son tolerantes a distintos tipos de hábitats. Se sabe que tienen una amplia distribución, encontrándose en zonas agrícolas, matorrales, bosques y a lo largo de diferentes cotas altitudinales (Pérez-Torres et al., 2013). Además, E. basalis se alimenta de un gran número de plantas silvestres y cultivadas, aprovechando tejidos florales, polen y néctar (Morón, 1997).
Al parecer, la fauna de Cetoniidae está relacionada con la riqueza de especies vegetales presentes en cada zona, debido a que se alimentan de estas. Por ejemplo, el género Euphoria estuvo mejor representado en el sitio bajo con 5 especies, donde existe una gran cantidad de flores de Asteraceae durante la época de lluvias. Estos resultados se asemejan a lo encontrado en el valle de Puebla (Pérez-Torres et al., 2013), en el cual las especies de Euphoria son más abundantes a finales del verano y mediados del otoño, cuando florece un gran número de especies de Asteraceae. Por otro lado, la especie C. flavoviridis se encontró únicamente en el sitio alto en abril —época secas—, suponemos que se debe a que se alimenta de las flores de una especie de Opuntia, la cual solo se encuentra en este sitio, y se observó que florece en esta época. Esta especie ya había sido asociada a flores de Opuntia sp. entre abril y julio (Morón, 1997).
Posiblemente la presencia de G. tepaneneca y de D. tarsalis únicamente en el sitio alto está relacionada con la mayor humedad, la altitud y la vegetación (presencia de encinos), ya que al parecer el hábitat original de G. tepaneneca es la frontera entre el matorral árido —en las zonas más húmedas— y el bosque de encino poco húmedo (Morón, 1995, 1997), en el cual posiblemente sus larvas se desarrollan donde se acumula materia vegetal en descomposición, o en los tocones y raíces podridas de encinos (Morón, 1997). Por otra parte, los ejemplares de D. tarsalis han sido recolectados en áreas montañosas caracterizadas por bosque de pino y encino-pino (Vaurie, 1958), y en el estado de Puebla se ha recolectado en la región del Iztaccíhuatl y Popocatépetl (Rodríguez et al., 2013).
De acuerdo con lo obtenido en este estudio, podemos ver que existe un cambio en la composición y estructura de las comunidades de escarabajos entre épocas y entre los 3 sitios de muestreo, lo cual muy probablemente está relacionado con las características propias de cada ambiente y la disponibilidad de alimento. Este trabajo es una contribución al conocimiento de los escarabaeoideos en zonas semiáridas de nuestro país, y resultan interesantes los resultados obtenidos, ya que son evidencia de que estas zonas albergan un mayor número de especies de las esperadas en un principio, las cuales ejercen un papel importante dentro de los microhábitats del ecosistema, y que bajo un muestreo sistemático podemos obtener información cada vez más completa del papel que desempeñan en él.
Agradecemos al doctor Miguel A. Morón por corroborar e identificar algunas de las especies registradas. Al Sr. Pedro G. Miranda por su ayuda en el trabajo de campo. Al M. en. C. Gonzalo Yanes por su ayuda en la elaboración del mapa de la zona de estudio. Alma L. Trujillo Miranda recibió apoyo como becaria del Consejo de Ciencia y Tecnología del Estado de Puebla (Concytep).
La revisión por pares es responsabilidad de la Universidad Nacional Autónoma de México.