El objetivo de este trabajo fue analizar la fauna parasitaria de una población de Chaetophractus vellerosus de Magdalena, provincia de Buenos Aires, Argentina, mediante análisis coproparasitológicos. Se evaluó la influencia de distintos parámetros del hospedero —edad, sexo, talla y peso— estacionalidad, cobertura vegetal y el impacto antrópico sobre la dinámica de la estructura parasitaria. Se hallaron ooquistes de 2 especies de Eimeria (Protozoa-Coccidea) y huevos de Aspidodera sp., Trichostrongylina, Ancylostoma sp. y Trichuris sp. (Nematoda). Los parásitos de mayor prevalencia fueron Eimeria sp. y Aspidodera sp., el de menor, Ancylostoma sp. Las cargas parasitarias de los coccidios fueron mayores en los hospederos juveniles; las de Trichuris sp. fueron mayores en los machos. Sólo los Trichostrongylina tuvieron mayores cargas en los hospederos con mala condición corporal. Trichostrongylina y Eimeria sp. fueron más prevalentes en verano, mientras que Aspidodera sp. lo fue en invierno. Ni la cobertura vegetal ni el impacto antrópico influenciaron sobre las cargas parasitarias. El presente estudio permitió conocer la fauna parasitaria de una población de C. vellerosus (Dasypodidae) en Argentina mediante el análisis coproparasitológico y su seguimiento durante 4 años consecutivos.
The aim of this study was to analyze the parasitic fauna of a population of Chaetophractus vellerosus from Magdalena, Buenos Aires province, Argentina, by parasitological analysis. We evaluated the influence on the parasitic dynamics of different host parameters —age, sex, height and weight— as well as seasonality, vegetation and human impact. Oocysts of 2 species of Eimeria (Protozoa-Coccidea) and eggs of Aspidodera sp. Trichostrongylina, Ancylostoma sp. and Trichuris sp. (Nematoda) were found. Eimeria sp. and Aspidodera sp. were the most prevalent parasites, and Ancylostoma sp. was the lowest prevalent. Parasite loads of coccideans were higher in hosts young. Parasite loads of Trichuris sp. were higher in males. Only Trichostrongylina had greater loads in specimens with poor body condition. Trichostrongylina and Eimeria sp. were most prevalent in summer, while Aspidodera sp. was in winter. Neither vegetation nor human impact influenced in parasitic loads. This study enabled us to know the parasitic fauna of a population of C. vellerosus (Dasypodidae) in Argentina through coproparasitological analysis, and monitor it for 4 consecutive years.
La importancia de los parásitos y patógenos como componentes normales de la ecología de cada especie ha sido aceptada por los ecólogos al considerar su presencia frecuente en poblaciones de animales y plantas (Dobson y Hudson, 1986). Los parásitos pueden verse ahora como factores denso dependientes que regulan la densidad poblacional, y ello contrasta con una visión más tradicional de los agentes patógenos, considerados con escasa frecuencia y que operan al azar de manera denso independiente (Dobson y Hudson, 1986). De este modo, las evaluaciones sobre el estado sanitario de poblaciones animales implican, entre otros aspectos, la identificación de parásitos —macro y microparásitos—, patógenos y su distribución e impacto en la población estudiada (Ezquiaga et al., 2009). La concentración de huevos o quistes de parásitos es un parámetro importante en la epidemiología, no sólo para el diagnóstico de las infecciones, sino también para estudios de resistencia a los medicamentos y evaluación de la eficacia del control biológico (Mes et al., 2007).
En este marco, el examen coproparasitológico se propone como herramienta diagnóstica y de utilidad en estudios parasitológicos de animales vivos, y así avanzar en el conocimiento del estado de salud de las poblaciones silvestres. Una leve a moderada carga parasitaria es normal en animales silvestres y no necesariamente está ligada a una manifestación clínica (Ezquiaga et al., 2009). Sin embargo, estudios llevados a cabo en insectos, peces, anfibios y roedores muestran que la ocurrencia de infección y la intensidad son probables y más severas en individuos con una pobre condición física subyacente (Beldoménico y Begon, 2009). Además, la infección en sí resulta en mayor deterioro del hospedero creándose un “círculo vicioso” (Beldoménico y Begon, 2009). Algunos parásitos pueden causar lesiones en sus sitios de infección por su localización (e. g., intracelular en Eimeria spp.), por su modo de fijación (e. g., Trichuris sp.) o en distintos tejidos durante la migración larval (Ezquiaga et al., 2009).
En este sentido, el monitoreo de las cargas parasitarias en una población hospedera a lo largo del tiempo permite evaluar también el impacto de diferentes actividades (e. g., antrópicas) y de factores ambientales sobre la salud poblacional, ya que el estrés crónico afecta negativamente el sistema inmunológico de los animales y puede llevar a un incremento de las cargas parasitarias (Oppliger et al., 1998). Asimismo, resulta esencial contar con información parasitológica de distintas poblaciones silvestres y, en el caso de que existan diferencias entre la composición parasitaria, el análisis coproparasitológico podría ayudar a referenciar áreas, especies hospederas y parásitas asociadas (Ezquiaga et al., 2009).
Chaetophractus vellerosus (Gray, 1865) se distribuye en el sudeste de Bolivia, noroeste de Paraguay y centro de Argentina, ocupando regiones áridas y semiáridas con suelo suelto y arenoso (Wetzel, 1985; Abba et al., 2007; Abba et al., 2011). En Argentina la principal población está ubicada en el noroeste y centro del país, cuya distribución no supera los 62°50’ O en su extensión hacia el este y los 39°20’ S hacia el sur. Una segunda población se encuentra ubicada en el noreste de la región pampeana, separada de la primera por unos 500 km, y se extiende desde los 34°56’ O hasta los 36° S, aproximadamente (Crespo, 1974; Carlini y Vizcaíno, 1987; Abba et al., 2011). Este armadillo se alimenta principalmente de insectos coleópteros y en menor medida de material vegetal y de pequeños mamíferos (Greegor, 1985; Soibelzon et al., 2007; Abba et al., 2011).
El objetivo de este trabajo fue estudiar la fauna parasitaria de una población de C. vellerosus procedente de la localidad de Magdalena, provincia de Buenos Aires, Argentina, teniendo en cuenta factores intrínsecos de los hospederos —edad, sexo, peso, talla— y extrínsecos — estacionalidad, cobertura vegetal y efecto antrópico— y analizar su influencia en la dinámica de la estructura parasitaria.
Materiales y métodosLos muestreos se realizaron estacionalmente durante 4 años —2006, 2007, 2009 y 2010— en un campo del partido de Magdalena, provincia de Buenos Aires, Argentina (35°10’ S, 57°20’ O). Los hospederos se capturaron de forma manual y con la ayuda de una red; se utilizó esta metodología, debido a que los armadillos no suelen caer en trampas estándar (Abba et al., 2011). Los ejemplares capturados fueron sexados, medidos, pesados, marcados para su liberación posterior y se tomaron muestras de materia fecal (Abba et al., 2011). Una parte de las heces fue conservada en una solución de dicromato de potasio (K2Cr2O7) al 2%, para permitir el desarrollo de ooquistes de protistas, y el resto se almacenó en formol al 10%.
Se analizaron 120 muestras de materia fecal distribuidas equitativamente entre las estaciones analizadas. Para ello, se siguió la técnica de flotación con solución sobresaturada de sacarosa (Sheather, d= 1 200) (Becerril-Flores y Romero-Cabello, 2004). Se tomaron las medidas correspondientes al diámetro de quistes de protistas, características de la pared y presencia o ausencia de micrópila. En el caso de los helmintos, se midió el largo y ancho de los huevos, se observó la forma, el estado de desarrollo y las particularidades de la cáscara. Las cargas parasitarias fueron estimadas mediante el uso de la cámara de MacMaster (Vignau et al., 2005) y se expresaron como el promedio de ooquistes o huevos por gramo de heces (opg o hpg, respectivamente). Para la esporulación de los ooquistes, la materia fecal se colocó en cajas de petri con dicromato de potasio al 2% y se mantuvo a temperatura ambiente por 10 días (Duszynski y Wilber, 1997).
Los análisis estadísticos fueron realizados con el programa R (R Development Core Team, 2012). Las prevalencias se analizaron mediante tablas de contingencia con los tests de Chi-cuadrada y exacto de Fisher. Para evaluar diferencias entre cargas parasitarias correspondientes a las distintas estaciones del año, sexo y edad de los hospederos, tipo de vegetación y ambiente del área de estudio, se utilizaron modelos lineales generalizados (GLM). Para una correcta elección de la familia de distribución, se evaluaron gráficamente la importancia de la sobrepoblación de ceros y sobredispersión de los datos mediante diagramas de puntos de Cleveland e histogramas de conteos (Zuur et al., 2009). No pudieron aplicarse los GLM para el parásito Ancylostoma sp., debido a la presencia de sólo 3 valores de conteos positivos. Para el resto de los parásitos se detectó sobrepoblación de ceros, siendo menos importante en Aspidodera, y sobredispersión de los datos, por lo que se procedió a utilizar los modelos con inflación de ceros, usando una distribución binomial negativa (ZINB GLM: Zero Inflated Negative Binomial GLM) (Zuur et al., 2009). En todos los casos se utilizó una constante para modelar la probabilidad de falsos ceros, ya que no hay ninguna razón biológica para pensar que las categorías influyan en falsos ceros. Todos los modelos fueron comparados con el modelo nulo mediante la prueba de cociente de verosimilitud (LRT: Likelihood ratio test; Zuur et al., 2009). Se trabajó con 66 hembras y 54 machos. La edad se estimó mediante el peso y el largo del cuerpo, separándose en juveniles (n= 25) y adultos (n= 95). La vegetación se dividió en pastizal, pastura y monte de talas. El efecto antrópico se consideró según el uso asignado a los 2 potreros seleccionados para el estudio, el potrero sur de 50 ha, altamente modificado por la actividad agroganadera, con pasturas; y el potrero norte de 50 ha, caracterizado por pastizales naturales y montes de talas. La condición física se evaluó realizando una regresión entre el peso y largo del cuerpo transformados en logaritmos decimales. Se analizaron los residuos de la regresión en busca de datos extremos y se recalculó la regresión, excluyendo estos datos. Este procedimiento se iteró hasta que no se encontraron datos extremos. A aquellos individos con valores extremos cuyos residuos son positivos se los consideró como en buena condición física y los de residuos negativos como de mala condición física.
ResultadosSe hallaron ooquistes de Eimeria spp. (Protozoa-Coccidea) (Figs. 1a, b) y huevos de nematodos: Aspidodera sp. (Fig. 1c), Trichostrongylina (Fig. 1d), Ancylostoma sp. (Fig. 1e) y Trichuris sp. (Fig. 1f). Los ooquistes de Eimeria no pudieron ser diferenciados en la cámara de MacMaster, por lo cual, las cargas parasitarias fueron estimadas para los Eimeria spp. en su conjunto, sin discriminar por especies. Las prevalencias totales se muestran en la figura 2.
Huevos y ooquistes hallados en las heces de Chaetophractus vellerosus de Magdalena, provincia de Buenos Aires, Argentina: a, ooquiste de Eimeria sp. 1 esporulado, con 4 esporoquistes en su interior; b, ooquiste de Eimeria sp. 2 esporulado, con 4 esporoquistes en su interior; c, huevos de Aspidodera sp., 1 larvado y el otro morulado; d, huevo de Trichostrongylina; e, huevo de Ancylostoma sp.; f, huevo de Trichuris sp.
Como resultado de los coprocultivos, se hallaron 2 tipos diferentes de ooquistes de coccidios: Eimeria sp. 1: ooquistes ovalados; con pared doble, la externa gruesa, rugosa o estriada; la interna muy delgada, sin micrópila. Comenzaron a esporular a los 8 días. Los esporoquistes ovalados, de pared granular, midieron 12x9 µm, sin residuos (Fig. 1a). Eimeria sp. 2: ooquistes redondos; con pared doble, la externa lisa y gruesa; la interna muy delgada, sin micrópila. Los ooquistes esporularon a los 6 días. Los esporoquistes subesféricos, presentaron una pared delgada y lisa, midieron 6x6 µm, sin residuos (Fig. 1b).
Prevalencias vs. estación del añoLa figura 3 muestra las prevalencias en porcentaje (%) por estación del año. Para Eimeria spp. las mayores prevalencias se observaron en el otoño (100%), y las menores en verano (78%); en Aspidodera sp. las prevalencias mayores se dieron en las estaciones frías (entre 94 y 98%), y las menores en las estaciones cálidas (73 a 80%). En cambio, para el resto de las especies halladas la mayor prevalencia fue en el verano (Trichostrongylina, Trichuris sp. y Ancylostoma sp.), aunque en Trichuris sp., excepto para el otoño (5%), las prevalencias en el resto de las estaciones fueron muy similares (~27%) (Fig. 3).
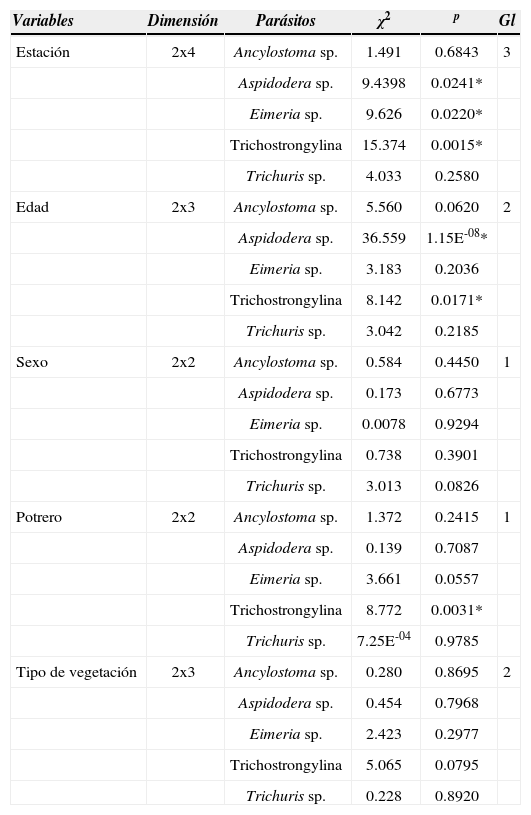
Los resultados de las tablas de contingencias de 2 x 4 para las estaciones del año mostraron que las prevalencias de Aspidodera sp., Eimeria sp. y los Trichostrongylina no son independientes de la estación del año (Cuadro 1).
Tablas de contingencia para las prevalencias de especie parásita halladas en Chaetophractus vellerosus de Magdalena, provincia de Buenos Aires, Argentina
| Variables | Dimensión | Parásitos | χ2 | p | Gl |
|---|---|---|---|---|---|
| Estación | 2x4 | Ancylostoma sp. | 1.491 | 0.6843 | 3 |
| Aspidodera sp. | 9.4398 | 0.0241* | |||
| Eimeria sp. | 9.626 | 0.0220* | |||
| Trichostrongylina | 15.374 | 0.0015* | |||
| Trichuris sp. | 4.033 | 0.2580 | |||
| Edad | 2x3 | Ancylostoma sp. | 5.560 | 0.0620 | 2 |
| Aspidodera sp. | 36.559 | 1.15E-08* | |||
| Eimeria sp. | 3.183 | 0.2036 | |||
| Trichostrongylina | 8.142 | 0.0171* | |||
| Trichuris sp. | 3.042 | 0.2185 | |||
| Sexo | 2x2 | Ancylostoma sp. | 0.584 | 0.4450 | 1 |
| Aspidodera sp. | 0.173 | 0.6773 | |||
| Eimeria sp. | 0.0078 | 0.9294 | |||
| Trichostrongylina | 0.738 | 0.3901 | |||
| Trichuris sp. | 3.013 | 0.0826 | |||
| Potrero | 2x2 | Ancylostoma sp. | 1.372 | 0.2415 | 1 |
| Aspidodera sp. | 0.139 | 0.7087 | |||
| Eimeria sp. | 3.661 | 0.0557 | |||
| Trichostrongylina | 8.772 | 0.0031* | |||
| Trichuris sp. | 7.25E-04 | 0.9785 | |||
| Tipo de vegetación | 2x3 | Ancylostoma sp. | 0.280 | 0.8695 | 2 |
| Aspidodera sp. | 0.454 | 0.7968 | |||
| Eimeria sp. | 2.423 | 0.2977 | |||
| Trichostrongylina | 5.065 | 0.0795 | |||
| Trichuris sp. | 0.228 | 0.8920 |
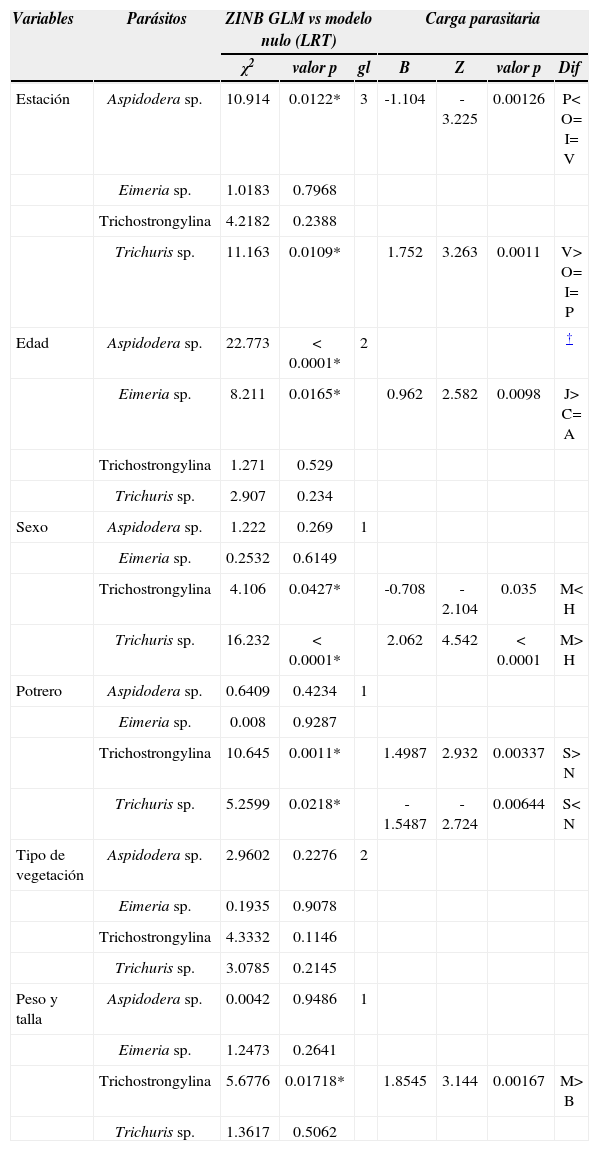
Para el análisis de la carga parasitaria utilizando ZINB GLM, sólo los modelos para Aspidodera y Trichuris difieren del modelo nulo al incorporar las estaciones del año como variable explicativa (Cuadro 2). En el caso de Aspidodera, aunque la probabilidad de obtener falsos ceros es significativa (z= -6.913; p< 0.0001), se detectaron diferencias significativas de la carga parasitaria entre estaciones, siendo menor en primavera que en el resto de las estaciones. Para Trichuris también la probabilidad de obtener falsos ceros fue significativa (z= 4 524; p< 0.0001) y la carga parasitaria fue mayor durante el verano. En ningún caso se observaron patrones en los residuos que invaliden el modelo.
Cargas parasitarias en Chaetophractus vellerosus y variables analizadas. Estación: O, otoño; I, invierno; P, primavera; V, verano. Edad: C, cría; J, juvenil; A, adulto. Sexo: H, hembra; M, macho. Potrero: S, sur; N, norte. Condición física: M, mala; B, buena
| Variables | Parásitos | ZINB GLM vs modelo nulo (LRT) | Carga parasitaria | |||||
|---|---|---|---|---|---|---|---|---|
| χ2 | valor p | gl | B | Z | valor p | Dif | ||
| Estación | Aspidodera sp. | 10.914 | 0.0122* | 3 | -1.104 | -3.225 | 0.00126 | P< O= I= V |
| Eimeria sp. | 1.0183 | 0.7968 | ||||||
| Trichostrongylina | 4.2182 | 0.2388 | ||||||
| Trichuris sp. | 11.163 | 0.0109* | 1.752 | 3.263 | 0.0011 | V> O= I= P | ||
| Edad | Aspidodera sp. | 22.773 | < 0.0001* | 2 | † | |||
| Eimeria sp. | 8.211 | 0.0165* | 0.962 | 2.582 | 0.0098 | J> C= A | ||
| Trichostrongylina | 1.271 | 0.529 | ||||||
| Trichuris sp. | 2.907 | 0.234 | ||||||
| Sexo | Aspidodera sp. | 1.222 | 0.269 | 1 | ||||
| Eimeria sp. | 0.2532 | 0.6149 | ||||||
| Trichostrongylina | 4.106 | 0.0427* | -0.708 | -2.104 | 0.035 | M< H | ||
| Trichuris sp. | 16.232 | < 0.0001* | 2.062 | 4.542 | < 0.0001 | M> H | ||
| Potrero | Aspidodera sp. | 0.6409 | 0.4234 | 1 | ||||
| Eimeria sp. | 0.008 | 0.9287 | ||||||
| Trichostrongylina | 10.645 | 0.0011* | 1.4987 | 2.932 | 0.00337 | S> N | ||
| Trichuris sp. | 5.2599 | 0.0218* | -1.5487 | -2.724 | 0.00644 | S< N | ||
| Tipo de vegetación | Aspidodera sp. | 2.9602 | 0.2276 | 2 | ||||
| Eimeria sp. | 0.1935 | 0.9078 | ||||||
| Trichostrongylina | 4.3332 | 0.1146 | ||||||
| Trichuris sp. | 3.0785 | 0.2145 | ||||||
| Peso y talla | Aspidodera sp. | 0.0042 | 0.9486 | 1 | ||||
| Eimeria sp. | 1.2473 | 0.2641 | ||||||
| Trichostrongylina | 5.6776 | 0.01718* | 1.8545 | 3.144 | 0.00167 | M> B | ||
| Trichuris sp. | 1.3617 | 0.5062 | ||||||
Los resultados de las tablas de contingencia mostraron valores significativos para Aspidodera y Trichostrongylina, o sea, que las prevalencias de estos parásitos no son independientes de la edad. Los modelos ZINB GLM para la carga parasitaria fueron significativos al compararlos con el modelo nulo para Aspidodera y Eimeria. En el caso de Aspidodera, la probabilidad de obtener falsos ceros fue significativa (z= -6.841; p< 0.0001), sin embargo, se observaron patrones en la distribución de los residuos que invalidan el modelo. Para Eimeria también la probabilidad de obtener falsos ceros fue significativa (z= 6.504; p< 0.0001), y la carga parasitaria para los juveniles fue mayor a las otras edades (Cuadro 2). En este último, no se detectaron patrones en los residuos que invaliden el modelo.
Prevalencia vs. sexo del hospederoLos resultados de las tablas de contingencia indican que la prevalencia de los parásitos es independiente del sexo. Los modelos ZINB GLM de la carga parasitaria de Trichuris y Trichostrongylina resultaron significativos contra el modelo nulo. En el caso de Trichuris, la probabilidad de obtener falsos ceros fue significativa (z= 5.124; p< 0.0001), y la carga parasitaria para los machos fue mayor a la de las hembras. Para los Trichostrongylina también la probabilidad de obtener falsos ceros fue significativa (z= 4.996; p< 0.0001) y la carga parasitaria de los machos fue menor a la de las hembras. No se observaron patrones en los residuos que invaliden el modelo.
PotrerosDe acuerdo con los resultados de las tablas de contingencia, hay independencia entre los potreros en todos los parásitos, excepto en Trichostrongylina que tuvo mayor prevalencia en el potrero norte. Los modelos ZINB GLM de la carga parasitaria de Trichuris y Trichostrongylina resultaron significativos contra el modelo nulo. En el caso de Trichuris, la probabilidad de obtener falsos ceros fue significativa (z= 4.389; p< 0.0001) y la carga parasitaria en el potrero sur fue menor a la del norte (Cuadro 2). Para Trichostrongylina también la probabilidad de obtener falsos ceros fue significativa (z= 5.035; p< 0.0001), y la carga parasitaria en el potrero norte fue mayor a la del sur. No se hallaron patrones en los residuos que invaliden el modelo.
VegetaciónLas tablas de contingencia mostraron que no hubo diferencias significativas entre los distintos tipos de vegetación (Cuadro 1). Los modelos ZINB GLM de las cargas parasitarias en todos los casos no fueron significativos respecto del modelo nulo (Cuadro 2).
Cargas parasitarias, peso y tallaComo resultado de la iteración se obtuvo la ecuación de la recta entre el logaritmo del largo del cuerpo y el peso (F(1.92)= 136.4; p< 0.0001; R2= 0.5973; ordenada= -0.02867; pendiente= 1.26781) y se excluyeron 22 valores extremos. De esta muestra, 13 individuos estuvieron por encima del nivel óptimo de su condición y 9 por debajo (Fig. 4). Sólo los modelos ZINB GLM de la carga parasitaria de Trichostrongylina resultaron significativos contra el modelo nulo (Cuadro 2). La probabilidad de obtener falsos ceros fue significativa (z= 2.401;p< 0.0163) y la carga parasitaria de los especímenes en mala condición, menor peso y talla, fue mayor a los de buena condición (Cuadro 2).
Regresión entre el logaritmo decimal del largo del cuerpo (mm) y el peso (gr) de Chaetophractus vellerosus de Magdalena, provincia de Buenos Aires, Argentina. Círculos blancos, crías; grises, juveniles; negros, adultos; asteriscos, datos extremos (outliers) utilizados para el análisis de condición física. Línea continua, recta de regresión por cuadrados mínimos ordinarios; línea de puntos, intervalo de confianza del 95%.
El análisis coproparasitológico permitió indicar la presencia de ooquistes de coccideos en Chaetophractus vellerosus y registrarlo como nueva especie de hospedero de Eimeria spp. Respecto a la identidad de Eimeria pudo observarse la presencia de 2 tipos morfológicos diferentes, que se separan por su tamaño, estructura de la pared quística y tiempo de desarrollo, lo cual muestra la coexistencia de diferentes especies de coccidios en la misma especie hospedera. Entre los Eimeriidae parásitos de xenartros, se conocen 3 especies para Myrmecophaga tridactyla L.: Eimeria escomeli (Rastegaieff, 1930) Gardner et al., 1991; E. tamanduae Lainson, 1968 y E. marajoensis Lainson y Shaw, 1991 (Freitas et al., 2006). Sin embargo, las características de las especies halladas aquí no coinciden con ninguna de las conocidas para M. tridactyla y no podrían atribuirse a otras especies hospederas, dado que en las heces de C. vellerosus fueron hallados ooquistes sin esporular. Ezquiaga et al. (2009) observaron 2 tipos morfológicos de ooquistes de Eimeria sp. en Zaedyus pichiy Desmarest, 1804, cuyas características morfométricas — estructura de la pared; tamaño, presencia de micrópila y cuerpos residuales— son diferentes a las observadas en el presente trabajo. En el mismo trabajo, Ezquiaga y colaboradores observaron ooquistes de Adeleidae, parásitos de insectos, que fueron reconocidos como parásitos en tránsito (Ezquiaga et al., 2009).
Los endoparásitos más frecuentes fueron Eimeria y Aspidodera quienes estuvieron presentes en más de las 3/4 partes de la población analizada, seguidos por los Trichostrongylina y Trichuris presentes en 1/4 de la población analizada. La presencia de Ancylostoma había sido previamente informada en otras especies de dasipódidos (Navone, 1990); el bajo porcentaje hallado podría atribuirse a la presencia, en el área de captura, de sus hospederos habituales (perros, zorros).
Si bien, en ejemplares de C. vellerosus provenientes de la misma zona (Pipinas, 35°34’36” S, 57°16’46” O) se hallaron adultos de Mazzia bialata Chabaud, Navone y Bain, 1983; Trichohelix tuberculata (Parona y Stossich, 1902); Pterygodermatites chaetophracti Navone y Lombardero, 1980; Aspidodera fasciata Schneider, 1866; A. scoleciformis Diesing, 1851 y Strongyloides sp. (Ezquiaga, 2013), en el presente estudio no se hallaron ni huevos de M. bialata ni de P. chaetophracti ni larvas de Strongyloides sp., y ello podría deberse a las bajas abundancias de estos parásitos en el área de estudio. Además, si bien el único Trichostrongylina observado en C. vellerosus fue T. tuberculata, los huevos hallados en los análisis coproparasitológicos no fueron atribuidos a esta especie por su diferente tamaño (74 x 43 vs. 64 x 33). El largo y ancho de los huevos es un carácter estable a nivel específico y hasta tanto no pueda establecerse la correspondencia entre los nematodos hallados por necropsia y los huevos hallados en el análisis coproparasitológico no se podrán identificar. En este sentido, si bien, algunos ejemplares de C. vellerosus fueron analizados por coproparasitología y necropsia, al no estar parasitados por Trichostrongylina, no pudo establecerse la correspondencia.
Los resultados sugieren cierta estacionalidad tanto en la prevalencia como en la carga parasitaria en C. vellerosus. Los coccidios presentaron menor prevalencia durante el verano, aunque no se encontraron diferencias en las cargas parasitarias. Al respecto, Stodart (1968) analizó las fluctuaciones estacionales de los coccidios hallados en conejos en Australia y observó que cuando la evaporación era mayor en el ambiente, la presencia de ooquistes en la materia fecal disminuía; Hobbs et al. (1999) sugirieron que los coccidios requieren temperaturas moderadas y ambientes relativamente húmedos para la esporulación y supervivencia. En este sentido, en el verano, al ser mayor la evaporación y permanecer seco el suelo, los ooquistes no tendrían las condiciones óptimas para esporular. Aspidodera fue más prevalente en las estaciones frías, mientras que Trichuris y Trichostrongylina lo fueron en las estaciones cálidas. Ello podría explicarse porque los huevos de Trichuris tienen una cáscara más gruesa y resistente a la desecación, y los Trichostrongylina tienen la larva infectiva (L3) libre, pero que conserva la muda del estado anterior (L2), la cual protege de la desecación (Anderson, 2000).
Respecto a la edad, en Aspidodera la prevalencia fue muy alta en juveniles y adultos, y nula en las crías, mientras que en Trichostrongylina la prevalencia fue muy alta en las crías, y baja en juveniles y adultos. En todos los casos no se encuentran diferencias si se excluyen las crías, cuyo número de observaciones es bajo. Quizá las diferencias observadas en la distribución de las especies parásitas puedan explicarse por el modo de transmisión de estos nematodos y por el desarrollo del sistema inmune del hospedero. Mientras que en los Aspidodera la transmisión es por ingesta del huevo, en los Trichostrongylina la larva infectante puede ser ingerida o penetrar activamente a través de la piel, o incluso puede haber transmisión transplacentaria (Anderson, 2000). Además, los animales jóvenes tienen un sistema inmune poco desarrollado y son más susceptibles de ser infectados por trichostrongílidos (Anderson, 2000). Del mismo modo, sólo las cargas parasitarias de Eimeria fueron significativamente más altas en los juveniles, y ello, probablemente pueda deberse al escaso desarrollo de la inmunidad frente a los coccidios, como ha sido observado en otros mamíferos. En este sentido, diversos trabajos han dado cuenta de una disminución de las prevalencias y cargas parasitarias de coccidios con el aumento de la edad en diferentes especies hospederas de importancia veterinaria —bovinos, caprinos, conejos y ovinos— (Hobbs et al., 1999; Díaz de Ramírez et al., 2001; Pino y Morales, 2002; Quijada et al., 2008). Quizá en xenartros la inmunidad a los coccidios se desarrolle plenamente en los adultos después de haber estado en contacto con los antígenos en las edades más jóvenes.
No se observaron diferencias en la prevalencia de los parásitos entre ambos sexos, aunque sí las hubo en las cargas parasitarias de Trichuris y Trichostrongylina con tendencias opuestas. Los machos presentaron una mayor carga parasitaria de Trichuris, mientras que las hembras estuvieron más parasitadas por Trichostrongylina. Es interesante indicar que no hay registros de Trichuris para dasipódidos y las medidas de los huevos de Trichuris sp. hallados en el presente estudio coinciden con las medidas de Trichuris bursacaudata Suriano y Navone, 1994, parásito de Ctenomys talarum (Rodentia, Ctenomyidae) de Punta Indio, provincia de Buenos Aires. Es probable que la mayor prevalencia de Trichuris sp. en los machos se deba a que, en la época de reproducción (primavera-verano), éstos necesitan ampliar su área de acción para aumentar la probabilidad de encontrar hembras en celo, mientras que las hembras en la misma época se dedican al cuidado de las crías, por lo que reducen su área de acción (Abba A. M., obs. pers.). Por lo tanto, durante esta época del año, los machos de C. vellerosus tendrían mayor probabilidad de contacto con los tuco-tucos y/o los ambientes frecuentados por estos roedores (hospederos de T. bursacaudata), lo que generaría una mayor probabilidad de contagio tanto por consumo accidental de heces o consumo directo de tuco-tucos. Esto está sustentado por estudios sobre hábitos alimenticios, los cuales mostraron un alto consumo de suelo (70% del peso seco de las heces, Abba et al., 2011) y por el consumo de pequeños mamíferos como Ctenomys (Greegor, 1985; Soibelzon et al., 2007; Abba et al., 2011). Asimismo, esta hipótesis podría corroborarse con el hecho que Ezquiaga et al. (2008) hallaron sobre C. vellerosus del mismo sitio varios ejemplares de Polygenis (Polygenis) platensis Jordan y Rothschild, 1908 (Siphonaptera), especies de pulgas parásitas de C. talarum.
Sólo se hallaron diferencias en la prevalencia de Trichostrongylina al considerar los potreros, siendo mayor para el norte. También se observaron diferencias en la carga parasitaria entre ambos potreros muestrados para Trichostrongylina, mayor en el potrero sur, y Trichuris, mayor en el potrero norte. Sin embargo, estos resultados pueden estar reflejando una diferencia sexual enmascarada, debido a que la proporción de hembras y machos en el potrero sur es 60:40, lo cual es coincidente con el hecho de que las hembras poseen mayores cargas parasitarias de Trichostrongylina.
Cuando se compararon las cargas parasitarias entre los individuos en estado óptimo de salud y aquellos de menor peso para su tamaño, se observó que, excepto en Trichostrongylina, no hubo diferencias significativas, sin embargo, Beldoménico y Begon (2009) observaron que en insectos, peces, anfibios y roedores los individuos en mal estado fisiológico general suelen ser más susceptibles a infecciones, y ello debilita aún más su condición. Estos autores sugieren que las poblaciones en mal estado de salud podrían exhibir una mayor prevalencia de parasitosis, y ello aumentaría el riesgo de adquirir otras infecciones, conduciendo de esta manera, a un mayor deterioro en su condición. Este “círculo vicioso” podría tener implicaciones importantes en la dinámica de los parásitos y un impacto en las poblaciones de los hospederos. Estas consideraciones permiten establecer la hipótesis de que en estudios poblacionales los individuos más deteriorados nunca son censados, dado que su mala condición los lleva a mayores niveles de morbi/mortalidad.
En Argentina, especialmente en los últimos años, se han realizado estudios coproparasitológicos descriptivos en varias especies de mamíferos (Navone y Merino, 1989; Beldoménico et al., 2005; Ezquiaga et al., 2009; Costa, 2011; Milozzi et al., 2012; Orozco et al., 2013), sin embargo, en el presente trabajo se analiza la fauna parasitaria de una población hospedera (C. vellerosus), teniendo en cuenta la edad, el sexo, talla y peso, evaluando el efecto de la estacionalidad, la cobertura vegetal y el impacto antrópico en la dinámica de la estructura parasitaria, constituyendo la primera vez que se monitorea una población de un dasipódido. El presente estudio permitió conocer la fauna parasitaria que caracteriza a una población hospedera, así como analizar los procesos que determinan la transmisión parasitaria y contribuyen a evaluar la salud de los ecosistemas. La continuidad de estos estudios y su replicación en otros sitios y especies hospederas, permitirán determinar áreas de procedencia en los programas de conservación de especies protegidas.
AgradecimientosLos autores agradecen a L. G. Pagano, P. A. Gado y F. C. Galliari por su ayuda en el campo; a M. T. Ezquiaga por su apoyo en el laboratorio; a S. F. Vizcaíno y a J. C. Fernícola por sus comentarios y aportes al manuscrito. Este estudio fue financiado por la Agencia Nacional de Promociones Científica y Tecnológica (PICT 0143 y PICT 2010-1412), Consejo Nacional de Investigaciones Científicas y Técnicas (PIP 1054), Universidad Nacional de La Plata (N 647 y N 627) y Universidad Nacional de Luján (CDD-CD 281-09).