En este trabajo se presenta el listado florístico, incluyendo las formas de vida de las angiospermas presentes en las sabanas de San Miguel Allende (Campeche) y de Chacho Lugo (Yucatán). Se registraron 142 especies pertenecientes a 96 géneros y 36 familias, siendo las plantas herbáceas las que tienen la forma de vida dominante. El valor Ij obtenido fue de 0.169, lo que demuestra las notables diferencias en la composición florística de cada una de las sabanas, las cuales comparten sólo 24 de las 142 especies registradas. Las características geomorfológicas de cada lugar indican variaciones en la dinámica hidrológica, lo que se refleja en notables variaciones en la composición florística. Así, San Miguel Allende se clasifica como una sabana estacional, caracterizada por la presencia de géneros como Trachypogon y por la escasa presencia de representantes de la familia Cyperaceae; mientras que Chacho Lugo se clasifica como una sabana hiperestacional, donde abundan especies típicas de ambientes más húmedos (Cyperaceae, Eriocaulaceae y Lentibulariaceae). La presencia de endemismos como Echeandia campechiana, E. petenensis y Hampea trilobata, así como la baja presencia de plantas introducidas, muestran la importancia florística y ecológica de estos enclaves tan pobremente estudiados y afectados por las actividades antropogénicas.
In this paper we present the floristic checklist, including life forms of angiosperms from the savannas of San Miguel Allende (Campeche) and Chacho Lugo (Yucatán). We recorded 142 species belonging to 96 genera and 36 families, herbaceous plants being the dominant life form. The Jaccard index value obtained was 0.169, which shows the significant differences in the floristic composition of each savanna, which share only 24 out of the 142 species recorded. The geomorphological characteristics of each site indicate variations in hydrological dynamics, as reflected in significant variations in the floristic composition. San Miguel Allende is classified as a seasonal savanna, characterized by the presence of genus as Trachypogon and the limited presence of taxa of Cyperaceae, while Chacho Lugo is classified as a savanna hiper seasonal, where species from humid environments are abundant (Cyperaceae, Eriocaulaceae and Lentibulariaceae). The presence of endemic as Echeandia campechiana, E. petenensis and Hampea trilobata and the limited presence of introduced plants show the floristic and ecological importance of these sites so poorly studied and highly affected by human activities.
La sabana tropical es el ecosistema más común sobre la tierra, ocupando 20% de la superficie total del planeta (Cole, 1986). Se estima que en la región Neotropical alrededor de 2 millones de km2 se encuentran dominados por este tipo de formación (Mistry, 2000). La sabana puede ser definida como una pradera de gramíneas, sin presencia de árboles o con árboles más o menos dispersos, en donde prevalecen suelos con drenaje deficiente (Miranda y Hernández, 1963; Gómez-Pompa, 1965; Sarukhán, 1968). A pesar de su gran valor ecológico como reservorio de especies de flora y fauna, se estima que aproximadamente el 60% de las sabanas podría haber desaparecido para el año 2100 (Sala et al., 2000) si no se toman medidas oportunas para su conservación. Es por ello, que ahondar en el estudio de este tipo de ecosistemas es de vital importancia para la valoración de aquellas áreas con mayores índices de biodiversidad; estudios que servirán de base para futuras acciones conservacionistas y de manejo del territorio. En México, las sabanas, además de ser ecosistemas importantes de la cubierta vegetal, presentan diferenciaciones florísticas y ecológicas claras respecto de otros tipos de vegetación (Pérez-García y Meave, 2006). Dichos autores mencionan que estas variaciones no han sido adecuadamente estudiadas y son consideradas por muchos investigadores como producto de las actividades antropogénicas sobre la vegetación (Gómez-Pompa, 1978; Leopold, 1990); aunque Miranda (1958) sugirió que no era el caso para las comunidades de la península de Yucatán. Estudios filogenéticos recientes, basados en datos del registro fósil apoyan la idea del origen natural de las sabanas, situando la formación de las mismas en torno al Mioceno, sin embargo, se estima que su distribución sufrió muchas variaciones posteriores, debido a las oscilaciones climáticas del Pleistoceno (Graham y Dilcher, 1995).
En México las sabanas se distribuyen en la vertiente del océano Pacífico, desde Sinaloa hasta Chiapas y en la vertiente del golfo de México, desde Veracruz hasta la península de Yucatán. Las mayores extensiones de este tipo de vegetación se pueden localizar en los estados de Campeche, Tabasco, Chiapas y Veracruz (Rzedowski, 1978; Pennington y Sarukhán, 1998). Los inventarios florísticos realizados en áreas adyacentes a la península de Yucatán, tanto en México como en Centroamérica (Pérez-García et al., 2001; Bridgewater et al., 2002; Laughlin, 2002; Farruggia et al., 2008), han registrado una gran riqueza de especies, además de diferencias en la composición florística de las sabanas del sur de México si se comparan con otras áreas de Sudamérica (Lenthal et al., 1999). Diversos estudios fisonómico florísticos realizados en la península de Yucatán (Miranda, 1958; Flores y Espejel, 1994; Flores et al., 2010) mencionan que estas comunidades están dominadas por gramíneas y ciperáceas, aunque citan pocas especies para dichos taxones, por lo que podría pensarse que presentan una baja riqueza florística. Sin embargo, es en estas comunidades vegetales en donde las familias mencionadas, además de las fabáceas, alcanzan una gran diversificación (Huber et al., 2006). Las 2 sabanas estudiadas en este trabajo cubren una superficie de aproximadamente 396 ha y se ubican en los estados de Campeche y Yucatán (Fig. 1). El primer sitio, conocido como sabana San Miguel Allende, pertenece al municipio de Hopelchén en Campeche; el segundo sitio, denominado sabana Chacho Lugo, está localizado en el municipio de Tekax en Yucatán, y son comunidades en donde se observan claramente los límites entre la vegetación de selva baja y de selva mediana que las circundan.
Las sabanas están asociadas a suelos con drenaje deficiente, por lo que se presentan inundaciones durante la época de lluvias. Sarmiento (1983) propone 4 tipos ecológicos de sabana si se atiende a la estacionalidad de las lluvias: i) sabana semiestacional, presentes, sobre todo, en climas húmedos, con una o 2 estaciones secas cortas; ii) sabana estacional, que se caracteriza por una temporada con suficiente humedad en las capas superiores del suelo, pero sin anegamiento, alternando con otra temporada con un déficit marcado de agua en el suelo; iii) sabanas hiperestacionales, con 2 periodos opuestos, el primero inducido por la sequía y el fuego y el otro por el anegamiento, y finalmente, iv) sabanas pantanosas, donde el exceso de agua está presente durante todo el año. Dado que para los estados de Campeche y Yucatán son escasos los estudios sobre sabanas (Várguez-Vázquez et al., 2012), los objetivos de este trabajo fueron: i) realizar el inventario florístico de las sabanas de San Miguel Allende (Campeche) y Chacho Lugo (Yucatán); ii) analizar las diferencias en la composición florística entre ambas sabanas y iii) clasificar las sabanas en estudio, atendiendo a los criterios establecidos por Sarmiento (1983).
Materiales y métodosÁrea de estudio. Los muestreos se realizaron en 2 sabanas en los estados de Campeche y Yucatán (Fig. 1). El primer sitio, conocido como sabana San Miguel Allende, pertenece al municipio de Hopelchén situado en el estado de Campeche (19°44’39” N, 89°50’40” O, 80 m snm) y cubre una superficie de 45 ha. El segundo sitio, denominado sabana Chacho Lugo, está ubicado en el municipio de Tekax en el estado de Yucatán (19°47’30.20” N, 89°20’04.79” O, 77 m snm), ocupando una superficie total de 351 ha. Los sitios de estudio se encuentran en 2 unidades geomorfológicas diferentes, la sabana de San Miguel Allende se ubica al interior de un extenso valle de origen kárstico, el cual es producto de los procesos de disolución y erosión de rocas calizas, la altitud del valle es de 80 a 90 m snm, las mesetas y colinas que lo limitan se encuentran entre 100 y 150 m snm. Por otra parte, la sabana Chacho Lugo se localiza en el fondo de un valle tectónico kárstico, el cual forma parte de un sistema mayor de valles estructurales de dirección noroeste-sureste. El tipo climático en el primer sitio es Aw1 (x’) (i’) g, cálido subhúmedo, con lluvias en verano, aunque la precipitación en invierno excede el 10% de la precipitación total, tiene poca oscilación térmica y el máximo de temperatura se presenta antes del solsticio de verano. La precipitación total anual en esta sabana varía entre los 1 100 y 1 200 mm. En el segundo sitio, se presenta un clima más seco, del tipo Aw1 (i’) g, cálido subhúmedo, con lluvias en verano, pero con bajo porcentaje de lluvia invernal, poca oscilación térmica y temperatura máxima antes del solsticio de verano (Orellana et al., 2010). La precipitación media anual oscila entre 1 000 y 1 100 mm. Los suelos sobre los que prosperan ambas sabanas son arcillosos, de tipo vertisol, los cuales se desarrollan en terrenos planos y con limitaciones en el movimiento del drenaje superficial. En general, los vertisoles son suelos que se caracterizan por tener un perfil poco diferenciado, sin más estratificación que un horizonte A de gran espesor (68 cm) y con un pH alcalino (7.5-7.9). Localmente los vertisoles son identificados genéricamente como suelos de sabana (chak’an) por ser éste el principal tipo de vegetación que se desarrollan sobre ellos (Duch, 1988).
Recolección y preservación de material botánico y análisis de datos. Con la finalidad de obtener el listado florístico de los sitios de estudio, se llevaron a cabo recorridos mensuales durante un año, de octubre del 2005 a octubre del 2006. De cada ejemplar recolectado se anotó el nombre científico y la forma biológica. El material botánico recolectado fue procesado e identificado y se depositó en el herbario Alfredo Barrera Marín del Campus de Ciencias Biológicas y Agropecuarias de la Universidad Autónoma de Yucatán.
Para la identificación de los ejemplares botánicos se utilizó literatura diversa relativa a trabajos florísticos (Standley y Steyermak, 1946a, 1946b, 1949; Standley y Williams, 1961, 1963, 1967, 1970, 1973, 1975; McVaugh, 1963; Standley et al., 1966; Standley et al., 1969; Standley et al., 1974; Gentry y Standley, 1974; Nash, 1976; Nash y Williams, 1976; Fryxell, 1992; Nee, 1993; Davidse et al., 1994; Diego, 1995; McDonald et al., 1997). La verificación y la actualización de la identidad taxonómica de las especies, géneros y familias registradas se cotejaron en los herbarios UADY y CICY, así como en el sitio web Tropicos ® (2013). El listado sigue el sistema de clasificación de Angiosperm Phylogeny Website (Stevens, 2001), presentándose en orden alfabético por familias y especies dentro de los 2 grupos reconocidos: Monocots y Eudicots (Apéndice). Los nombres de los autores de las especies se presentan según Brummitt y Powell (1992). Para designar las formas de vida se utilizaron las siguientes categorías: herbácea; incluye hierbas graminoides y no graminoides, enredaderas, bejucos y acuáticas; arbórea y arbustiva. Para determinar la riqueza florística se empleó el número total de las especies presentes en ambas sabanas. La comparación de la diversidad entre ambos sitios se hizo mediante un análisis de similitud, para lo que se usó el índice de Jaccard (Krebs, 1999), basado en la presencia- ausencia de las especies estudiadas en cada sabana.
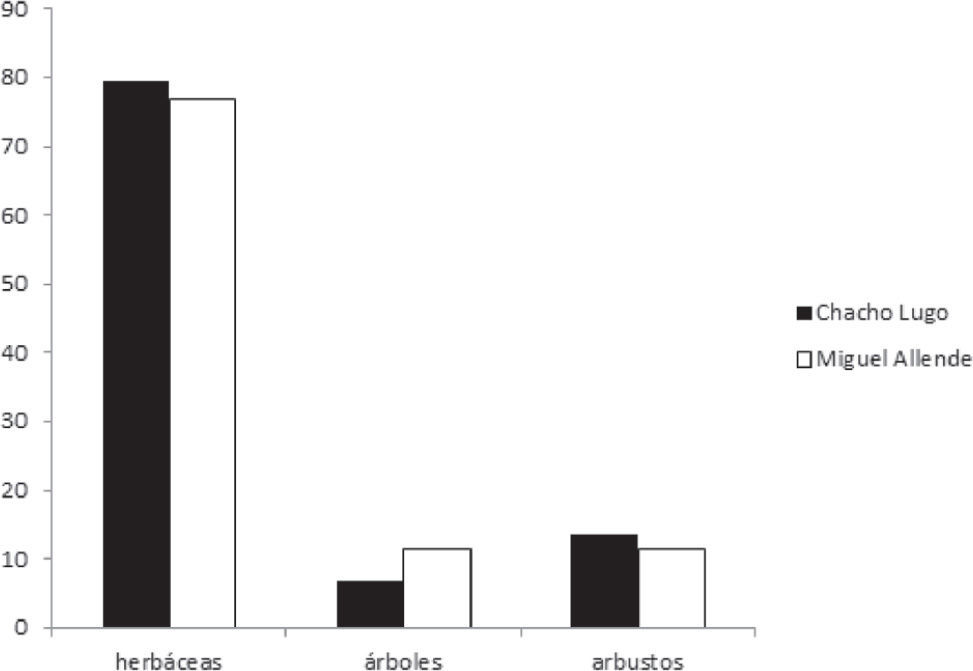
ResultadosPara las 2 sabanas estudiadas se registraron en total 142 especies, 96 géneros y 36 familias de angiospermas (Apéndice); 138 especies se identificaron a nivel de especie y 7 sólo a nivel de género, debido a la presencia de estructuras reproductoras inmaduras y la ausencia de bibliografía especializada pertinente para su correcta identificación. En Chacho Lugo se registraron 88 especies y en Miguel Allende 78. Solamente 24 de las 142 especies son comunes a ambos sitios. La familia mejor representada a nivel genérico fue Poaceae (18), seguida de Fabaceae (16), Malvaceae (6), Euphorbiaceae (5), Cyperaceae (4) y Convulvulaceae (3), aportando en conjunto 51.04% del total de los géneros encontrados en las 2 áreas de estudio (Fig. 2). Asimismo, la familia Poaceae es la que mayor número de especies presenta (34), seguida por Fabaceae (19), Cyperaceae (9), Convolvulaceae (10) y Malvaceae (8) (Fig. 3), representando 56.34% del total de las especies encontradas en las sabanas estudiadas. Los géneros con mayor número de especies registradas fueron Paspalum (6), Chamaecrista (4), Evolvolus (4), Solanum (4), Cyperus (3) y Rhynchospora (3). El análisis de la composición florística de ambas sabanas muestra diferencias notables a nivel de familia, compartiéndose solamente 54.1% de las mismas. Las familias Asteraceae (Calea jamaicensis, Pectis elongata, Vernonia ctenophora, Wedelia trilobata), Bignoniaceae (Crescentia cujete), Eriocaulaceae (Eriocaulon bilobatum), Gentianaceae (Schultesia guianensis), Iridaceae (Cipura campanulata), Lentibulariaceae (Utricularia subulata), Loganiaceae (Spigelia polystachya), Olacaceae (Schoepfia schreberi), Onagraceae (Jussiaea decurrens) Primulaceae (Bonellia albiflora) y Santalaceae (Phoradendron wattii) sólo están presentes en la sabana Chacho Lugo. Por otra parte, las familias Apocynaceae (Asclepias woodsoniana y Asclepias sp.), Bixaceae (Cochlospermum vitifolium), Orobanchaceae (Buchnera pusilla) y Polygonaceae (Coccoloba barbadensis) se registraron únicamente en la sabana Miguel Allende. Solamente 33.33% de los géneros y 16.90% de las especies son compartidas por ambos sitios de estudio. Los géneros comunes a ambas sabanas se ubican dentro de las familias más diversas como, por ejemplo, Convolvulaceae (Evolvolus, Ipomoea, Merremia), Cyperaceae (Rhynchospora), Euphorbiaceae (Euphorbia), Fabaceae (Bauhinia, Chamaecrista, Mimosa), Malvaceae (Melochia, Waltheria) y Poaceae (Aristida, Hyparrhenia, Imperata, Panicum, Paspalum, Schizachyrium, Setaria, Urochloa). Entre las especies que se comparten pueden citarse a Curculigo scorzonerifolia (Hypoxidaceae), Schwenckia americana (Solanaceae), Piriqueta cistoides (Passifloraceae), Lantana camara (Verbenaceae) e Hybanthus oppositifolius (Violaceae), entre otras. El valor Ij obtenido fue de 0.169 (Cuadro 1). Las plantas herbáceas fueron las más abundantes en ambos sitios estudiados, representando 79.58% del total de las especies registradas, seguidas por los arbustos (12.68%) y los árboles (7.45%). Al realizar el análisis comparativo de las sabanas, se observa que el porcentaje de especies que representan las herbáceas en Chacho Lugo y Miguel Allende fue de 85.23 y 76.92%, respectivamente; en el caso de los árboles 6.81 y 10.25%, y para los arbustos 11.36 y 11.53%, respectivamente (Fig. 4).
El inventario florístico de las sabanas estudiadas, ha permitido contar con mayor información sobre este tipo de vegetación en la península de Yucatán, poniendo de manifiesto la gran riqueza vegetal presente en estas sabanas, y destaca la importancia de estudiar más detalladamente este tipo ecosistemas. Los resultados obtenidos muestran la existencia de elementos comunes entre las sabanas de Chacho Lugo y Miguel Allende con los de otras sabanas neotropicales estudiadas por diversos autores (Samek, 1973; Sarmiento y Monasterio, 1975; Medina y Silva, 1990), destacando Byrsonima crassifolia y C. cujete como especies indicadoras de este tipo de ecosistemas (Lenthal et al., 1999).
En las 2 sabanas estudiadas las familias botánicas más diversas fueron Poaceae y Fabaceae, lo que es consistente con lo registrado para otras sabanas neotropicales por otros autores (Rippstein et al., 2001; Pérez-García et al., 2001; Huber et al., 2006; López-Olmedo et al., 2006). Las Cyperaceae y Asteraceae han sido mencionadas entre las familias con mayor número de especies en las sabanas de Belice (Goodwin et al., 2013) y aunque presentes en los sitios estudiados, fueron relativamente menos ricas. Es importante hacer notar que la sabana Chacho Lugo por sus condiciones topográficas particulares de anegamiento temporal favoreció una mayor presencia de especies de Cyperaceae. Las sabanas también incluyen algunos grupos que son exclusivos de estas comunidades vegetales como lo son: Rhynchospora, Scleria, Utricularia, Eleocharis, Chamaecrista, Fimbristylis y Polygala y que son característicos en otras regiones de México, Centro y Sudamérica (Puig, 1972; Pérez-García et al., 2001; Bridgewater et al., 2002; López-Olmedo et al., 2006; Parra, 2006).
La presencia de las Pteridophyta y las familias Bromeliaceae, Orchidaceae y Melastomataceae se han mencionado en numerosos trabajos de sabanas neotropicales (Pérez-García et al., 2001; Bridgewater et al., 2002; Laughlin, 2002; Farruggia et al., 2008; Goodwin et al., 2013), sin embargo, no estuvieron presentes en los sitos de estudio. La ausencia de representantes de los 3 primeros taxa podría explicarse por la relativa poca abundancia de árboles hospederos para las epífitas, así como por el fuego. En nuestros viajes de campo hubo indicios de quema durante la temporada de sequía y en la época de lluvia se observó que los escasos árboles tenían cortezas gruesas y quemadas, haciendo de las mismas un ambiente poco favorable para las epífitas. Cabe mencionar que en otras 2 sabanas de Campeche en las que no hubo evidencia de fuego fueron registradas 3 epífitas de las familias Bromeliaceae, Orchidaceae y Piperaceae (Várguez-Vázquez et al., 2012). La ausencia de Melastomataceae en las 2 localidades muestreadas, así como en las sabanas citadas anteriormente de Campeche (Várguez-Vázquez et al., 2012), quizás se deba a que esta familia ocurre principalmente en ambientes mésicos, frescos y en suelos profundos más ricos en nutrientes. Así lo sugieren los trabajos de Puig (1972) en Tabasco y Goodwin et al. (2013) en Belice, en los que se menciona a la familia Melastomataceae con una alta diversidad de especies.
El valor de Ij obtenido (0.169) muestra la disimilitud existente entre ambas sabanas, las cuales comparten únicamente 24 de las 142 especies registradas. Esta situación también se presenta en otro par de sabanas en el estado de Campeche (Várguez-Vázquez et al., 2012) y al igual que en nuestro caso, posiblemente obedezca a que dichas sabanas se localizan en unidades geomorfológicas distintas, lo que implicaría variaciones en la dinámica hidrológica y, por tanto, en la composición florística particular. La sabana San Miguel Allende se ubica al interior de un gran valle de origen kárstico, lo que favorece la escorrentía en la época de lluvias; sin embargo, la de Chacho Lugo se encuentra ubicada el fondo de un valle, formando parte de un sistema mayor de valles estructurales, lo que facilita el estancamiento del agua en el periodo de lluvias. Por tanto, si atendemos a la clasificación de sabanas propuesta por Sarmiento (1983), San Miguel Allende se ubica dentro de las sabanas estacionales, por presentar un periodo de estrés hídrico en la época de secas seguido de un periodo húmedo sin anegamiento del terreno dadas las buenas condiciones de drenaje. La presencia exclusiva en esta sabana de Trachypogon es indicadora del buen drenaje del terreno (Beard, 1953), en tanto que la escasa presencia de especies de la familia Cyperaceae en Miguel Allende, solamente Rhynchospora nervosa subsp. nervosa, es otro claro indicio de la falta de zonas encharcadas en este sitio. Por el contrario, en el caso de la sabana de Chacho Lugo, las condiciones geomorfológicas condicionan un periodo de anoxia por anegamiento de los terrenos durante la época de lluvias, siendo caracterizada como una sabana hiperestacional, según la clasificación de Sarmiento (1983). La presencia exclusiva de especies de la familia Cyperaceae (Cyperus aggregatus, C. amabilis, C. ochraceus, Eleocharis minima, E. mitrata, Rhynchospora cephalotes y R. holoschoenoides), y la presencia de Dalbergia glabra ha sido también registrada para este tipo sabanas (Sarmiento, 1983). Asimismo, la presencia de U. subulata (Lentibulariaceae) especie insectívora propia de ambientes húmedos, apoya la categoría de sabana seleccionada.
La dominancia de especies nativas, además de la presencia de especies endémicas de la península de Yucatán (E. campechiana en Chacho Lugo y E. petenensis y H. trilobata en San Miguel Allende) son evidencias que apoyan la condición primaria de estas formaciones vegetales (Miranda, 1958). Otro indicio que apoya la idea del origen natural de las 2 sabanas estudiadas, es el hecho de su gran semejanza florística con otras comunidades neotropicales no antropogénicas, en las que Paspalum plicatulum y Trachypogon spicatus también son importantes (Bridgewater et al., 2002; Laughlin, 2002; López-Olmedo et al., 2006; Farruggia et al., 2008). La presencia de especies exóticas como Hyparrhenia rufa y Mnesithea granularis es un indicio de que ambos lugares están siendo sometidos a actividades antrópicas (Pennington et al., 2006), sin embargo, se piensa que su introducción ha sido de manera espontánea, pues los sitios de estudio son tangencialmente cortados por vías terrestres que comunican los poblados cercanos.
Los resultados obtenidos en este trabajo, muestran que las sabanas en esta región del SE de México presentan una flora muy variada y estructurada en 2 tipos de sabanas: estacional e hiperestacional. La mayoría de las especies presentes en los sitios estudiados son nativas y de amplia afinidad meridional Neotropical, poniendo de manifiesto el valor ecológico de estos lugares y la importancia de profundizar en el estudio de este tipo de ecosistemas. Lo anterior, permitirá contar con información valiosa y útil para la toma de decisiones sobre futuras acciones relativas a la conservación y el manejo adecuado de estas comunidades vegetales, ecológicamente infravaloradas y severamente afectadas por las actividades humanas.
AgradecimientosA la familia Kú Góngora del poblado de Bekanchén, Yucatán, quienes muy amablemente brindaron hospedaje y alimentación a los autores durante los viajes de campo. Este trabajo fue financiado por la SEP (Secretaría de Educación Pública) y el Promep (Programa para el Desarrollo Profesional Docente), mediante el proyecto “Fortalecimiento del Cuerpo Académico Diversidad de los Recursos Florísticos de Mesoamérica” (UADY-CA- 94) y al Gobierno de México por medio de la Secretaría de Relaciones Exteriores, por la beca posdoctoral otorgada al tercer autor.
| Taxa | Chacho Lugo | Miguel Allende |
|---|---|---|
| Monocots | ||
| Anthericaceae | ||
| Echeandia campechiana Cruden, J. J. Ortiz, C. Várguez y J. Tún, 2860, Hb | X | |
| Echeandia petenensis Cruden, J. J. Ortiz y I. Miranda, 2120, 2278, Hb | X | |
| Cyperaceae | ||
| Cyperus aggregatus (Willd.) Endl., J. J. Ortiz y R. Alfaro, 2153, Hb | X | |
| Cyperus amabilis Vahl, J. J. Ortiz y R. Alfaro, 2166, Hb | X | |
| Cyperus ochraceus Vahl, J. J. Ortiz y R. Alfaro, 2401, Hb | X | |
| Eleocharis minima Kunth, J. J. Ortiz y R. Alfaro, 2143, 2171, 2353, 2354, 2368, Hb | X | |
| Eleocharis mitrata Franch. y Sav. ex Makino, J. J. Ortiz y R. Alfaro, 2151, Hb | X | |
| Rhynchospora cephalotes (L.) Vahl, J. J. Ortiz y M. Magaña, 2327, Hb | X | |
| Rhynchospora holoschoenoides (Rich.) Herter, J. J. Ortiz y M. Magaña, 2150, 2159, 2340, Hb | X | |
| Rhynchospora nervosa (Vahl) Boeckeler ssp. nervosa, J. J. Ortiz y R. Alfaro, 2147; J. J. Ortiz | X | X |
| y I. Miranda, 2314, Hb | ||
| Scleria eggersiana Boeckeler, J. J. Ortiz y M. Magaña, 2157, 2168, 2330, Hb | X | |
| Eriocaulaceae | ||
| Eriocaulon bilobatum Morong, J. J. Ortiz y R. Alfaro, 2344, 2355, 2361, Hb | X | |
| Hypoxidaceae | ||
| Curculigo scorzonerifolia (Lam.) Baker, J. J. Ortiz y I. Miranda, 2276; J. J. Ortiz y R. Alfaro, | X | X |
| 2400, Hb | ||
| Iridaceae | ||
| Cipura campanulata Ravenna, J. J. Ortiz y R. Alfaro, 2144, Hb | X | |
| Poaceae | ||
| Andropogon glomeratus (Walter) Britton, Sterns y Poggenb., J. J. Ortiz y R. Alfaro, 2169; J. | X | |
| J. Ortiz, 390, Hb | ||
| Andropogon selloanus (Hack.) Hack., J. J. Ortiz y R. Alfaro, 2174, 2405, Hb | X | |
| Andropogon virginicus L., J. J. Ortiz y R. Alfaro, 2158, 2170, Hb | X | |
| Aristida appressa Vasey, J. J. Ortiz y I. Miranda, 662, 2140, 2307, Hb | X | |
| Aristida tincta Trin. y Rupr., J. J. Ortiz y I. Miranda, 393, 2300; J. J. Ortiz y L. Dzib, 2907, | X | |
| Hb | ||
| Bouteloua repens (Kunth) Scribn. y Merr., J. J. Ortiz y I. Miranda, 2128, 2305, Hb | X | |
| Bouteloua triaena (Trin. ex Spreng.) Scribn., J. J. Ortiz I. Miranda, 606, 2302, 2306, Hb | X | |
| Digitaria cayoensis Swallen, J. J. Ortiz y I. Miranda, 2289, Hb | X | |
| Digitaria sp., J. J. Ortiz y I. Miranda, 2320, Hb | X | |
| Heteropogon contortus (L.) P. Beauv. ex Roem. y Schult., J. J. Ortiz y I. Miranda, 297, 607, | X | |
| 2132, 2277, 2295, 2297, Hb | ||
| Hyparrhenia rufa (Nees) Stapf, J. J. Ortiz y A. España, 2396 ; J. J. Ortiz y R. Alfaro, 2366, | X | X |
| 2887, Hb | ||
| Imperata brasiliensis Trin., J. J. Ortiz, 2408; J. J. Ortiz y R. Alfaro, 2404, Hb | X | X |
| Lasiacis rugelii (Griseb.) Hitchc., J. J. Ortiz y M. Magaña, 2322, Hb | X | |
| Lasiacis ruscifolia (Kunth) Hitchc., J. J. Ortiz y M. Magaña, 2323, Hb | X | |
| Leptochloa virgata (L.) P. Beauv., J. J. Ortiz y R. Alfaro, 2155, Hb | X | |
| Mnesithea granularis (L.) de Koning y Sosef, J. J. Ortiz y I. Miranda, 610, 2285, Hb | X | |
| Panicum ghiesbreghtii E. Fourn., J. J. Ortiz y I. Miranda, 2298, Hb | X | |
| Paspalum caespitosum Flüggé, J. J. Ortiz y R. Alfaro, 2148, Hb | X | |
| Paspalum clavuliferum C. Wright, J. J. Ortiz y I. Miranda, 2288, Hb | X | |
| Paspalum coryphaeum Trin., J. J. Ortiz y I. Miranda, 2308; J. J. Ortiz y M. Magaña, 2332, | X | X |
| Hb | ||
| Paspalum plicatulum Michx., J. J. Ortiz y I. Miranda, 395, 609, 653, 2133, 2296; J. J. Ortiz y | X | X |
| R. Alfaro, 2146, 2154, Hb | ||
| Paspalum virgatum L., J. J. Ortiz, 392; J. J. Ortiz y M. Magaña, 2331, Hb | X | |
| Paspalum sp., J. J. Ortiz y M. Magaña, 2326, Hb | X | |
| Schizachyrium brevifolium (Sw.) Nees ex Büse, J. J. Ortiz y L. Dzib, 2905, Hb | X | |
| Schizachyrium microstachyum (Desv. ex Ham.) Roseng., B.R. Arrill. y Izag., J. J. Ortiz y I. | X | |
| Miranda, 2303, Hb | ||
| Schizachyrium sanguineum (Retz.) Alston, J. J. Ortiz y I. Miranda, 2304; J. J. Ortiz y L. Dzib, | X | X |
| 2910, Hb | ||
| Setaria parviflora (Poir.) Kerguélen, J. J. Ortiz, 2279; J. J. Ortiz y R. Alfaro, 2161; J. J. Ortiz | X | X |
| y I. Miranda, 2122, Hb | ||
| Setaria tenax (Rich.) Desv. var. tenax, J. J. Ortiz, 2142; J. J. Ortiz, C. Várguez y J. Tún, | X | X |
| 2859, Hb | ||
| Sorghastrum setosum (Griseb.) Hitchc., J. J. Ortiz y M. Magaña, 2160, 2167, 2333, Hb | X | |
| Sporobolus jacquemontii Kunth, J. J. Ortiz y I. Miranda, 2299, Hb | X | |
| Steinchisma laxa (Sw.) Zuloaga, J. J. Ortiz y M. Magaña, 2324, Hb | X | |
| Trachypogon spicatus (L. f.) Kuntze, J. J. Ortiz, 2407; J. J. Ortiz y I. Miranda, 2141, Hb | X | |
| Urochloafusca (Sw.) B. F. Hansen y Wunderlin, J. J. Ortiz, C. Várguez y J. Tun, 2858,) | X | |
| Urochloa mollis (Sw.) Morrone y Zuloaga, J. J. Ortiz y I. Miranda, 2287; J. J. Ortiz y M. | X | |
| Magaña, 2334, Hb | ||
| Eudicots | ||
| Apocynaceae | ||
| Asclepias woodsoniana Standl. y Steyerm., J. J. Ortiz y I. Miranda, 2144, Hb | X | |
| Asclepias sp., J. J. Ortiz y I. Miranda, 2301, Hb | X | |
| Asteraceae | ||
| Calea jamaicensis (L.) L., J. J. Ortiz y R. Alfaro, 2162, Hb | X | |
| Lepidaploa uniflora (Mill.) H. Rob., J. J. Ortiz y L. Dzib, 2884, Ab | X | |
| Pectis elongata Kunth, J. J. Ortiz y L. Dzib, 2899, Hb | X | |
| Sphagneticola trilobata (L.) Pruski, J. J. Ortiz et al., 2544; J. J. Ortiz y M. Magaña, 2328, Hb | X | |
| Bignoniaceae | ||
| Crescentia cujete L., J. J. Ortiz y R. Alfaro, 2398, Ar | X | |
| Bixaceae | ||
| Cochlospermum vitifolium (Willd.) Spreng., J. J. Ortiz y A. España, 2369, Ar | X | |
| Boraginaceae | ||
| Heliotropium procumbens Mill., J. J. Ortiz y L. Dzib, 2909, Hb | X | |
| Heliotropium ternatum Vahl, J. J. Ortiz, 2138, Hb | X | |
| Convolvulaceae | ||
| Evolvulus alsinoides (L.) L., J. J. Ortiz y I. Miranda, 2286, Hb | X | |
| Evolvulus nummularius (L.) L., J. J. Ortiz y I. Miranda, 2131, 2312, 2286, 2321; J. J. Ortiz y | X | X |
| R. Alfaro, 2357, 2908, Hb | ||
| Evolvulus sericeus Sw., J. J. Ortiz, 612, 2410, Hb | X | |
| Evolvulus sp., J. J. Ortiz y M. Magaña, 2343, Hb | X | |
| Operculina pinnatifida (Kunth) G. Don, J. J. Ortiz y I. Miranda, 2293, Hb | X | |
| Ipomoea triloba L., J. J. Ortiz y L. Dzib, 2895, Hb | X | |
| Jacquemontia pentantha (Jacq.) G. Don., J. J. Ortiz y L. Dzib, 2894, Hb | X | |
| Jacquemontia tamnifolia (L.) Griseb., J. J. Ortiz y L. Dzib, 2877, Hb | X | |
| Merremia dissecta (Jacq.) Hallier f., J. J. Ortiz y I. Miranda, 2121, Hb | X | |
| Merremia quinquefolia (L.) Hallier f., J. J. Ortiz, 2416; J. J. Ortiz y L. Dzib, 2893, Hb | X | |
| Euphorbiaceae | ||
| Croton argenteus L., J. J. Ortiz y I. Miranda, 2312, Hb | X | |
| Croton sp., J. J. Ortiz y A. España, 2371, Ab | X | |
| Dalechampia scandens L., J. J. Ortiz, 2383, Hb | X | |
| Euphorbia hypericifolia L., J. J. Ortiz, 2393, Hb | X | |
| Euphorbia thymifolia L., J. J. Ortiz y I. Miranda, 2317; J. J. Ortiz y L. Dzib, 2890, Hb | X | X |
| Tragia yucatanensis Millsp., J. J. Ortiz, 2382, Hb | X | |
| Fabaceae | ||
| Bauhinia ungulata L., J. J. Ortiz, 2375; J. J. Ortiz y L. Dzib, 2897, Ab | X | X |
| Calliandra houstoniana (Mill.) Standl., J. J. Ortiz, 2379, Ab | X | |
| Centrosema angustifolium (Kunth) Benth., J. J. Ortiz, 2388, 2395, Hb | X | |
| Chamaecrista flexuosa (L.) Greene, J. J. Ortiz, 657, 2413, Hb | X | |
| Chamaecrista nictitans (L.) Moench, J. J. Ortiz y L. Dzib, 2891, Hb | X | |
| Chamaecrista pilosa (L.) Greene, J. J. Ortiz y M. Magaña, 2329, Hb | X | |
| Chamaecrista serpens (L.) Greene, J. J. Ortiz y I. Miranda, 2315, 2126, Hb | X | |
| Dalbergia glabra (Mill.) Standl., J. J. Ortiz y M. Magaña, 2156, 2338, Ab | X | |
| Desmanthus virgatus (L.) Willd., J. J. Ortiz, C. Várguez y J. Tún, 2862, Hb | X | |
| Galactia sp., J. J. Ortiz, 2392, Hb | X | |
| Indigofera lespedezioides Kunth, J. J. Ortiz, 256, 2412, Hb | X | |
| Lysiloma acapulcense (Kunth) Benth., J. J. Ortiz, 2370, Ar | X | |
| Mimosa albida Humb. y Bonpl. ex Willd., J. J. Ortiz, 656, 2378; J. J. Ortiz y L. Dzib, 2900, | X | X |
| Hb | ||
| Neptunia plena (L.) Benth., J. J. Ortiz y I. Miranda, 2319; J. J. Ortiz, 2409, Hb | X | |
| Pithecellobium lanceolatum (Humb. y Bonpl. ex Willd.) Benth., J. J. Ortiz y L. Dzib, 2903, | X | |
| Ar | ||
| Senna obtusifolia (L.) H. S. Irwin y Barneby, J. J. Ortiz y L. Dzib, 2898, Ab | X | |
| Senna pallida (Vahl) H. S. Irwin y Barneby, J. J. Ortiz, 2391, Ar | X | |
| Tephrosia cinerea L. (Pers.) J. J. Ortiz, 2411, 2415, Hb | X | |
| Zornia gemella Vogel, J. J. Ortiz y I. Miranda, 2316, Hb | X | |
| Gentianaceae | ||
| Schultesia guianensis (Aubl.) Malme, J. J. Ortiz y R. Alfaro, 2356, Hb | X | |
| Lamiaceae | ||
| Hyptis spicigera Lam., J. J. Ortiz y L. Dzib, 2879, Hb | X | |
| Hyptis suaveolens (L.) Poit., J. J. Ortiz, 2417, Hb | X | |
| Lentibulariaceae | ||
| Utricularia subulata L., J. J. Ortiz y R. Alfaro, 2352, Hb | X | |
| Loganiaceae | ||
| Spigelia polystachya Klotzsch ex Progel, J. J. Ortiz et al., 2543, Hb | X | |
| Malpighiaceae | ||
| Byrsonima crassifolia (L.) Kunth, J. J. Ortiz y R. Alfaro, 2406; J. J. Ortiz, 2417, Ar | X | X |
| Stigmaphyllon ellipticum (Kunth) A. Juss., J. J. Ortiz y R. Alfaro, 2360, Hb | X | |
| Tetrapterys seleriana Nied., J. J. Ortiz y L. Dzib, 2878, Hb | X | |
| Malvaceae | ||
| Ayenia pusilla L., J. J. Ortiz, 2384, Hb | X | |
| Hampea trilobata Standl., J. J. Ortiz y A. España, 2377, Ar | X | |
| Helicteres guazumifolia Kunth, J. J. Ortiz y M. Magaña, 2337, Ab | X | |
| Melochia tomentosa L., J. J. Ortiz y L. Dzib, 2880, Hb | X | |
| Melochia villosa (Mill.) Fawc. y Rendle, J. J. Ortiz, 2394; J. J. Ortiz y M. Magaña, 2339, | X | X |
| 2397, 2364, Hb | ||
| Sida ciliaris L., J. J. Ortiz y I. Miranda, 2129, 2313, Hb | X | |
| Sida linifolia Cav., J. J. Ortiz y I. Miranda, 658, 2282, 2124; J. J. Ortiz y L. Dzib, 2882, Hb | X | X |
| Waltheria indica L., J. J. Ortiz y R. Alfaro, 2365, 2904; J. J. Ortiz y A. España, 2139, 2372, | X | X |
| Hb | ||
| Myrtaceae | ||
| Psidium guineense Sw., J. J. Ortiz, 2125; J. J. Ortiz y R. Alfaro, 2484; J. J. Ortiz y M. | X | X |
| Magaña, 2149, 2336, Ar | ||
| Psidium salutare (Kunth) O. Berg, J. J. Ortiz y I. Miranda, 2290, Ar | X | |
| Olacaceae | ||
| Schoepfia schreberi J. F. Gmel., J. J. Ortiz y R. Alfaro, 2477, Ab | X | |
| Onagraceae | ||
| Ludwigia decurrens Walter, J. J. Ortiz y R. Alfaro, 2164, 2362, Hb | X | |
| Orobanchaceae | ||
| Buchnera pusilla Kunth, J. J. Ortiz, 613, 2123, 2284, 2390, Hb | X | |
| Oxalidaceae | ||
| Oxalis corniculata L., J. J. Ortiz y L. Dzib, 2911, Ab | X | |
| Oxalis frutescens L., J. J. Ortiz y I. Miranda, 2294, 2310, Ab | X | |
| Passifloraceae | ||
| Passiflora foetida L., J. J. Ortiz y I. Miranda, 2291, 2292, Hb | X | |
| Passiflora palmeri Rose, J. J. Ortiz y L. Dzib, 2896, Hb | X | |
| Piriqueta cistoides (L.) Griseb., J. J. Ortiz y R. Alfaro, 2359, 2901; J. J. Ortiz, 615, 2137, | X | X |
| 2387, Hb | ||
| Turnera diffusa Willd. ex Schult., J. J. Ortiz, 2373, 2414, 2129, Ab | X | |
| Plantaginaceae | ||
| Bacopa lacertosa Pennell ex. Standl., J. J. Ortiz y R. Alfaro, 2367, Hb | X | |
| Stemodia durantifolia (L.) Sw., J. J. Ortiz, 2380, Hb | X | |
| Polygalaceae | ||
| Polygala leptocaulis Torr. y A. Gray, J. J. Ortiz y R. Alfaro, 2152, 2358, 2892, Hb | X | |
| Polygala violacea Aubl., J. J. Ortiz y L. Dzib, 2888; J. J. Ortiz y I. Miranda, 614, 661, 2283, | X | X |
| 2318, 2389, Hb | ||
| Polygonaceae | ||
| Coccoloba barbadensis Jacq., J. J. Ortiz, 396, 2130, Ar | X | |
| Primulaceae | ||
| Bonellia albiflora (Lundell) B. Sthål y Källersjö, J. J. Ortiz y M. Magaña, 2342, Ab | X | |
| Rubiaceae | ||
| Diodella teres (Walter) Small, J. J. Ortiz y L. Dzib, 2885, Hb | X | |
| Morinda royoc L., J. J. Ortiz y L. Dzib, 2881; J. J. Ortiz y R. Alfaro, 2487, Hb | X | |
| Randia aculeata L., J. J. Ortiz y A. España, 2374, Ab | X | |
| Spermacoce tenuior L., J. J. Ortiz y I. Miranda, 2135, 2309, Hb | X | |
| Salicaceae | ||
| Xylosma flexuosa (Kunth) Hemsl., J. J. Ortiz y A. España, 2376; J. J. Ortiz y L. Dzib, 2886, | X | X |
| Ab | ||
| Santalaceae | ||
| Phoradendron wattii Krug y Urb., J. J. Ortiz y R. Alfaro, 2479, Hb | X | |
| Solanaceae | ||
| Schwenckia americana L., J. J. Ortiz y I. Miranda, 2136; J. J. Ortiz y L. Dzib, 2906, Hb | X | X |
| Solanum donianum Walp., J. J. Ortiz y M. Magaña, 2335, Ab | X | |
| Solanum erianthum D. Don, J. J. Ortiz y L. Dzib, 2902, Hb | X | |
| Solanum hirtum Vahl, J. J. Ortiz y I. Miranda, 2280, Ab | X | |
| Solanum sp., J. J. Ortiz y I. Miranda, 2386, Ab | X | |
| Verbenaceae | ||
| Lantana camara L., J. J. Ortiz y I. Miranda, 2134; J. J. Ortiz y M. Magaña, 2341, 2345, Ab | X | X |
| Lantana trifolia L., J. J. Ortiz y I. Miranda, 2281, Ab | X | |
| Stachytarpheta angustifolia (Mill.) Vahl, J. J. Ortiz y R. Alfaro, 2351, 2876, Hb | X | |
| Stachytarpheta jamaicensis (L.) Vahl, J. J. Ortiz y M. Magaña, 2325, Hb | X | |
| Violaceae | ||
| Hybanthus oppositifolius (L.) Taub., J. J. Ortiz y I. Miranda, 2127, 2311; J. J. Ortiz y R. | X | X |
| Alfaro, 2165, 2889, Hb |