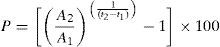El conocimiento del estado de fragmentación y transformación de un paisaje boscoso es crucial para una adecuada planificación y conservación de la biodiversidad. En Chile se encuentra uno de los hotspots mundiales de biodiversidad; dentro de este, se encuentra la cordillera de Nahuelbuta, la cual es considerada como un área de alto valor de biodiversidad y de intensa presión antrópica. A pesar de ello, no se cuenta con información precisa sobre el grado de transformación de su paisaje y su estado de conservación. El objetivo de este trabajo fue evaluar el estado del paisaje y los cambios espacio-temporales de los bosques nativos en dicha cordillera. A partir de imágenes Landsat de los años 1986 y 2011, se generaron mapas temáticos de usos del suelo. Se observó una pérdida de bosque nativo del 33% en 25 años asociada principalmente a la sustitución por plantaciones forestales. Los cambios en los patrones espaciales de las coberturas y usos del suelo revelan una profunda transformación del paisaje y una fragmentación avanzada de los bosques nativos. Se discute como estos patrones de cambio amenazan la persistencia de diversas especies endémicas con alto riesgo de extinción. De continuar estos procesos antrópicos, estas especies podrían enfrentar un aumento en su riesgo de extinción.
The understanding of the degree of forest fragmentation and landscape transformation is crucial for landscape sustainability and biodiversity conservation. Within the Chilean hotspot the Nahuelbuta Mountain can be found, which is considered as a high biodiversity value area under an intense human pressure. However, there is no information on the degree of transformation of the landscape and the conservation status of its natural forest ecosystems. The aim of this study was to evaluate the state of the landscape and the spatiotemporal changes in native forests in Nahuelbuta. Through the use of Landsat imagery acquired for 1986 and 2011, land-cover and use maps were generated. Results revealed a loss of 33% of native forest in 25 years, mainly associated with the conversion to forest plantations. Changes in spatial patterns of land-cover and uses revealed a profound transformation of the study landscape and an advanced fragmentation of native forests. We discuss how these changes threaten the persistence of different endemic species at high risk of extinction. If the current trend of spatial pattern changes continues, it is probable that these species might face an increase in their extinction risk.
El estado de transformación de un paisaje boscoso se caracteriza por el grado de destrucción y modificación del hábitat, la tasa de deforestación, los patrones de fragmentación de bosques naturales y los cambios en la matriz (Echeverría, Newton, Nahuelhual, Coomes y Rey-Benayas, 2012; McIntyre y Hobbs, 1999). En este sentido, se pueden encontrar paisajes poco modificados, con baja tasa de deforestación, y áreas extensas y bien conectadas de bosques nativos (Echeverría et al., 2012), o paisajes altamente fragmentados y modificados, donde la cobertura boscosa ocupa una reducida área del paisaje, con fragmentos de hábitat dispersos, aislados y sin conectividad, y una matriz compuesta por usos antrópicos (Echeverría et al., 2006; Steininger et al., 2001). El conocimiento del estado de transformación de un paisaje es un antecedente crucial para una adecuada planificación, manejo y restauración del paisaje, ya que indican el grado de integridad o funcionalidad de estos y los principales atributos que requieren ser mantenidos o mejorados para la conservación de la biodiversidad y el bienestar humano (Liu y Taylor, 2002). Estos antecedentes son especialmente importantes en paisajes con alta diversidad y endemismos de especies de flora y fauna, pero con pérdidas substanciales de hábitats boscosos (Steininger et al., 2001).
La fragmentación de bosques naturales es una de las principales causas de pérdida de biodiversidad en el mundo (Turner, 1996). Los principales efectos de la fragmentación a nivel de paisaje son la reducción del tamaño y calidad del hábitat boscoso, el aumento de borde y número de parches, y la pérdida de conectividad (Forman y Godron, 1986; Lindenmayer y Fischer, 2006). El borde de un parche en el paisaje es definido como la zona de transición entre hábitats, y su percepción varía dependiendo del observador, organismo o variable estudiada (López-Barrera, 2004). Los fragmentos boscosos pueden llegar a tener bordes suaves o abruptos, dependiendo del grado de contraste entre hábitats, lo cual desempeña un papel crítico en la capacidad de las especies de adaptarse y moverse dentro de hábitats perturbados, la capacidad de recuperación del bosque y la penetración de los efectos de borde que originan un deterioro en la calidad del hábitat en regresión (Bennett, 1999; Lindenmayer y Fischer, 2006; Peyras, Vespa, Bellocq y Zurita, 2013). La reducción del tamaño de los fragmentos boscosos genera cambios en la composición y estructura a nivel de comunidades (Echeverría, Newton, Lara, Rey-Benayas y Coomes, 2007; Tabarelli, Mantovani y Peres, 1999), modificando las dinámicas poblacionales y diversos procesos ecológicos (Laurance et al., 2002; Wiegand, Revilla y Moloney, 2005) que, junto al aislamiento y la disminución de la conectividad funcional, tienen efectos negativos sobre la persistencia de poblaciones de especies (Crooks, Burdett, Theobald, Rondinini y Boitani, 2011; Lindenmayer y Fischer, 2006). Se ha constatado que la continua fragmentación y pérdida de bosques tropicales y templados han afectado la riqueza y estructura del bosque, la abundancia y diversidad de aves, el ensamble de comunidades de insectos y la persistencia de poblaciones de mamíferos, entre otros (Barbosa y Marquet, 2002; Castelletta, Thiollay y Sodhi, 2005; De Angelo, Paviolo y di Bitetti, 2011; Echeverría et al., 2007; Stratford y Stouffer, 2015).
Los hotspot son regiones con prioridad mundial para la conservación por su alto grado de endemismo y fuerte impacto antrópico; cifras alarmantes señalan que más del 85% del hábitat original presente en los hotspot ha sido destruido (Mittermeier, Turner, Larsen, Brooks y Gascon, 2011). En la actualidad se han definido 35 hotspots, entre los cuales el hotspot «Chilean winter rainfall-Valdivian forests» se caracteriza por albergar un total de 3,893 especies de plantas vasculares nativas, el 50% de ellas endémicas del propio hotspot y contener más de la mitad de los bosques templados del hemisferio sur (Mittermeier et al., 2011). Uno de los paisajes más singulares, menos protegidos y más alterados del hotspot chileno es aquel presente en la cordillera de Nahuelbuta («cordillera», de aquí en adelante) (Smith-Ramírez, 2004). Esta zona es considerada por algunos científicos como un área de alto valor de conservación y reserva mundial de la biodiversidad, por sus altos niveles de diversidad de especies y endemismo, y características físicas que favorecieron la persistencia de algunas especies, incluso durante la última glaciación (Smith-Ramírez, 2004; Wolodarsky-Franke y Díaz, 2011). La alta riqueza de especies y endemismo de esta área se atribuye al hecho que los bosques deciduos y matorrales característicos de la zona mediterránea del norte de Chile convergen con la vegetación siempreverde valdiviana del sur de Chile, formando un singular ecosistema ecotonal y por poseer especies remanentes desde el Mezosoico de origen Gondwanico, y especies del Terciario de origen tropical (Smith-Ramírez, 2004).
A pesar de su alto valor para la conservación de la biodiversidad, diversos procesos antrópicos, tales como la sustitución de bosque nativo por plantaciones de especies exóticas, incendios forestales, extracción de leña, agricultura intensiva y sobreexplotación de especies nativas, han sido asociados a la degradación y pérdida de los bosques naturales de esta «cordillera» (Smith-Ramírez, 2004; Wolodarsky-Franke y Díaz, 2011); lo cual ha afectado diferentes especies de flora y fauna endémicas de Chile y presentes en la «cordillera», que se encuentran amenazadas y en riesgo de extinción, como los árboles, queule (Gomortega keule (Mol.) Baillon) y pitao (Pitavia punctata (R. et P.) Mol.), los anfibios, ranita de Darwin (Rhinoderma darwini (Duméril et Bibron, 1841)) y sapo de Contulmo (Eupsohus contulmoensis (Ortiz, Ibarra y Formas, 1989)), entre los mamíferos, el zorro de Darwin (Lycalopex fulvipes (Martin, 1837)) y el marsupial (Dromiciops gliroides (Thomas, 1894)) (Hechenleitner et al., 2005; Wolodarsky-Franke y Díaz, 2011), entre muchos otros. Si bien existen estudios puntuales de la transformación de los paisajes costeros de Chile (Miranda, Altamirano, Cayuela, Lara y González, 2017), no existen estudios espacio-temporales sobre el estado de transformación de la «cordillera», y en particular, de los cambios en los patrones espaciales de sus bosques nativos. Debido a ello, no se cuenta con información básica para planificar acciones o estrategias de conservación y restauración a escala de paisaje.
El objetivo de este trabajo es evaluar el estado del paisaje y los cambios espacio-temporales de los bosques nativos en la «cordillera», y a partir de estos resultados, discutir las implicaciones que tienen tales cambios, en la persistencia de varias especies de flora y fauna amenazadas de la «cordillera», dependientes de hábitats de bosque nativo. Es posible esperar que debido a la constante pérdida y sustitución de bosque nativo por plantaciones forestales de especies exóticas y habilitación de áreas para agricultura, la «cordillera» se encuentre en un estado avanzado de transformación y fragmentación de los bosques naturales.
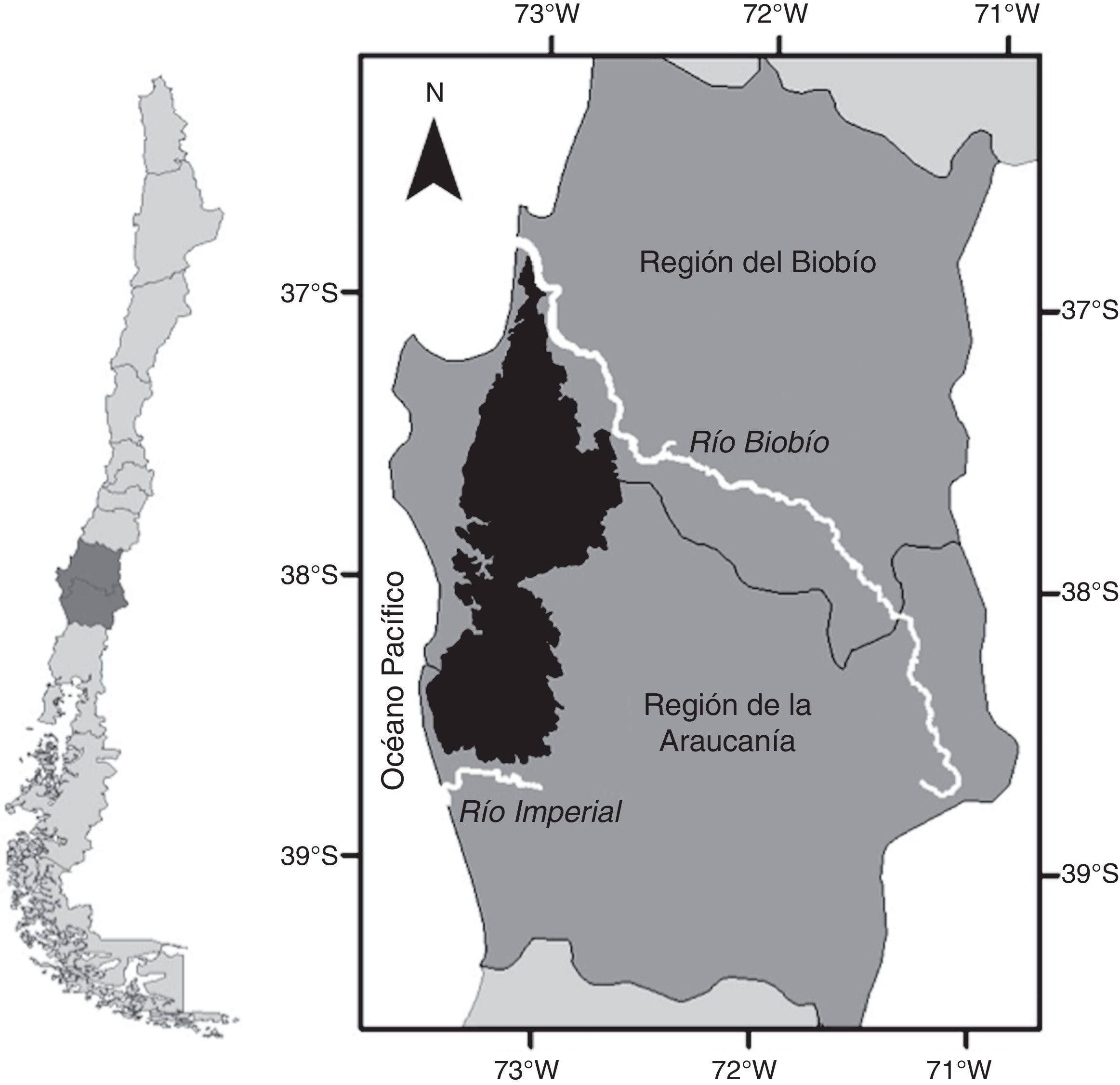
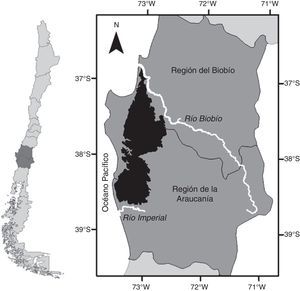
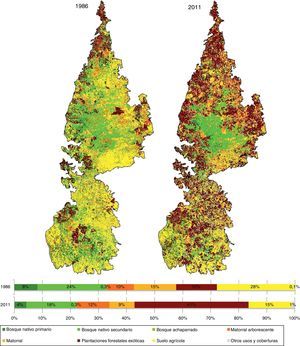
Materiales y métodosLa «cordillera» se localiza entre el río Biobío y el río Imperial, en las regiones administrativas del Biobío y La Araucanía, respectivamente, y se extiende por 200km en sentido norte sur, alcanzando una altitud máxima de 1,530msnm (fig. 1). Las precipitaciones se concentran en un 80% en los meses de otoño e invierno, aumentando en 2 gradientes, uno latitudinal (norte sur) y otro longitudinal (oeste este), con frecuentes nevadas por encima de los 1,000msnm en los meses de invierno (Di Castri y Hajek, 1976).
Debido a que no existe ningún estudio que defina con precisión los límites de la «cordillera», en el presente trabajo se establecieron límites con base a criterios geológicos, pedológicos, vegetacionales y altimétricos. El criterio geológico considera la formación de la «cordillera» en el Paleozoico superior, siendo mucho más antigua que la cordillera de Los Andes, que data de fines del Terciario (Mardones, 2005). Se excluyeron en esta delimitación a secuencias sedimentarias marinas plataformales y depósitos piroclásticos asociados a calderas de colapso (Mardones, 2005; SERNAGEOMIN, 2003). La pedología de la «cordillera» corresponde en su mayoría a suelos ultisoles de la serie Asociación Nahuelbuta generados a partir de rocas metamórficas, de textura arcillosa, franco-arcillo-limosa y arcillo-limosa, profundos y generalmente de topografía escarpada (CIREN, 1999). La redelimitación a partir de formaciones vegetacionales consistió en suavizar y cerrar los bordes del producto obtenido de las anteriores redelimitaciones, para lo cual se usó la clasificación de pisos de vegetaciones propuesto por Luebert y Pliscoff (2006). El límite altimétrico se basó en la cota de 200msnm, debido a su congruencia espacial con los demás criterios analizados.
Para generar mapas temáticos de los usos del suelo, se utilizaron imágenes satelitales Landsat de primavera y verano de 1986 (TM) y 2011 (ETM+), con una nubosidad inferior del 10%. Para facilitar su procesamiento y llevar a cabo la comparación cuantitativa de las coberturas de uso del suelo, las imágenes se proyectaron a una resolución espacial de 30×30m/píxel y, posteriormente, fueron corregidas geométrica, atmosférica y topográficamente (Chander, Markham y Helder, 2009). Por medio de la metodología del factorC, se eliminaron las sombras proyectadas por la topografía del lugar (Reese y Olsson, 2011). Para aumentar la exactitud de la clasificación fueron utilizados los índices de vegetación NDVI, SR, SAVI y LSWI (Huete, 1988; Rouse, Haas, Schell y Deering, 1974; Tucker, 1979).
Se realizó una clasificación supervisada para cada imagen utilizando el método estadístico de máxima verosimilitud y puntos de entrenamiento, los cuales representan los patrones de los tipos de cobertura del suelo. Un total de 300 puntos de entrenamiento fueron tomados en diferentes campañas en terreno para la clasificación de las imágenes más recientes. Mientras que para las imágenes de 1986, se utilizaron mapas de la cobertura del suelo generados por estudios previos (Conaf et al., 1999; Lara, Araya, Capella, Fierro y Cavieres, 1989) y consulta local de coberturas de uso del suelo que no mostraron cambio de uso en los últimos 20 años. La precisión en la clasificación de las imágenes se calculó por medio de matrices de confusión, a partir de un rango de entre 60 y 90 puntos de validación tomados en terreno y fotografías aéreas recientes, por cada tipo de cobertura, de cada imagen satelital. Se realizó un filtro por clasificación a cada una de las clases de coberturas presentes con el objetivo de excluir parches con menos de 4pixeles.
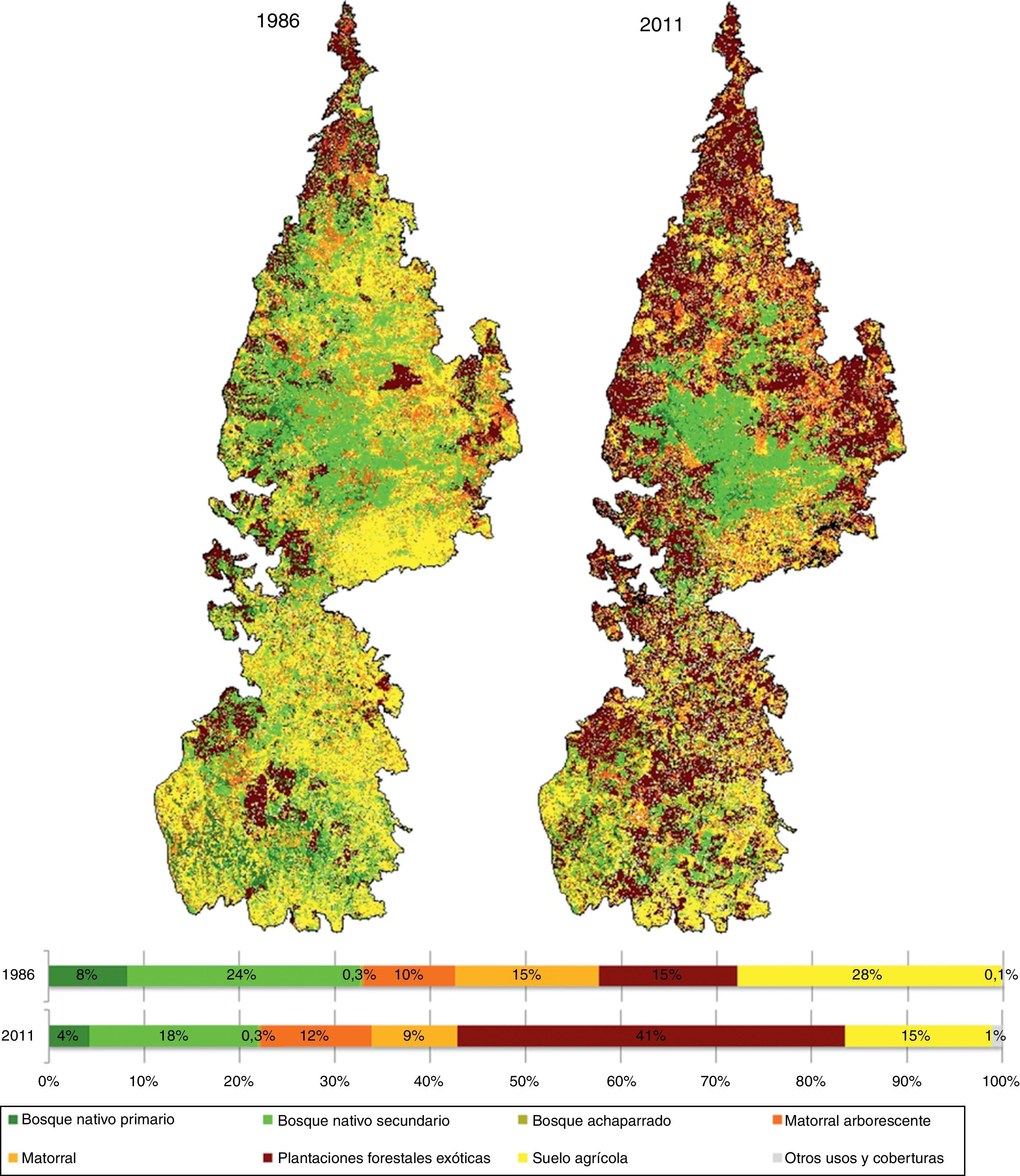
Las clases de coberturas o usos del suelo del paisaje de la «cordillera» identificados a partir de cada imagen fueron: 1) bosque nativo primario (bosques antiguos originados por sucesión natural); 2) bosque nativo secundario (regeneración de bosques posterior a un disturbio); 3) bosque achaparrado; 4) matorral arborescente; 5) matorral; 6) plantaciones forestales exóticas (plantaciones comerciales); 7) suelo agrícola (cultivos agrícolas, praderas y zonas de uso ganadero), y 8) otros usos y coberturas (cuerpos de agua, urbano, nubes y sombras).
La transición de las coberturas de bosques nativos a otros usos del suelo fueron analizados mediante el módulo Análisis de Cambio de la extensión Land Change Modeler del software IDRISI (IDRISI, 2012). En el caso de cambios en bosques nativos, se empleó la siguiente fórmula para determinar la tasa de deforestación anual:
donde A1 y A2 son el área de bosque nativo en el tiempo t1 y t2, respectivamente, y P es el porcentaje de pérdida por año (Newton, 2007).
El estado actual del paisaje fue analizado con base en los modelos de cambio del paisaje propuestos por McIntyre y Hobbs (1999) y Echeverría et al. (2012). Específicamente, se emplearon las siguientes variables: pérdida y fragmentación de bosques nativos, tasa de deforestación, proceso dominante del paisaje, y cambios en la matriz durante el periodo estudiado. Por otra parte, la transformación del paisaje se midió como porcentaje de hábitat remanente en términos de bosques naturales (McIntyre y Hobbs, 1999).
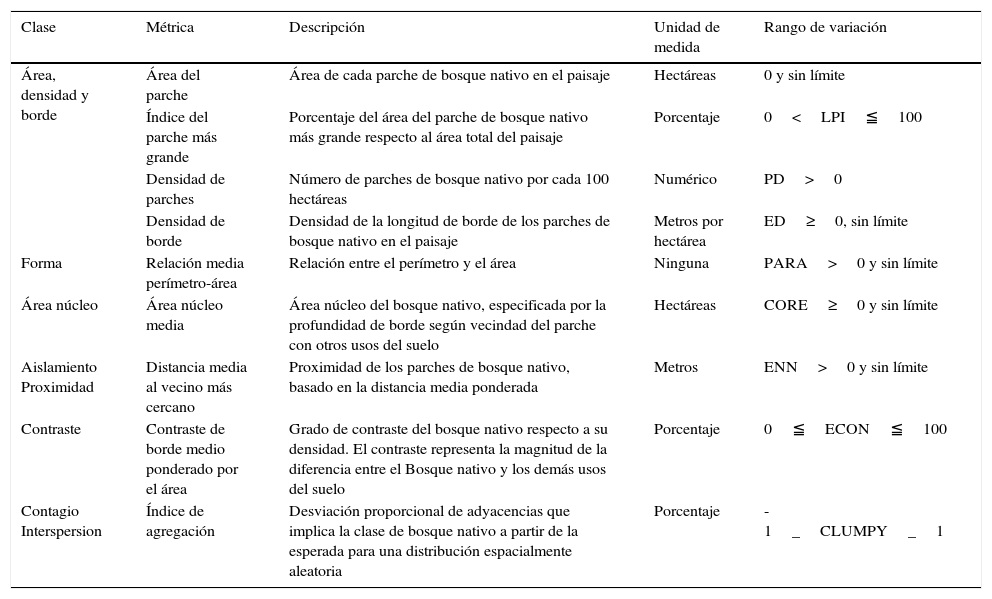
Para el análisis de los patrones espaciales de la cobertura boscosa nativa entre 1986 y 2011, se usó el software FRAGSTATS (McGarigal, Cushman, Neel y Ene, 2013). La elección del conjunto de métricas a utilizar se basó en la revisión de diversos estudios sobre métricas del paisaje que expresaran en mejor forma la configuración espacial de paisajes reales, y además fueran representativas de componentes esenciales de la estructura del paisaje como son: la calidad de parche, el borde del parche, el contexto del parche en el paisaje y la conectividad del parche (tabla 1) (Cushman, McGarigal y Neel, 2008; Liu y Taylor, 2002; Mas, Gao y Pacheco, 2010; Peng et al., 2010; Zeng y Wu, 2005).
Métricas del paisaje usadas para el análisis de patrones espaciales de los bosques nativos de la cordillera de Nahuelbuta (McGarigal et al., 2013).
| Clase | Métrica | Descripción | Unidad de medida | Rango de variación |
|---|---|---|---|---|
| Área, densidad y borde | Área del parche | Área de cada parche de bosque nativo en el paisaje | Hectáreas | 0 y sin límite |
| Índice del parche más grande | Porcentaje del área del parche de bosque nativo más grande respecto al área total del paisaje | Porcentaje | 0<LPI≦100 | |
| Densidad de parches | Número de parches de bosque nativo por cada 100 hectáreas | Numérico | PD>0 | |
| Densidad de borde | Densidad de la longitud de borde de los parches de bosque nativo en el paisaje | Metros por hectárea | ED≥0, sin límite | |
| Forma | Relación media perímetro-área | Relación entre el perímetro y el área | Ninguna | PARA>0 y sin límite |
| Área núcleo | Área núcleo media | Área núcleo del bosque nativo, especificada por la profundidad de borde según vecindad del parche con otros usos del suelo | Hectáreas | CORE≥0 y sin límite |
| Aislamiento Proximidad | Distancia media al vecino más cercano | Proximidad de los parches de bosque nativo, basado en la distancia media ponderada | Metros | ENN>0 y sin límite |
| Contraste | Contraste de borde medio ponderado por el área | Grado de contraste del bosque nativo respecto a su densidad. El contraste representa la magnitud de la diferencia entre el Bosque nativo y los demás usos del suelo | Porcentaje | 0≦ECON≦100 |
| Contagio Interspersion | Índice de agregación | Desviación proporcional de adyacencias que implica la clase de bosque nativo a partir de la esperada para una distribución espacialmente aleatoria | Porcentaje | -1_CLUMPY_1 |
Para el cálculo del índice de contraste se asignaron pesos de contraste entre los bordes de parches de bosques nativos y los demás tipos de coberturas presentes en el área de estudio. El peso de contraste de los bordes se determinó con base en variables de composición y estructura de la vegetación, medidas en 13 parcelas de muestreo de 20×10m. Para el cálculo de área núcleo se emplearon distancias perpendiculares desde el borde hacia el centro del parche, la cual correspondió a la zona de efecto borde entre el bosque nativo y los demás tipos de coberturas. La distancia asignada fue con base en los trabajos realizados por Laurance et al. (2002), López-Barrera (2004) y Lindenmayer y Fischer (2006), considerando que el grado de contraste entre hábitats (bordes suaves o abruptos) expresa la magnitud y distancia de respuestas primarias y secundarias de la estructura, composición y procesos del hábitat ante los efectos de borde.
ResultadosClasificación de imágenes. La precisión de la clasificación de 1986 fue del 87%, siendo la clase plantaciones exóticas la menos precisa (81%), confundiéndose con coberturas de bosques nativos primarios. Los bosques nativos primarios para 1986 tuvieron una precisión del 88%, mientras que los bosques nativos secundarios y achaparrados tuvieron una precisión del 86 y 87%, respectivamente. Para el año 2011 la precisión de clasificación se estimó en un 85%, siendo la clase matorral arborescente la menos precisa (77%). Las plantaciones forestales tuvieron un 78% de precisión, mientras que bosques nativos primarios obtuvieron un 86%, bosques nativos secundarios un 85% y bosques achaparrados un 88%.
Pérdida de cobertura boscosa. La «cordillera» posee un área aproximada a 620,000ha, de las cuales 206,130ha±26,8 estaban constituidas por bosques nativos en 1986, disminuyendo a 137,700ha±19, 3 al año 2011 (fig. 2). Es decir, en 25 años la cobertura boscosa disminuyó un 33.2% con una tasa de deforestación del 1.6% año–1. La pérdida neta fue más intensa en bosques nativos primarios que en bosques nativos secundarios, mientras que los bosques achaparrados no presentaron pérdida. En 1986 los bosques nativos primarios ocupaban tan solo un 8% del total del paisaje (52,019ha), reduciendo su área a la mitad en el 2011, con una tasa de deforestación del 2.6% año–1 (fig. 2). En comparación, los bosques nativos secundarios presentaron una pérdida neta de 43,000ha, lo que representa un 28% del área original en 1986 (152,200ha), con una tasa de deforestación del 1.3% año–1 (fig. 2).
En cuanto a las transiciones de bosques nativos primarios, un 68% de la pérdida neta ocurrió por la sustitución a plantaciones de especies exóticas y en menor proporción por degradación a bosques nativos secundarios (11%) y matorrales arborescentes (12%). Por otra parte, un 95% de los cambios de cobertura de bosques nativos secundarios correspondió a la sustitución por plantaciones de especies exóticas. En este mismo periodo de estudio (1986-2011), las plantaciones de especies exóticas se incrementaron casi un 150% aumentando de 90,750ha en 1986 a 251,250ha en el 2011, con una tasa de forestación del 4.2% año–1, siendo la cobertura predominante el 2011 (fig. 2).
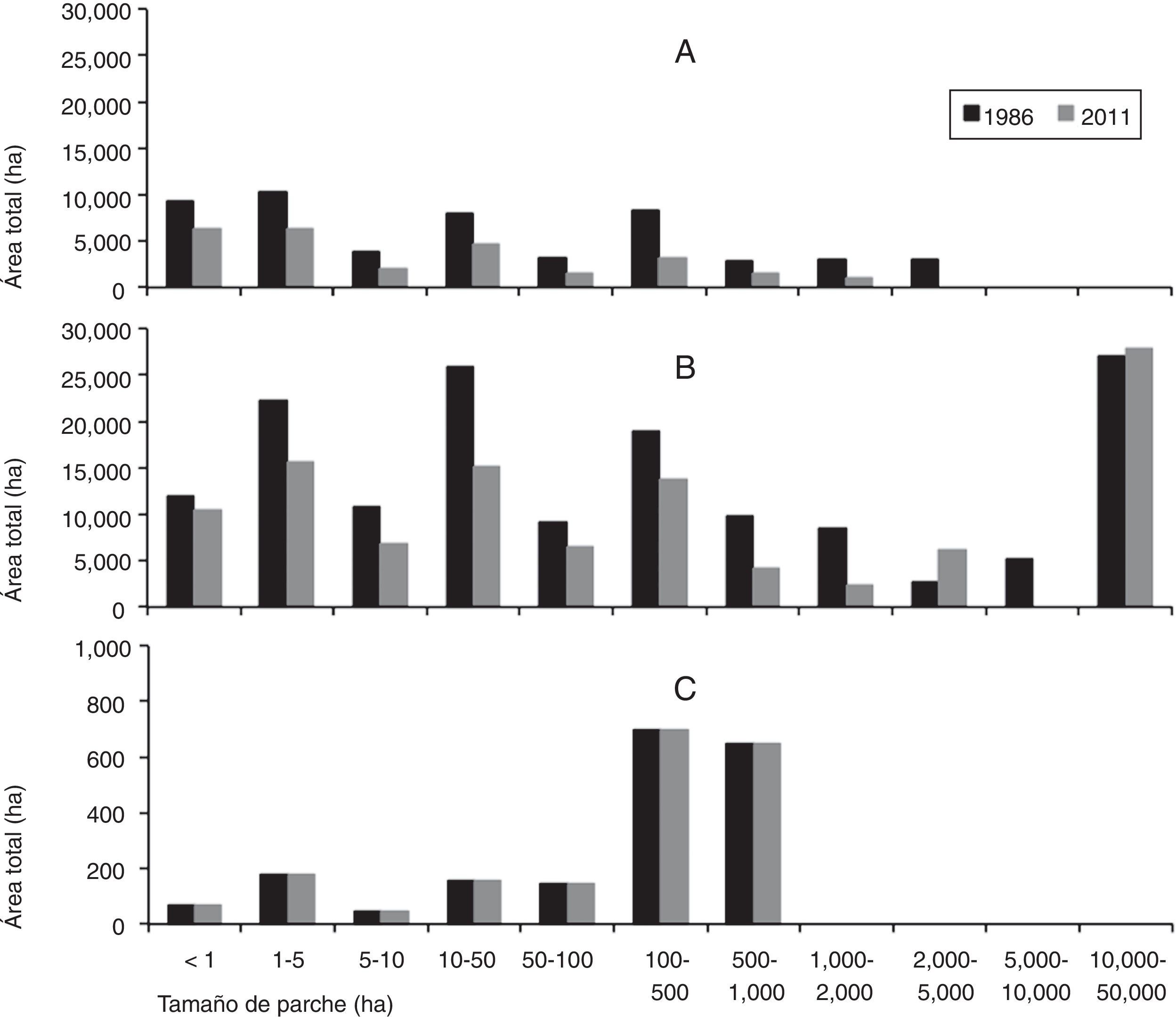
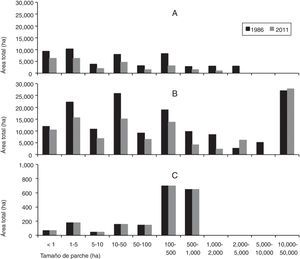
Análisis de los patrones espaciales de la cobertura boscosa nativa. Se observaron cambios considerables en la distribución del tamaño de los parches de la cobertura boscosa durante el periodo 1986-2011 (fig. 3). En 1986, el 61% del área de bosque nativo primario se encontraba en parches inferiores a 50ha, el 22% en parches de 50 a 500ha y un 17% distribuido en 7 parches mayores de 500ha (fig. 3). Posteriormente, en el 2011, de las 26,600ha de bosque nativo primario existente, el 72% estaba distribuido en parches inferiores a 50ha, un 18% en parches de 50 a 500ha y tan solo un 10% se distribuía en 3 parches de tamaño mayor que 500ha (fig. 3). En el año 2011, se observó un único gran parche de bosque nativo primario de 1,120ha. De las 25,420ha deforestadas de bosque nativo primario, el 49% ocurrió en parches de área inferior a 50ha.
En relación con el bosque nativo secundario, aproximadamente el 50% se encontraba en parches de área inferior a 50ha, persistiendo en el tiempo un único gran fragmento, que representaba el 4.3% del área total del paisaje en 1986 y el 4.5% en el 2011 (fig. 3). En el periodo de estudio, el bosque nativo secundario presentó una regeneración aproximada de 5,680ha, de las cuales un 82% ocurrió en parches de 2,000 a 5,000ha. No obstante, de las 43,000ha deforestadas de bosque nativo secundario, el 53% de la pérdida ocurrió en parches con tamaño inferior a las 50ha.
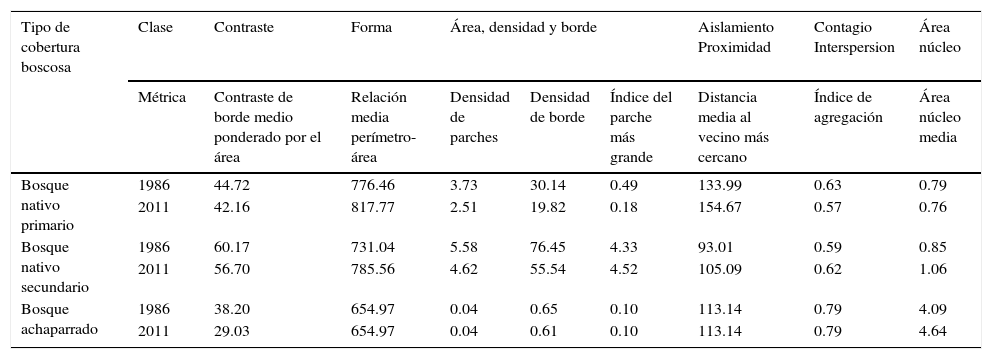
De 1986 a 2011 se observó un incremento en la complejidad de la forma de los fragmentos de bosque nativo primario y secundario (tabla 2). Por su parte, el grado de contraste de hábitat fue mayor en bosque nativo primario que en secundario, con una leve tendencia a decrecer en el tiempo (tabla 2). Los bosques achaparrados presentaron el menor grado de contraste en el periodo de estudio (1986=38%, 2011=29%) (tabla 2).
Cambios en los índices de patrones del paisaje en la cordillera de Nahuelbuta a nivel de clase entre 1986 y 2011.
| Tipo de cobertura boscosa | Clase | Contraste | Forma | Área, densidad y borde | Aislamiento Proximidad | Contagio Interspersion | Área núcleo | ||
|---|---|---|---|---|---|---|---|---|---|
| Métrica | Contraste de borde medio ponderado por el área | Relación media perímetro-área | Densidad de parches | Densidad de borde | Índice del parche más grande | Distancia media al vecino más cercano | Índice de agregación | Área núcleo media | |
| Bosque nativo primario | 1986 | 44.72 | 776.46 | 3.73 | 30.14 | 0.49 | 133.99 | 0.63 | 0.79 |
| 2011 | 42.16 | 817.77 | 2.51 | 19.82 | 0.18 | 154.67 | 0.57 | 0.76 | |
| Bosque nativo secundario | 1986 | 60.17 | 731.04 | 5.58 | 76.45 | 4.33 | 93.01 | 0.59 | 0.85 |
| 2011 | 56.70 | 785.56 | 4.62 | 55.54 | 4.52 | 105.09 | 0.62 | 1.06 | |
| Bosque achaparrado | 1986 | 38.20 | 654.97 | 0.04 | 0.65 | 0.10 | 113.14 | 0.79 | 4.09 |
| 2011 | 29.03 | 654.97 | 0.04 | 0.61 | 0.10 | 113.14 | 0.79 | 4.64 | |
En 1986 la densidad de parches de bosque nativo primario y secundario fue de 3.73 y 5.58, respectivamente (tabla 2). En el 2011, este índice se redujo a 2.51 fragmentos para el bosque nativo primario y 4.62 fragmentos para el bosque nativo secundario (tabla 2). Igualmente, la densidad de borde disminuyó de 1986 a 2011 para los 3 tipos de bosque, presentándose la mayor reducción de borde en bosque nativo secundario (tabla 2).
Se observó un incremento de la distancia entre los parches de bosque nativo primario y secundario (tabla 2). El índice de agregación de bosque nativo primario disminuyó, mientras que para bosque nativo secundario aumentó (tabla 2). No obstante, no se observó una variación considerable del índice de agregación de los fragmentos boscosos en el paisaje. Por su parte, los bosques achaparrados no presentaron cambios en la distancia media entre fragmentos, y en su índice de agregación (tabla 2).
El área núcleo de bosque nativo primario tuvo una pérdida del 4%, lo cual concuerda con la disminución en un 63% del área del parche más grande para este tipo de bosque (tabla 2). En cambio, el bosque nativo secundario y el bosque achaparrado incrementaron en un 20% y 12% el área núcleo, respectivamente (tabla 2).
DiscusiónPérdida cobertura boscosa. El presente estudio reveló una pérdida total de bosque nativo del 33.2% a una tasa de deforestación del 1.6% año–1 entre 1986 y 2011 en un paisaje de alto valor de conservación, inserto en un hotspot de biodiversidad. Esta pérdida fue más intensa en bosques nativos primaros (49%) que en bosques nativos secundarios (28%), y ocurrió principalmente por la sustitución a plantaciones forestales exóticas. Una pérdida de bosque nativo similar a la del presente estudio también fue observada en el hotspot chileno, entre las regiones del Biobío y La Araucanía en el periodo 1979-2000, donde la pérdida neta boscosa fue del 28.2% a una tasa de deforestación del 1.6% año–1 (Aguayo, Pauchard, Azócar y Parra, 2009). De este porcentaje de pérdida, el 71.7% ocurrió por sustitución de bosque a plantaciones forestales exóticas (Aguayo et al., 2009). Por otra parte, en el paisaje costero chileno de la región del Maule, entre 1975 y 2000 se estimó una pérdida de bosques nativos de un 67%, el doble de lo registrado en el presente estudio, a una tasa de deforestación del 4.5% año–1, como consecuencia principal de la sustitución por plantaciones forestales exóticas (Echeverría et al., 2006). Esto refleja la constante pérdida de bosque nativo por sustitución a plantaciones forestales exóticas y la actual ausencia de grandes extensiones de bosques nativos costeros en paisajes del hotspot chileno.
Pérdidas de hábitat boscosos en hotspot de biodiversidad también han sido reportadas en otros zonas del mundo para las últimas décadas. Por ejemplo, en el hotspot de la provincia de Limón en Costa Rica, la deforestación a 1997 fue de 54,830ha, equivalente al 8.4% de la cubierta forestal existente en 1986 (Van Laake y Sánchez-Azofeifa, 2004). Porcentajes superiores de deforestación a lo estimado en la «cordillera» se observaron en el hotspot de las montañas del Arco Oriental de Tanzania, donde los bosques siempreverdes y sabanas arboladas naturales desaparecieron en un 48% entre 1975 y 2000 (Green et al., 2013), y en el hotspot del Ecuador, ubicado en las provincias de Loja y Zamora Chinchipe, donde la pérdida de cobertura boscosa fue del 46% entre 1976 y 2008 (Tapia-Armijos, Homeier, Espinosa, Leuschner y de la Cruz, 2015).
Estado del paisaje. El paisaje exhibió una tasa de deforestación del 2.6% año1 para bosque nativo primario y del 1.3% año–1 para bosque nativo secundario, persistiendo en el 2011 el 22% de la cobertura boscosa. Igualmente, se observó una disminución en la densidad de parches y de bordes de bosque nativo primario y secundario, incremento de la distancia entre parches, y aumento de la matriz dominada por plantaciones de especies exóticas. Según estos resultados, la «cordillera» corresponde a un estado avanzado de transformación del paisaje (Echeverría et al., 2012; McIntyre y Hobbs, 1999). En este estado del paisaje, la pérdida de fragmentos de bosques domina sobre la división de ellos y suele ocurrir posteriormente a procesos intensos de fragmentación de bosques (Echeverría et al., 2012; McIntyre y Hobbs, 1999). Muy diferente fue lo observado en la India entre 1975 y 2005 (Reddy, Sreelekshmi, Jha y Dadhwal, 2013), y en el hotspot de biodiversidad al sur de Ecuador (Tapia-Armijos et al., 2015), entre 1976 y 2008, donde existió la reducción y división de grandes parches de bosque nativo, mientras, se producía un aumento en el número de parches, la longitud y densidad de borde, patrón característico de fases iniciales de fragmentación (Newton, 2007).
De continuar la trayectoria en el paisaje estudiado y careciendo de medidas en la planificación y gestión para la conservación, protección y restauración de ecosistemas boscosos, se esperaría a futuro una pérdida considerable de cobertura boscosa, con una disminución de la tasa de deforestación. Asimismo, si la tasa actual de forestación con especies exóticas se mantiene constante a la estimada (4.2% año–1), es posible esperar una mayor homogeneización del paisaje con una o 2 especies de interés comercial, convirtiendo a la «cordillera» en un paisaje en estado relictual, severamente desforestado, con pequeños parches de bosque nativo altamente modificados, aislados y sin conectividad, rodeados de usos de suelo altamente contrastantes (Echeverría et al., 2012; McIntyre y Hobbs, 1999). En este estado, el ligero aumento de bosques nativos secundarios y los cambios en las trayectorias indicarían regeneración en zonas agrícolas abandonadas, tal como se ha reportado en la comuna de Ancud, región de Los Lagos, Chile (Carmona, Nahuelhual, Echeverría y Báez, 2010).
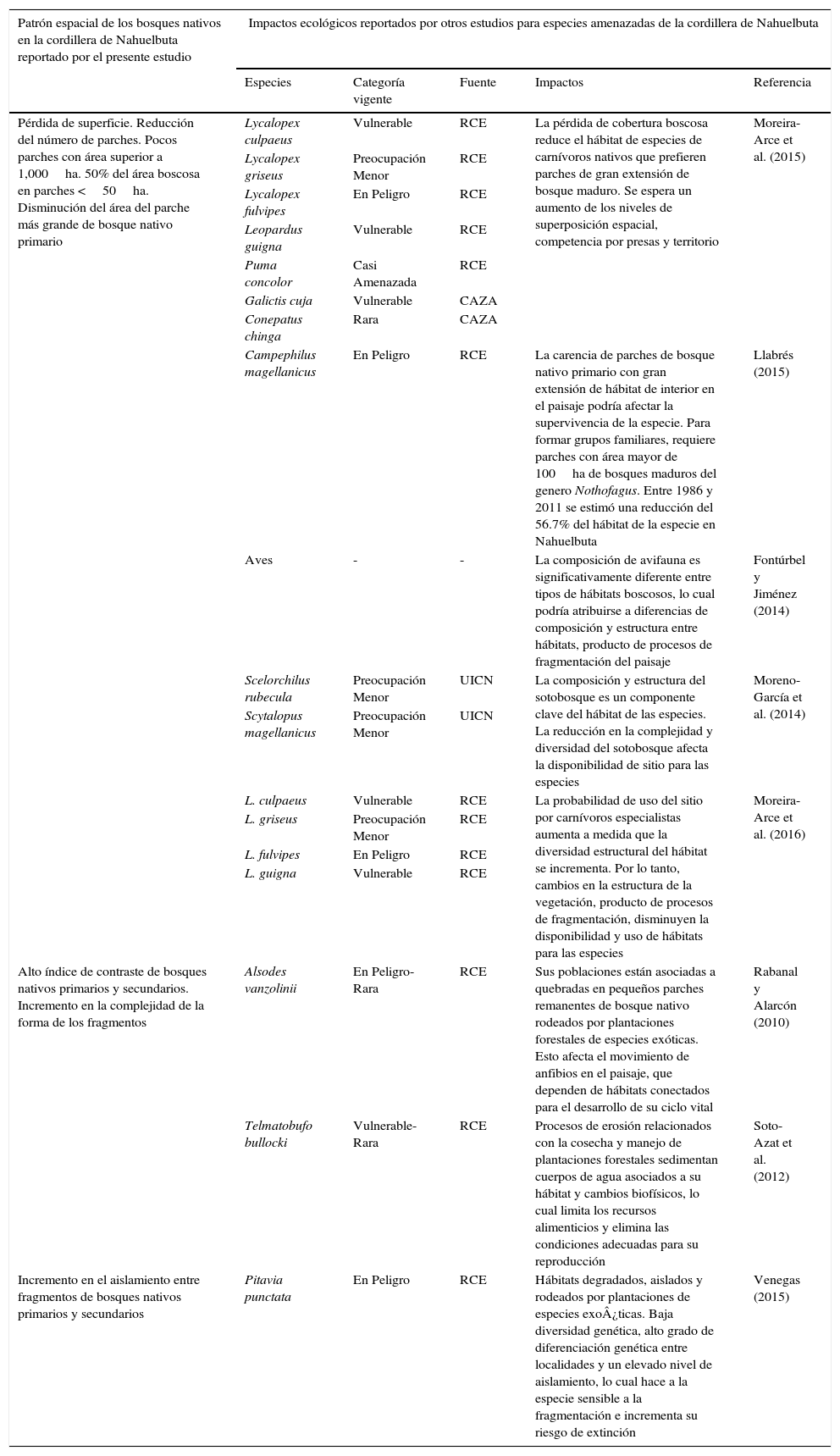
Cambios en el patrón espacial de la cobertura boscosa e implicancias para la conservación de la biodiversidadImpactos de la disminución del tamaño de los parches hábitat. El rápido proceso de deforestación en la «cordillera» ocasionó que en tan solo 25 años se perdieran grandes fragmentos de bosque nativo primario y secundario, llegando a poseer pocos parches de tamaño superior a 1,000ha y 50% del área boscosa en parches menores de 50ha. En este sentido, en el paisaje costero del río Maule-Cobquecura en Chile (al norte de la «cordillera»), se encontró que durante el periodo 1975-2000 en el primer año de estudio el 44% de la superficie boscosa se concentraba en un gran parche de entre 20,000 y 100,000ha. Para el año 2000, el 69% de los bosques se encontraban en parches de menos de 100ha y solo un 3% del área boscosa estaba en parches con un tamaño superior a 1,000ha (Echeverría et al., 2006). Esta reducción en el tamaño de los parches de bosques nativos en paisajes chilenos puede afectar la disponibilidad de hábitat de diversas especies que requieren de grandes extensiones para persistir (De Angelo et al., 2011; Laurance et al., 2002; Uezu y Metzger, 2011). En este sentido, se ha reportado que especies de carnívoros presentes en la «cordillera», como el puma (Puma concolor (Linnaeus, 1771)) y el zorro de Darwin, muestran preferencias por hábitats de bosque nativo adulto y parches de gran extensión, lo cual concentraría sus poblaciones en pocos parches en la «cordillera», aumentando los niveles de superposición espacial entre las especies de carnívoros, incluido el perro asilvestrado, y la competencia por presas y territorio (Moreira-Arce, Vergara y Boutin, 2015) (tabla 3). Por su parte, especies de aves amenazadas presentes en la «cordillera» y asociadas a bosques nativos primarios de interior, como el carpintero negro (Campephilus magellanicus (King, 1828)), han experimentado un declive en sus hábitats, junto con una disminución del tamaño y rango de distribución de sus poblaciones (Llabrés, 2015) (tabla 3).
Vinculación entre los patrones espaciales reportados en el presente estudio y procesos ecológicos de especies amenazadas en la cordillera de Nahuelbuta.
| Patrón espacial de los bosques nativos en la cordillera de Nahuelbuta reportado por el presente estudio | Impactos ecológicos reportados por otros estudios para especies amenazadas de la cordillera de Nahuelbuta | ||||
|---|---|---|---|---|---|
| Especies | Categoría vigente | Fuente | Impactos | Referencia | |
| Pérdida de superficie. Reducción del número de parches. Pocos parches con área superior a 1,000ha. 50% del área boscosa en parches <50ha. Disminución del área del parche más grande de bosque nativo primario | Lycalopex culpaeus | Vulnerable | RCE | La pérdida de cobertura boscosa reduce el hábitat de especies de carnívoros nativos que prefieren parches de gran extensión de bosque maduro. Se espera un aumento de los niveles de superposición espacial, competencia por presas y territorio | Moreira-Arce et al. (2015) |
| Lycalopex griseus | Preocupación Menor | RCE | |||
| Lycalopex fulvipes | En Peligro | RCE | |||
| Leopardus guigna | Vulnerable | RCE | |||
| Puma concolor | Casi Amenazada | RCE | |||
| Galictis cuja | Vulnerable | CAZA | |||
| Conepatus chinga | Rara | CAZA | |||
| Campephilus magellanicus | En Peligro | RCE | La carencia de parches de bosque nativo primario con gran extensión de hábitat de interior en el paisaje podría afectar la supervivencia de la especie. Para formar grupos familiares, requiere parches con área mayor de 100ha de bosques maduros del genero Nothofagus. Entre 1986 y 2011 se estimó una reducción del 56.7% del hábitat de la especie en Nahuelbuta | Llabrés (2015) | |
| Aves | - | - | La composición de avifauna es significativamente diferente entre tipos de hábitats boscosos, lo cual podría atribuirse a diferencias de composición y estructura entre hábitats, producto de procesos de fragmentación del paisaje | Fontúrbel y Jiménez (2014) | |
| Scelorchilus rubecula | Preocupación Menor | UICN | La composición y estructura del sotobosque es un componente clave del hábitat de las especies. La reducción en la complejidad y diversidad del sotobosque afecta la disponibilidad de sitio para las especies | Moreno-García et al. (2014) | |
| Scytalopus magellanicus | Preocupación Menor | UICN | |||
| L. culpaeus | Vulnerable | RCE | La probabilidad de uso del sitio por carnívoros especialistas aumenta a medida que la diversidad estructural del hábitat se incrementa. Por lo tanto, cambios en la estructura de la vegetación, producto de procesos de fragmentación, disminuyen la disponibilidad y uso de hábitats para las especies | Moreira-Arce et al. (2016) | |
| L. griseus | Preocupación Menor | RCE | |||
| L. fulvipes | En Peligro | RCE | |||
| L. guigna | Vulnerable | RCE | |||
| Alto índice de contraste de bosques nativos primarios y secundarios. Incremento en la complejidad de la forma de los fragmentos | Alsodes vanzolinii | En Peligro-Rara | RCE | Sus poblaciones están asociadas a quebradas en pequeños parches remanentes de bosque nativo rodeados por plantaciones forestales de especies exóticas. Esto afecta el movimiento de anfibios en el paisaje, que dependen de hábitats conectados para el desarrollo de su ciclo vital | Rabanal y Alarcón (2010) |
| Telmatobufo bullocki | Vulnerable-Rara | RCE | Procesos de erosión relacionados con la cosecha y manejo de plantaciones forestales sedimentan cuerpos de agua asociados a su hábitat y cambios biofísicos, lo cual limita los recursos alimenticios y elimina las condiciones adecuadas para su reproducción | Soto-Azat et al. (2012) | |
| Incremento en el aislamiento entre fragmentos de bosques nativos primarios y secundarios | Pitavia punctata | En Peligro | RCE | Hábitats degradados, aislados y rodeados por plantaciones de especies exo¿ticas. Baja diversidad genética, alto grado de diferenciación genética entre localidades y un elevado nivel de aislamiento, lo cual hace a la especie sensible a la fragmentación e incrementa su riesgo de extinción | Venegas (2015) |
Diferentes estudios realizados en diversos ecosistemas demuestran que la fragmentación y deforestación altera un conjunto de variables relacionadas con la estructura del bosque; asimismo, el tamaño de los fragmentos se relaciona significativamente con la composición de especies y la estructura de comunidades (Cadotte, Franck, Reza y Lovett-Doust, 2002; Castelletta et al., 2005; Echeverría et al., 2007; Tabarelli et al., 1999; Uezu y Metzger, 2011). Diferencias estructurales en la vegetación se han asociado con cambios en la composición de aves entre hábitats en la «cordillera» (Fontúrbel y Jiménez, 2014; Moreno-García, Zamora y Herrera, 2014) (tabla 3), respondiendo posiblemente a variables como el aumento de la irradiación y temperatura (Patten y Smith-Patten, 2012). Igualmente, se ha demostrado que la probabilidad de uso de sitio por carnívoros en riesgo de extinción, como la güiña (Leopardus guigna (Molina, 1782)), el zorro de Darwin y el puma, aumenta a medida que la diversidad estructural del hábitat se incrementa (Moreira-Arce et al., 2016) (tabla 3).
Efectos borde. En el presente estudio, los bosques nativos primario y secundario exhibieron un alto contraste debido a la interface entre usos del suelo antrópico y vegetación nativa secundaria. Estudios anteriores en Chile y el sur de Portugal reportan que las plantaciones de eucalipto (Eucalyptus globulus Labill) presentan bordes de alto contraste con el hábitat natural debido a su composición monoespecífica y estructura sencilla (Echeverría, Gatica y Fuentes, 2013; Reino et al., 2009), lo cual puede afectar directamente el movimiento de organismos (Peyras et al., 2013). En la «cordillera» se han encontrado poblaciones de anfibios en riesgo de extinción, como son el Sapo de pecho espinoso de Vanzolini y el sapo de Bullock (Telmatobufo bullocki (Schmidt, 1952)), en pequeños remanentes de bosque nativo rodeados por plantaciones de especies exóticas. Estas plantaciones afectan la movilidad de los anfibios y el desarrollo de su ciclo vital (Rabanal y Alarcón, 2010; Soto-Azat, Cuevas, Flores y Valenzuela-Sánchez, 2012) (tabla 3). Igualmente, procesos de erosión relacionados con la cosecha, y manejo de plantaciones forestales, generan cambios biofísicos y la sedimentación de cuerpos de agua asociados a su hábitat, eliminando las condiciones adecuadas para su reproducción (Soto-Azat et al., 2012) (tabla 3).
Efectos de aislamiento entre hábitats. Un patrón espacial discontinuo de hábitats, como el que se describe para el área de estudio, puede conducir a una disminución de la conectividad funcional entre sitos aptos para las especies y a una alteración de la capacidad de dispersión en función de las condiciones de la matriz que las separa (Bennett, 1999; Uezu y Metzger, 2011). Esto induce, a su vez, a un incremento del riesgo de extinciones locales, al hacer más vulnerables a las especies ante procesos estocásticos, catástrofes naturales, amenazas humanas y pérdida de variabilidad genética (Bennett, 1999; Hooftman, Billeter, Schmid y Diemer, 2004; Lindenmayer y Fischer, 2006). En este sentido, se ha demostrado que poblaciones de la especie arbórea pitao (P. punctata) en la «cordillera», y de distribución restringida en la cordillera de la costa en Chile, presentan una baja variabilidad genética dentro de cada localidad, y un alto grado de diferenciación genética entre localidades por efecto del aislamiento entre poblaciones (Venegas, 2015) (tabla 3), comparado con otras especies arbóreas del centro sur de Chile, como el queule y el hualo (Lophozonia glauca (Phil.) Heenan y Smissen.) (Delaveau et al., 2013; Vergara, Gitzendanner, Soltis y Soltis, 2014). De acuerdo con esto, se puede inferir que la P. punctata se encuentra en un cuello de botella genético, más aun si se considera que su área de ocupación es inferior a 1,000ha y que en la naturaleza persisten menos de 1,000 individuos maduros (Hechenleitner et al., 2005).
La cordillera de Nahuelbuta debe ser considerada como un paisaje premium de conservación, ya que aún concentra altos niveles de biodiversidad y endemismo, pero a la vez un estado avanzado de transformación y progresiva fragmentación de los bosques nativos. Esta condición premium dentro del hotspot de biodiversidad justifica la urgencia de salvaguardar las diferentes especies de flora y fauna cuyo riesgo de extinción puede incrementarse debido a la pérdida y modificación de sus hábitats. Esta condición también se fundamenta por su bajo grado de protección (±10.4%), existiendo actualmente 10 áreas de alto valor de conservación con una superficie aproximada de 57,500ha, siendo la quebrada Caramávida el área de conservación más extensa en el paisaje (37,000ha). Las 2 únicas áreas resguardadas por el Sistema Nacional de Áreas Silvestres Protegidas del Estado son el Parque Nacional Nahuelbuta (6,832ha) y el Monumento Natural Contulmo (82ha), cuyas extensiones difícilmente pueden sostener la alta biodiversidad de la zona (Armesto, Rozzi, Smith-Ramírez y Arroyo, 1998; Simonetti y Mella, 1997).
Se sugiere la implementación de manera urgente de estrategias para la planificación de la conservación en la cordillera de Nahuelbuta que impliquen: restauración de ecosistemas degradados, conectividad de fragmentos boscosos en el paisaje, conservación de especies amenazadas en el paisaje, actualización de sitios prioritarios para la conservación de la biodiversidad, implementación de nuevas áreas protegidas y análisis de los impactos ecológicos de pérdida de hábitat en especies y comunidades de flora y fauna.
Por último, se sugiere que futuras investigaciones aborden las causas de transformación del paisaje y la pérdida de bosque nativo en la «cordillera», con el fin de ser incluidas en la toma de acciones para la conservación de la biodiversidad y planificación del territorio.
CONICYT y la «Beca Nacional de Doctorado para Extranjeros sin Residencia Definitiva». Proyecto FONDECYT 1140531 y el Laboratorio de Ecología del Paisaje por la información brindada; al Dr. Anibal Pauchad y Dra. Dolors Armenteras por sus comentarios y observaciones. Ms. C. Rodrigo Fuentes por la información y ayuda suministrada.
La revisión por pares es responsabilidad de la Universidad Nacional Autónoma de México.