El presente estudio registra los helmintos parásitos de Boa constrictor Linnaeus, 1758 en el sur del estado de Quintana Roo, México. Se analizaron un total de 14 boas, recolectadas en 5 localidades, entre julio 2009 y septiembre 2010. En la revisión helmintológica se obtuvieron 133 parásitos individuales: 70 nemátodos (Contracaecum sp. tipo 2 larvas de Moravec, Kohn et Fernandes, 1993, Cruzia sp., Kalicephalus subulatus Molin, 1861, Physocephalus sp.), 62 digeneos (Styphlodora horridum [Leidy, 1850]) y 1 acantocéfalo en estado larval no identificado. Los nemátodos K. subulatus, Physocephalus sp. y Cruzia sp. tuvieron los valores de prevalencia más altos, mientras que el resto de helmintos presentaron valores menores al 10%. La mayor abundancia e intensidad media correspondió a S. horridum, aunque éste sólo parasitó a 1 boa. Se sugiere que B. constrictor participa como un hospedero definitivo para los helmintos adultos (Cruzia sp., K. subulatus y S. horridum), como uno paraténico para algunas larvas (Physocephalus sp.) y accidental para otras (Contracaecum sp. tipo 2 y probablemente también para el cistacanto). Este es el primer trabajo sistemático sobre los helmintos parásitos de B. constrictor en Quintana Roo, donde se presentan nuevos registros de hospedero (Contracaecum sp. tipo 2, Cruzia sp., Physocephalus sp.) y geográficos (K. subulatus, S. horridum).
We report the helminth fauna of Boa constrictor Linnaeus, 1758 in southern Quintana Roo, Mexico. A total of 14 boas were collected in 5 localities from July 2009 to September 2010. The helminthological examination revealed the presence of 133 individuals: 70 nematodes (Contracaecum sp. type 2 larvae of Moravec, Kohn et Fernandes, 1993, Cruzia sp., Kalicephalus subulatus Molin, 1861, Physocephalus sp.), 62 digeneans (Styphlodora horridum [Leidy, 1850]) and 1 unidentified larval acanthocephalan. The nematodes K. subulatus, Physocephalus sp. and Cruzia sp. were the most prevalent; while the remaining helminths showed values lower than 10%. The digenean S. horridum was the most abundant and intense parasite, although it was found in only 1 host. It is suggested that B. constrictor participates as a definitive host for those adult helminths (Cruzia sp., K. subulatus and S. horridum), as a paratenic host (Physocephalus sp.) and as an accidental one (Contracaecum sp. type 2, larval acanthocephalan) for some larval stages. This work represents the first systematic survey on the parasitic helminth fauna of B. constrictor in Quintana Roo; therefore, it includes 3 new (Contracaecum sp. type 2, Cruzia sp., Physocephalus sp.) and 2 geographical records (K. subulatus, S. horridum).
México, al igual que Australia, Colombia, Indonesia y Brasil, es considerado como uno de los países con mayor riqueza específica de reptiles en el mundo (Semarnat, 2008), con 804 especies descritas (Flores-Villela y Canseco-Márquez, 2004), de las cuales un poco más del 18% (145) se presentan en la península de Yucatán (Lee, 2000). Particularmente, de los 3 estados de México que conforman dicha península, Quintana Roo tiene una de las mayores faunas de reptiles, con 106 especies (Calderón-Mandujano y Cedeño-Vázquez, 2011). Como parte importante de esta riqueza, se encuentra a la boa o mazacuata, B. constrictor Linnaeus, 1758, que a diferencia de otras serpientes, no es venenosa, pero sí peligrosa por la cantidad de dientes que posee y su hábito constrictor (Sánchez et al., 2004). Se alimenta, principalmente de aves, reptiles y mamíferos pequeños o medianos (Álvarez-Romero et al., 2005), lo que le confiere un papel ecológico importante al servir de regulador de poblaciones de presas y ubicarse en la parte alta de la cadena trófica (Sánchez, 1999). Adicionalmente, la boa tiene gran relevancia económica, ya que forma parte del mercado negro de piel y mascotas, mientras que sus huesos y carne son y han sido históricamente usados por el ser humano (Malkin, 1958; Dodd, 1986; Lee, 1996). Como sucede con la mayoría de las poblaciones silvestres de organismos, la boa también está expuesta a sufrir infecciones parasitarias. A pesar de esto, el conocimiento sobre sus parásitos en la península de Yucatán es escaso. Por tanto, el presente trabajo muestra la fauna parasitaria de la boa en la parte sur del estado de Quintana Roo.
Materiales y métodosConsiderando que la boa es una especie protegida en la Nom-059 (Semarnat, 2010), los ejemplares utilizados para este trabajo fueron aquellos encontrados muertos en carreteras o predios, pero que todavía se encontraban en buen estado. La búsqueda y recolecta de ejemplares se llevó a cabo de julio 2009 a septiembre 2010. Para ello, se realizó una salida mensual, en vehículo, hacia los caminos primarios y secundarios del sur del estado. Los recorridos se realizaron desde tempranas horas de la mañana (6:307:00 am), hasta antes del mediodía, cubriendo distancias aleatorias (Altos de Sevilla-84 km, Andrés Quintana Roo-104 km, Bacalar-40 km, Huay Pix-13 km, Laguna Guerrero-27 km, Mahahual-140 km, Morocoy-70 km, Nicolás Bravo-67 km, Palmar-35 km, Raudales-32 km, Reforma-62 km, Tres Garantías-98 km y Uvero-160 km) y siempre iniciando en la ciudad de Chetumal (Fig. 1).
Cada boa encontrada fue colocada inmediatamente en una bolsa de plástico y en una nevera con abundante hielo para detener el proceso de descomposición. Posteriormente, en el laboratorio se les tomó la longitud total con la ayuda de una cinta métrica. Con el fin de extraer las vísceras, se realizó una incisión a lo largo de la línea media ventral del cuerpo (Munson, 1999). Los procedimientos de fijación y preservación de los parásitos se realizaron de acuerdo con las técnicas propuestas para cada grupo de parásitos por Vidal-Martínez et al. (2001). La caracterización de las infecciones -prevalencia, abundancia e intensidad media- sigue los parámetros descritos por Bush et al. (1997). Los parásitos fueron identificados con el uso de literatura especializada (Byrd et al., 1940; Schad, 1962; Ubelaker y Dailey, 1966; Fernandes y Artigas, 1975; Vidal-Martínez et al., 2001). Todos los helmintos fueron depositados en la Colección de Parásitos de El Colegio de la Frontera Sur, Unidad Chetumal (Núms. ECOPA 059-065). Algunas de las serpientes recolectadas fueron depositadas en la Colección Herpetológica del Museo de Zoología de Ecosur, Unidad Chetumal (Núms. ECO-CH-H 2782, 2783, 2787).
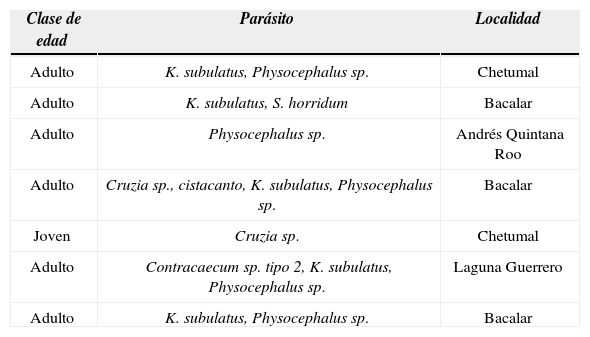
ResultadosUn total de 14 boas fueron encontradas en distintas localidades: Andrés Quintana Roo (19°09’44.20” N, 88°06’13.33” O) (n= 1), Bacalar (18°40’41.89” N, 88°23’32.70” O) (4), Chetumal (18°30’10.74” N, 88°18’12.85” O) (7), Huay Pix (18°30’55.50” N, 88°23’32.02” O) (1) y Laguna Guerrero (18°41’23.69” N, 88°15’58.39” O) (1). Seis de las boas recolectadas estuvieron en estado adulto (LT= 1.320-1.635 m), 4 jóvenes (0.705-0.964 m) y 4 crías (0.490-0.648 m). Huay-Pix fue la única localidad donde no se encontraron parásitos. Las boas del resto de las localidades tuvieron entre 1-5 especies de parásitos, siendo Bacalar la que presentó la mayor riqueza específica (5). La prevalencia de infección fue de 50%, ya que sólo 7 boas (6 adultos, 1 joven), de las 14 revisadas, presentaron al menos 1 especie de helminto (Cuadro 1).
Registro parasitológico y geográfico de las boas (Boa constrictor) parasitadas
| Clase de edad | Parásito | Localidad |
|---|---|---|
| Adulto | K. subulatus, Physocephalus sp. | Chetumal |
| Adulto | K. subulatus, S. horridum | Bacalar |
| Adulto | Physocephalus sp. | Andrés Quintana Roo |
| Adulto | Cruzia sp., cistacanto, K. subulatus, Physocephalus sp. | Bacalar |
| Joven | Cruzia sp. | Chetumal |
| Adulto | Contracaecum sp. tipo 2, K. subulatus, Physocephalus sp. | Laguna Guerrero |
| Adulto | K. subulatus, Physocephalus sp. | Bacalar |
De las boas parasitadas se recolectaron 133 ejemplares de parásitos distribuidos en 3 taxa: Nematoda (adultos de Kalicephalus subulatus Molin, 1861, Cruzia sp., y larvas de Physocephalus sp., Contracaecum sp. tipo 2 larvas de Moravec, Kohn et Fernandes, 1993), Digenea (Styphlodora horridum [Leidy, 1850]= S. lachesidis) y Acanthocephala (no identificado por estar en estadio de cistacanto). Los que presentaron los valores de prevalencia más altos fueron los nemátodos K. subulatus, Physocephalus sp. y Cruzia sp., mientras que el resto de los helmintos tuvieron porcentajes menores al 10%. Por su parte, S. horridum tuvo los mayores valores de abundancia e intensidad media; mientras que los menores fueron para el acantocéfalo no identificado y Contracaecum sp. tipo 2. Los 3 sitios de infección parasitados fueron: riñón, estómago e intestino grueso (Cuadro 2).
Parámetros de infección de los parásitos encontrados en Boa constrictor (n= 14) en el sur del estado de Quintana Roo. Abreviaturas: SI, sitio de infección; AM, abundancia media; IM, intensidad media; R, riñón; IG, intestino grueso; E, estómago
| Parásito | SI | Boas inf | Núm. de parásitos | Preval. (%) | AM | IM |
|---|---|---|---|---|---|---|
| Digenea (adulto) Styphlodora horridum§ | R | 1 | 62 | 7 | 4.4±16.5 | 62±0 |
| Acanthocephala Cistacanto NI | IG | 1 | 1 | 7 | 0.07±0.3 | 1±0 |
| Nematoda (adultos) Kalicephalus subulatus§ | IG | 5 | 51 | 36 | 3.6±6.3 | 10.2±6.9 |
| Cruzia sp.* | IG | 2 | 5 | 14 | 0.3±0.9 | 2.5±0.7 |
| Larvas Physocephalus sp.* | E | 5 | 13 | 36 | 0.9±1.7 | 2.6±2.0 |
| Contracaecum sp. tipo 2* | IG | 1 | 1 | 7 | 0.07±0.3 | 1±0 |
Este trabajo representa el primer estudio sistemático sobre la parasitofauna de la boa, ya que los estudios previos, tanto nacionales como internacionales, sólo consideraron la revisión de un hospedero y una localidad (MacCallum, 1921; Thatcher, 1963, 1964; Ubelaker y Dailey, 1966; Mosqueda-Cabrera, 2003; Sánchez et al., 2004; Ribeiro-Barbosa et al., 2006; Gómez y Sánchez, 2007), o se basaron en un grupo particular de helmintos (Nematoda) (Viquez, 1935; Bursey y Brooks, 2011). La diferencia en el tamaño de muestra analizada entre éste y otros trabajos (14 vs. 2), se vio reflejada en una mayor riqueza de helmintos parásitos (6), en comparación con los estudios antes mencionados (1-4). Cabe señalar, que en los trabajos de Sánchez et al. (2004) y Ribeiro-Barbosa et al. (2006) se registró una riqueza baja (4 y 3 spp., respectivamente), ya que únicamente se analizaron las heces de animales en cautiverio, lo que da como resultado que sólo sean registrados los parásitos que habitan el tracto digestivo.
De la parasitofauna previamente registrada para B. constrictor en otros estados de la República Mexicana (MacCallum, 1921; Thatcher, 1964; Telford, 1965; Lamothe-Argumedo, 1997; Mosqueda-Cabrera, 2003; Paredes-León et al., 2008), 9 especies (Amblyomma dissimile, Crepidobothrium gerrardi, Gnathostoma sp., G. binucleatum, Macdonaldius colimensis, M. oschei, Ophionyssus natricis, Porocephalus calvatus, Telorchis corti) no fueron encontradas en el presente estudio. Posiblemente, esto puede estar relacionado con las diferencias ecológicas que se presentan en cada región y que son producto del tipo de hábitat estudiado, tipo y disponibilidad de presas (hospederos intermediarios), así como de las condiciones medioambientales y las relaciones tróficas.
Al comparar la parasitofauna de la boa con especies de otros géneros de serpientes (Epicrates, Corallus), pertenecientes a la misma familia (Boidae), este mismo patrón se repite. Esto es, son trabajos parasitológicos donde sólo se revisaron 1 o 2 hospederos y se encontraron pocas especies de helmintos (Ruiz y Pérez, 1959; Caubisens-Poumarau, 1968; Teixeira De Freitas, 1968; Martínez et al., 1999; Silva et al., 2006). De manera general, se registra en promedio una especie de helminto por cada hospedero, lo que hace suponer que la boa tiene una parasitofauna relativamente más grande que sus congéneres (14 spp.), aunque hay que considerar el bajo tamaño de muestra hasta ahora analizado para el resto de bóidos. Por su parte, la mayoría de los vipéridos (Viperidae) tienen una riqueza de parásitos baja (1-3 spp.), excepto para Bothrops asper (6) (Caballero y Caballero, 1949; Paredes-León et al., 2008). Algo similar sucede con los colúbridos, donde la mayoría han presentado entre 1-8 especies, aunque dentro de esta familia hay serpientes que tienen parasitofaunas relativamente ricas, tales como Leptodeira septentrionalis (8), Thamnophis eques (12), Drymarchon corais (13) y T. melanogaster (15) (Thatcher, 1963; Ubelaker y Younus, 1965; Paredes-León et al., 2008). Bush et al. (1990) demuestran que la herpetofauna (anfibios+reptiles) presenta una comunidad compuesta por pocas especies de parásitos (2.0±1.7), la cual es menor que la que se presenta en mamíferos y aves (3.4±2.5, 4.3±4.3, respectivamente). Otro punto relevante es el tipo de ambiente que habitan los hospederos y que puede generar una mayor o menor riqueza de parásitos. En general, aquellos organismos relacionados con hábitats acuáticos o semiacuáticos; por ejemplo, colúbridos; tienen una fauna de helmintos mayor que aquellos relacionados totalmente con el ambiente terrestre (Pérez-Ponce de León y García-Prieto, 2001; Paredes-León et al., 2008). Por lo anterior, se podría inferir que, en general, la parasitofauna de las serpientes netamente terrestres es pobre, probablemente debido a que no son hospederos naturales para muchos parásitos o a la escasa disponibilidad de formas infecciosas en su ambiente.
La infestación por helmintos en las boas presentó una diferenciación muy evidente cuando se consideró el estado de desarrollo de los hospederos, ya que sólo las boas adultas y 1 en estado juvenil, resultaron parasitadas. Por su parte, todas las crías y la mayoría de los jóvenes estuvieron libres de parásitos. Esto puede ser debido a que los organismos más grandes han tenido un mayor tiempo de exposición hacia los agentes infecciosos o a que su presencia está fuertemente relacionada con el tipo de alimentación de cada una de las clases de edad (crías-jóvenes-adultos). De manera general, las boas pequeñas (≤ 1.5 m), a pesar de ser capaces de cazar anfibios, reptiles -por ejemplo, lagartijas pequeñas- mamíferos pequeños y aves, incluyendo huevos y polluelos, tienen una dieta más restringida que los adultos, los cuales pueden depredar iguanas, agutíes, mapaches, coatíes, hocofaisanes, murciélagos y monos (Álvarez-Romero et al., 2005, 2008; Quick et al., 2005).
De las 6 especies de helmintos encontradas en este trabajo, sólo 2 de ellas (K. subulatus y S. horridum) habían sido previamente registradas en B. constrictor (Caballero y Caballero y Vogelsang, 1950; Thatcher, 1963; Ubelaker y Dailey, 1966; Gómez y Sánchez, 2007; Bursey y Brooks, 2011). La primera, es una especie muy común en las boas y posiblemente es específica para este hospedero (Schad, 1962; Bursey y Brooks, 2011); en tanto que la segunda, parece ser menos específica, ya que ha sido registrada en varias familias de serpientes (Boidae, Colubridae y Viperidae) (Thatcher, 1963). La especie S. lachesidis es actualmente considerada como un sinónimo de S. horridum (Dawes, 1942; Thatcher, 1963). La biología de ambas especies no está bien definida, pero es posible que K. subulatus tenga un ciclo de vida directo y que la adquisición de la larva infectante sea por medio del alimento o agua (Jacobson, 2007), aunque la perforación cutánea activa también es posible (Sánchez et al., 2004). Schad (1956) sugiere que las larvas pudieran adherirse a la lengua de las serpientes cuando éstas la sacan para “probar” el ambiente, aunque también existe la posibilidad de que las larvas infectivas invadan a algunos moluscos y anfibios, los cuales pudieran servir como hospederos pasajeros (Anderson, 2000). Para S. horridum, no se conoce prácticamente nada sobre los detalles de su ciclo de vida, aunque algunos anfibios pueden servir como hospederos intermediarios (Hamann et al., 2012). Respecto del resto de los helmintos, Physocephalus sp., Contracaecum sp. tipo 2 y el acantocéfalo no identificado, pueden considerarse como infestaciones accidentales, producto de la ingesta de presas como: peces, anfibios, reptiles, aves y mamíferos; que actúan como hospederos comunes para estos estadios larvales. Esta aseveración puede sustentarse si consideramos el sitio de infección de las larvas, ya que éstas, generalmente se encuentran encapsuladas en las paredes de los órganos, cavidad corporal y tejidos asociados (mesenterios), pero cuando están libres en el tracto digestivo, tal como pasó en esta ocasión, pueden ser parte de la parasitofauna de las presas consumidas o tratarse de individuos recién reclutados, propios de los cocodrilos. Para el caso particular de Cruzia sp., este nemátodo no pudo ser identificado hasta nivel de especie, debido al escaso material recolectado, aunque algunas características morfológicas del único macho disponible, sugieren que pudiera representar una nueva especie.
Por lo tanto, todos los helmintos adultos son parásitos característicos de la boa, mientras que la presencia de las larvas puede considerarse como accidental y producto de la dieta de la serpiente. Del total de especies aquí documentadas, K. subulatus y S. horridum representan nuevos registros geográficos, mientras que Contracaecum sp. tipo 2, Cruzia sp. y Physocephalus sp. son registradas por primera vez en este hospedero.
En este estudio, los nemátodos fueron el grupo mejor representado en cuanto al número de especies. Esto puede estar muy relacionado con el tipo de géneros encontrados, ya que 2 de ellos: Kalicephalus y Cruzia, tienen ciclos de vida directos, y su infección es continua y común; esto aunado a que muchas de las presas de la boa son mamíferos que son parasitados por nemátodos de los géneros antes mencionados y que pasan al sistema digestivo una vez que la presa ha sido digerida. Este patrón no es raro, ya que se sabe que los 2 grupos de helmintos con la mayor riqueza de especies en los vertebrados de México, incluyendo a los reptiles, son los Nematoda y Digenea (Pérez-Ponce de León y García-Prieto, 2001).
A pesar de que se trabajó con organismos atropellados, es importante hacer mención que los parásitos pertenecientes a los géneros Styphlodora y Kalicephalus presentan cierta importancia clínica, debido a que ocasionan letargo, debilidad, anorexia y hemorragias internas en el intestino y heces con sangre en los reptiles (Jacobson, 2007). Sin embargo, ninguna de las boas analizadas durante este estudio presentó daños evidentes y que puedan estar relacionados con la presencia de los parásitos, aun cuando esto sólo puede asegurarse con los estudios histológicos pertinentes. Aparentemente, las 2 especies de helmintos encontradas (K. subulatus, S. horridum) generan poco o nulo daño sobre sus hospederos, ya que son especies comunes en la boa y el daño que se infringen mutuamente es mínimo. Kennedy (1975) señala que cuando el parásito es habitual, el hospedero lo trata como parte de su tejido y cesa su respuesta hacia él. Además, se sabe que los parásitos con menor especificidad hospedatoria son más patógenos que aquellos con una alta especificidad (Adamson y Caira, 1994).
Si consideramos que la boa es una de las pocas especies de serpientes que es consumida por el hombre en varias regiones de México, es importante determinar la existencia de helmintos que pudieran transmitirse al ser humano. De las especies de helmintos aquí registradas, la mayoría no tienen potencial zoonótico, a excepción de los nemátodos del género Contracaecum, los cuales han sido considerados como los agentes causales de la anisakidosis humana, que se adquiere al consumir carne cruda de peces o pobremente cocida (McCarthy y Moore, 2000). Por su parte, hasta la fecha, ninguna especie de Styphlodora ha sido registrada como agente causal de zoonosis, aunque un género (Plagiorchis) dentro de la misma familia (Plagiorchiidae) infecta humanos cuando éstos consumen carne cruda de peces en Corea (Guk et al., 2007).
Cabe señalar que, aunque no fue encontrado en este estudio, el nemátodo Gnathostoma binucleatum Almeyda-Artigas, 1991 sí tiene un alto potencial zoonótico y ha sido registrado en la musculatura de boas en la cuenca del Papaloapan (entre Oaxaca y Veracruz) (Mosqueda-Cabrera, 2003). Dicha especie es una de las responsables de generar la gnathostomosis en humanos, una enfermedad infecciosa emergente en México y que se adquiere al consumir carne cruda de pez o mal cocida (Lamothe-Argumedo y Osorio-Sarabia, 1998; Ogata et al., 1998; Almeyda-Artigas et al., 2000; León-Regagnon et al., 2002). Por tanto, es importante monitorear su presencia para evitar posibles infecciones en humanos al momento de consumir la carne de esta serpiente.
Es necesario seguir documentando la diversidad de parásitos en hospederos poco estudiados o con alguna categoría de protección, ya que eso nos permitirá conocer más profundamente la relación parásito-hospedero y poder generar planes de manejo y conservación adecuados para las especies que pretendemos proteger.
A la MTI Janneth A. Padilla Saldívar por su valiosa ayuda en la elaboración del mapa. A Luis Gómez por su apoyo en la búsqueda de literatura de difícil acceso. Al Consejo Quintanarroense de Ciencia y Tecnología, por el apoyo económico otorgado a FJDG.