Eichhornia crassipes y Eichhornia azurea son plantas acuáticas invasivas comunes en humedales del neotrópico. Estas plantas comparten especies para su control biológico, como curculionoideos del género Neochetina y el acridio Cornops aquaticum. En este trabajo se analizó la herbivoría de estos insectos específicos en hojas de E. azurea y E. crassipes, en periodo de crecimiento y decaimiento de las poblaciones de plantas; asimismo, se comparó la herbivoría de C. aquaticum en ambas especies de plantas. Los muestreos se realizaron en 2 humedales del noreste argentino, entre enero y febrero de 2006 (periodo de crecimiento) y agosto de 2006 (periodo de decaimiento). En cada fecha de muestreo, se recolectaron muestras de hojas de E. azurea y E. crassipes. La herbivoría se midió como el área foliar dañada y el porcentaje del área foliar dañada por herbívoros. La herbivoría fue mayor en periodo de crecimiento que en el decaimiento en las 2 especies de hospederas. La herbivoría de C. aquaticum en el periodo de decaimiento fue del 0.34% en E. azurea y del 0.44% en E. crassipes; en el periodo de crecimiento el daño producido por este acridio fue mayor en E. azurea (16.19%) que en E. crassipes (6.92%). Durante el periodo de decaimiento, solo en E. crassipes la herbivoría por C. aquaticum fue menor que la de las especies de Neochetina. La efectividad de la herbivoría varió entre periodos de crecimiento poblacional de las plantas. Los resultados muestran la importancia de considerar la acción combinada de estos herbívoros en el control biológico de estas plantas acuáticas.
Eichhornia crassipes and Eichhornia azurea are common invasive aquatic plants in Neotropical wetlands. These plants share species for their biological control, such as curculionoids of the genus Neochetina and the acridium Cornops aquaticum. In this study the herbivory of these specific insects was analyzed in leaves of E. azurea and E. crassipes, in period of growth and decay of plant populations; likewise, the herbivory of C. aquaticum was compared in both species of plants. Sampling was taken in 2 wetlands in the Argentine northeast, between January and February 2006 (growth period) and August 2006 (period of decay). At each sampling date, leaf samples of E. azurea and E. crassipes were collected. The herbivory was measured as the damaged leaf area and percentage of the leaf area damaged by herbivores. The herbivory was higher in growth period than in the decay in the 2 host species. The herbivory of C. aquaticum in the decay period was 0.34% in E. azurea and 0.44% in E. crassipes; in the growing period the damage caused by this acridium was higher in E. azurea (16.19%) than in E. crassipes (6.92%). During the decay period, only in E. crassipes, the herbivory by C. aquaticum was lower than that of the Neochetina species. The effectiveness of the herbivory varied between periods of population growth of the plants. The results show the importance of considering the combined action of these herbivores in the biological control of these aquatic plants.
Los estudios en insectos herbívoros asociados a plantas invasivas en los ambientes originarios o nativos son fundamentales para identificar los posibles agentes de control biológico y encarar estrategias de manejo, control y restauración de ambientes invadidos por plantas acuáticas (Center, Hill, Cordo y Julien, 2002; Keane y Crawley, 2002). Entre estas plantas, Eichhornia crassipes (Mart.) Solms y Eichhornia azurea (Kunth) Solms se distinguen por su alta biomasa, cobertura y su amplia distribución en los humedales del neotrópico (Gopal, 1973; Milne, Murphy y Thomaz, 2006; Neiff, Casco y Poi de Neiff, 2008). Eichhornia crassipes constituye la maleza más importante a nivel mundial (Center et al., 2002), su naturaleza altamente invasiva se debe a la reproducción vegetativa y a la elevada tasa de productividad primaria neta (Gopal, 1973) que puede alcanzar hasta 13.8 toneladas por hectárea por año en humedales del neotrópico (Lallana, 1980). Estas características hacen que su erradicación de los ecosistemas afectados sea casi imposible y que el control de su proliferación sea muy difícil, en especial en países que no cuentan con los recursos económicos necesarios para invertir en proyectos de manejo de estas plantas (Gutiérrez, Arreguín, Huerto y Saldaña, 1994; Harley, 1990). Por su parte, E. azurea presenta una raíz anclada al sustrato (Gopal, 1973) lo que hace más lenta su expansión y transporte a ecosistemas foráneos. Sin embargo, su reproducción es muy rápida y eficiente, teniendo la capacidad de producir más de 5,000 semillas por individuo, generando cada planta a su vez más de 1,200 plantas por reproducción vegetativa (Zettler y Freeman, 1972).
Ecológicamente, estas especies difieren en cuanto a su bioforma y adaptación al medio acuático, siendo E. crassipes una planta flotante libre, mientras que E. azurea es una planta arraigada de hojas flotantes. Estas 2 especies de plantas hospederas tienen distribuciones solapadas en el neotrópico y pueden coexistir en humedales siempre que haya condiciones óptimas para ambas (Milne et al., 2006).
Las 2 especies de plantas también comparten géneros y especies de insectos herbívoros específicos, que han sido catalogados dentro de la lista de agentes de control biológico (Cordo, 1999; Harley, 1990; Julien, 2001; Julien, Griffiths y Wright, 1999; Labrada, 1996; Winston et al., 2014). Entre estos insectos, se distinguen los curculionoideos del género Neochetina (Hustache, 1926) y el acridio Cornops aquaticum (Bruner, 1906), debido a que constituyen los herbívoros más abundantes numéricamente y de mayor biomasa en las poblaciones de E. azurea y E. crassipes en el neotrópico (Capello, Marchese y de Wysiecki, 2013; Casco y Poi de Neiff, 1998; Gallardo, Franceschini, Poi de Neiff y de Wysiecki, 2015; Martínez, 2016). Neochetina eichhorniae (Warner, 1970) y Neochetina bruchi (Hustache) constituyen los agentes de control biológico más utilizados en E. crassipes ya que son altamente específicos, comparten nichos similares, pero no compiten debido a que los sitios de oviposición y de alimentación de las larvas son diferentes dentro de la planta (DeLoach y Cordo, 1976). Neochetina affinis (Hustache) ha sido poco estudiada y si bien ocurre en las 2 especies de Eichhornia ha sido más relacionada a E. azurea (DeLoach y Cordo, 1981; Morrone y O’Brien, 1999). El acridio C. aquaticum constituye un posible agente de control biológico para áreas invadidas por E. crassipes (Hill y Oberholzer, 2000) debido a su efectividad para remover la biomasa de esta planta (Bownes, Hill y Byrne, 2010; Franceschini, de Wysiecki, Poi de Neiff, Galassi y Martínez, 2011) y por alcanzar altas densidades poblacionales en E. azurea y E. crassipes (Capello, de Wysiecki y Marchese, 2011; Franceschini, Neiff y Amedegnato, 2011; Gallardo et al., 2015). Sin embargo, este acridio continúa bajo estudio debido a que no ha logrado establecerse exitosamente en los ecosistemas invadidos por E. crassipes en Sudáfrica (Hill, com. pers.) y por presentar oligofagia en condiciones naturales y polifagia en laboratorio (Capello et al., 2011; Ferreira y Vasconcellos-Neto, 2001; Franceschini, Martínez y de Wysiecki, 2014).
Si bien se ha estudiado ampliamente el ciclo de vida, la especificidad alimentaria y la abundancia de estos insectos herbívoros específicos, no existe hasta el momento información de cómo varía la herbivoría en los distintos periodos de crecimiento de sus plantas hospederas, ni tampoco cuantificaciones que evalúen comparativamente, y en simultáneo, el daño que puede ocasionar una misma especie de herbívoro en 2 plantas hospederas diferentes. En los humedales subtropicales, los insectos herbívoros y las plantas hospederas tienen un fuerte componente estacional, determinado en gran parte por las temperaturas. En estos humedales, las poblaciones de E. crassipes y E. azurea exhiben un patrón de crecimiento estacional (Bini, 1996; Center y Spencer, 1981; Da Silva y Esteves, 1993; Neiff et al., 2008; Wilson, Niels y Rees, 2005), con una reducción de biomasa en invierno que corresponde al periodo de decaimiento. El periodo de crecimiento inicia a fines de invierno y primavera, dependiendo de la especie de planta y se caracteriza por un incremento en los valores de biomasa, con un máximo pico de biomasa en verano que llega a ser de hasta un 50% mayor de los valores observados en el periodo de decaimiento. En el periodo de crecimiento, las plantas presentan hojas más largas y con mayor tamaño de lámina foliar respecto al de decaimiento (Franceschini, Poi de Neiff y Galassi, 2010; Neiff et al., 2008). Esto se traduce en distinta cantidad de recurso disponible para los herbívoros (DeLoach y Cordo, 1976; Franceschini et al., 2010), especialmente para aquellos que tienen alta especificidad con la planta hospedera. Asimismo, la abundancia total de los insectos herbívoros y los estadios de desarrollo varían estacionalmente, con picos máximos de abundancia y reproducción en primavera y verano (Capello et al., 2013; Franceschini et al., 2011a; Franceschini, Poi de Neiff y de Wysiecki, 2013). Por lo tanto, es de esperar marcadas diferencias en los valores de herbivoría entre el periodo de crecimiento y el de decaimiento de las plantas hospederas. Eichhornia azurea y E. crassipes constituyen diferente oferta para los herbívoros en cuanto a la calidad del recurso alimentario y microhábitat. Esto se debe a las diferencias en cuanto a la arquitectura, bioforma y composición química, especialmente en lo que se refiere al contenido de N, P y lignina (Martínez, Franceschini y Poi de Neiff, 2013; Milne et al., 2006), por lo que se espera encontrar diferencias en los niveles de herbivoría que produce una especie de insecto herbívoro específico, como C. aquaticum, en 2 especies de hospederas distintas.
Los objetivos de este trabajo fueron analizar la herbivoría de insectos específicos asociados a las hojas de E. azurea y E. crassipes, en el periodo de crecimiento y decaimiento de las poblaciones de plantas, y comparar la herbivoría producida por C. aquaticum, en E. azurea y E. crassipes.
Materiales y métodosLos muestreos se realizaron en 2 humedales del noreste de Argentina, el madrejón El Puente y la laguna Pampín. El madrejón El Puente (27°26’S, 58°51’O) está ubicado en la planicie de inundación del río Paraná, presenta su superficie cubierta de vegetación flotante, con E. crassipes como especie dominante y alberga poblaciones de los herbívoros C. aquaticum, N. eichhorniae y N. bruchi. Este humedal tiene comunicación con el río Paraná y durante el periodo de estudio estuvo en una fase de aguas bajas prolongada, debido al estiaje, con pocos meses en aguas altas. La laguna Pampín (27°30’S, 58°45’O) se encuentra a 14km del madrejón El Puente, no presenta conexión con ningún río, por lo cual el nivel del agua depende básicamente de las lluvias; este humedal tiene vegetación emergente, sumergida y flotante, y E. azurea constituye la planta hospedera de los herbívoros C. aquaticum y N. affinis. Además de la conectividad, la diferencia entre ambos humedales también está determinada por las variables fisicoquímicas tales como la conductividad, pH, oxígeno disuelto, tipo de sedimento y el contenido de nitrógeno en agua (Carignan y Neiff, 1992; Ostrowski-de Núñez, Hamann y Rumi, 1991; Poi de Neiff y Carignan, 1997; Rumi y Hamann, 1992).
Dado que la abundancia de los insectos herbívoros puede variar de acuerdo al estado sucesional de la vegetación (Schowalter, 1985, 2011), estos humedales fueron seleccionados debido a que las plantas estudiadas estuvieron presentes en una etapa sucesional tardía, con bajo disturbio, cubriendo entre el 40 y 80% del espejo de agua, E. azurea y E. crassipes, respectivamente. El clima del área de estudio es subtropical, con muy pocos días con heladas (Bruniard, 1981, 1996). Durante el periodo de estudio las temperaturas absolutas variaron entre 1.2-37.2°C en los meses de invierno (decaimiento) y entre 15.7-42.4°C en los meses de verano (crecimiento).
Para comparar la herbivoría total por insectos en los distintos periodos de crecimiento de las plantas y la herbivoría de C. aquaticum entre especies de plantas hospederas, los muestreos se realizaron en 2 fechas distintas, entre enero y febrero de 2006 (periodo de crecimiento) y en agosto de 2006 (periodo de decaimiento), en simultáneo para E. azurea y E. crassipes. Para cada especie de planta y fecha de muestreo se tomaron por triplicado muestras de 10 hojas provenientes de individuos diferentes, que fueron extraídas en los márgenes (proximal y distal), y en el centro de la densa cobertura vegetal flotante que forman estas especies de plantas dentro del humedal (Franceschini et al., 2010), haciendo un total de 120 hojas muestreadas.
Los valores de herbivoría en hoja fueron calculados como daño promedio por lámina foliar considerando el daño acumulativo producido por los herbívoros desde que la hoja se despliega hasta que alcanza la madurez; estudios preliminares permitieron determinar que este periodo es de 30 días en las hojas de E. crassipes y E. azurea en el área de estudio, lo cual asegura que el daño acumulativo medido en hojas no se superponga entre las 2 fechas de muestreo. La herbivoría fue cuantificada en hojas verdes maduras, excluyendo las hojas jóvenes y no desplegadas (Boyd, 1978; Mattson, 1980). Los valores de herbivoría se expresaron como área foliar dañada (mm2) y porcentaje de la lámina foliar dañada por los herbívoros (%).
Para asociar las distintas especies de insectos herbívoros con el tipo de daño producido en E. crassipes y E. azurea se realizaron observaciones y recolectas de herbívoros de las 8:00 a las 13:00h, en los márgenes y centro de la cobertura vegetal y en los distintos periodos de crecimiento. Los insectos fueron recolectados con redes entomológicas y trasladados al laboratorio en bolsas de plástico trasparente. Para la recolecta de insectos se consideró el mismo esfuerzo de muestreo en cada especie de planta. En el laboratorio, los herbívoros fueron colocados en cajas de plástico trasparente de 32×23×11cm con hojas sanas de las especies de plantas en cuestión, a fin de confirmar la asociación de cada insecto herbívoro con el tipo de daño producido.
Los valores de herbivoría fueron calculados como daño promedio por hoja. Para calcular el daño por hoja, se cuantificó el tamaño del área foliar y la herbivoría en cada hoja obteniendo imágenes digitales que fueron procesadas con el programa ImageJ 1.44. (Abramoff, Magalhaes y Ram, 2004; Rasband, 2014). El área dañada por C. aquaticum (mm2) se midió directamente con el software mencionado. Las especies de Neochetina producen abrasiones circulares en forma de máculas de tamaño regular (DeLoach y Cordo, 1976, 1981). Para calcular el daño por hoja producido por estos curculionoideos se obtuvo primeramente un promedio del área de la mácula; posteriormente el daño producido en cada hoja fue obtenido multiplicando este valor por el número total de máculas en cada lámina foliar. Para obtener el promedio de área de mácula se midió un total de 1,595 máculas en las hojas. Se consideró el tamaño de lámina foliar y la densidad de hojas como variables indicadoras de la cantidad de recurso disponible en los periodos de decaimiento y crecimiento. La densidad de hojas en cada especie de planta hospedera se determinó contando el número de hojas contenido en una superficie delimitada por un aro de aluminio de 0.33 m2, considerando 3 replicas por especie de planta y fecha de muestreo.
En todos los datos se analizó la normalidad (prueba de Shapiro-Wilk) y homogeneidad de varianzas (prueba de Levene). Las diferencias en el tamaño de lámina foliar y densidad de hojas entre periodos de crecimiento de las plantas se evaluó mediante Anova de un factor y la comparación de las medias con prueba post-hoc de Tukey. Para comparar estadísticamente el daño total de insectos entre periodos de crecimiento y el daño de C. aquaticum entre especies de hospederas se utilizaron los valores de porcentaje de área foliar dañada, para eliminar el efecto del tamaño del área foliar que varía entre especies de plantas y entre periodos. Estas comparaciones se realizaron mediante Anova de un factor con prueba post-hoc de Tukey, transformando previamente las variables a arcoseno. Por otro lado, cuando se comparó la herbivoría de C. aquaticum versus la de Neochetina dentro de una misma especie de hospedera y periodo de crecimiento, se utilizaron los valores absolutos de herbivoría (mm2). Como estos datos de herbivoría no cumplieron con los requisitos del Anova, las diferencias entre especies de insectos se evaluaron con modelos lineales mixtos generalizados, analizándose los promedios del área dañada por los insectos herbívoros (variable respuesta), en función de «planta» y «periodo» (factores fijos) y el sitio de la muestra (factor aleatorio). Los valores se expresaron como promedio y error estándar de la media (±). Se consideraron significativas las diferencias con una p<0.05. Los análisis estadísticos se realizaron con el Software Infostat versión 2015 (Di Rienzo et al., 2014).
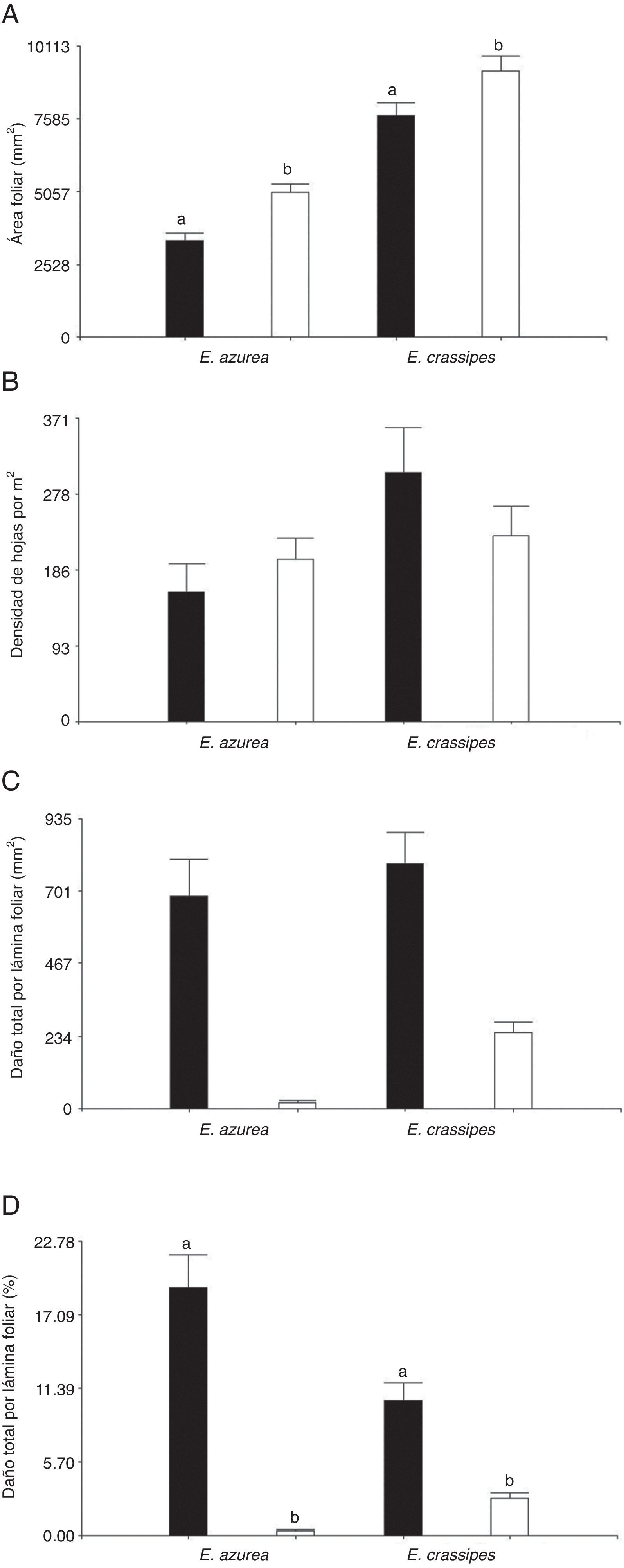
ResultadosLa cantidad de recurso disponible para los insectos herbívoros fue diferente según los periodos de crecimiento de las especies hospederas. El área foliar de E. azurea y E. crassipes fue distinta entre periodos de crecimiento (F=19.91, p<0.0001, n=60 y F=5.2, p<0.0263, n=60, respectivamente). Ambas plantas hospederas mostraron un área foliar mayor en época de decaimiento, siendo 1.5 y 1.2 veces mayor en E. azurea y en E. crassipes respectivamente, con relación al área foliar cuantificada en el periodo de crecimiento (fig. 1A). Si bien la densidad de hojas de E. crassipes en el periodo de crecimiento fue 1.34 veces más alta que la registrada en el periodo de decaimiento, esta variable no fue estadísticamente diferente entre periodos en esta especie hospedera (F=1.44, p=0.296, n=60) ni en E. azurea (F=0.86, p=0.407, n=60) (fig. 1B). En ambos periodos muestreados se confirmó la presencia de C. aquaticum y N. affinis en E. azurea, y de C. aquaticum, N. eichhorniae y N. bruchi en E. crassipes.
Disponibilidad de recurso y herbivoría de insectos en láminas foliares de E. azurea y E. crassipes, en el periodo de crecimiento (negro) y el periodo de decaimiento (blanco) en los humedales el madrejón El Puente y la laguna Pampín, del noreste de Argentina. A, Área foliar (mm2); B, densidad de hojas por m2; C, área foliar dañada por hoja (mm2); D, porcentaje de lámina foliar dañada por insectos. Los valores indican promedio y error estándar de la media.
Cornops aquaticum produjo lesiones de tamaño y forma irregular, en el centro y margen de la hoja, que fueron de tipo abrasiones y perforaciones. Las abrasiones fueron causadas principalmente por las ninfas de los primeros estadios; en este tipo de daño los tejidos no son removidos completamente y el tejido más basal persiste en las zonas afectadas. Las perforaciones implican una remoción completa de los tejidos y fueron producidas principalmente por los adultos, pudiendo también ser ocasionadas por las ninfas de últimos estadios. El tamaño de las perforaciones fue de hasta 2,465mm2 y el de las abrasiones de hasta 427mm2. Las especies de Neochetina produjeron abrasiones en forma de máculas, de tamaño regular, e indistinguibles entre sí. Las máculas fueron realizadas mayoritariamente en el haz. El tamaño promedio de las máculas producidas en el haz fue de 2.77mm2 (±0.02, n=1,402), mientras que el tamaño promedio de las producidas en el envés fue de 0.87mm2 (±0.02, n=195).
Los insectos herbívoros removieron en promedio hasta 684mm2 de área foliar en E. azurea y hasta 790mm2 en E. crassipes en el periodo de crecimiento, con un daño aparentemente similar en ambas especies de plantas (fig. 1C). Sin embargo, cuando estos valores se analizaron en porcentaje, se pudo apreciar que el impacto que los herbívoros generaron fue diferente en cada especie de planta hospedera. En E. azurea el porcentaje de hoja dañada por herbivoría durante el periodo de crecimiento alcanzó en promedio hasta el 20.47%, mientras que en E. crassipes fue solo del 10.27% (fig. 1D), debido a que el tamaño de área foliar de E. crassipes es mayor que el de E. azurea (fig. 1A). En el periodo de decaimiento, los valores de herbivoría fueron menores en E. azurea respecto a E. crassipes; esta tendencia se observó tanto en valores absolutos (fig. 1C) como en porcentaje (fig. 1D). Cuando se compara el porcentaje de lámina foliar dañada entre periodos, hubo diferencias significativas en ambas especies hospederas (fig. 1D), siendo mayor la herbivoría en el periodo de crecimiento que en el periodo de decaimiento tanto en E. azurea (F=114.09, p<0.0001, n=60) como en E. crassipes (F=34.08, p<0.0001, n=60). La herbivoría en E. azurea en el periodo de crecimiento fue 54 veces más alta que la producida en el periodo de decaimiento; en E. crassipes la herbivoría en el periodo de crecimiento fue 4 veces más alta a la producida en el periodo de decaimiento (fig. 1D).
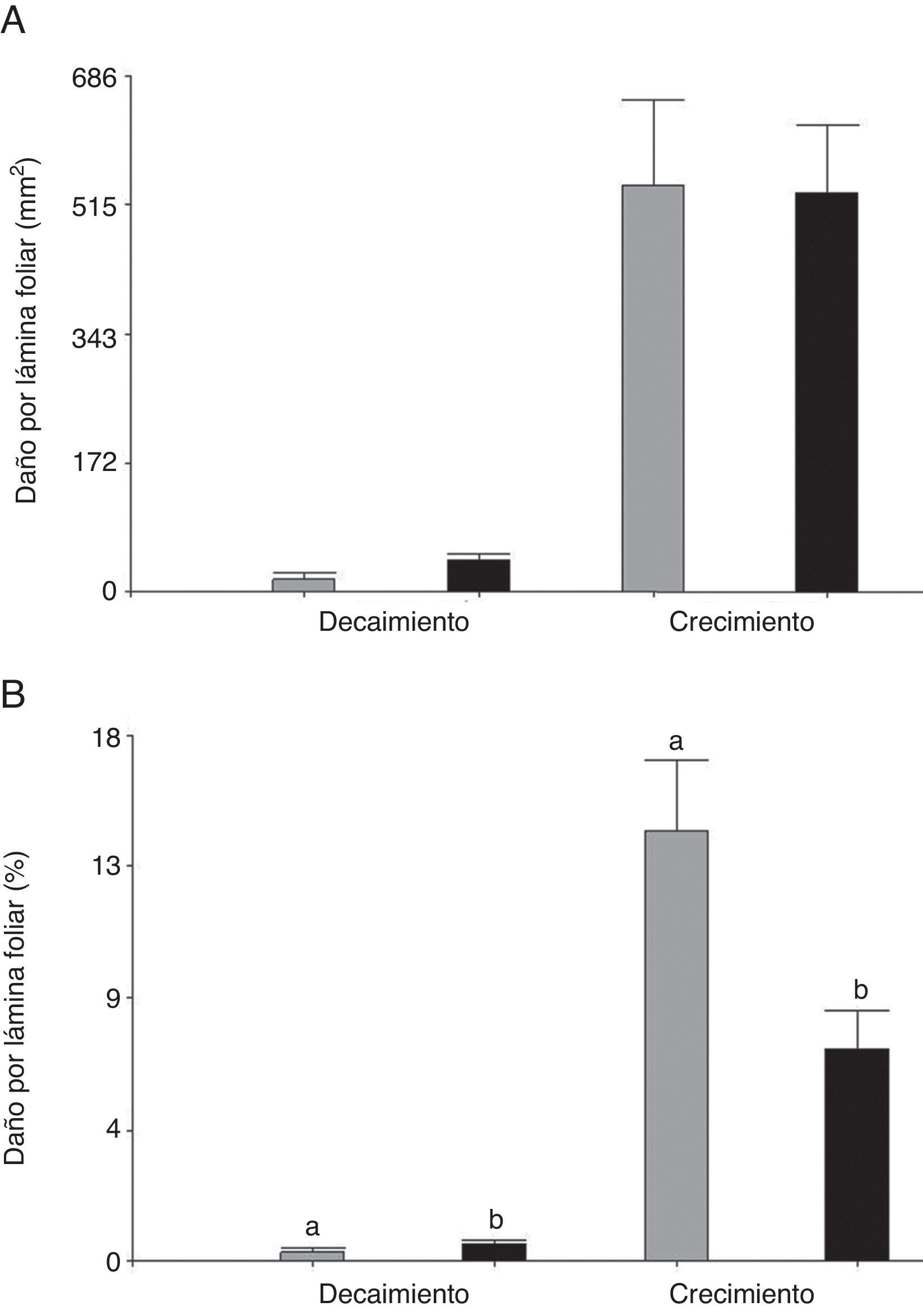
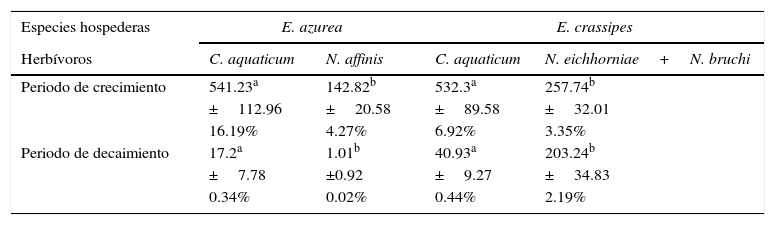
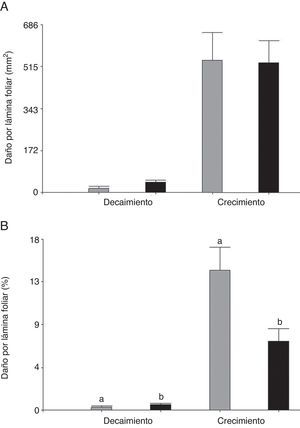
Al comparar la herbivoría de C. aquaticum en las 2 especies de hospederas se observó que el área foliar removida por este acridio fue mayor durante el periodo de crecimiento respecto al de decaimiento (fig. 2A). Cuando los valores de herbivoría de C. aquaticum se expresaron como porcentaje de área foliar dañada, hubo diferencias significativas entre plantas hospederas. En el periodo de decaimiento, los porcentajes de daño de área foliar exhibieron el mismo patrón que los valores absolutos de área foliar dañada (mm2), con valores significativamente más altos en E. crassipes (F= 4.20, p=0.05, n=60) donde el daño promedio alcanzó el 0.44% (±0.01), mientras que en E. azurea el promedio fue de 0.34% (±0.01). En el periodo de crecimiento, la herbivoría fue significativamente más alta en E. azurea (F=5.48, p=0.03, n=60) donde el daño promedio alcanzó el 16.19% (±0.03), mientras que en E. crassipes el promedio fue de 6.92% (±0.03) (fig. 2B, tabla 1). Cuando se comparan los valores de área foliar dañada por C. aquaticum con el daño producido por las especies de Neochetina, en E. azurea C. aquaticum generó un daño significativamente mayor que N. affinis tanto en el periodo de crecimiento (F=13.42, p<0.001, n=60) como en el de decaimiento (F=4.27, p<0.0479, n=60). En esta planta hospedera, C. aquaticum produjo un daño entre 4 y 17 veces mayor que el que produjo N. affinis (tabla 1).
Daño producido por C. aquaticum (Orthoptera: Acrididae) en láminas foliares de E. azurea (gris) y E. crassipes (negro) en diferentes periodos de crecimiento de las plantas hospedadoras en los humedales el madrejón El Puente y laguna Pampín, del noreste de Argentina. A, Área foliar dañada (mm2) por hoja; B, porcentaje de la lámina dañada. Los valores indican promedio y error estándar de la media.
Herbivoría de C. aquaticum con relación a las especies de Neochetina en las 2 plantas hospederas en los humedales el madrejón El Puente y la laguna Pampín, del noreste de Argentina. La herbivoría se expresa como área foliar removida por hoja (mm2) y porcentaje de área foliar removida por los herbívoros.
| Especies hospederas | E. azurea | E. crassipes | ||
|---|---|---|---|---|
| Herbívoros | C. aquaticum | N. affinis | C. aquaticum | N. eichhorniae+N. bruchi |
| Periodo de crecimiento | 541.23a | 142.82b | 532.3a | 257.74b |
| ±112.96 | ±20.58 | ±89.58 | ±32.01 | |
| 16.19% | 4.27% | 6.92% | 3.35% | |
| Periodo de decaimiento | 17.2a | 1.01b | 40.93a | 203.24b |
| ±7.78 | ±0.92 | ±9.27 | ±34.83 | |
| 0.34% | 0.02% | 0.44% | 2.19% | |
Se indican promedio y error estándar (±), así como porcentaje de área dañada por herbívoros. Dentro de cada especie de planta hospedera, letras distintas (a, b) indican diferencias significativas en la herbivoría producida entre especies de herbívoros.
En E. crassipes las tendencias fueron diferentes en cada uno de los periodos de las poblaciones de plantas; el área foliar dañada por C. aquaticum fue significativamente mayor respecto al producido por N. bruchi y N. eichhorniae en la época de crecimiento (F=9.48, p<0.0045, n=30), mientras que en época de decaimiento el daño por C. aquaticum fue significativamente más bajo que el de ambas especies de Neochetina (F=20.27, p<0.0001, n=30). En esta especie hospedera, el daño de C. aquaticum fue el doble al producido por N. eichhorniae y N. bruchi en el periodo de crecimiento, mientras que en decaimiento ambas especies de Neochetina produjeron un daño 5 veces mayor que el producido por C. aquaticum (tabla 1).
DiscusiónLos valores de área foliar registrados durante el periodo de crecimiento en ambas especies fueron bajos, siendo en E. crassipes 1.65 veces menor al obtenido previamente en el área de estudio (Franceschini et al., 2010). Si se considera el patrón de tamaño obtenido para las láminas foliares de ambas plantas en los 2 periodos estudiados, los herbívoros tuvieron una mayor disponibilidad de recursos en época de decaimiento, lo cual es un patrón opuesto al esperado, y al encontrado previamente para estas plantas y sus herbívoros (DeLoach y Cordo, 1976; Franceschini et al., 2010). De acuerdo a lo obtenido anteriormente en E. crassipes, en el periodo de decaimiento las hojas de menor tamaño presentan mayor contenido de nitrógeno en los tejidos (1.7-2%) respecto a las hojas del periodo de crecimiento, que son de mayor tamaño y con menor contenido de nitrógeno (1-1.4%).
Los mayores tamaños de área foliar en periodo de decaimiento respecto al periodo de crecimiento pudieron ser el resultado de las elevadas temperaturas observadas durante todo el ciclo anual. En el periodo de decaimiento se registraron temperaturas absolutas máximas de hasta 37.2°C, lo que pudo haber influido en el mayor tamaño de área foliar de ambas plantas durante este periodo.
En cuanto a la densidad de hojas, se observó un patrón diferente según la especie de hospedera. En E. crassipes los bajos valores de área foliar pudieron estar sobrecompensados con una tendencia a la mayor densidad de hojas en el periodo de crecimiento. En E. azurea la menor densidad de hojas y menor tamaño de lámina foliar en el periodo de crecimiento pudo estar ocasionado por la disminución drástica de la cobertura y biomasa de esta especie, debido a la disminución marcada del nivel del agua de este humedal durante este periodo (Franceschini, Adis, Poi de Neiff y de Wysiecki, 2007). En humedales de Brasil no se han encontrado diferencias estacionales en el crecimiento y biomasa de E. azurea (Ikusima y Gentil, 1993).
La inclusión de un mayor número de variables de disponibilidad de recurso de las especies hospederas, como la biomasa total de las plantas, biomasa foliar, área foliar específica, que contemplen la variación interanual, además de la variación entre periodos de crecimiento de las plantas, contribuiría a dilucidar este aspecto en futuras investigaciones de herbivoría. Estos estudios deberían también analizar la relación de las variables medioambientales y fisicoquímicas del agua, especialmente el contenido de nutrientes en agua, para tener una interpretación más integral de los factores que regulan la disponibilidad de recurso y la calidad del microhábitat para los herbívoros.
De acuerdo a los valores obtenidos, el 10.3 y 20.5% de área foliar dañada por los herbívoros en E. crassipes y E. azurea en el periodo de crecimiento, podría considerarse que la herbivoría en estas plantas es alta, según los criterios de Dirzo y Domínguez (2002), quienes plantean que la herbivoría es baja cuando los valores de daño están entre el 1-5% del área foliar, intermedia del 5-10% y alta cuando los valores de daño superan el 10%. Estos criterios han sido formulados para especies de plantas de selvas bajas caducifolias, por lo que los taxones de herbívoros, tipos de daño y patrones entre estos ecosistemas terrestres y los acuáticos podrían ser muy contrastantes, especialmente cuando los valores de herbivoría se calculan a nivel de individuo, poblaciones y comunidades de plantas. Sin embargo, estos criterios son empleados para comparar los resultados obtenidos debido a que estos autores hacen referencia al daño por hoja, y fundamentalmente porque hasta el momento no se cuenta con criterios generales para caracterizar la herbivoría de plantas acuáticas por la escasa información que hay para ambientes subtropicales (Esteves, 2011).
El patrón de herbivoría se caracterizó por presentar mayores valores en el periodo de crecimiento respecto al periodo de decaimiento. Este patrón se observó considerando tanto los valores absolutos de área foliar dañada como el porcentaje de lámina foliar dañada por los herbívoros para cada especie de planta hospedera. Franceschini et al. (2010) encontraron que el porcentaje de área foliar dañada por herbivoría en E. crassipes varió entre el 11% en periodo de crecimiento y el 6% en periodo de decaimiento. Los valores de herbivoría en el periodo de crecimiento obtenidos son muy similares a los de este estudio, a diferencia de los valores dados para el periodo de decaimiento que son 2.6 veces más altos. El 20.47% de área foliar removida por los herbívoros en E. azurea en el periodo de crecimiento es 1.86 veces mayor al registrado para E. crassipes en este estudio y previamente (Franceschini et al., 2010) para este mismo periodo. El mayor porcentaje de área foliar dañada por los herbívoros en E. azurea respecto a E. crassipes durante época de crecimiento se debe a que, si bien los valores absolutos de daño no difieren demasiado entre especies, el tamaño de la lámina de E. azurea es 2.3 veces más pequeño que el de la de E. crassipes.
Mayor herbivoría en periodo de crecimiento respecto al de decaimiento es coincidente con los patrones de abundancia que tienen las especies de los herbívoros estudiadas, las cuales exhiben un mayor número de individuos en el periodo de crecimiento que en el de decaimiento (Casco y Poi de Neiff, 1998; DeLoach y Cordo, 1981; Franceschini et al., 2011b; Franceschini et al., 2013). Los resultados de este estudio muestran que durante la época de decaimiento de la biomasa de Eichhornia, la disminución de la herbivoría podría estar más relacionada con la capacidad homeostática, y las adaptaciones de los herbívoros a las condiciones climáticas invernales, que con la cantidad de recursos que ofrece la hoja de las plantas hospederas para los herbívoros estudiados. En este sentido, Clissold, Coggan y Simpson (2013) demostraron que los insectos herbívoros presentan un comportamiento termorregulador a través del cual son capaces de alimentarse según el gradiente térmico, minimizando el costo energético que le representa digerir y absorber nutrientes con temperaturas desfavorables, logrando afrontar los retos nutricionales específicos impuestos por la variación ambiental. Esto indica que la temperatura es uno de los factores ambientales que influyen notablemente en la relación planta-herbívoro.
Si bien E. azurea y E. crassipes representan diferente oferta de calidad de recurso alimentario y de microhábitat (Martínez et al., 2013; Milne et al., 2006), en el periodo de crecimiento C. aquaticum remueve similares valores de área foliar en E. azurea y E. crassipes (tabla 1), indicando que este insecto tuvo una eficiencia similar de consumo en ambas plantas hospederas durante este periodo. Sin embargo, el menor tamaño de la área foliar que presentan las hojas de E. azurea hace que el impacto de este insecto sea mucho mayor, lo que se ve reflejado en los porcentajes de daño por hoja obtenidos en el periodo de crecimiento, que son hasta 2.3 veces más altos en esta planta comparados con los obtenidos en E. crassipes.
En el periodo de decaimiento, C. aquaticum consume mayor área foliar y remueve mayor porcentaje de la lámina foliar en E. crassipes, respecto a E. azurea. Esto podría estar en relación con el comportamiento que exhiben las poblaciones de este insecto durante el invierno respecto a las características del microhábitat que ofrece cada planta hospedera. Mientras que las poblaciones de C. aquaticum permanecen durante el invierno y el verano alimentándose en E. crassipes (Franceschini et al., 2013), las poblaciones de este insecto asociadas a E. azurea migran durante el invierno a los pirizales de la Cyperaceae Oxycaryum cubense, que le provee de mejor calidad de microhábitat durante esta época desfavorable (Franceschini et al., 2011b). Asimismo, el consumo de O. cubense por parte de C. aquaticum fue confirmado tanto en situación de laboratorio (Franceschini et al., 2011b) como de campo (Capello et al., 2011). Al igual que E. crassipes, O. cubense crece como una densa mata de vegetación flotante, con plantas que alcanzan entre 106 a 120cm de altura, con altos valores de biomasa y densidad foliar comparadas con E. azurea (Franceschini et al., 2011b; Franceschini et al., 2013).
Respecto a la herbivoría de C. aquaticum en las 2 plantas hospederas, los valores son notablemente más altos en el periodo de crecimiento respecto al de decaimiento en ambas plantas hospederas, y estaría en relación con la mayor abundancia y biomasa poblacional de este acridio en verano. Asimismo, los patrones de herbivoría observados en este trabajo y los de abundancia, biomasa y consumo poblacional obtenidos previamente en el área de estudio (Capello et al., 2013; Franceschini et al., 2007, 2013; Gallardo et al., 2015) indican que las poblaciones de C. aquaticum tienen mayor eficacia de consumo en el periodo de crecimiento en ambas plantas hospederas.
Si se comparan el área foliar dañada por todos los insectos con el área foliar removida por C. aquaticum se observa que el daño de este acridio puede representar del 79 al 94% del daño total por herbivoría en E. azurea, en el periodo de decaimiento y crecimiento, respectivamente. Debido a que en E. crassipes el daño de C. aquaticum representa del 16.8 a 67% del daño total de herbivoría, la acción combinada de este acridio junto con el daño producido por N. bruchi y N. eichhorniae contribuirían a aumentar el impacto de la herbivoría en esta planta hospedera en programas de control biológico en áreas nativas de estos insectos, especialmente en la época de decaimiento donde la herbivoría total disminuye. En coincidencia, Sanders, Theriot y Theriot (1982) encontraron un elevado nivel de ataque combinado de 3 especies de controladores biológicos y un patógeno, observando una sustancial reducción de E. crassipes. Asimismo, según DeLoach y Cordo (1976), la permanencia de las 2 especies de Neochetina en E. crassipes durante todo el año sería importante para lograr un mayor impacto en ambos periodos de crecimiento, debido a que N. eichhorniae es más resistente en condiciones de baja temperatura, mientras que N. bruchi está más adaptada a las temperaturas altas. En áreas donde E. crassipes tienen alta productividad y es muy prolifera, el estrés ocasionado por los herbívoros no es suficiente para obtener el nivel de control deseado (Sanders et al., 1982), por lo que el manejo integrado de insectos herbívoros con patógenos podrían ser efectivo para disminuir la cobertura de esta planta en ambientes invadidos.
Al igual que Neochetina y C. aquaticum, más de 15 especies de insectos e invertebrados muestran alta especificidad y tienen su ciclo de vida asociado a E. crassipes y E. azurea (Center et al., 2002; Cordo, 1999). De acuerdo a lo observado en E. azurea en el periodo de crecimiento, los factores ambientales extremos o de carácter antrópico pueden modificar drásticamente la cobertura de las plantas hospederas, trayendo como consecuencia la disminución de la cantidad de recursos alimentarios y de sitios de oviposición disponibles para los herbívoros sin que se modifique el patrón de herbivoría. Esto lleva a pensar que si el efecto es prolongado afectando la capacidad de resiliencia del humedal y la pérdida de la calidad del microhábitat, las especies de herbívoros asociadas a E. azurea y E. crassipes, pueden verse enormemente afectadas en especial en el periodo de crecimiento, donde la herbivoría se presenta con mayor intensidad. Entre estas especies de herbívoros especial interés revisten para las redes tróficas de estos sistemas las especies semiacuáticas y/o con larvas endófitas que tienen alta especificidad, como Neochetina spp y C. aquaticum que exhiben alta abundancia poblacional y herbivoría intermedia a alta.
En el caso de C. aquaticum, especie que está bajo estudio en ecosistemas exóticos como agente controlador de E. crassipes (Bownes et al., 2010; Bownes, King y Nongogo et al., 2011; Julien, 2012), los resultados de herbivoría obtenidos en este estudio muestran que su acción como controlador biológico podría ser factible, y que el porcentaje de área foliar removida por este insecto es considerable en ambas especies de Eichhornia. Estudios de las interacciones de este acridio con el resto del ecosistema (especificidad alimentaria, depredadores en ecosistemas naturales y exóticos y los factores que afectan el establecimiento y reproducción de sus poblaciones), permitirán un mejor manejo de este insecto como biocontrolador de E. crassipes en otras regiones del neotrópico.
Este estudio fue financiado con los PICT 2160-2011 y PICT 1910-2015 de la Agencia de Promoción Científica y Tecnológica, Argentina. Se agradece la colaboración de los técnicos de campaña Casimiro Roberto y Pablo Bertoni durante las salidas de campo.
La revisión por pares es responsabilidad de la Universidad Nacional Autónoma de México.