En el presente trabajo se analizó la riqueza específica, abundancia y actividad de la comunidad de arañas Mygalomorphae en la Reserva Natural Sierra del Tigre, Buenos Aires, Argentina. Este ecosistema serrano alberga numerosas especies endémicas y es rico en fauna y flora nativa. La abundancia de arañas se muestreó mensualmente desde mayo de 2011 a mayo de 2012, mediante recolección manual y trampas de caída. Las especies registradas en el área de estudio fueron Actinopus sp. 1 (Actinopodidae), Grammostola vachoni Schiapelli y Gerschman, 1960; Plesiopelma longisternale Schiapelli y Gerschman, 1942 y Catumiri argentinense (Mello-Leitão, 1941) (Theraphosidae). Grammostola vachoni resultó la especie dominante en la recolección manual y Actinopus sp. 1 en trampas de caída. Se discuten y analizan la variación estacional, diversidad y abundancia de la comunidad de migalomorfas. Las Mygalomorphae del sistema de Tandilia comprenden un grupo importante de arañas sedentarias y criptozoicas que parecen depender del tipo de ambiente y factores ambientales.
We documented the specific richness, abundance and activity of the Mygalomorph spider community in the Natural Reserve Sierra del Tigre, Buenos Aires, Argentina. This hilly ecosystem is home for many endemic species and rich in native fauna and flora. Spider abundance was sampled monthly from May 2011 - May 2012 by hand capture and pitfall traps. The species recorded in the study area were Actinopus sp. 1 (Actinopodidae), Grammostola vachoni Schiapelli y Gerschman, 1960; Plesiopelma longisternale Schiapelli y Gerschman, 1942 and Catumiri argentinense (Mello-Leitão, 1941) (Theraphosidae). Grammostola vachoni was the dominant species in hand capture and Actinopus sp. 1 in pitfall traps. The seasonal variation, diversity, and abundance of the mygalomorph community are analyzed and discussed here. The Mygalomorphae of the Tandilia system comprises an important group of sedentary and cryptozoic spiders that seem to be dependent on habitat type and environmental factors.
Las arañas comprenden uno de los grupos más numerosos del reino animal, con más de 43 000 especies descritas hasta la actualidad (Platnick, 2012) y ocupan una gran variedad de biótopos (Coddington y Levi, 1991; Foelix, 2011). Consecuentemente, las arañas son un grupo adecuado para estimar cambios en la estructura y calidad del hábitat (Wheater et al., 2000). En Argentina, actualmente se realizan numerosos estudios sobre las comunidades de arañas en áreas alteradas o modificadas (Beltramo et al., 2006; Ávalos et al., 2007; Armendano y González, 2010) y las investigaciones referidas a aspectos ecológicos de comunidades de arañas en áreas naturales de Argentina se han incrementado en los últimos años (Corronca y Abdala, 1994; Ávalos et al., 2005, 2007; Rubio et al., 2008; Grismado et al., 2011; Ferretti et al., 2010; López-Lezama, 2010; Ferretti et al., 2012).
La presencia de arañas migalomorfas en una comunidad aumenta su diversidad filogenética, debido a que constituyen un grupo basal con buena divergencia en relación con el resto de las arañas (Faith, 1992; Bond et al., 2006). La mayoría de las especies de migalomorfas son especialistas en sus ambientes, como así también extraordinariamente sedentarias (Main, 1987; Coyle y Icenogle, 1994).
Las sierras de Tandil se encuentran en el sudeste de la provincia de Buenos Aires, Argentina. Dicho sistema forma un conjunto de serranías que se extienden en sentido noroeste-sudeste, formando un cordón de alrededor de 300 km de largo y 60 km de ancho máximo. Hasta el presente, no existen antecedentes en el estudio sobre aspectos ecológicos de este grupo particular de arañas en las sierras de Tandil. El objetivo de esta nota es estimar la riqueza específica, abundancia y actividad de la comunidad de arañas Mygalomorphae en la Reserva Natural Sierra del Tigre.
La Reserva Natural Sierra del Tigre (37°22’46” S, 59°7’44” O) se encuentra en el sistema serrano de Tandilia, al sudeste de la provincia de Buenos Aires, Argentina (Fig. 1). La reserva comprende un área aproximada de 142 ha y las altitudes máximas alcanzan los 350 a 400 m snm. El clima es templado pampeano con temperaturas medias anuales de 13° C y con precipitaciones anuales de aproximadamente 900 mm (Velázquez et al., 1998).
El muestreo se llevó a cabo mensualmente de mayo de 2011 a mayo de 2012. Se colocaron 10 trampas de caída (cilíndricos de plástico de 23 cm de diámetro y 15 cm de alto, Churchill y Arthur, 1999) a lo largo de un transecto en línea recta de 100 m; cada trampa separada 10 m de la siguiente. En cada trampa se colocaron aproximadamente 1 500 ml de etilenglicol como líquido conservante. Las trampas se mantuvieron durante aproximadamente 1 mes. Además, se realizaron 12 muestreos manuales a lo largo de transectos, 250 m de largo y 9 m de ancho, sucesivos y adyacentes. Tres recolectores trabajaron en una franja de 3 m de ancho dentro del transecto, durante 4 h ininterrumpidas, buscando en ambientes criptozoicos. El área cubierta fue de aproximadamente 0.5 ha. El material capturado se conservó en alcohol 70% hasta el momento de su análisis en el laboratorio. Las arañas se determinaron a nivel de especie/morfoespecie. Actinopus sp. 1 constituyó la única morfoespecie que no pudo ser identificada a nivel específico.
Se calculó la riqueza de especies (S), así como la diversidad mediante los índices de Shannon-Whienner (H´) y de Simpson (D). Para analizar el reemplazo de especies temporalmente se obtuvo la diversidad beta mediante el índice de Whittaker (β), calculado como el cociente entre la diversidad gamma (γ), número total de especies presentes en la totalidad de la muestra, y la diversidad alfa (α) promedio, riqueza específica en los distintos meses. Este índice puede tomar valores desde 1, cuando no existe reemplazo de especies, hasta γ, el reemplazo de especies es máximo (Magurran, 2004). Además, se estimó el grado de similitud en cuanto a las abundancias mensuales mediante un análisis de conglomerados, usando como medida de disimilitud la distancia Euclidiana y como método de agrupamiento el encadenamiento promedio o UPGMA. Se utilizó el coeficiente de correlación de Pearson para explorar posibles relaciones lineales entre las abundancias de los individuos con el registro de temperatura y precipitación. Finalmente, se realizó una curva de acumulación de especies utilizando el método de rarefacción basado en el número de individuos (Gotelli y Colwell, 2001) mediante el programa EstimateS, versión 8,0 (Colwell, 2006). Los valores de las variables climáticas utilizadas se obtuvieron de la estación meteorológica Aero-Tandil (876450SAZT) (37°14’ S, 59°15’ O) cercana al área de estudio.
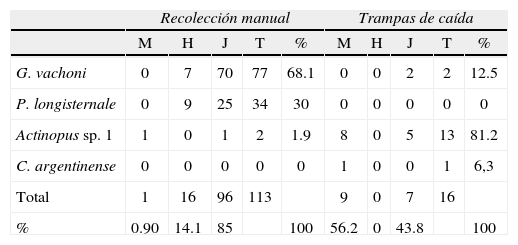
Durante el periodo de estudio se capturó un total de 129 individuos, de los cuales 113 se recolectaron manualmente y 16 en trampas de caída. La riqueza específica obtenida en el área de estudio fue de S=4 y los índices de diversidad mostraron valores de H´=0,93 y D=0,54. Las especies registradas en el área de estudio pertenecieron a 2 familias: Actinopus sp. 1 (Actinopodidae); G. vachoni Schiapelli y Gerschman, 1960 (Theraphosidae); P. longisternale Schiapelli y Gerschman, 1942 (Theraphosidae); y C. argentinense (Mello-Leitão, 1941) (Theraphosidae). Las frecuencias absolutas y relativas de los individuos capturados durante el año de muestreo se presentan en el Cuadro 1.
Frecuencias absolutas y relativas de los individuos capturados mediante recolección manual y trampas de caída durante el periodo de estudio. M=machos, H=hembras, J=juveniles, T=total, %=porcentaje
| Recolección manual | Trampas de caída | |||||||||
| M | H | J | T | % | M | H | J | T | % | |
| G. vachoni | 0 | 7 | 70 | 77 | 68.1 | 0 | 0 | 2 | 2 | 12.5 |
| P. longisternale | 0 | 9 | 25 | 34 | 30 | 0 | 0 | 0 | 0 | 0 |
| Actinopus sp. 1 | 1 | 0 | 1 | 2 | 1.9 | 8 | 0 | 5 | 13 | 81.2 |
| C. argentinense | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 6,3 |
| Total | 1 | 16 | 96 | 113 | 9 | 0 | 7 | 16 | ||
| % | 0.90 | 14.1 | 85 | 100 | 56.2 | 0 | 43.8 | 100 | ||
El número de especies observado resultó similar al hallado en otras áreas naturales de Argentina (Ávalos et al., 2005; Ferretti et al., 2010, 2012) y también de la región Neotropical, como en Amazonia (Höfer 1990), São Paulo, Brasil (Indicatti et al., 2005), Bolivia (Sandoval, 2005) y Uruguay (Pérez-Miles et al., 1993). A pesar de ello, el número de especies en Tandilia seguramente fue subestimado, debido a las ausencias locales en el relevamiento de una especie de Migidae, Calatotharsus simoni Schiapelli y Gerschman, 1975 y de Mecicobothrium thorelli Holmberg, 1882 (Mecicobothriidae) citadas para las localidades de sierra de la Ventana y Tandil.
Grammostola vachoni fue la especie predominante en la recolección manual, constituyendo más del 60% de los individuos recolectados. Actinopus sp. 1 fue la especie más abundante en trampas de caída, con el 81,2% de los individuos recolectados por ese método durante el periodo de estudio. Ambas técnicas mostraron diferente eficiencia entre las especies: la técnica de recolección manual resultó más efectiva para capturar las especies G. vachoni y P. longisternale (Theraphosidae), y la técnica de trampas de caída fue más efectiva para recolectar a Actinopus sp. 1 (Actinopodidae). Catumiri argentinense sólo se capturó mediante trampas de caída. Mediante recolección manual, los juveniles prevalecieron sobre los individuos adultos, con un 85% del total de los individuos recolectados. Por otra parte, en trampas de caída, los adultos fueron ligeramente más abundantes que los juveniles: 56.2 y 43,7%, respectivamente. En trampas de caída, sólo se capturaron machos y juveniles, mientras que en recolección manual las hembras estuvieron presentes con un 14.1%.
Las altas abundancias observadas de G. vachoni y P. longisternale mediante la recolección manual puede explicarse porque este método resulta más efectivo para especies sedentarias que habitan bajo piedras, troncos caídos y estiércol, refugios utilizados en el día, pudiendo ser más activas durante la noche. Asimismo, estas especies generalmente no caen en trampas de caída y requieren de una búsqueda más activa (Pérez-Miles et al., 1993; Ferretti et al., 2010, 2012). Los juveniles de estas especies de tarántulas claramente predominaron sobre los individuos adultos en la recolección manual. Esta dominancia probablemente refleje un largo periodo juvenil de los individuos, sus hábitos crípticos y limitada capacidad de dispersión lejos de la cueva de la madre (Pérez-Miles et al., 1993; Costa y Pérez-Miles, 2002; Shillington y McEwen, 2006).
La curva de acumulación de especies capturadas por ambas técnicas (Fig. 2) mostró que más del 50% de las especies se obtuvieron luego de recolectar aproximadamente 30 individuos y al capturar un total aproximado de 120 individuos, la curva no llegó a una asíntota. El alcance inmediato del 50% de las especies indica la eficiencia del muestreo en el área de estudio, aunque la curva no llegó a una asíntota probablemente debido a las ausencias locales de C. simoni y M. thorelli.
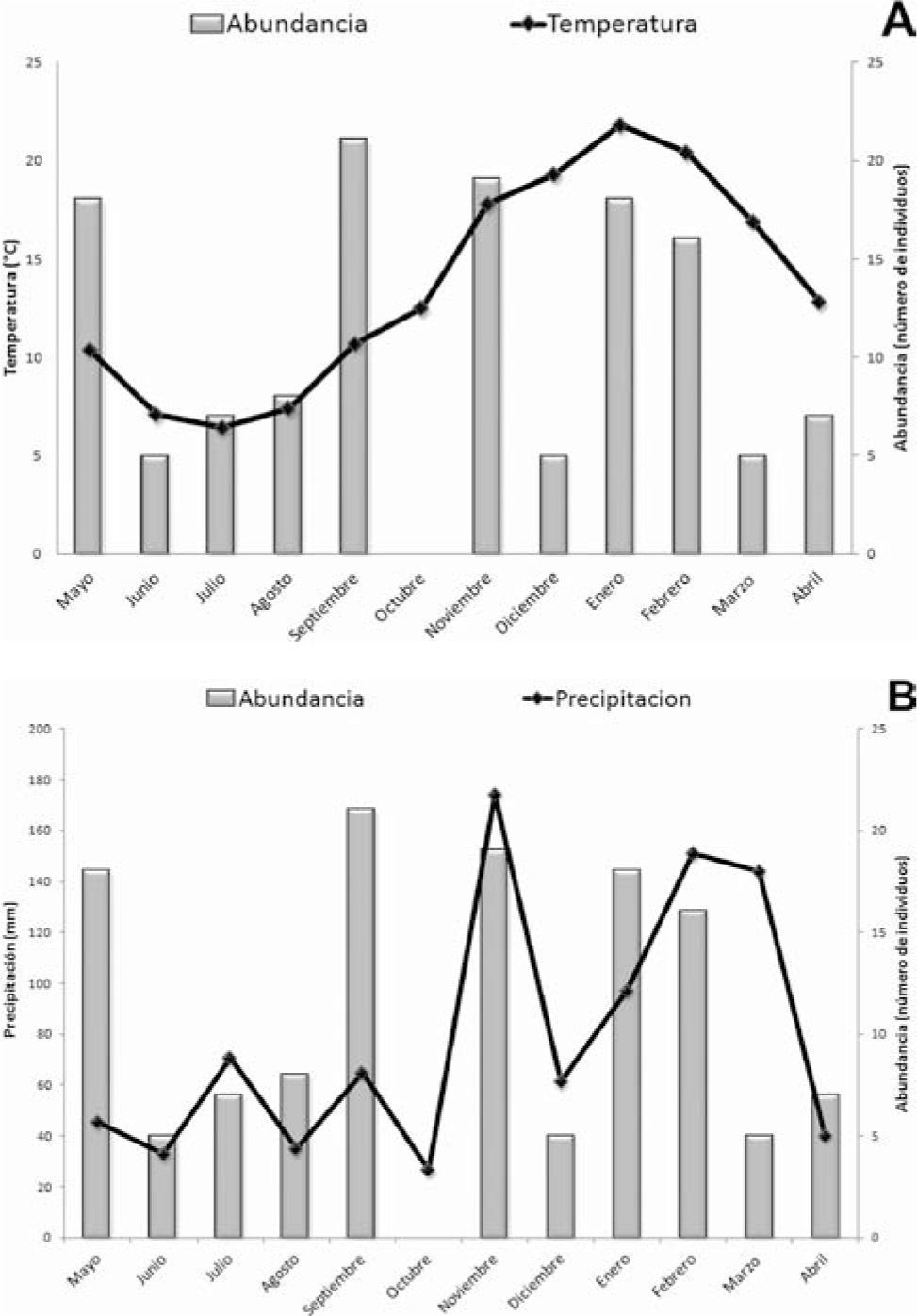
De acuerdo con la diversidad beta temporal para las estaciones se obtuvieron los siguientes valores: β=1.7 para el invierno, junio, julio y agosto, verano; diciembre, enero y febrero, y otoño; marzo, abril y mayo; β=3 para la primavera, septiembre, octubre y noviembre. El mayor recambio de especies tuvo lugar durante la primavera. La similitud entre los diferentes meses diferenció 2 grupos de acuerdo con las abundancias relativas, noviembre, enero, septiembre y mayo fueron los más abundantes, mientras que en el otro grupo restaron los meses de menor abundancia (Fig. 3). Los valores máximos de abundancia se correspondieron con altos valores de temperaturas en el área durante el periodo de estudio, y consecuentemente, los menores valores de abundancia se observaron durante el otoño; marzo y abril; e invierno; junio, julio y agosto (Fig. 4A). No se encontró correlación de la temperatura con la abundancia de migalomorfas (r=-0.284, p=0.37). Sin embargo, durante los periodos de baja precipitación, en los meses de abril, junio, agosto y octubre, la abundancia disminuyó considerablemente. Cuando las precipitaciones fueron altas durante fines de primavera y verano, noviembre, enero y febrero; la abundancia de arañas migalomorfas aumentó, a excepción de marzo (Fig. 4B). A pesar de no haber encontrado correlación de los valores de precipitación con la abundancia de las migalomorfas (r=-0.44, p=0.151), el análisis de conglomerados agrupó los meses con altas abundancias de arañas migalomorfas, los cuáles se correspondieron con altos valores de precipitación. Esto podría explicarse por una mayor disponibilidad de presas y consecuentemente, una mayor actividad de las arañas (Uetz, 1976, Riechert y Luczark, 1982; Ferretti et al., 2010, 2012).
A lo largo del año de muestreo, los machos de Actinopus sp. 1 se observaron desde febrero hasta abril con trampas de caída, correspondiendo a fines de verano y otoño (Fig. 5A). Los juveniles estuvieron activos durante los meses de abril y mayo, en otoño. La actividad sexual de Actinopus sp. 1 en Tandilia es similar a la observada para las especies de Actinopus de Uruguay, Ventania e isla Martín García (Buenos Aires) (Pérez-Miles et al., 1993; Ferretti et al., 2010, 2012). La presencia de numerosos juveniles de pequeño tamaño en trampas de caída durante el mes de mayo estaría indicando que la eclosión y dispersión tendría lugar durante ese periodo, superponiéndose con la actividad sexual de los machos.
No se capturaron machos de G. vachoni con recolección manual ni trampas de caída. Las hembras se observaron durante el verano, diciembre y enero, y en agosto y septiembre (Fig. 5B) y los juveniles durante casi todo el año. Una hembra se observó en el campo manteniendo un saco de huevos durante el mes de diciembre. Los individuos juveniles de esta especie se observaron durante todo el periodo de estudio, con picos de actividad en el verano, primavera y fin del otoño.
No se observaron machos de P. longisternale durante el año de muestreo (Fig. 5C). Las hembras se observaron durante el verano, diciembre-febrero, e invierno y comienzo de primavera, agosto-septiembre,). Por otra parte, los juveniles resultaron más abundantes que las hembras, con la mayor actividad observada en el mes de noviembre, fines de primavera, y febrero, verano.
Se recolectó un macho de C. argentinense con trampa de caída durante el mes de abril, otoño. Contrariamente en Uruguay, C. parvum presenta la mayor actividad sexual durante los meses de septiembre y octubre, primavera (Pérez-Miles et al., 1993; Costa y Pérez-Miles, 2002).
Finalmente, las especies de arañas Mygalomorphae del sistema Tandilia comprenden un grupo importante de arañas sedentarias y criptozoicas, ya que la abundancia y la fenología de dichas especies responden a cambios en factores ambientales como temperatura y precipitación. Las condiciones microclimáticas y la vegetación del área de estudio podrían proveer un hábitat adecuado para dichas especies criptozoicas (Frangi, 1975; Bilenca, 2000; Álvarez et al., 2005; Alonso et al., 2009). Este estudio de la comunidad de Mygalomorphae en una reserva natural contribuye a caracterizar los ambientes involucrados, particularmente los pastizales naturales, aportando información de base para la aplicación de diseños de conservación y manejo.
Los autores desean expresar su gratitud al Ing. Ulises Barletta por permitirnos realizar el estudio en la Reserva Natural Sierra del Tigre; a Claudio Barletta y al Guardaparque Marcelo por su colaboración. Este estudio en parte fue financiado a Alda González, por la Universidad Nacional de La Plata (UNLP N611). N. Ferretti, G. Pompozzi y S. Copperi agradecen a Conicet por becas doctorales y posdoctorales.