Se describen las larvas de tercer estadio y las pupas de Phyllophaga heteronycha (Bates) y P.leonina (Bates) y la larva de tercer estadio de P.angulicollis (Bates), con ejemplares colectados en suelos de una plantación de Pseudotsuga macrolepis (Pinaceae) establecida a 2,300m de altitud en Las Vigas, Veracruz, México. Se incluyen diagnosis comparativas de las larvas del primer y segundo estadios de las 3 especies, ilustraciones de las estructuras características, comentarios sobre las similitudes con larvas de otras especies y una clave para la identificación de las larvas de Phyllophaga en México.
Third instar larvae and pupae of Phyllophaga heteronycha (Bates) and P.leonina (Bates), and third instar larva of P.angulicollis (Bates) are described with specimens collected in soils of a Pseudotsuga macrolepis (Pinaceae) plantation, located at 2,300m in Las Vigas, Veracruz, Mexico. Comparative brief descriptions of larvae of the first and second instars of the 3 species, drawings of diagnostic structures, comments on similarities with other species, and a key to the larvae of Phyllophaga in Mexico are included.
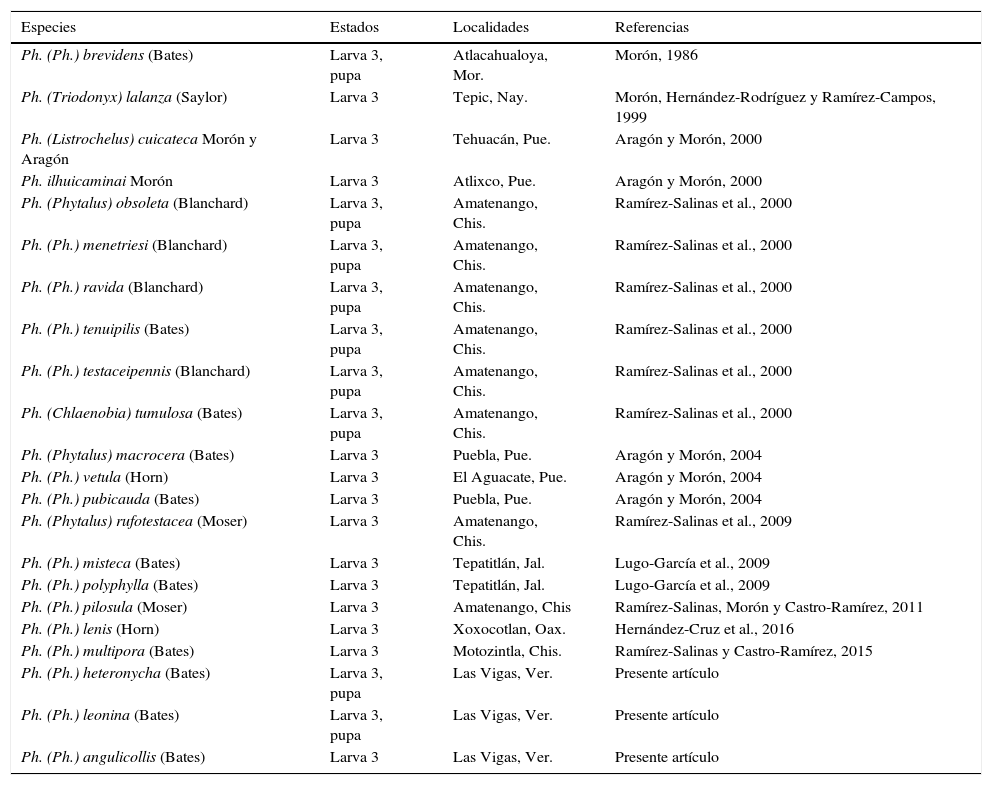
El género Phyllophaga está representado en México por 387 especies, la mayoría restringidas a localidades de montaña; solo 20 de ellas muestran amplia distribución en el país, a veces con extensiones hacia América Central y del Sur o al sur de los Estados Unidos de América (Morón, 1986, 2003, 2010). De esta notable diversidad solo se han descrito las larvas de 22 especies (tabla 1), que en su mayoría se encuentran con frecuencia en terrenos cultivados, donde forman parte de un complejo de especies popularmente conocidas como «gallina ciega». En México este complejo incluye más de 1,200 especies de Melolonthidae y Cetoniidae, incluyendo a Phyllophaga, la mayor parte de las cuales no se alimentan con raíces y no afectan a los cultivos pero sí contribuyen a optimizar las condiciones del suelo (Morón, 2010). Para lograr un programa exitoso de manejo de plagas subterráneas es indispensable la identificación precisa de las especies asociadas al cultivo y el estudio de sus hábitos y ciclos de vida (Ramírez-Salinas, Morón y Castro-Ramírez, 2000; Morón y Rodríguez-del Bosque, 2010). En este sentido es recomendable evaluar la composición específica del complejo «gallina ciega» en cada localidad, para evitar o disminuir los efectos de los medios de control sobre las poblaciones de especies benéficas. Con el propósito de incrementar los recursos para la identificación de la fauna edafícola de México, en este trabajo se presentan las descripciones de las larvas de tercer estadio de Phyllophaga heteronycha (Bates), P.leonina (Bates) y P.angulicollis (Bates), con datos comparativos de las larvas de primero y segundo estadio, así como las descripciones de las pupas de las 2 primeras especies, con observaciones sobre su ciclo vital y sus hábitos.
Especies mexicanas de Phyllophaga cuyos estados inmaduros han sido descritos.
| Especies | Estados | Localidades | Referencias |
|---|---|---|---|
| Ph. (Ph.) brevidens (Bates) | Larva 3, pupa | Atlacahualoya, Mor. | Morón, 1986 |
| Ph. (Triodonyx) lalanza (Saylor) | Larva 3 | Tepic, Nay. | Morón, Hernández-Rodríguez y Ramírez-Campos, 1999 |
| Ph. (Listrochelus) cuicateca Morón y Aragón | Larva 3 | Tehuacán, Pue. | Aragón y Morón, 2000 |
| Ph. ilhuicaminai Morón | Larva 3 | Atlixco, Pue. | Aragón y Morón, 2000 |
| Ph. (Phytalus) obsoleta (Blanchard) | Larva 3, pupa | Amatenango, Chis. | Ramírez-Salinas et al., 2000 |
| Ph. (Ph.) menetriesi (Blanchard) | Larva 3, pupa | Amatenango, Chis. | Ramírez-Salinas et al., 2000 |
| Ph. (Ph.) ravida (Blanchard) | Larva 3, pupa | Amatenango, Chis. | Ramírez-Salinas et al., 2000 |
| Ph. (Ph.) tenuipilis (Bates) | Larva 3, pupa | Amatenango, Chis. | Ramírez-Salinas et al., 2000 |
| Ph. (Ph.) testaceipennis (Blanchard) | Larva 3, pupa | Amatenango, Chis. | Ramírez-Salinas et al., 2000 |
| Ph. (Chlaenobia) tumulosa (Bates) | Larva 3, pupa | Amatenango, Chis. | Ramírez-Salinas et al., 2000 |
| Ph. (Phytalus) macrocera (Bates) | Larva 3 | Puebla, Pue. | Aragón y Morón, 2004 |
| Ph. (Ph.) vetula (Horn) | Larva 3 | El Aguacate, Pue. | Aragón y Morón, 2004 |
| Ph. (Ph.) pubicauda (Bates) | Larva 3 | Puebla, Pue. | Aragón y Morón, 2004 |
| Ph. (Phytalus) rufotestacea (Moser) | Larva 3 | Amatenango, Chis. | Ramírez-Salinas et al., 2009 |
| Ph. (Ph.) misteca (Bates) | Larva 3 | Tepatitlán, Jal. | Lugo-García et al., 2009 |
| Ph. (Ph.) polyphylla (Bates) | Larva 3 | Tepatitlán, Jal. | Lugo-García et al., 2009 |
| Ph. (Ph.) pilosula (Moser) | Larva 3 | Amatenango, Chis | Ramírez-Salinas, Morón y Castro-Ramírez, 2011 |
| Ph. (Ph.) lenis (Horn) | Larva 3 | Xoxocotlan, Oax. | Hernández-Cruz et al., 2016 |
| Ph. (Ph.) multipora (Bates) | Larva 3 | Motozintla, Chis. | Ramírez-Salinas y Castro-Ramírez, 2015 |
| Ph. (Ph.) heteronycha (Bates) | Larva 3, pupa | Las Vigas, Ver. | Presente artículo |
| Ph. (Ph.) leonina (Bates) | Larva 3, pupa | Las Vigas, Ver. | Presente artículo |
| Ph. (Ph.) angulicollis (Bates) | Larva 3 | Las Vigas, Ver. | Presente artículo |
Larvas, pupas y adultos fueron colectados entre marzo de 2009 y agosto de 2015 en los suelos de 4 lotes de una plantación de arbolitos de Navidad (Pseudotsuga macrolepis Flous.) (Pinaceae) del rancho Los Castaños, localidad Manzanillo, municipio de Las Vigas de Ramírez, Veracruz, entre los 2,200 y los 2,480msnm (Morón, Rojas-Gómez y Arce-Pérez, 2010). En el campo todos los especímenes extraídos del suelo se fijaron en solución de Pampel y una semana después se pasaron a solución acuosa de etanol al 70% para su conservación e identificación. Los caracteres morfológicos y la terminología utilizada en las descripciones son los propuestos por Boving (1942), Ritcher (1966) y Morón (1986). Las observaciones e ilustraciones se realizaron con una cámara clara asociada con un estereomicroscopio Leica MZ8 empleando aumentos de 6.3 a 50×, y con una videocámara acoplada a un estereomicroscopio Celestron 44206. Las medidas se obtuvieron con un micrómetro ocular o con un vernier electrónico. Las fotografías se lograron con un equipo Nikon D5200 provisto con un lente AF-S DX Micro Nikkor 40mm. Los ejemplares estudiados se depositaron en la Colección Entomológica IEXA, INECOL, Xalapa, Veracruz, y en la colección del Centro de Agroecología, Instituto de Ciencias, Benemérita Universidad Autónoma de Puebla.
DescripcionesPhyllophaga (Phyllophaga) heteronycha (Bates, 1888) Larva de tercer estadio (figs. 1-9, 28).Descripción (n=16)Cabeza (figs. 1-9). Anchura máxima de la cápsula cefálica 3.5-3.8mm. Superficie del cranium casi lisa, parda amarillenta. Frente con una seda frontal exterior y una seda frontal posterior a cada lado; 8 sedas frontales anteriores; una seda en cada ángulo anterior de la frente; resto de superficie craneal con 2 sedas dorsoepicraneales y 5-6 sedas paraocelares a cada lado. Clípeo sin sedas centrales y 2 sedas laterales a cada lado. Labro casi simétrico, con los márgenes laterales redondeados, 2 sedas centrales, 2 sedas postero-laterales y 3-4 sedas laterales a cada lado. Manchas oculares ausentes. Epifaringe (fig. 2) sin zygum y con epizygum estrecho, poco marcado, irregular, pardo rojizo oscuro; haptomerum prominente con 6 sensilas redondeadas notables y 7-8 heli; cada plegmatium formado con 6-7 plegmata anchos. Cada acanthoparia con 6-8 sedas espiniformes cortas, recurvadas. Proplegmatia pobremente marcado por 4-7 plegmata espaciados. Laeophoba larga y extendida desde el extremo interno de la laeotorma hacia la chaetoparia izquierda; dexiophoba escasa, apenas visible en el extremo derecho del haptolachus. Dexiotorma casi recta, con el extremo exterior truncado y el extremo interior adelgazado; laeotorma corta y ancha, con el extremo interno aguzado. Haptolachus con pocas microsensilas dispersas y un cono sensorial redondeado. Placa esclerosada pequeña y angulosa. Crepis poco acentuado. Chaetoparia izquierda formada por 48-51 sedas medianas y 20-28 sedas cortas delgadas. Chaetoparia derecha formada por 38-40 sedas medianas y 14-18 sedas cortas delgadas. Mandíbulas (figs. 3, 4) sin área estriduladora ventral, área incisiva de la mandíbula derecha con una lámina cortante distal breve separada de un dientecillo incisivo proximal por una escotadura incisiva poco acentuada; área incisiva de la mandíbula izquierda con 3 dentículos redondeados separados del dientecillo incisivo proximal por una escotadura incisiva; márgenes internos de ambas mandíbulas sin dientes; área molar de la mandíbula izquierda con el lóbulo distal (M1) muy desarrollado; brustia moderadamente setosa; área molar de la mandíbula derecha con lóbulo distal poco desarrollado; calx prominente y brustia moderadamente setosa. Maxilas (fig. 5) con uncus terminal en la galea y 3 unci en la lacinia, los 2 distales con las bases fusionadas, flanqueados por 4-5 heli a cada lado. Área estriduladora maxilar formada por 9-10 dientecillos ligeramente aguzados sin proceso anterior. Escleroma hipofaríngeo (fig. 5) asimétrico, con lado derecho prominente, dentiforme. Último artejo antenal con área sensorial ovalada dorsal grande (fig. 6) y 2 áreas sensoriales ventrales medianas.
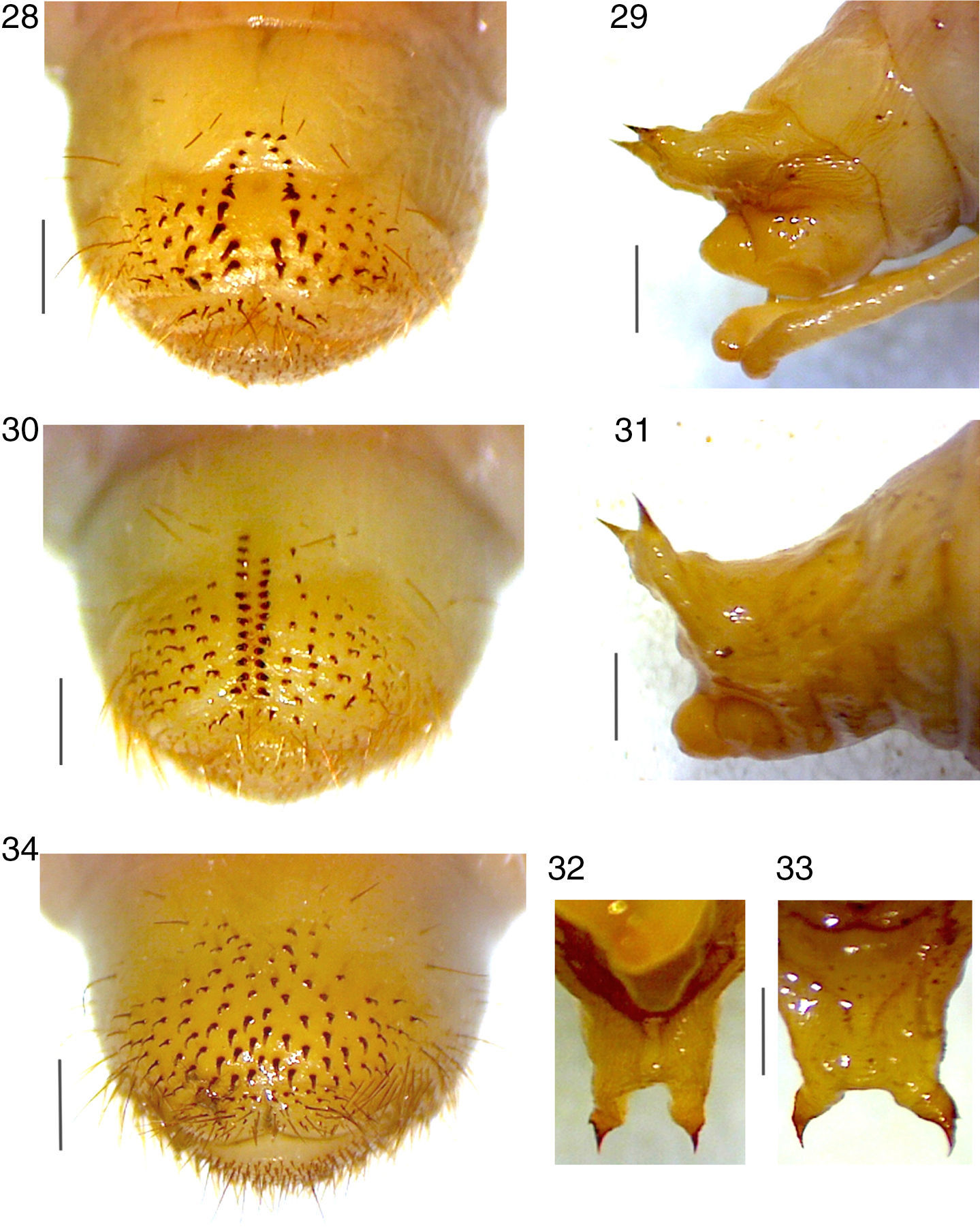
Estructuras diagnósticas en la larva de tercer estadio de Phyllophaga heteronycha: 1, vista frontal de la cabeza; 2, aspecto ventral de la epifaringe; mandíbulas en vista ventral: 3, izquierda; 4, derecha; 5, maxila derecha y labio hipofaringe, vista dorsal; 6, último artejo antenal, vista dorsal; 7, placa respiratoria torácica; 8, uña protarsal; 9, uña metatarsal. Líneas de escala en milímetros.
Tórax. Estigmas respiratorios (fig. 7) de 0.17-0.18mm de largo por 0.23-0.24mm de ancho; placa respiratoria amarillenta, con lóbulos uniformemente recurvados en forma de C, la distancia entre los lóbulos es menor al diámetro dorsoventral de la bulla redondeada; con 12-14 poros microscópicos en una línea transversal de la placa respiratoria, con forma y tamaño irregular, ligeramente alargados. Pronoto con escleroma lateral semiovalado a cada lado, amarillento, con 2 sedas al centro y numerosas sedas periféricas. Proprescudo con 24 sedas medianas y largas distribuidas de forma irregular; proescudo con 10-12 sedas cortas y largas en hilera transversal irregular; mesoprescudo con 40-48 sedas medianas y largas en 2 hileras transversales irregulares; mesoescudo con 10-12 sedas medianas en hilera transversal; mesoescutelo con 6-8 sedas medianas transversales; metaprescudo con 48-54 sedas medianas en 3 hileras; metaescudo con 10-12 sedas medianas transversales; metaescutelo con 6-8 sedas medianas en hilera transversal. Uñas pro y mesotarsales largas, con el ápice afilado, con una seda prebasal interna mediana y una lateral externa larga (fig. 8); uñas metatarsales mucho más cortas que las precedentes con 2 sedas largas (fig. 9).
Abdomen. Estigmas de segmentos i-vii de tamaño similar, 0.16-0.17mm de largo por 0.23-0.24mm de ancho; estigma del segmento viii más pequeño que precedentes, 0.12-0.13mm de largo por 0.15-0.16mm de ancho; placas respiratorias amarillentas, regularmente recurvadas en forma de C. Dorso del primer segmento abdominal con 3 hileras transversales de sedas medianas y largas, sin sedas espiniformes; dorso de los segmentos abdominales ii-vi con numerosas sedas espiniformes y varias sedas medianas y largas distribuidas transversalmente, segmento vii con escasas sedas espiniformes y pocas sedas medianas y largas esparcidas en hileras transversales irregulares; segmentos viii-ix sin sedas espiniformes, y escasas sedas largas esparcidas; dorso del segmento x con abundantes sedas cortas y medianas y algunas sedas largas dispersas, más abundantes hacia los lados. Venter de segmentos i-ix cada uno con 10-14 sedas medianas distribuidas transversalmente. Raster con par de palidia longitudinales claramente divergentes hacia el extremo caudal que definen una septula semitriangular (fig. 28); cada palidium está formado por 9-12 pali espiniformes, cortos y gruesos, dirigidos caudalmente; los pali proximales son mucho más pequeños que los distales. Cada tegillum está formado por 17-22 sedas hamate, 8-10 de las mesiales son gruesas. Campus con 8-10 sedas delgadas largas. Barbula moderadamente setosa. Labio anal dorsal con numerosas sedas delgadas cortas o largas. Labio anal ventral claramente escotado, con 10 sedas gruesas centradas. Abertura anal en forma de Y. Longitud total aproximada del cuerpo 3.5-4.0cm (3.8cm en promedio).
Larva de segundo estadio. Semejante al tercer estadio excepto en anchura de cápsula cefálica 2.0-2.2mm, último antenómero tan largo como el precedente (1:1) y un poco más ancho que él; placas respiratorias constreñidas, con bulla, similares a las del tercer estadio excepto por las dimensiones proporcionalmente menores y la mayor distancia entre los lóbulos de la placa; cada palidium divergente con 9-10 pali.
Larva de primer estadio. Similar al segundo excepto en la anchura de la cápsula cefálica 1.1-1.2mm; último antenómero poco más largo que el precedente (1.2:1) pero casi 2 veces más ancho que él; con espina de eclosión pequeña y aguzada a cada lado del metaescudo; placas respiratorias reniformes, con bulla poco acentuada; cada palidium divergente formado por 6-7 pali pequeños.
Pupa. Macho. Longitud 14.0-14.8mm. Anchura abdominal máxima 6.7-7.0mm. Cabeza: superficie glabra, deflexa; frente convexa, ligeramente irregular; borde anterior del clípeo abultado redondeado; labro, mandíbulas, maxilas discernibles, palpos maxilares alargados; teca antenal poco alargada y prominente. Ojos grandes con canthus ocular corto. Tórax: superficie glabra. Pronoto convexo, ángulos anteriores prominentes, ángulos posteriores prominentes. Escutelo amplio, liso, semitriangular. Metanoto bien diferenciado. Tecas elitral y alar laxas, recurvadas ventralmente alrededor del cuerpo; teca elitral sin surcos longitudinales ni tubérculo humeral; teca alar ligeramente más larga que la elitral. Protibia con 3 tubérculos en el borde preapical externo. Meso y metatibia con 2 tubérculos pequeños en el borde apical interno. Abdomen: segmentos i-vi con anchura similar, con suturas transversales profundas, sin quillas dorsales transversales; entre los segmentos iv-vi se ubican 2 pares de órganos dioneiformes, con las estructuras proximales proyectadas como espinas recurvadas cortas que se alojan en receptáculos esclerosados de las estructuras distales opuestas; segmentos vii-x progresivamente más estrechos hacia el extremo abdominal, con suturas transversales apenas marcadas; segmentos ix y x fusionados entre sí dorsalmente. Segmento x con ámpula genital ventral prominente, y par de urogomphi pedunculados, casi rectos y paralelos entre sí, con ápices agudos (figs. 29, 32). Segmentos apicales con pruinosidad dorada. Lóbulos pleurales redondeados. Espiráculo i ovalado con peritrema esclerosado poco prominente, en parte cubierto por la teca alar; espiráculos ii-iv circulares, con peritrema esclerosado prominente; espiráculos v-viii circulares, no prominentes, obliterados. Pupa hembra. Similar al macho, solo que más grande, longitud 15.3-15.8mm, anchura abdominal máxima 8.7-9.0mm, con la teca antenal más pequeña y sin ámpula genital prominente.
Material examinadoDieciséis larvas de tercer estadio en total, colectadas en México: Veracruz, Las Vigas, rancho Los Castaños, por C. V. Rojas y R. Arce, en las siguientes fechas: 25-IX-2009 (2), 15-X-2010 (2), 29-I-2010 (2), 7-XII-2011 (2), 24-II-2012 (2), 15-X-2013 (2), 28-XI-2014 (2), 14-VIII-2015 (2). Diez larvas de segundo estadio en total, colectadas en la misma localidad pero en las siguientes fechas: 31-VII-2009 (2), 27-VIII-2010 (2), 14-X-2011 (2), 10-VIII-2012 (2), 17-X-2014 (2). Diez larvas de primer estadio en total, de la misma localidad pero en las siguientes fechas: 29-VI-2009 (2), 27-VIII-2010 (2), 12-VIII-2011 (2), 15-VI-2012 (2), 20-VIII-2013 (2). Diez pupas de las misma procedencia colectadas durante 26-VI-2009 (2), 28-IV-2010 (2), 11-IV-2011 (2), 9-IV-2012 (2), 11-V-2015 (2).
ComentariosLa larva de P. heteronycha es muy diferente de otras especies conocidas por la estructura del raster, donde las palidia divergen hacia el extremo caudal, formadas por 9-12 pali cortos y gruesos, dirigidos caudalmente, los pali proximales son mucho más pequeños que los distales, y la septula es amplia y semitriangular, características no observadas en otros miembros del género.
Datos biológicosEspecie distribuida en los bosques de montaña de Hidalgo, México, Puebla, Oaxaca y Veracruz, entre los 1,300 y 2,400m de altitud. Los adultos vuelan en las primeras horas de la noche y son atraídos por las luces eléctricas entre mayo y agosto. Tienen ciclo vital anual. El acoplamiento se realiza en el suelo, sobre hierbas, arbustos o árboles. Durante mayo y junio se depositan los huevos en suelos sombreados. En ambientes donde son muy abundantes, como en Las Vigas, los estados de desarrollo se superponen bastante: las larvas de primer estadio se encuentran desde junio hasta octubre, las de segundo estadio desde junio hasta noviembre y las de tercer estadio se observan entre agosto y mayo. Las pupas se encuentran desde abril hasta junio y los adultos tenerales de abril a julio. Las larvas pequeñas consumen restos vegetales humificados, y las de segundo y tercer estadio al parecer combinan las raíces de herbáceas con detritus del suelo (Morón, Rojas-Gómez y Arce-Pérez, 2014).
Phyllophaga (Phyllophaga) leonina (Bates, 1888) Larva de tercer estadio (figs. 10-18, 30)Descripción (n=10)Cabeza (fig. 10). Anchura máxima de cápsula cefálica 4.0-4.1mm. Superficie del cranium fina y densamente punteada, parda amarillenta. Frente con una seda frontal exterior y una seda frontal posterior a cada lado; 4 sedas frontales anteriores; con una seda en cada ángulo anterior de la frente; resto de superficie craneal con 2 sedas dorsoepicraneales, 3 sedas epicraneales y 8-9 sedas paraocelares a cada lado. Clípeo sin sedas centrales y 2 sedas laterales a cada lado. Labro ligeramente asimétrico, con los márgenes laterales redondeados, 2 sedas centrales, 4 sedas posterolaterales, y 3-4 sedas laterales a cada lado. Manchas oculares ausentes. Epifaringe (fig. 11) sin zygum y con epizygum estrecho, bien definido, irregular, pardo rojizo oscuro; haptomerum prominente con 6 sensilas redondeadas notables y 9-11 heli; cada plegmatium formado con 8-10 plegmata anchos. Cada acanthoparia con 8 sedas espiniformes recurvadas, con longitud decreciente. Proplegmatia marcado, con 10-13 plegmata estrechos. Laeophoba larga y extendida desde el extremo izquierdo del haptolachus hacia la chaetoparia izquierda; dexiophoba larga, extendida en el extremo derecho del haptolochus. Dexiotorma casi recta, con extremo exterior redondeado y extremo interior ligeramente truncado; laeotorma corta y ancha, con extremo interno adelgazado. Haptolachus con pocas microsensilas dispersas y cono sensorial ovalado. Placa esclerosada pequeña y angulosa. Crepis poco acentuado. Chaetoparia izquierda formada por 54-58 sedas medianas y 18-25 sedas cortas delgadas. Chaetoparia derecha formada por 55-60 sedas medianas y 20-26 sedas cortas delgadas. Mandíbulas (figs. 13-14) sin área estriduladora ventral, área incisiva de la mandíbula derecha con una lámina cortante distal breve separada de un dientecillo incisivo proximal por escotadura incisiva poco profunda; área incisiva de mandíbula izquierda con lámina cortante separada del dientecillo incisivo proximal por escotadura incisiva poco marcada; márgenes internos de ambas mandíbulas sin dientes; área molar de mandíbula izquierda con lóbulo distal (M1) muy desarrollado; brustia formada por sedas largas; área molar de mandíbula derecha con lóbulo distal poco desarrollado; calx prominente y brustia formada por sedas largas. Maxilas (fig. 15) con uncus terminal en la galea y 3 unci en la lacinia, los 3 largos y no fusionados en sus bases, flanqueados por 4-6 heli a cada lado. Área estriduladora maxilar formada por 9 dientecillos ligeramente aguzados sin proceso anterior. Escleroma hipofaríngeo (fig. 15) asimétrico, con el lado derecho prominente, dentiforme. Último artejo antenal con un área sensorial ovalada dorsal grande (fig. 12) y 2 áreas sensoriales ventrales medianas.
Estructuras diagnósticas en la larva de tercer estadio de Phyllophaga leonina: 10, vista frontal de la cabeza; 11, aspecto ventral de la epifaringe; mandíbulas en vista ventral: 12, izquierda; 13, derecha; 14, maxila derecha y labio hipofaringe, vista dorsal; 15, último artejo antenal, vista dorsal; 16, placa respiratoria torácica; 17, uña protarsal; 18, uña metatarsal. Líneas de escala en milímetros.
Tórax. Estigmas respiratorios (fig. 16) de 0.25-0.26mm de largo por 0.37-0.38mm de ancho; placa respiratoria amarillenta, con lóbulos uniformemente recurvados en forma de C, la distancia entre los lóbulos es casi igual al diámetro dorsoventral de la bulla redondeada; con 13-15 poros microscópicos en una línea transversal de la placa respiratoria, con forma y tamaño irregular, ligeramente alargados. Pronoto con escleroma lateral semiovalado a cada lado, blanquecino-amarillento, con 2 sedas centrales y numerosas sedas periféricas. Proprescudo con 40-44 sedas medianas y largas distribuidas de forma irregular; proescudo con 24-26 sedas medianas y largas en hilera transversal irregular; mesoprescudo con 30-34 sedas medianas y largas en hileras transversales irregulares; mesoescudo con 18-19 sedas medianas y largas en hilera transversal; mesoescutelo con 16-18 sedas medianas en hilera transversal; metaprescudo con 24-26 sedas medianas y largas irregularmente dispuestas; metaescudo con 16-18 sedas medianas y largas en hilera transversal; metaescutelo con 12-14 sedas de longitud variada dispuestas en hilera transversal. Uñas pro y mesotarsales largas, con el ápice afilado, con una seda prebasal interna mediana y una lateral externa larga (fig. 17); uñas metatarsales mucho más cortas que las precedentes con 2 sedas largas (fig. 18).
Abdomen. Estigma del primer segmento con 0.22-0.23mm de largo y 0.30-0.31mm de ancho, estigmas en segmentos ii-vii de tamaño similar, 0.20-0.21mm de largo por 0.27-0.30mm de ancho; estigma del segmento viii más pequeño que precedentes, 0.15-0.16mm de largo por 0.20-0.21mm de ancho; placas respiratorias amarillentas, regularmente recurvadas en forma de C. Dorso del primer segmento abdominal con 3 hileras transversales irregulares de 60-80 sedas cortas, medianas y largas, con pocas sedas espiniformes; dorso de los segmentos abdominales ii-vi con sedas espiniformes predominantes entre sedas medianas y largas delgadas distribuidas transversalmente, segmento vii con 110-126 sedas espiniformes y pocas sedas largas esparcidas en hileras transversales irregulares; segmento viii sin sedas espiniformes, con 2 hileras de 8-12 sedas delgadas largas esparcidas; segmento ix sin sedas espiniformes, con 2 hileras de 10-12 sedas delgadas largas esparcidas; dorso del segmento x con numerosas sedas delgadas largas dispersas, más abundantes hacia los lados. Venter de cada uno de los segmentos de i-ix con 10-14 sedas medianas distribuidas transversalmente. Raster con par de palidia longitudinales casi paralelas que definen una septula alargada y estrecha (fig. 30); cada palidium formado por 10-13 pali espiniformes, cortos y afilados, dirigidos hacia el lado opuesto de septula. Cada tegillum formado por 28-30 sedas hamate gruesas. Campus con 4-6 sedas delgadas largas. Barbula moderadamente setosa. Labio anal dorsal con numerosas sedas delgadas cortas o largas. Labio anal ventral claramente escotado, con 6-8 sedas cortas gruesas. Abertura anal en forma de Y. Longitud total aproximada del cuerpo 3.9-4.8cm (4.3cm en promedio).
Larva de segundo estadio. Semejante al tercer estadio excepto en anchura de cápsula cefálica 2.2-2.3mm, último antenómero más corto que el precedente (0.7:1) y un poco más ancho que él; placas respiratorias constreñidas, con bulla, similares a las del tercer estadio excepto por las dimensiones proporcionalmente menores y la mayor distancia entre los lóbulos de la placa; cada palidium paralelo formado por 12-15 pali con ápices dirigidos hacia fuera de la línea media.
Larva de primer estadio. Similar al segundo excepto en anchura de cápsula cefálica 1.3-1.4mm; último antenómero tan largo como el precedente (1:1) pero poco más ancho que él; con espina de eclosión pequeña y aguzada a cada lado del metaescudo; placas respiratorias reniformes, con bulla poco acentuada; cada palidium paralelo con 14-15 pali pequeños con sus ápices dirigidos hacia el lado opuesto de línea media.
Pupa. Macho. Longitud 17.1-17.7mm. Anchura abdominal máxima 7.6-7.9mm. Cabeza: superficie glabra, deflexa; frente convexa, irregular; borde anterior del clípeo redondeado; labro, mandíbulas, maxilas discernibles, palpos maxilares alargados; teca antenal poco alargada, no prominente. Ojos grandes con canthus ocular corto. Tórax: superficie glabra. Pronoto convexo, ángulos anteriores redondeados, ángulos posteriores prominentes. Escutelo amplio, liso, semitriangular. Metanoto bien diferenciado. Tecas elitral y alar laxas, recurvadas ventralmente alrededor del cuerpo; teca elitral sin surcos longitudinales ni tubérculo humeral; teca alar ligeramente más larga que la elitral. Protibia con 3 tubérculos en el borde preapical externo. Meso y metatibia con 2 tubérculos pequeños en el borde apical interno. Abdomen: segmentos i-vi con anchura similar, con suturas transversales profundas, sin quillas dorsales transversales; entre los segmentos iv-vi se ubican 2 pares de órganos dioneiformes, con estructuras proximales proyectadas como espinas recurvadas cortas que se alojan en receptáculos esclerosados de las estructuras distales opuestas; segmentos vii-x progresivamente más estrechos hacia el extremo abdominal, con suturas transversales apenas marcadas; segmentos ix y x fusionados entre sí dorsalmente. Segmento x con ámpula genital ventral prominente y par de urogomphi pedunculados, poco curvados con ápices agudos convergentes hacia la línea media (figs. 31, 33). Segmentos apicales con la cutícula finamente estriada sin pruinosidad. Lóbulos pleurales redondeados. Espiráculo i ovalado con peritrema esclerosado poco prominente, en parte cubierto por la teca alar; espiráculos ii-iv circulares, con peritrema esclerosado prominente; espiráculos v-viii circulares pequeños no prominentes, obliterados. Pupa hembra. Similar al macho, solo que más grande, longitud 18.4-18.7mm, anchura abdominal máxima 7.7-7.9mm, con la teca antenal pequeña y sin ámpula genital prominente.
Material examinadoDiez larvas de tercer estadio en total, colectadas en México: Veracruz, Las Vigas, rancho Los Castaños, por C. V. Rojas y R. Arce, en las siguientes fechas: 10-XII-2011 (2), 24-II-2012 (2), 16-X-2013 (2), 28-XI-2014 (2), 14-VIII-2015 (2). Diez larvas de segundo estadio en total, colectadas en la misma localidad pero en las siguientes fechas: 10-X-2011 (2), 8-X-2012 (2), 12-VIII-2013 (2), 11-VIII-2014 (2), 10-VIII-2015 (2). Diez larvas de primer estadio en total, de la misma localidad pero en las siguientes fechas: 8-VIII-2011 (2), 6-VIII-2012 (2), 9-VIII-2013 (2), 11-VIII-2014 (2), 10-VIII-2015 (2). Diez pupas de la misma localidad colectadas en 12-IV-2013 (4), 25-IV-2014 (4), 11-V-2015 (2).
ComentariosLa larva es parecida a la de P.pubicauda (Aragón y Morón, 2004) y se distingue sobre todo por la presencia de 4 sedas anterofrontales, cada palidium formado por 10-13 pali espiniformes, cortos y afilados, mientras que P.pubicauda tiene 13-14 sedas anterofrontales y su palidium está formado por 14-20 pali largos y agudos.
Datos biológicosEspecie distribuida en las praderas, plantaciones o bosques abiertos en las montañas y valles del estado de México, Oaxaca y Veracruz, entre los 2,200 y los 2,600m de altitud. Los adultos vuelan en las primeras horas de la noche y son atraídos por las luces eléctricas entre junio y agosto. Tienen ciclo vital anual. Durante mayo y junio se depositan los huevos en suelos con vegetación. Las larvas de primer estadio se encuentran desde junio hasta agosto, las de segundo estadio desde agosto hasta diciembre y las de tercer estadio se observan entre octubre y abril. Las pupas se encuentran en abril y mayo, y los adultos tenerales entre abril y junio. Las larvas pequeñas consumen restos vegetales humificados, y las de segundo y tercer estadio prefieren las raíces de herbáceas (Morón et al., 2014).
Phyllophaga (Phyllophaga) angulicollis (Bates, 1888) Larva de tercer estadio (figs. 19-27, 34).Descripción (n=10)Cabeza (fig. 19). Anchura máxima de cápsula cefálica 5.1-5.2mm. Superficie del cranium brillante con puntos someros dispersos, parda amarillenta. Frente con una seda frontal exterior y una seda frontal posterior a cada lado; 8 sedas frontales anteriores; con una seda en cada ángulo anterior de la frente; resto de la superficie craneal con 2 sedas dorsoepicraneales, 5-6 sedas epicraneales y 8-10 sedas paraocelares a cada lado. Clípeo con 2 sedas centrales y 2 sedas laterales a cada lado. Labro ligeramente asimétrico, con los márgenes laterales redondeados, 2 sedas centrales, 10-12 sedas posteriores, 2 sedas posterolaterales y 4-6 sedas laterales a cada lado. Manchas oculares ausentes. Epifaringe (fig. 20) sin zygum y con epizygum estrecho, bien definido, irregular, pardo rojizo oscuro; haptomerum prominente con 6 sensilas redondeadas notables, 8-10 sensilas pequeñas y 7-8 heli; cada plegmatium formado con 8-12 plegmata anchos. Cada acanthoparia con 10-12 sedas espiniformes recurvadas, con longitud similar. Proplegmatia marcado, con 5-8 plegmata anchos muy separados entre sí. Laeophoba larga y extendida desde el extremo izquierdo del haptolachus hacia la chaetoparia izquierda; dexiophoba moderada, limitada en el extremo derecho del haptolochus. Dexiotorma casi recta, con el extremo exterior redondeado y el extremo interior adelgazado; laeotorma corta y ancha, con el extremo interno adelgazado. Haptolachus con pocas microsensilas dispersas y un cono sensorial ovalado. Placa esclerosada estrecha. Crepis acentuado. Chaetoparia izquierda formada por 38-43 sedas medianas y 20-24 sedas cortas delgadas. Chaetoparia derecha formada por 22-25 sedas medianas y 24-28 sedas cortas delgadas. Mandíbulas (figs. 22-23) sin área estriduladora ventral, área incisiva de la mandíbula derecha con una lámina cortante distal amplia separada de un dientecillo incisivo proximal por una escotadura incisiva notable; área incisiva de la mandíbula izquierda con una lámina cortante separada del dientecillo incisivo proximal por una escotadura incisiva bien marcada; márgenes internos de ambas mandíbulas sin dientes; área molar de la mandíbula izquierda con el lóbulo distal (M1) muy desarrollado; brustia formada por sedas largas; área molar de la mandíbula derecha con el lóbulo distal poco desarrollado; calx prominente y brustia formada por numerosas sedas largas. Maxilas (fig. 24) con uncus terminal en la galea y 3 unci en la lacinia, los 3 largos y no fusionados en sus bases, flanqueados por 3-4 heli alargados a cada lado. Área estriduladora maxilar formada por 12-14 dientecillos ligeramente aguzados, sin proceso anterior. Escleroma hipofaríngeo (fig. 24) asimétrico, con el lado derecho prominente, dentiforme. Último artejo antenal con área sensorial ovalada dorsal grande (fig. 21) y 2 áreas sensoriales ventrales medianas.
Estructuras diagnósticas en la larva de tercer estadio de Phyllophaga angulicollis: 19, vista frontal de la cabeza; 20, aspecto ventral de la epifaringe; mandíbulas en vista ventral: 21, izquierda; 22, derecha; 23, maxila izquierda y labio hipofaringe, vista dorsal; 24, último artejo antenal, vista dorsal; 25, placa respiratoria torácica; 26, uña protarsal; 27, uña metatarsal. Líneas de escala en milímetros.
Tórax. Estigmas respiratorios (fig. 25) de 0.30-0.31mm de largo por 0.40-0.42mm de ancho; placa respiratoria amarillenta, con lóbulos uniformemente recurvados en forma de C, la distancia entre los lóbulos es menor al diámetro dorsoventral de la bulla redondeada; con 24-28 poros microscópicos en una línea transversal de la placa respiratoria, con forma y tamaño irregular. Pronoto con escleroma lateral semiovalado a cada lado, blanquecino-amarillento, con 2-3 sedas centrales y numerosas sedas periféricas de diferentes longitudes. Proprescudo con 36-40 sedas cortas, medianas y largas distribuidas en 4 hileras irregulares; proescudo con 24-28 sedas medianas y largas en 2 hileras transversales irregulares; mesoprescudo con 28-30 sedas medianas y largas distribuidas en forma irregular; mesoescudo con 24-26 sedas medianas y largas en una hilera transversal; mesoescutelo con 20-22 sedas medianas y largas en hilera transversal; metaprescudo con 30-32 sedas medianas y largas irregularmente dispuestas; metaescudo con 28-30 sedas medianas y largas en hilera transversal; metaescutelo con 28-30 sedas de longitud variada dispuestas en hilera transversal. Uñas pro y mesotarsales largas, con ápice afilado, con una seda prebasal interna mediana y una lateral externa larga (fig. 26); uñas metatarsales más cortas que las precedentes con 2 sedas medianas (fig. 27).
Abdomen. Estigma del primer segmento con 0.30-0.31mm de largo y 0.35-0.37mm de ancho, los estigmas en los segmentos ii-vii de tamaño similar, 0.25-0.29mm de largo por 0.32-0.37mm de ancho; estigma del segmento viii más pequeño que los precedentes, 0.25-0.27mm de largo por 0.24-0.27mm de ancho; placas respiratorias amarillentas, regularmente recurvadas en forma de C. Dorso del primer segmento abdominal con 3 hileras transversales irregulares de 110-120 sedas cortas, medianas y largas, irregularmente dispuestas; dorso de segmentos abdominales ii-vi con sedas espiniformes predominantes entre 200-220 sedas medianas y largas delgadas distribuidas en hileras transversales irregulares; segmento vii con menos de 120 sedas espiniformes y pocas sedas largas esparcidas en hileras transversales irregulares; segmento viii sin sedas espiniformes y 2 hileras de 70-76 sedas delgadas largas esparcidas; segmento ix sin sedas espiniformes y 2 hileras de 70-80 sedas delgadas largas esparcidas; dorso del segmento x con numerosas sedas delgadas medianas y largas dispersas, más abundantes hacia los lados. Venter de cada uno de los segmentos de i-ix con 15-18 sedas medianas distribuidas en hileras transversales. Raster sin septula (fig. 34). Teges formado por 90- 98 sedas hamate gruesas curvadas caudalmente, en la porción central 18-20 hamate son más gruesas que las laterales. Campus con 4-6 sedas delgadas largas. Barbula moderadamente setosa. Labio anal dorsal con numerosas sedas medianas o largas. Labio anal ventral claramente escotado, con 14-16 sedas cortas gruesas. Abertura anal en forma de Y. Longitud total aproximada del cuerpo 4.8-5.4cm (5.1cm en promedio).
Larva de segundo estadio. Semejante al tercer estadio excepto en anchura de cápsula cefálica 3.0-3.1mm, el último antenómero más corto que el precedente (0.6:1.0) y un poco más ancho que él; placas respiratorias constreñidas, con bulla, similares a las del tercer estadio excepto por las dimensiones proporcionalmente menores; el número de sedas hamate del raster es similar, aunque son más delgadas que en el tercer estadio.
Larva de primer estadio. Similar al segundo excepto en anchura de cápsula cefálica 1.7-1.8mm; último antenómero tan largo como el precedente (1.3:1.0) pero poco más ancho que él; con espina de eclosión pequeña y aguzada a cada lado del metaescudo; placas respiratorias reniformes, con bulla poco acentuada; número de sedas hamate del raster similar, aunque son más pequeñas y delgadas que en el segundo estadio.
Material examinadoDiez larvas de tercer estadio en total, colectadas en México: Veracruz, Las Vigas, rancho Los Castaños, por C. V. Rojas y R. Arce, en las siguientes fechas: 29-I-2010 (2), 15-X-2010 (2), 16-IV-2011 (2), 14-II-2013 (2), 20-VI-2014 (2). Diez larvas de segundo estadio obtenidas en la misma localidad durante 15-X-2010 (4), 13-VI-2011 (2), 9-IV-2012 (2), 11-II-2013 (2). Diez larvas de primer estadio capturadas en: 28-IV-2010 (4), 13-VI-2011 (4), 9-IV-2012 (2).
ComentariosLa larva es parecida a la de P.rufotestacea (Ramírez-Salinas, Morón, Castro-Ramírez y Pacheco-Flores, 2009), con la cual comparte la ausencia de septula y palidia definidos. Además de un tamaño corporal mayor, en P.angulicollis la proplegmatia está formada por 5-8 proplegmata anchos, muy separados entre sí, el teges está constituído por 18-20 sedas hamate gruesas en la parte central. En P.rufotestacea la proplegmatia se integra con 17-19 proplegmata anchos, finamente delineados, próximos entre sí, el teges cuenta con solo 6-8 sedas hamate gruesas en la parte central.
Datos biológicosEspecie distribuida en zonas boscosas de las montañas de Hidalgo, Oaxaca y Veracruz, entre los 2,000 y 2,500m de altitud. Los adultos vuelan en las primeras horas de la noche y ocasionalmente son atraídos por las luces eléctricas en septiembre. Su ciclo vital es bianual o trianual y provoca la coexistencia de distintos estadios larvarios. Durante abril se depositan los huevos en suelos con hojarasca sombreados. Las larvas de primer estadio se han encontrado en febrero, abril, junio, agosto y octubre, las de segundo y tercer estadio durante cualquier mes del año. No se han localizado pupas en el campo pero los adultos tenerales se han observado en febrero, agosto y octubre. Todas las larvas prefieren como alimento los restos vegetales humificados en el suelo (Morón et al., 2014).
Clave para separar las larvas de tercer estadio de Phyllophaga (sensu lato) en México| 1. Raster sin septula, teges formado por número variable de sedas hamate de longitud y grosor variables.…................................……………………………………………………………………2 |
| 1’. Raster con septula y palidia, tegilla formada por número variable de sedas hamate usualmente delgadas………………………..........................................……………………………………..…3 |
| 2. Proplegmatia formada por 17-19 proplegmata anchos, finamente delineados y muy próximos entre sí; teges con 6-8 sedas hamate gruesas en parte central; anchura de la cabeza 3.4-3.7mm. Chiapas y Guatemala………………………..........................................……………………………………..P. rufotestacea (Moser) |
| 2’. Proplegmatia formada por 5-8 proplegmata anchos, muy separados entre sí; teges con 18-20 sedas hamate gruesas en parte central; anchura de la cabeza 5.1-5.2mm. Hidalgo, Veracruz, Oaxaca…………………………………………………………………………….……P. angulicollis (Bates) |
| 3. Epifaringe con proplegmatia………………………………………………………………………4 |
| 3’. Epifaringe sin proplegmatia……………………………………………………………………..11 |
| 4. Placa respiratoria del segmento abdominal 7 con diámetro mayor al de la placa respiratoria del segmento 6; palidia muy recurvadas, cercanamente convergentes en ambos extremos; anchura de la cabeza 5.0-5.6mm. Guerrero, Jalisco, México, Michoacán, Morelos, Puebla....P. ilhuicaminai Morón |
| 4’. Placa respiratoria del segmento abdominal 7 con diámetro similar al de la placa respiratoria del segmento 6; palidia con forma diversa....…..…………………………………………………………..5 |
| 5. Palidia divergentes hacia el extremo caudal, formadas por 9-12 pali cortos y gruesos, dirigidos caudalmente, pali proximales mucho más pequeños que los distales; septula amplia, semitriangular; anchura de la cabeza 3.5-3.8mm. Ciudad de México, Hidalgo, México, Veracruz, Oaxaca………………………………………….………………………………………P. heteronycha (Bates) |
| 5’. Palidia paralelos o convergentes con pali de tamaño similar……………………………………….6 |
| 6. Ápices de los pali dirigidos hacia los lados de la septula……………………………………………7 |
| 6’. Ápices de los pali dirigidos hacia la línea media de la septula……………………….……………..8 |
| 7. Cabeza con 4 sedas anterofrontales; cada palidium formado por 10-13 pali espiniformes, cortos y afilados; palidia ligeramente divergentes en el extremo caudal; ancho de la cabeza 4.0-4.1mm. Guerrero, México, Oaxaca, Veracruz……….…………………………………….P. leonina (Bates) |
| 7’. Cabeza con 13-14 sedas anterofrontales: cada palidium formado por 14-20 pali largos y agudos; palidia divergentes en ambos extremos; ancho de la cabeza 4.3-4.6mm. Guerrero, Oaxaca, Puebla………………….……………………………………………………………P. pubicauda (Bates) |
| 8. Cabeza amarillenta, 3.8-4.1mm de anchura; proplegmatia con 8-11 plegmata separados entre sí. Chiapas, Quintana Roo, América Central.…………………………P. (Chlaenobia) tumulosa (Bates) |
| 8’. Cabeza parda rojiza o anaranjada, 4.2-5.1mm de anchura; proplegmatia con 8-13 plegmata muy próximos entre sí…………………………………………………………………………………….9 |
| 9. Palidia formadas por 18-23 pali largos muy próximos entre sí, con ambos extremos ligeramente convergentes; cabeza con 6-8 sedas frontales anteriores, 4.5-4.6mm de anchura. Chiapas y América Central………………………………………………………………………P. multipora (Bates) |
| 9’. Palidia casi paralelas entre sí, poco convergentes en el extremo posterior, con los pali separados entre sí…………………………………………………………………………………………..…10 |
| 10. Cabeza con 8-9 sedas frontales anteriores, 4.2-5.3mm de anchura; plegmatia formada por 8-9 plegmata; cada palidium con 13-16 pali. Aguascalientes, Jalisco, Michoacán...…P. polyphylla (Bates) |
| 10’. Cabeza con 7-12 sedas frontales anteriores, 4.5-5.1mm de anchura; plegmatia formada por 9-13 plegmata; cada palidium con 14-21 pali. Casi todo México (excepto penínsulas de Baja California y Yucatán), Arizona, Texas, Belice y Guatemala……..............……………….P. ravida (Blanchard) |
| 11. Diámetro dorsoventral de las placas respiratorias de segmentos abdominales 6 y 7 claramente más pequeño que las placas precedentes; ancho de la cabeza 3.6mm. Oaxaca, Puebla……………………………………………………………P. (Listrochelus) cuicateca Morón y Aragón |
| 11’. Diámetro dorsoventral de las placas respiratorias de segmentos abdominales 6 y 7 semejantes a la placa del segmento 5.......…………………………………………………………………………...12 |
| 12. Frente con 26-30 sedas frontales anteriores y 30-54 sedas frontales posteriores; palidia poco convergentes en ambos extremos, cada palidium formado por 27-37 pali cortos; ancho de la cabeza 7.4-8.0mm. Jalisco, Nayarit, Sinaloa…………………………………P. (Triodonyx) lalanza Saylor |
| 12’. Frente con 8-15 sedas frontales anteriores y 2-4 sedas frontales posteriores; palidia paralelas o convergentes, cada palidium formado por menos de 30 pali; ancho de la cabeza 4.1-6.7 mm………13 |
| 13. Palidia muy recurvadas; septula ovalada, bien delimitada………………………………………14 |
| 13’. Palidia poco recurvadas o casi rectas; septula alargada, poco delimitada en los extremos.............15 |
| 14. Cada palidium con 9-25 pali cortos; frente poco rugosa; ancho de la cabeza 4.9-5.2mm. Este y sureste de México……………………………………………..………P. testaceipennis (Blanchard) |
| 14’. Cada palidium con 18-20 pali largos; frente casi lisa; ancho de la cabeza 3.0mm. Oaxaca, Puebla, Tlaxcala………………………………………………………………………….P. macrocera (Bates) |
| 15. Palidia casi paralelos, formados por 23-30 pali………………………………………………….16 |
| 15’. Palidia ligeramente convergentes en uno o ambos extremos, formados por 11-27 pali...................17 |
| 16. Septula lisa. Placa respiratoria del segmento abdominal 7 con diámetro similar al de la placa del 6; maxilas con 11-18 dientecillos estriduladores; ancho de la cabeza 5.6-6.2mm. Chiapas, Puebla, Oaxaca, Veracruz………………………….............………………………P. menetriesi (Blanchard) |
| 16’. Septula con estrías transversales; placa respiratoria del segmento abdominal 7 con diámetro poco mayor al de la placa del 6; maxilas con 11 dientecillos estriduladores; ancho de la cabeza 5.8mm. Noroeste, Centro y Sur de México…..........................………………………………P. vetula (Horn) |
| 17. Palidia convergentes en ambos extremos; cabeza con 2 sedas frontales posteriores.…………..18 |
| 17’. Palidia convergentes en los extremos anteriores; cabeza con 4 sedas frontales posteriores, 4.6-4.8mm de anchura. Guerrero, Jalisco, México, Morelos, Nayarit, Puebla, Sinaloa......P. brevidens (Bates) |
| 18. Frente casi lisa……………………………………………………………………………19 |
| 18’. Frente finamente rugosa…………………………………………………………….…………21 |
| 19. Acanthoparia formado por 7-10 sedas espiniformes; cada palidium con 15-27 pali cortos; ancho de la cabeza 4.1-4.8mm. Casi todo México (excepto el norte y península de Baja California), Texas, América Central y Colombia……………………………………………….P. obsoleta (Blanchard) |
| 19’. Acanthoparia formado por 9-12 sedas espiniformes…………………………………………….20 |
| 20. Cabeza con 13-15 sedas frontales posteriores, 4.5-4.8mm de anchura; palidia con 13-21 pali. Chiapas……………………………………………………………………….…..P. pilosula (Moser) |
| 20’. Cabeza con 12 sedas frontales posteriores, 4.7mm de anchura; palidia con 19-21 pali. Noroeste, centro, sur y sureste de México……………………………………………………...P. lenis (Horn) |
| 21. Cabeza con 10-12 sedas frontales anteriores, 4.9-5.6mm de anchura; plegmata formada por 9-10 plegmatia; palidium con 24-26 pali. Centro y Sur de México.....................................P. misteca (Bates) |
| 21’. Cabeza con 8-14 sedas frontales anteriores, 6.1-6.7mm de anchura; plegmata formada por 10-15 plegmatia; palidium con 11-18 pali. Sur y sureste de México.……………….…….P. tenuipilis (Bates) |
Al personal del rancho Los Castaños, Téodulo Pineda y David Areas, por las facilidades para obtener muestras en el suelo de la plantación de Las Vigas, Veracruz. Esta publicación es una contribución a la línea de investigación «Sistemática, biología e importancia de los Coleópteros Lamelicornios de América Latina», apoyada con recursos del Instituto de Ecología A.C. (cuenta 20030-10011).
La revisión por pares es responsabilidad de la Universidad Nacional Autónoma de México.