Se presenta un análisis de las especies de moluscos del arrecife coralino de Tenacatita, Jalisco en el Pacífico central mexicano. El estudio incluye especies encontradas tanto en la estructura arrecifal como en los fondos blandos circundantes y en la zona intermareal rocosa. La lista sistemática está integrada por moluscos pertenecientes a las clases Gasteropoda, Bivalvia, Polyplacophora y Cephalopoda, de las que fueron encontradas un total de 123 especies contenidas en 48 familias, entre las que destacan como las más representativas: Calyptraeidae, Thaididae, Columbellidae, Conidae, Arcidae, Pteridae, Chamidae e Ischnochitonidae. Se presenta una serie de observaciones ecológicas sobre las especies más frecuentes, así como su afinidad por los diversos tipos de hábitat en el arrecife. Se realiza una síntesis de todas aquellas especies que han tenido algún cambio en su nomenclatura ocurrida en los últimos 40 años. De acuerdo con una revisión de la literatura publicada, se encontró que las especies aquí listadas están dentro de su ámbito geográfico conocido; sin embargo, constituyen registros nuevos para el área de estudio. Por último, se realiza un análisis comparativo entre la riqueza de especies del arrecife de Tenacatita y la registrada en otras localidades de la costa del Pacífico con y sin presencia de arrecifes coralinos.
An analysis of the most common species of mollusks of the coral reef of Tenacatita, Jalisco, in the central Mexican Pacific is presented. The study includes species found both in the reef structure as well as in the surroundings of bottom sand adjacent rocky intertidal zone. The systematic list comprises species of mollusks of the Gastropoda, Bivalvia, Polyplacophora and Cephalopoda classes making a total of 123 different species in 48 families, from which Calyptraeidae, Thaididae, Columbellidae, Conidae, Arcidae, Pteridae, Chamidae and Ischnochitonidae are the most representative. A series of ecological observations on the most conspicuous species and their affinity for the various types of habitat on the coral reef are made. A synthesis of all species that have had a change in nomenclature in the last 40 years is carried out. According to a review of the published literature, we found the species listed here are within their known geographic environment; however, they are new records for the study area. Finally, we carried out a comparative analysis between the species richness of the Tenacatita reef and that recorded in other locations of the Pacific coast with and without the presence of coral reefs.
Hasta mediados del siglo XX se consideraba que la costa occidental de América era poco propicia para la formación de arrecifes coralinos debido a su configuración orográfica y sus características oceanográficas (Reyes-Bonilla, 2003). No fue sino hasta años recientes cuando se registró la presencia de verdaderos arrecifes de coral en algunos sitios localizados a lo largo del Pacífico mexicano, y que pueden ser naturalmente divididos en 3 grupos: los del golfo de California, que se caracterizan por abundantes parches de coral; los del archipiélago Revillagigedo, con una mayor riqueza de especies de coral y formaciones masivas en aguas profundas, y los del Pacífico tropical mexicano, que se consideran los más desarrollados en cuanto a su cobertura, pero con una riqueza baja (Reyes-Bonilla, 2003). Entre estos últimos, se encuentran los arrecifes de coral de las bahías de Banderas, Nayarit y Chamela-Tenacatita en Jalisco (López-Uriarte y Ríos-Jara, 2004).
Los arrecifes coralinos son ecosistemas marinos que destacan por la riqueza y abundancia de especies de invertebrados y peces asociados a ellos que los pueden ocupar como refugio, crianza o área de alimentación. Para el área considerada en este estudio; el arrecife coralino de Tenacatita, conocido también como arrecife de playa Mora, los antecedentes en general son escasos. López-Uriarte y Ríos-Jara (2004) reportaron la presencia de 3 familias de corales, entre las que destacaba por su abundancia la familia Pocilloporidae y describieron 27 especies de crustáceos asociados al coral. Dentro de la ictiofauna asociada al arrecife, Galván-Villa et al. (2011) registraron un total de 64 especies, mientras que para peces crípticos se encontraó un total de 13 especies (Galván-Villa, 2008). Se han realizado otros trabajos para el estudio de las algas presentes en diferentes estratos de la zona (Hernández-Herrera et al., 2005; Mendoza-González et al., 2011).
El primer estudio específico de moluscos para la bahía de Tenacatita abarcó diferentes sitios de muestreos, profundidades, ambientes y consideró ejemplares recolectados entre 1961 y 1970, registrando un total de 134 especies de gasterópodos para toda la bahía y únicamente 2 especies para la zona arrecifal; Jenneria pustulata (Lightfoot, 1786) y Quoyula madreporarum (Sowerby, 1834 y González-Villarreal, 1977). En estudios más recientes, otros autores han encontrado para el área alrededor de 70 especies (López-Uriarte y Ríos-Jara, 2004), en tanto que Ríos-Jara et al. (2006) encontraron 40 especies en su mayoría de gasterópodos. En un estudio detallado que se considera el antecedente directo de este trabajo, Rodríguez-Urzúa (2006) registró 53 especies pertenecientes a gasterópodos, bivalvos y poliplacóforos.
En la actualidad, una prioridad nacional en materia ambiental es el conocimiento de la biodiversidad; por ello, se han destinado recursos humanos y económicos con el fin de contar con inventarios confiables. En este contexto es que se estructura esta contribución, que tiene como objetivo principal exponer un panorama cualitativo de la malacofauna asociada al arrecife coralino de Tenacatita, Jalisco, México. Esta información, junto con otros listados que se han generado para el arrecife, además de una caracterización física, permitirá establecer la línea de base ecológica y por lo tanto, contar con información actual, pertinente y veraz que facilite estructurar programas de gestión y conservación del área. Sobre todo, tomando en cuenta que a la fecha, el área del arrecife coralino de Tenacatita no cuenta con un esquema de protección o figura jurídica, aunado a un conflicto social por los terrenos aledaños al área.
Materiales y métodosEl arrecife coralino de Tenacatita se localiza en la porción sur del estado de Jalisco, en la región conocida como Costa Alegre, en el municipio de La Huerta, México, entre las coordenadas geográficas 19°16'49” N, 104°52'20” O, es también conocido como el arrecife de playa Mora (Fig. 1) (Google earth, 2012) y se considera como un arrecife litoral que se caracteriza por permanecer parcialmente expuesto durante bajamares extremas. Está constituido en su mayor parte por especies de corales pétreos del género Pocillopora, los cuales forman arrecifes ubicados en aguas someras (Reyes-Bonilla, 2003). En su parte continental se encuentra delimitado por una zona intermareal rocosa que presenta una gran heterogeneidad de sustratos; que van desde fragmentos de conchas, arena y cantos rodados hasta rocas de gran tamaño y acantilados. Este arrecife se encuentra dividido en 2 bloques paralelos a la línea de costa, separados por una barra de arena. El bloque de mayor dimensión tiene una extensión cercana a los 300m de largo y un máximo de 62m de ancho, con una altura que va de 0.85 a 3.20m. El segundo bloque presenta 210m de largo y hasta 50m de ancho, y aunque es de menor longitud tiene una altura promedio de 1.72m, con un máximo de 3.20m y un mínimo de 0.85m. (Galván-Villa et al., 2011). La temperatura del agua presenta variaciones de más de 10°C en un ciclo anual, que va desde los 30°C en verano y hasta 18°C en los meses de invierno (López-Uriarte y Ríos-Jara, 2004).
Los muestreos se realizaron semestralmente entre el 2001 y el 2010. Se utilizó la técnica de búsqueda y recolección directa de los organismos tanto en la zona intermareal rocosa como en la parte somera y profunda del arrecife, empleando, técnicas de buceo libre y autónomo. Adicionalmente, se extrajeron pequeños bloques de coral con un peso aproximado de 1 a 3kg, los cuales fueron revisados cuidadosamente para obtener aquellas especies de hábitos crípticos y, con la finalidad de evitar mayores daños al arrecife sólo se tomaron los bloques desprendidos por acción directa del oleaje o del anclado de embarcaciones. Una vez revisados los fragmentos y extraídos los invertebrados, los corales fueron depositados nuevamente en el lugar donde fueron obtenidos.
En la mayoría de los casos, el material biológico recolectado fue fotografiado e identificado in situ, para posteriormente ser liberado vivo en el mismo sitio de recolección. En los casos en que existieron dudas para su identificación taxonómica, los ejemplares se preservaron primero en formol al 10% y posteriormente en alcohol al 70% e ingresados a la Colección de Invertebrados del Departamento de Estudios para el Desarrollo Sustentable de Zonas Costeras de la Universidad de Guadalajara (en formación).
Para la identificación de los organismos, se empleó literatura especializada tal como Keen (1971), Vaught (1989) y Coan et al. (2000), considerando solamente caracteres externos (conquiliológicos). Aunado a ésto y debido a que en las últimas décadas han ocurrido cambios sustanciales en cuanto a la nomenclatura y los arreglos sistemáticos, se realizó una actualización de dicha información de acuerdo con Skoglund (1991, 1992, 2001, 2002).
ResultadosSistemática. Del material biológico recolectado en el arrecife coralino de Tenacatita y la zona intermareal rocosa y arenosa aledañas a éste, se logró identificar un total de 48 familias y 123 especies de moluscos pertenecientes a 4 clases: Bivalvia, Gasteropoda, Polyplacophora y Cephalopoda. El grupo predominante fue el de los gasterópodos con 87 especies, seguido por el de bivalvos con 24, los poliplacóforos con 11 y por último, los cefalópodos con 1 especie (Cuadro 1). En cuanto a número de familias por cada clase, se encontraron 9 de bivalvos, 36 de gasterópodos, 2 de poliplacóforos y 1 de cefalópodos.
Lista sistemática de los moluscos del arrecife coralino de Tenacatita, Jalisco, México
| Clase Bivalvia | Familia Lottidae |
| Familia Arcidae | Lottia dalliana (Pilsbry, 1891) |
| Acar bailyi (Bartsch, 1931) | Lottia pediculus (Philippi, 1846) |
| Acar gradata (Broderip and Sowerby, 1829) | Lottia mesoleuca (Menke, 1851) |
| Acar rostae Berry 1954 | Tectura fascicularis (Menke, 1851) |
| Anadara (Larkinia) grandis (Broderip and Sowerby, 1829) | Familia Trochidae |
| Familia Mytilidae | Calliostoma aequisculptum Carpenter, 1865 |
| Brachidontes adamsianus (Dunker, 1857) | Tegula (Agathistoma) globulus (Carpenter, 1857) |
| Brachidontes semilaevis (Menke, 1849) | Familia Turbinidae |
| Choromytilus palliopunctatus (Carpenter, 1857) | Astraea (Uvanilla) unguis (Wood, 1828) |
| Lithophaga (Diberus) plumula (Hanley, 1843) | Familia Neritidae |
| Modiolus (Modiolus) capax (Conrad, 1837) | Nerita (Cymostyla) scabricosta Lamarck, 1822 |
| Familia Pteriidae | Nerita (Theliostyla) funiculata Menke, 1851 |
| Pinctada mazatlanica (Hanley, 1856) | Familia Littorinidae |
| Isognomon (Melina) janus Carpenter, 1857 | Nodlittorina (Nodilittorina) aspera (Philippi, 1846) |
| Isognomon (Melina) recognitus (Mabille, 1895) | Nodilittorina (Fossarilittorina) modesta (Philippi, 1846) |
| Familia Pectinidae | Familia Turritellidae |
| Nodipecten subnodosus (Sowerby, 1835) | Vermicularia pellucida eburnea (Reeve, 1842) |
| Familia Spondylidae | Familia Rissoinidae |
| Spondylus calcifer Carpenter, 1857 | Rissoina (Rissoina) stricta Menke, 1850 |
| Spondylus princeps (Broderip, 1833) | Familia Architectonicidae |
| Familia Carditidae | Architectonica (Architectonica) nobilis Röding, 1798 |
| Carditamera affinis Sowerby, 1833 | Familia Cerithiidae |
| Cardites crassicostata (Sowerby, 1825) | Cerithium (Thericium) adustum (Kiener, 1841) |
| Familia Chamidae | Cerithium (Thericium) maculosum Kiener, 1841 |
| Chama (Chama) buddiana Adams,1852 | Cerithium (Thericium) menkei Carpenter, 1857 |
| Chama (Chama) sordida Broderip, 1835 | Familia Planaxidae |
| Pseudochama dalli Bernard, 1976 | Planaxis obsoletus Menke, 1851 |
| Pseudochama saavedrai Hertlein and Strong, 1946 | Familia Hipponicidae |
| Familia Veneridae | Hipponix grayanus (Menke, 1853) |
| Periglypta multicostata (Sowerby, 1835) | Hipponix (Antiquatus) panamensis Adams, 1852 |
| Megapitaria squalida (Sowerby, 1835) | Pilosabia pilosa (Deshayes, 1832) |
| Familia Corbulidae | Familia Calyptraeidae |
| Corbula (Juliacorbula) bicarinata Sowerby, 1833 | Calyptraea (Trochita) spirata (Forbes, 1852) |
| Clase Gastropoda | Crepidula onyx (Sowerby, 1824) |
| Familia Fissurellidae | Crucibulum (Crucibulum) cyclopium Berry, 1969 |
| Fissurella (Cremides) nigrocincta Carpenter, 1856 | Crucibulum (Crucibulum) lignarium (Broderip, 1834) |
| Fissurella (Cremides) virescens Sowerby, 1835 | Crucibulum (Crucibulum) scutellatum (Wood, 1828) |
| Familia Patellidae | Crucibulum (Crucibulum) spinosum (Sowerby, 1824) |
| Scutellastra mexicana (Broderip and Sowerby, 1829) | Familia Triviidae |
| Trivia (Pusula) sanguinea (Sowerby, 1832) | Cosmioconcha rehderi (Hertlein and Strong, 1951) |
| Familia Cypraeidae | Mitrella ocellata (Gmelin, 1791) |
| Erosaria (Erosaria) albuginosa (Gray, 1825) | Familia Fasciolariidae |
| Macrocypraea cervinetta Kiener, 1843 | Latirus mediamericanus Hertlein and Strong, 1951 |
| Mauritia arabicula (Lamarck, 1811) | Leucozonia cerata (Wood, 1828) |
| Familia Ovulidae | Opeatostoma pseudodon (Burrow, 1815) |
| Jenneria pustulata (Lightfoot, 1786) | Familia Olividae |
| Familia Cassididae | Oliva (Strephona) spicata (Röding, 1798) |
| Cypraecassis (Lovenia) coarctata (Sowerby, 1825) | Familia Vasidae |
| Morum (Morum) tuberculosum (Reeve, 1842) | Vasum caestus (Broderip, 1833) |
| Familia Cymatiidae | Familia Mitridae |
| Cymatium (Turritriton) gibbosum (Broderip, 1833) | Mitra (Nebularia) lens Wood, 1828 |
| Cymatium sp. | Mitra (Strigatella) tristis Broderip, 1836 |
| Familia Muricidae | Familia Conidae |
| Hexaplex (Trunculariopsis) princeps (Broderip, 1833) | Conus (Conus) brunneus Wood, 1828 |
| Muricopsis (Muricopsis) zeteki Hertlein and Strong, 1951 | Conus (Conus) gladiator Broderip, 1833 |
| Eupleura muriciformis (Broderip, 1833) | Conus (Conus) princeps Linnaeus, 1758 |
| Pterotyphis (Pterotyphis) fimbriatus (A. Adams, 1854) | Conus (Chelyconus) californicus Reeve, 1844 |
| Trachypollia lugubris (C. B. Adams, 1852) | Conus (Chelyconus) purpurascens Sowerby, 1833 |
| Familia Coralliophidae | Conus (Lithoconus) archon Broderip, 1833 |
| Quoyula madreporarum (Sowerby, 1834) | Conus (Pyruconus) fergusoni Sowerby 1833 |
| Quoyula monodonta (Blainville, 1882) | Conus (Stephanoconus) nux Broderip, 1833 |
| Familia Thaididae | Familia Turridae |
| Mancinella speciosa (Valenciennes, 1832) | Pilsbryspira (Pilsbryspira) garciacubasi Shasky, 1971 |
| Mancinella tringularis (Blainville, 1832) | Familia Siphonariidae |
| Stramonita biserialis (Blainville, 1832) | Siphonaria (Heterosiphonaria) maura (Sowerby, 1835) |
| Vasula melones (Duclos, 1832) | Siphonaria (Heterosiphoraria) palmata (Carpenter, 1857) |
| Plicopurpura columellaris (Lamarck, 1822) | Familia Trimusculidae |
| Plicopurpura pansa (Gould, 1853) | Trimusculus reticulatus (Sowerby, 1835) |
| Familia Buccinidae | Familia Aglajidae |
| Cantharus (Pollia) sanguinolentus (Duclos, 1833) | Navanax aenigmaticus (Bergh, 1893) |
| Cantharus sp. | Familia Placobranchidae |
| Engina maura (Sowerby, 2832) | Elysia diomedea (Bergh, 1894) |
| Engina tabogaensis Bartsch, 1931 | Familia Chromodorididae |
| Familia Columbellidae | Chromodoris marislae Bertsch, 1973 |
| Columbella fuscata (Sowerby, 1832) | Familia Arminiidae |
| Culumbella major (Sowerby, 1832) | Armina californica (Cooper, 1863) |
| Columbella strombiformis (Lamarck, 1822) | Clase Polyplacophora |
| Columbella sp. | Familia Chitonidae |
| Costoanachis nigrofusca (Carpenter, 1857) | Chiton (Chiton) albolineatus Broderip and Sowerby, 1829 |
| Cosmioconcha palmeri (Dall, 1913) | Chiton (Chiton) articulatus Sowerby, 1832 |
| Tonicia forbesii Carpenter, 1857 | Callistoplax retusa (Sowerby, 1832) |
| Familia Ischnochitonidae | Callistoplax elenensis |
| Radsiella sp. | Ischnochiton (Ischnochiton) muscarius (Reeve, 1847) |
| Stenoplax (Stenoplax) limaciformis (Sowerby in Broderip and Sowerby, 1832) | Ischnochiton (Ischnochiton) sp. |
| Clase Cephalopoda | |
| Stenoplax sp. | Familia Octopodidae |
| Callistochiton elenensis (Sowerby, 1832) | Octopus hubbsorum Berry, 1953 |
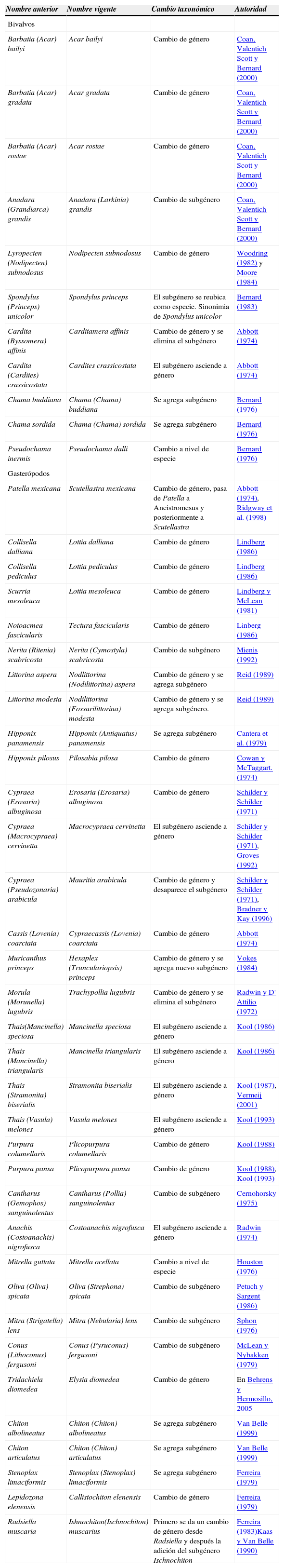
Por otra parte, después de realizar una extensa revisión en cuanto a los cambios taxonómicos propuestos en los últimos años, se encontró que la nomenclatura de 50 especies de esta lista ha sido modificada por diversos autores, proponiendo nuevas combinaciones (algunas de ellas en más de una ocasión), es decir, una nueva nomenclatura para el grupo. Estas modificaciones se presentaron en el 40.5% del total de las especies identificadas, lo cual puede dar una idea de cómo la sistemática y la taxonomía de moluscos se encuentran en una dinámica constante (Cuadro 2).
Cambios recientes en la nomenclatura de algunas especies de moluscos del arrecife coralino de Tenacatita, Jalisco, México, de acuerdo con la literatura compilada por Skoglund (1991, 1992, 2001, 2002)
| Nombre anterior | Nombre vigente | Cambio taxonómico | Autoridad |
|---|---|---|---|
| Bivalvos | |||
| Barbatia (Acar) bailyi | Acar bailyi | Cambio de género | Coan, Valentich Scott y Bernard (2000) |
| Barbatia (Acar) gradata | Acar gradata | Cambio de género | Coan, Valentich Scott y Bernard (2000) |
| Barbatia (Acar) rostae | Acar rostae | Cambio de género | Coan, Valentich Scott y Bernard (2000) |
| Anadara (Grandiarca) grandis | Anadara (Larkinia) grandis | Cambio de subgénero | Coan, Valentich Scott y Bernard (2000) |
| Lyropecten (Nodipecten) subnodosus | Nodipecten subnodosus | Cambio de género | Woodring (1982) y Moore (1984) |
| Spondylus (Princeps) unicolor | Spondylus princeps | El subgénero se reubica como especie. Sinonimia de Spondylus unicolor | Bernard (1983) |
| Cardita (Byssomera) affinis | Carditamera affinis | Cambio de género y se elimina el subgénero | Abbott (1974) |
| Cardita (Cardites) crassicostata | Cardites crassicostata | El subgénero asciende a género | Abbott (1974) |
| Chama buddiana | Chama (Chama) buddiana | Se agrega subgénero | Bernard (1976) |
| Chama sordida | Chama (Chama) sordida | Se agrega subgénero | Bernard (1976) |
| Pseudochama inermis | Pseudochama dalli | Cambio a nivel de especie | Bernard (1976) |
| Gasterópodos | |||
| Patella mexicana | Scutellastra mexicana | Cambio de género, pasa de Patella a Ancistromesus y posteriormente a Scutellastra | Abbott (1974), Ridgway et al. (1998) |
| Collisella dalliana | Lottia dalliana | Cambio de género | Lindberg (1986) |
| Collisella pediculus | Lottia pediculus | Cambio de género | Lindberg (1986) |
| Scurria mesoleuca | Lottia mesoleuca | Cambio de género | Lindberg y McLean (1981) |
| Notoacmea fascicularis | Tectura fascicularis | Cambio de género | Linberg (1986) |
| Nerita (Ritenia) scabricosta | Nerita (Cymostyla) scabricosta | Cambio de subgénero | Mienis (1992) |
| Littorina aspera | Nodlittorina (Nodilittorina) aspera | Cambio de género y se agrega subgénero | Reid (1989) |
| Littorina modesta | Nodilittorina (Fossarilittorina) modesta | Cambio de género y se agrega subgénero. | Reid (1989) |
| Hipponix panamensis | Hipponix (Antiquatus) panamensis | Se agrega subgénero | Cantera et al. (1979) |
| Hipponix pilosus | Pilosabia pilosa | Cambio de género | Cowan y McTaggart. (1974) |
| Cypraea (Erosaria) albuginosa | Erosaria (Erosaria) albuginosa | Cambio de género | Schilder y Schilder (1971) |
| Cypraea (Macrocypraea) cervinetta | Macrocypraea cervinetta | El subgénero asciende a género | Schilder y Schilder (1971), Groves (1992) |
| Cypraea (Pseudozonaria) arabicula | Mauritia arabicula | Cambio de género y desaparece el subgénero | Schilder y Schilder (1971), Bradner y Kay (1996) |
| Cassis (Lovenia) coarctata | Cypraecassis (Lovenia) coarctata | Cambio de género | Abbott (1974) |
| Muricanthus princeps | Hexaplex (Trunculariopsis) princeps | Cambio de género y se agrega nuevo subgénero | Vokes (1984) |
| Morula (Morunella) lugubris | Trachypollia lugubris | Cambio de género y se elimina el subgénero | Radwin y D' Attilio (1972) |
| Thais(Mancinella) speciosa | Mancinella speciosa | El subgénero asciende a género | Kool (1986) |
| Thais (Mancinella) triangularis | Mancinella triangularis | El subgénero asciende a género | Kool (1986) |
| Thais (Stramonita) biserialis | Stramonita biserialis | El subgénero asciende a género | Kool (1987), Vermeij (2001) |
| Thais (Vasula) melones | Vasula melones | El subgénero asciende a género | Kool (1993) |
| Purpura columellaris | Plicopurpura columellaris | Cambio de género | Kool (1988) |
| Purpura pansa | Plicopurpura pansa | Cambio de género | Kool (1988), Kool (1993) |
| Cantharus (Gemophos) sanguinolentus | Cantharus (Pollia) sanguinolentus | Cambio de subgénero | Cernohorsky (1975) |
| Anachis (Costoanachis) nigrofusca | Costoanachis nigrofusca | El subgénero asciende a género | Radwin (1974) |
| Mitrella guttata | Mitrella ocellata | Cambio a nivel de especie | Houston (1976) |
| Oliva (Oliva) spicata | Oliva (Strephona) spicata | Cambio de subgénero | Petuch y Sargent (1986) |
| Mitra (Strigatella) lens | Mitra (Nebularia) lens | Cambio de subgénero | Sphon (1976) |
| Conus (Lithoconus) fergusoni | Conus (Pyruconus) fergusoni | Cambio de subgénero | McLean y Nybakken (1979) |
| Tridachiela diomedea | Elysia diomedea | Cambio de género | En Behrens y Hermosillo, 2005 |
| Chiton albolineatus | Chiton (Chiton) albolineatus | Se agrega subgénero | Van Belle (1999) |
| Chiton articulatus | Chiton (Chiton) articulatus | Se agrega subgénero | Van Belle (1999) |
| Stenoplax limaciformis | Stenoplax (Stenoplax) limaciformis | Se agrega subgénero | Ferreira (1979) |
| Lepidozona elenensis | Callistochiton elenensis | Cambio de género | Ferreira (1979) |
| Radsiella muscaria | Ishnochiton(Ischnochiton) muscarius | Primero se da un cambio de género desde Radsiella y después la adición del subgénero Ischnochiton | Ferreira (1983)Kaas y Van Belle (1990) |
Asociaciones de especies. Como resultado de las observaciones efectuadas durante 10 años de trabajo en campo sobre las asociaciones de los moluscos del área estudiada, fue posible establecer ciertos patrones de agregación entre las especies registradas que pueden responder a diversos factores bióticos y abióticos, como relaciones interespecíficas, disponibilidad de alimento, tipos de nutrición y afinidad por el hábitat. En función de lo anterior y apoyados por el análisis e interpretación de un gran número de fotografías digitales, se lograron distinguir al menos 13 grupos de especies, aunque sólo se mencionan las más conspicuas de cada caso.
Grupo A, reúne a las especies presentes en las zonas superiores del intermareal rocoso y que permanecen por grandes periodos expuestas a la desecación (ej. Nodilittorina aspera, N. modesta y Nerita scabricosta).
Grupo B, incluye especies de gran movilidad, típicas de pozas de marea, que dependen en gran medida de las fluctuaciones de la misma y que por sus hábitos
alimenticios se definen como carnívoras y carroñeras. Son especies tolerantes a una considerable variación de temperatura y salinidad (ej. Mancinella trinagularis y Columbella fuscata).
Grupo C, compuesto por especies que en condiciones de bajamar habitan por debajo de rocas sueltas y, en ocasiones, enterradas en fondos arenosos (ej. Planaxis obsoletus, Mitrella ocellata, Rissoina stricta y Tegula globulus).
Grupo D, incluye especies típicas de la parte media del mesolitoral en el intermareal rocoso, que van desde los pateliformes herbívoros hasta los depredadores carnívoros (ej. Fissurella virescens, Lottia mesoleuca, Mancinella speciosa, Stramonita biserialis y Chiton articulatus).
Grupo E, reúne a especies sésiles filtradoras que colonizan las grietas de grandes rocas y la zona más expuesta al embate de las olas (ej. Brachidontes adamsianus, Isognomon recognitus, Pseudochama dalli y Modiolus capax).
Grupo F, compuesto por aquellas especies que comparten el límite inferior de la zona intermareal y el inicio del arrecife, habitando ya sea por encima o debajo de rocas sueltas permanentemente sumergidas en el agua (ej. Acar gradata, Isognomon janus, Cardites crassicostata, Chama buddiana, Astraea unguis, Cerithium maculosum, Crucibulum cyclopium, Mauritia arabicula, Cantharus sanguinolentus, Engina maura, Latirus mediamericanus, Leucozonia cerata y Callistochiton elenensis).
Grupo G, incluye especies directamente asociadas al sustrato coralino, que van desde las que ocupan espacios entre sus ramificaciones y lo utilizan como refugio o zona de caza hasta las que se alimentan de él y las bioerosionadoras que lo perforan para formar galerías y refugios (ej. Acar rostae, Lithophaga plumula, Chama sordida, Jenneria pustulata, Muricopsis zeteki, Cymatium gibbosum, Quoyula madreporarum y Q. monodonta).
Grupo H, compuesto por aquellas especies presentes en los fondos blandos y rocosos adyacentes al arrecife, algunas veces enterradas en el sustrato (ej. Nodipecten subnodosus, Macrocypraea cervinetta, Hexaplex princeps y Vasum caestus).
Grupo I, incluye especies de libre movimiento, con una notable capacidad para habitar cualquier zona del arrecife o realizar importantes migraciones verticales durante los ciclos de marea (ej. Cerithium adustum, Opeatostoma pseudodon, Conus brunneus, C. gladiator, C. princeps, C. purpurascens y C. nux).
Grupo J. contiene especies epibiontes que habitan sobre otros moluscos (ej. Crepidula onyx, Radsiella sp. y Crucibulum lignarium).
Grupo K, reúne especies que utilizan el arrecife temporalmente como una zona de reproducción y crecimiento antes de realizar migraciones hacia mayores profundidades (ej. Octopus hubbsorum, Elysia diomedea y Strombus galeatus).
Grupo L, incluye especies herbívoras y omnívoras que mantienen una estrecha relación con lechos de algas adheridas a las rocas (ej. Navanax aenigmaticus, Chromodoris marislae, Fissurella virescens y Tectura fascicularis).
Grupo M, incluyen especies carismáticas del arrecife (Periglypta multicostata, Megapitaria squalida, Calyptraea spirata, Conus spp.) o que se encuentran listadas como sujetas a protección especial (ej. Plicopurpura pansa, Pinctada mazatlanica, Spondylus spp. y Scutellastra mexicana), ya sea por su importancia social, económica, biomédica o ecológica y que son consideradas, en ocasiones, como especies bandera, pudiendo ser utilizadas con fines de protección de áreas naturales.
Observaciones ecológicas. A manera de información complementaria a la lista sistemática, se describen también algunas características ecológicas notables de los moluscos más comunes en el arrecife coralino y la zona intermareal y arenosa aledaña. Dicha descripción aborda de manera individual algunos aspectos básicos sobre la biología y hábitos de las principales especies, así como interacciones observadas y características anatómicas especiales (Cuadro 3).
Características ecológicas notables de algunas especies en el arrecife coralino de Tenacatita
| Observaciones | |
|---|---|
| Clase Bivalvia | |
| Acar gradata | Especie común en la zona mesolitoral inferior, se presenta adherida por debajo de piedras sumergidas y móviles que frecuentemente son colonizadas por esponjas y otros invertebrados como pepinos de mar. Los organismos de esta especie no suelen formar colonias. El color puede variar de café claro a café oscuro y algunos ejemplares pueden presentar una banda clara en el borde de la concha. |
| Brachidontes adamsianus | Suele habitar adherida por medio de un biso a grietas de rocas fijas de gran tamaño formando agregaciones considerables. Regularmente se le encuentra en el intermareal rocoso en zonas expuestas al oleaje. También se observa en pozas de marea. Presenta una gran resistencia a la desecación. |
| Lithophaga (Diberus) plumula | Esta es una de las especies que guardan una estrecha relación con el sustrato coralino. Es común encontrarla dentro de las ramificaciones y perforando la base de corales pétreos del género Pocillopora, pero también ha sido encontrada bajo piedras sumergidas de tamaño mediano. En ocasiones se observa perforando conchas de gran tamaño del género Spondylus y Scutellastra. Por el hecho de permanecer oculta, se considera por varios autores como especie críptica. No es común que forme grandes colonias, pero en conchas parasitadas sí puede estar presente más de un organismo. |
| Isognomon (Melina) recognitus | Especie intermareal adaptada al embate del fuerte oleaje. Se le ha observado tanto en grietas de rocas grandes como adheridas por debajo de rocas medianas inestables (que pueden tener cierta movilidad) cercanas al arrecife. Por su aspecto puede confundirse con juveniles de Pteria sterna, sin embargo, no llega a alcanzar gran tamaño. Se encuentra de manera solitaria sin llegar a formar colonias. |
| Modiolus (Modiolus) capax | Especie sumamente adaptada al mayor embate de las olas. Siempre localizada en la región más expuesta del arrecife fuertemente fijada a rocas sólidas y formando colonias de considerable abundancia. Un periostraco duro velloso en el borde de la concha es una de sus principales características. Ocasionalmente extraída como pesca de autoconsumo por pescadores de la localidad. Generalmente, se encuentra compartiendo el hábitat con lechos de algas. |
| Chama (Chama) buddiana | Especie no muy abundante que es común encontrarla fuertemente adherida por debajo de rocas sueltas de tamaño mediano en la zona mesolitoral inferior y muy cercanas al arrecife coralino. No llega a formar colonias y puede confundirse fácilmente con otras especies pequeñas del mismo género. |
| Pseudochama dalli | Ésta es una de las almejas de mayor abundancia en el litoral rocoso del arrecife y es un excelente competidor de espacio. Se encuentra también en la región más expuesta al oleaje y una vez despegada de la roca es fácilmente reconocible por la coloración rosa, naranja y púrpura que presenta al interior de sus valvas. Su adhesión a las rocas es tanta que en la mayoría de las ocasiones sólo es posible desprender la valva superior. |
| Clase Gasteropoda | |
| Fissurella (Cremides) virescens | Ésta es una especie que habita la zona intermareal rocosa, distribuida desde la franja mesolitoral media hasta el nivel submareal. Puede resistir periodos grandes de exposición al sol, sin embargo, presenta importantes desplazamientos de acuerdo con los cambios en el nivel de la marea. Es común encontrarla entre lechos de algas de las cuales se alimenta. Los organismos de mayores tallas suelen ser recolectados para consumo humano y como carnada para la pesca. Sus conchas son ocasionalmente usadas en artesanías. |
| Lottia mesoleuca | Al igual que la anterior, ésta es una especie que habita la zona intermareal rocosa, compartiendo el hábitat con otras especies de lapas. Distribuida desde la franja mesolitoral media hasta el nivel submareal. Puede resistir también periodos grandes de exposición al sol, sin embargo, presenta importantes desplazamientos de acuerdo con los cambios en el nivel de la marea. Se le puede observar por encima de rocas lisas y en ocasiones llega a ser abundante. |
| Tectura fascicularis | Especie pateliforme que comparte características muy similares a las otras representantes de la familia Lotidae (Fissurella y Lottia). Es común encontrarla en la parte inferior y superior de rocas lisas en el nivel de la marea. |
| Tegula (Agathistoma) globulus | Ésta es una especie característica del intermareal rocoso, que puede encontrarse formando grandes colonias en la arena por debajo de rocas sueltas. Rara vez se les encuentra por encima de las rocas. Constituye1 de los alimentos preferidos del gasterópodo Stramonita biserialis e incluso de Plicopurpura pansa. |
| Nerita (Cymostyla) scabricosta | Éste es 1 de los gasterópodos más comunes y abundantes del intermareal rocoso del Pacífico tropical y del área de estudio. Llega a formar grandes colonias que habitan el mesolitoral superior, medio e inferior. Llegan a ser notablemente tolerantes a la desecación. Pueden tener desplazamientos importantes en busca de pequeñas algas que cubren las rocas. Se consideran de hábitos gregarios formando grandes colonias, por lo que en ocasiones los organismos de mayores tallas son consumidos de manera local. |
| Nodlittorina (Nodilittorina) aspera | Habitan el sustrato rocoso de la franja supralitoral y mesolitoral superior formando densas agregaciones. |
| En cuanto al número de individuos puede considerarse como la especie más abundante en el área de estudio. Son especialmente tolerantes a la desecación y su supervivencia depende en gran medida sólo de la salpicadura del oleaje. Por lo general viven asociados a Nodilittorina modesta y forman parte de la dieta de muchos gasterópodos de mayor tamaño. | |
| Cerithium (Thericium) maculosum | En el área de estudio, esta especie se encontró frecuentemente asociada a sustratos coralinos del género Pocillopora. Observada durante las mareas bajas en que se descubre la parte superior del arrecife. También ha sido encontrada en fondos arenosos y en la arena depositada entre guijarros en aguas muy someras desde el límite inferior de la zona intermareal rocosa hasta la zona sublitoral. Sus conchas son frecuentemente ocupadas por cangrejos ermitaños de la especie Calcinus californiensis. |
| Planaxis obsoletus | Se le encuentra formando grandes colonias en fondos arenosos por debajo de rocas de tamaño medio. Sólo se les observa sobre las rocas en horas tempranas o en el ocaso cuando los rayos solares bajan su intensidad. Tienen fototropismo negativo y pueden ser depredados por asteroideos que frecuentan el arrecife. |
| Hipponix (Antiquatus) panamensis | Por lo general, esta especie ha sido observada cerca del sustrato coralino, pero por debajo de rocas sueltas. Suele compartir el hábitat con bivalvos del género Chama, poliquetos tubícolas y colonias de esponjas. No llega a formar grandes colonias considerándose de baja abundancia. |
| Crucibulum (Crucibulum) cyclopium | Aunque su presencia puede ser común habitando la parte inferior de rocas de tamaño mediano cercanas al sustrato coralino, nunca ha sido observado en gran número o formando colonias. Es frecuente observarlo como parte de las conchas vacías que arrastra el oleaje. |
| Hexaplex (Trunculariopsis) princeps | Por su tamaño y sabor, esta especie que antes era abundante en la zona submareal del arrecife, ahora puede ser observada con menor frecuencia. Aunque es más común encontrarla en sustratos rocosos con intenso oleaje, suele frecuentar el arrecife con fines alimenticios, ya que existe una gran cantidad de caracoles que pueden ser presas potenciales para este depredador. |
| Quoyula monodonta | Junto con Quoyula madreporarum, esta especie se encuentra directamente asociada con sustratos coralinos del género Pocillopora. Habita en la base de las ramas del coral y ocupa cualquier espacio disponible del arrecife del cual se alimenta. Sin embargo, a diferencia de lo observado en otros arrecifes, la presencia simultánea de ambas especies es rara, debido quizás para evitar competencia por alimento. |
| Mancinella speciosa | Esta es una especie que habita en el mesolitoral inferior del intermareal rocoso. Es observada por encima de las rocas junto con otros gasterópodos de la familia Thaididae. |
| Mancinella tringularis | Al igual que la anterior, es una especie que habita en el mesolitoral inferior del intermareal rocoso. Al compartir parte del hábitat del caracol Plicopurpura pansa y debido a que no alcanza grandes tallas, se convierte en presa fácil de este caracol. |
| Plicopurpura pansa | Es 1 de los pocos caracoles que presentan una importancia cultural ancestral debido al tinte que produce. Ha sido utilizado desde épocas prehispánicas por la cultura mixteca y zapoteca para fines de tinción y ceremoniales. Es un caracol abundante en el área de estudio y forma importantes colonias en el intermareal rocoso. Es un depredador activo que incide principalmente sobre las poblaciones de Chiton articulatus y otros pequeños caracoles. |
| Cantharus (Pollia) sanguinolentus | Especie de talla pequeña que suele encontrarse en sustratos coralinos y aguas moderadamente someras sobre rocas cercanas al arrecife. Se caracteriza por presentar una abertura de la concha con un color rojo púrpura intenso y pústulas granosas de color blanco. |
| Columbella fuscata | Esta especie en ocasiones puede ser muy abundante en el mesolitoral inferior y muy común en pozas de marea. Sus conchas son una de las preferidas por cangrejos ermitaños del género Calcinus y pueden encontrarse hasta la zona submareal en la base del arrecife coralino. |
| Mitrella ocellata | Especie de tamaño pequeño que puede formar grandes colonias en los sustratos arenosos por debajo de piedras sueltas y en pozas intermareales. Tienen una gran movilidad y una vez expuestas pueden enterrarse en la arena y perderse de vista. |
| Leucozonia cerata | Es una especie muy vistosa que se encuentra desde el límite inferior de la zona intermareal rocosa, siendo más abundante sobre sustratos de coral erosionado por el oleaje. Nunca se han observado hábitos gregarios, mas no por eso deja de ser frecuente. |
| Opeatostoma pseudodon | Se ha observado que ésta es una de las especies que presenta una mayor amplitud en su distribución vertical. Puede encontrarse desde la zona mesolitoral superior del intermareal rocoso y en pozas de marea hasta el borde inferior del arrecife, preferentemente ocupando sustratos duros. Presenta un falso diente a manera de colmillo al final del labio externo que le da su identidad y que puede tener funciones alimenticias y reproductivas. |
| Vasum caestus | Es una de los gasterópodos de mayor tamaño del arrecife que puede presentar una abundancia considerable en ciertas épocas del año, sin embargo, debido a que es utilizado para el consumo humano en ocasiones puede estar ausente. |
| Conus (Conus) brunneus | Entre los caracoles de la familia Conidae, éste es1 de los más abundantes y puede ser encontrado desde el mesolitoral medio por encima y debajo de rocas sueltas hasta la parte más profunda del arrecife. Al igual que los otros representantes de esta familia, se caracteriza por los potentes venenos que han desarrollado, lo que le permite ampliar su espacio de caza. |
| Conus (Stephanoconus) nux | Esta es otra especie venenosa de menor tamaño que habita desde pozas intermareales hasta la zona submareal en todo el arrecife. En el intermareal frecuentemente es observado siguiendo el nivel de la marea. En estado de reposo suele encontrarse semienterrado en las grietas formadas por la unión de las rocas. Es de las especies de conos, la que presenta una mayor abundancia de organismos. |
| Siphonaria (Heterosiphoraria) palmata | De las especies competidoras por espacio en la zona intermareal rocosa, ésta puede ser una de las más exitosas, sin embargo, se ha observado una presencia estacional con épocas de mucha abundancia y otras casi ausente. Al parecer un competidor del espacio que ésta ocupa es el balano Chtamalus sp., que incluso tiene un aspecto muy parecido a primera vista. Cuando alguno de estos2 organismos está presente, llegan a cubrir la parte superior de las rocas soportando grandes periodos de exposición al sol debido a su adaptación de respiración aérea |
| Elysia diomedea | Es una de las especies de opistobranquios más comunes en el arrecife. Habita desde el mesolitoral medio, las pozas de marea y fondos con sustrato coralino somero. Suele ser abundante cuando hay presencia de lechos de algas sobre las cuales nada libremente. |
| Clase Polyplacophora | |
| Chiton (Chiton) albolineatus | Una de las especies de quitones más común, sin embargo, por su fototropismo negativo siempre permanece formando colonias por debajo de la rocas. |
| Chiton (Chiton) articulatus | Esta es una de las especies de quitones que alcanza mayores tallas. Tiene una gran adaptación al fuerte embate de las olas. Habita formando colonias en la unión de grandes rocas o por encima de ellas sobre lechos de algas. Por su tamaño ha sido susceptible a explotación para el consumo humano quien llega a depredar grandes extensiones de litoral rocoso. |
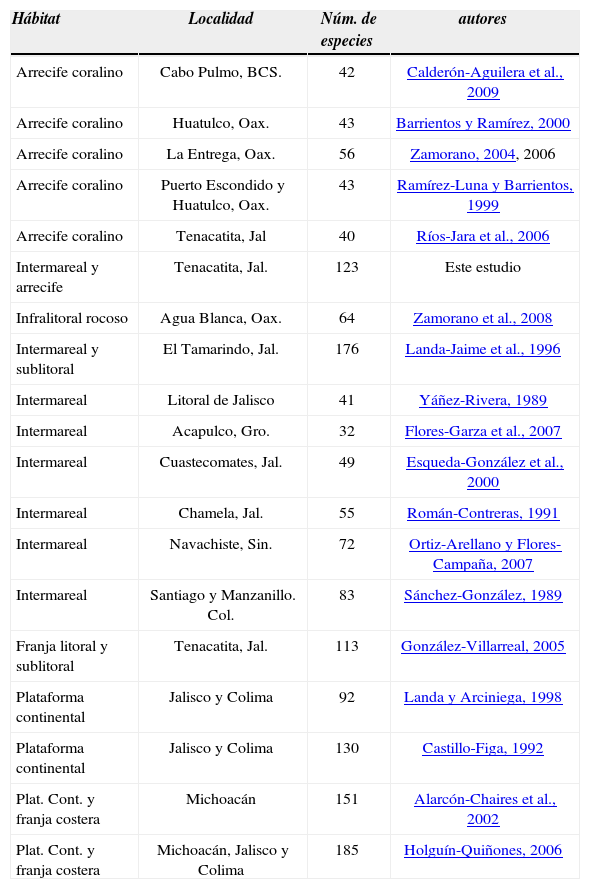
Análisis de la riqueza específica. Luego de una búsqueda minuciosa, se presenta una serie de datos consultados en la literatura publicada, en donde se muestra el número de especies de moluscos registradas en localidades del Pacífico mexicano que presentan diversas condiciones ambientales. Tales resultados son contrastados con los obtenidos, destacando éste como uno de los sitios con mayor riqueza de especies, al menos en lo que respecta a ecosistemas afines (Cuadro 4).
Número de especies de moluscos registradas en distintas localidades del Pacífico mexicano, considerando diversos hábitats marinos.
| Hábitat | Localidad | Núm. de especies | autores |
|---|---|---|---|
| Arrecife coralino | Cabo Pulmo, BCS. | 42 | Calderón-Aguilera et al., 2009 |
| Arrecife coralino | Huatulco, Oax. | 43 | Barrientos y Ramírez, 2000 |
| Arrecife coralino | La Entrega, Oax. | 56 | Zamorano, 2004, 2006 |
| Arrecife coralino | Puerto Escondido y Huatulco, Oax. | 43 | Ramírez-Luna y Barrientos, 1999 |
| Arrecife coralino | Tenacatita, Jal | 40 | Ríos-Jara et al., 2006 |
| Intermareal y arrecife | Tenacatita, Jal. | 123 | Este estudio |
| Infralitoral rocoso | Agua Blanca, Oax. | 64 | Zamorano et al., 2008 |
| Intermareal y sublitoral | El Tamarindo, Jal. | 176 | Landa-Jaime et al., 1996 |
| Intermareal | Litoral de Jalisco | 41 | Yáñez-Rivera, 1989 |
| Intermareal | Acapulco, Gro. | 32 | Flores-Garza et al., 2007 |
| Intermareal | Cuastecomates, Jal. | 49 | Esqueda-González et al., 2000 |
| Intermareal | Chamela, Jal. | 55 | Román-Contreras, 1991 |
| Intermareal | Navachiste, Sin. | 72 | Ortiz-Arellano y Flores-Campaña, 2007 |
| Intermareal | Santiago y Manzanillo. Col. | 83 | Sánchez-González, 1989 |
| Franja litoral y sublitoral | Tenacatita, Jal. | 113 | González-Villarreal, 2005 |
| Plataforma continental | Jalisco y Colima | 92 | Landa y Arciniega, 1998 |
| Plataforma continental | Jalisco y Colima | 130 | Castillo-Figa, 1992 |
| Plat. Cont. y franja costera | Michoacán | 151 | Alarcón-Chaires et al., 2002 |
| Plat. Cont. y franja costera | Michoacán, Jalisco y Colima | 185 | Holguín-Quiñones, 2006 |
Durante los últimos años, la taxonomía de los moluscos presenta un cambio constante. Skoglund, en sus obras de los años 1991, 1992, 2001 y 2002, es una de las autoras que han realizado la gran tarea de rescatar y compilar toda aquella información recientemente publicada para el Pacífico en cuanto a nuevos nombres de especies y revisiones taxonómicas, así como nuevas distribuciones e información biológica. Su trabajo ha sido basado en Keen (1971), una de las monografías más importantes de moluscos que se han realizado para el Pacífico americano, utilizando incluso la misma secuencia numérica en su actualización. Hoy en día se conoce de nuevas propuestas sistemáticas en las que se evalúan distintas características utilizadas para separar los grupos, sobre todo, a niveles taxonómicos superiores a familia al contar con nuevos elementos de discusión sobre caracteres específicos y la disponibilidad de nuevas tecnologías mediante estudios genéticos y moleculares. Aunado al incremento del trabajo en campo por parte de un mayor número de investigadores, ha permitido ampliar considerablemente la información disponible sobre los ámbitos de distribución geográfica, nuevas profundidades, nuevos registros, tallas máximas y mínimas, sinonimias, entre otros aspectos.
Estos estudios rectifican omisiones y errores del pasado utilizando caracteres y técnicas de mayor validez, lo que resulta en grandes revisiones de las distintas clases de moluscos y el consecuente cambio de nombres científicos y nuevos ordenamientos taxonómicos, que derivan en actualizaciones de las listas sistemáticas tradicionales, sin embargo, aunque se entiende que ésta es una consecuencia propia de la naturaleza de esta ciencia tan dinámica, en ocasiones la velocidad de acceso a tal información puede no ser la deseada y cuando se tiene disponible, ya existen otras nuevas propuestas. Considerando lo anterior, en la elaboración de la presente lista se decidió utilizar para una mayor comprensión, 2 de las obras más destacadas para la fauna malacológica del Pacífico tropical que ya han sido mencionadas al inicio de este apartado. En dichas obras puede reflejarse claramente y de una manera secuencial, el uso tradicional de la nomenclatura utilizada en el pasado reciente, década de los setenta, su transformación, de los noventa al año dos mil y las nuevas tendencias del año dos mil a la fecha.
Por otra parte, es preciso mencionar que debido a que esta lista contiene a diferentes clases de moluscos, ha sido necesario realizar el trabajo de actualización basándose en las propuestas de diversos autores publicadas en distintos años, ya que hasta la fecha no existe una obra reciente que integre un nuevo ordenamiento del phylum en su totalidad y sólo obedece al avance paulatino del trabajo de investigadores especializados en determinados grupos de moluscos.
Con el fin de contar con más elementos de discusión en cuanto a la distribución de la malacofauna en la costa del Pacífico y en el caso especial de la clase Bivalvia, se realizó una revisión comparativa con el material biológico registrado por Coan et al. (2000), encontrando que sólo 6 de las 23 especies de la presente lista fueron comunes con las citadas por dichos autores en el oeste de Norteamérica. Las especies mencionadas fueron Acar bailyi, Brachidontes adamsianus, Lithophaga (Diberus) plumula, Isognomon (Melina) janus, Isognomon (Melina) recognitus y Nodipecten subnodosus. Lo anterior viene a confirmar que realmente existe una afinidad mayor de las especies contenidas en esta lista por la región Panámica y que en la mayoría de los casos, presentan su límite norte en el estado de California.
En cuanto a la clase Gasteropoda y con el fin de mantener un estado de conocimiento vigente sobre los cambios sistemáticos a nivel mundial, se consultó el arreglo propuesto recientemente por Bouchet y Rocroi (2005) y Bouchet et al. (2010); sin embargo, el impacto que este nuevo arreglo tiene sobre la presente lista es mínimo debido a que por lo general, los cambios propuestos se han dado a niveles superiores a la categoría de familia.
Con respecto a los gasterópodos de la subclase Opistobranquia, entre los trabajos de mayor importancia se encuentran los realizados por Behrens y Hermosillo (2005) y Hermosillo, et al. (2006), en los cuales se ilustra, describe y actualiza una gran cantidad de especies desde Alaska hasta América Central. Cabe mencionar que antes de dichas obras, no se contaba con una fuente bibliográfica que concentrara la fauna de opistobranquios conocida para toda la costa del Pacífico mexicano.
Para el análisis de los moluscos de la clase Polyplacophora, se consultó entre otros el trabajo realizado por Reyes-Gómez (2004), quien revisó y actualizó las especies de quitones conocidas para el Pacífico mexicano.
Se ha mencionado con anterioridad que el arrecife coralino de Tenacatita, al igual que el resto de los arrecifes distribuidos en el Pacífico tropical mexicano, son considerados como ecosistemas con un alto valor ambiental, entre otras cosas por la riqueza de especies que estos albergan. Con la finalidad de contar con un marco de referencia que permitiera poder evaluar este aspecto, se presentan los resultados obtenidos en éste y otros estudios en cuanto al número de especies de moluscos registrados en cada uno de ellos.
Otro difícil de determinar, es el de tratar de establecer patrones de distribución y riqueza de especies en un gradiente latitudinal, debido a diferencias metodológicas de dichos estudios. A pesar de lo anterior, se rescataron algunos datos generales que pueden dar una idea aproximada de la riqueza regional y local, sin la intención de que éstos sean considerados con rigurosa objetividad para fines comparativos. Lo que sí resultó viable fue comparar el número de especies de moluscos registrado exclusivamente en arrecifes coralinos; sin embargo, la literatura publicada sobre estos ecosistemas es particularmente escasa y sólo se remite a 5 referencias: para cabo Pulmo y Baja California Sur, se mencionó la presencia de 42 especies (Calderón et al., 2009; en las bahías de Huatulco, Oaxaca, se registraron 43 especies (Barrientos y Ramírez, 2000); en Zihuatanejo, Guerrero, un total de 48 especies (Zamorano, 2008); en La Entrega, Oaxaca, 56 especies (Zamorano, 2004, 2006), y Tenacatita, Jalisco, con 40 especies mencionadas por Ríos-Jara et al. (2006). Partiendo de lo anterior, es notable el mayor número de especies registrado en esta lista, ya que de un total de 123 especies, 80 de ellas se encontraron directamente asociadas al arrecife.
Lo anterior puede tener relación con el hecho de que la bahía de Tenacatita se encuentra geográficamente localizada entre la región del golfo de California y la región Panámica y es posible encontrar una combinación de fauna representativa de ambas regiones zoogeográficas (Lara-Lara et al. 2008). Sin embargo, más que las condiciones generales de clima y fisiografía, que de alguna manera se consideran estándares para grandes regiones geográficas, algunos de los factores determinantes para la presencia o ausencia de las especies son el tipo o la combinación de sustrato, la disponibilidad del alimento, la magnitud de los bloques o manchas de coral, la pendiente de la playa, la amplitud de marea, la exposición al oleaje, la heterogeneidad de ambientes, el estado de salud de los ecosistemas y las interacciones biológicas, las cuales pueden variar significativamente. En este sentido, se realizó una serie de observaciones que pueden marcar la pauta para determinar la presencia de importantes grupos funcionales, que podrán ser abordados posteriormente para lograr una mayor comprensión del ecosistema estudiado. Como ejemplo de ésto, se puede mencionar a los caracoles venenosos del género Conus, que por ser depredadores activos con distintos hábitos alimenticios (vermívoros, molusquívoros, piscívoros) se encuentran en los niveles superiores de las tramas tróficas entre los invertebrados bentónicos presentes en el arrecife. Lo anterior será retomado con mayor detalle en un artículo en preparación por el primer autor de este trabajo, VLJ.
Esta aproximación estábasada únicamente en numerosas observaciones personales de campo; sin embargo, sería deseable establecer mediante métodos más rigurosos las tramas tróficas entre moluscos, invertebrados, peces y algas presentes en el arrecife, a partir de los cuales se pudieran establecer grupos funcionales y flujos de energía.
Finalmente, es importante mencionar que aun cuando la mayoría de las especies contenidas en esta lista tienen una amplia distribución y no representan nuevos ámbitos geográficos, sí contribuyen de una manera importante en el sentido de ampliar el conocimiento regional y local.
Para la validación de las determinaciones en cada clase de moluscos se contó con la asesoría de investigadores expertos, tales como Gene Coan para los bivalvos, Kirstie Kaiser para los gasterópodos, Douglas Ernise y Adriana Gómez-Reyes para los quitones y Alicia Hermosillo para los opistobranquios. Al Fondo Mixto Conacyt-Gobierno del estado de Jalisco, Proyecto 2009-05-124426, por los fondos proporcionados para el desarrollo del proyecto.