Pachira aquatica ha sido considerada históricamente como elemento acompañante de los manglares americanos de Rhizophora mangle, Avicennia germinans y Laguncularia racemosa. Esta especie posee semillas flotantes con grandes cotiledones y es criptovivípara. Desarrolla en el tallo contrafuertes y raíces adventicias. Soporta salinidades intersticiales de 8.4 ups y superficiales de más de 18.7 ups. En las planicies costeras donde la salinidad es baja, se mezcla con elementos de selva inundable, y donde la salinidad es mayor lo hace con especies de mangle. Sus semillas germinan en concentraciones de sal entre 0 y 9.2 ups. Se determinó el hidroperiodo de sitios de P. aquatica, el cual fluctúa entre 1.5 a −1 m con una inundación de 8-12 meses. El potencial redox del suelo varía entre 490 a −47 mV. Se elaboraron mapas de 2 lagunas costeras y un estero mostrando la distribución de los manglares y las selvas de P. aquatica alrededor de éstos. Con base en la información generada, se plantea considerar a P. aquatica como una especie de mangle de marea alta, y utilizar su distribución como límite de los manglares. Se sugiere que debe de ser considerada y protegida por las leyes mexicanas como una especie más de los manglares.
Pachira aquatica has historically been regarded as a companion to the American mangroves Rhizophora mangle, Avicennia germinans and Laguncularia racemosa. This species has floating seeds with large cotyledons and is cryptoviviparous. On the stem it develops buttresses and aerial roots. It supports interstitial water salinities of 8.4 ups and superficial water of 18.7 ups. In the coastal plains where salinity is low it is mixed with elements of the floodplain forest and where the salinity is greater it appears with mangrove species. The seeds germinate in salt concentrations between 0 and 9.2 ups. Hydroperiod was determined in sites where the species is present, and ranges from 1.5 to −1 m with a flooding period of 8-12 months. Soil redox potential is from 490 to −47 mV. Maps were produced for 2 coastal lagoons and an estuary showing the distribution of mangroves and forested wetlands of P. aquatica around them. Based on the information generated, we propose P. aquatica should be considered as a high tide mangrove species and used as the distribution limit of mangroves. It is suggested that it should be considered and protected under Mexican law as one species of mangrove.
Los manglares constituyen el humedal arbóreo tropical más estudiado y se consideran como el más extendido en los trópicos (Spalding et al., 2010). Hay una gran diversidad de otros tipos de humedales arbóreos o pantanos tropicales, conocidos como selvas inundables, bosques de galería y petenes (Durán, 1995; Ellison, 2004; Campos et al., 2011; Infante-Mata et al., 2011; Moreno-Casasola et al., 2012) que incluyen desde aquellos con o sin una capa gruesa de material orgánico, hasta aquellos que reciben la influencia de agua marina, estuarina, o bien, únicamente agua dulce. Las definiciones para los pantanos tropicales son confusas (Page et al., 2007). Para los manglares aún hay discusiones sobre sus límites, y si todas las especies frecuentes constituyen mangles verdaderos, i.e. Conocarpus erectus no es considerado como manglar dentro la legislación de los Estados Unidos de América, sino asociado al manglar como las halófitas Salicornia spp., Batis maritima y otras (Tomlinson, 1986).
Los trabajos sobre la distribución y ecología de los manglares y de las selvas inundables en las planicies costeras del golfo de México; Veracruz, Tabasco; y Chiapas, han mostrado una visión más detallada de la ecología de diversas asociaciones arbóreas inundables y de éstas con el manglar típico. Se establecen gradientes de inundación y de salinidad que hacen difícil separar en esta región a los manglares propiamente de las selvas inundables. En México hay 6 especies de manglar, aunque 2 de ellas tienen una distribución muy limitada y acerca de una de ellas no todos los investigadores coinciden en que es un mangle verdadero. Las especies más comunes incluyen: Rhizophora mangle L., Avicennia germinans (L.) L., Laguncularia racemosa (L.) C. F. Gaertn. y Conocarpus erectusL. Rico-Gray (1982) reportó la presencia de Rhizophora harrisonii Leechman en México, un híbrido entre R. mangle y R. racemosa G. Meyer y Leechman; aunque el último realmente no se encuentra en México. Recientemente, Nettel et al. (2008) registraron la presencia de A. bicolor Standl. en la costa de Chiapas.
Pachira aquatica Aubl. pertenece a la familia Malvaceae, y es de amplia distribución, se localiza desde México hasta Brasil (Pennington y Sarukhán, 1968; Avendaño, 1998; http://www.tropicos.org/Name/3900113?tab=distribution) forma parte de muchas de las selvas inundables que colindan con los manglares a lo largo de las costas de México (García-López et al., 2006; Tovilla-Hernández et al., 2009; Moreno-Casasola et al., 2012), Centro América (Van Andel, 2003; Ellison 2004) y las Antillas (Migeot y Imbert, 2011) y aparece bajo diversas condiciones ambientales (Infante-Mata et al., 2011). Se le conoce como apompo, zapote reventador o zapotón (Álvarez del Toro, 1993; Avendaño, 1998). Se ha encontrado creciendo entre las especies de mangle, o bien, como dominante en comunidades cercanas o aun colindantes, y que localmente se han denominado selvas inundables, selvas o bosques de galería o riparios, bosques tropicales inundados (Rzedowski, 1978; Orozco y Lot, 1976; Lot y Novelo, 1990; Ascencio, 1994). Numerosos estudios de manglares la registran y la han considerado como una especie acompañante (Miranda y Hernández, 1963; Holdridge y Budowski, 1956; Vázquez-Yanes, 1968; Porter, 1973; Spp, 1981; Inegi, 1988; Montes-Cartas et al., 1999; Huber y Riina, 2003). En ocasiones también se encuentra tierra adentro en planicies de inundación, como en el caso de la laguna La Apompal, municipio de Jamapa, Veracruz (Infante-Mata et al., 2011).
La diversidad de especies en los manglares es baja por las pocas especies que pueden soportar las condiciones de salinidad e inundación y aumenta conforme disminuye la salinidad (López-Portillo y Ezcurra, 1989). Los manglares en general son dominados por 2 o 3 especies de las 10 que hay en América. En otras regiones presentan más especies, como en la zona indio-australiana con 40 especies de mangle (Spalding et al., 2010). Sin embargo, las especies de mangle pueden vivir en condiciones de baja salinidad (Smith, 1987; Hogarth, 1999), pero no se establecen por lo poco competitivos que pueden resultar en otros ecosistemas inundables. De acuerdo con la capacidad que tienen las especies para soportar la salinidad y la inundación (Thom, 1967), los mangles se clasifican como de alta, media o baja marea, correspondiendo con la zonación dentro del estuario y la distancia al mar (Duke, 2006). Por otro lado, los hábitats lagunares costeros se clasifican de acuerdo con su rango de salinidad como lagunas hiperhalinas > 40 ups, eurihalinas 40-30 ups, mixohalinas 30-5 ups, oligohalinas 5-0.5 ups y de agua dulce < 0.5 ups (Contreras-Espinosa, 1994; Contreras-Espinosa y Warner, 2004). A su vez, Cowardin et al. (1979) desglosan el rango de mixohalina (agua salobre) en polihalina 30-18 ups y mesohalina 5-18 ups.
Como componentes principales del manglar se han descrito 73 especies (Spalding et al., 2010). Las principales pertenecen a 5 familias: Acanthaceae con el género Avicennia (8 especies); Combretaceae con los géneros Laguncularia (1 sp.) y Lumnitzera (2 spp.); Arecaceae con una especie del género Nypa; Rhizophoraceae con los géneros Rhizophora (8 spp.), Bruguiera (6 spp.), Ceriops (2 spp.), Kandelia (1 spp.); y, finalmente, Lythraceae con el género Sonneratia (5 spp.). La familia Malvaceae a la que pertenece P. aquatica cuenta con el género Camptostemon con 2 especies de mangle.
Con base en el trabajo de muestreo de vegetación y parámetros ambientales realizado en las selvas inundables y manglares de Veracruz y en la revisión bibliográfica, se ha examinado la biología y ecología de las comunidades de P. aquatica, así como características de la especie. Estos resultados sugieren que P. aquatica comparte muchas características con las especies de mangle y, por consiguiente, resulta importante discutir su inclusión como una especie de mangle americano y analizar su distribución y su relación con factores ambientales para evaluar su papel como una especie de mangle del golfo de México y como límite local del manglar. Los objetivos del presente trabajo son: i) describir el gradiente formado por el manglar típico y las selvas inundables dominadas por P. aquatica, en las planicies costeras de Veracruz; ii) presentar los criterios básicos y datos que permitan a la comunidad científica considerar a P. aquatica como una especie de mangle de marea alta y iii) fundamentar las bases para delimitar las comunidades de manglar, utilizando las superficies cubiertas por las especies típicas de mangle como también las superficies cubiertas por P. aquatica que se encuentran colindantes. Para ello, se describen los componentes florísticos y sus relaciones con el medio ambiente en comunidades típicas de P. aquatica, y se comparan sus características ambientales y ecológicas con los manglares de R. mangle, A. germinans y L.racemosa. Las características botánicas fueron comparadas con los géneros de los manglares australianos Ceriops, Camptostemon, Xylocarpus y Heritiera, debido a su coincidencia en la forma de crecimiento y por compartir la misma familia botánica con uno de ellos. La determinación de incluir a P. aquatica como especie de manglar y como especie límite de esta comunidad, tiene implicaciones importantes en México desde el punto de vista legal, de conservación y de restauración y cobra importancia en un escenario de cambio climático, de necesidades de recuperación de estos humedales y en función del nivel de deterioro al que están sometidos.
Materiales y métodosPara la descripción de las características de la especie, de su distribución y de las asociaciones vegetales en las que se presenta P. aquatica, se realizó una revisión de la literatura de los humedales arbóreos de México y de los países de Centro y Sudamérica. Esta misma revisión permitió comparar las características biológicas y ecológicas que comparte con las especies de mangle. Además se realizaron muestreos de vegetación como se describe a continuación.
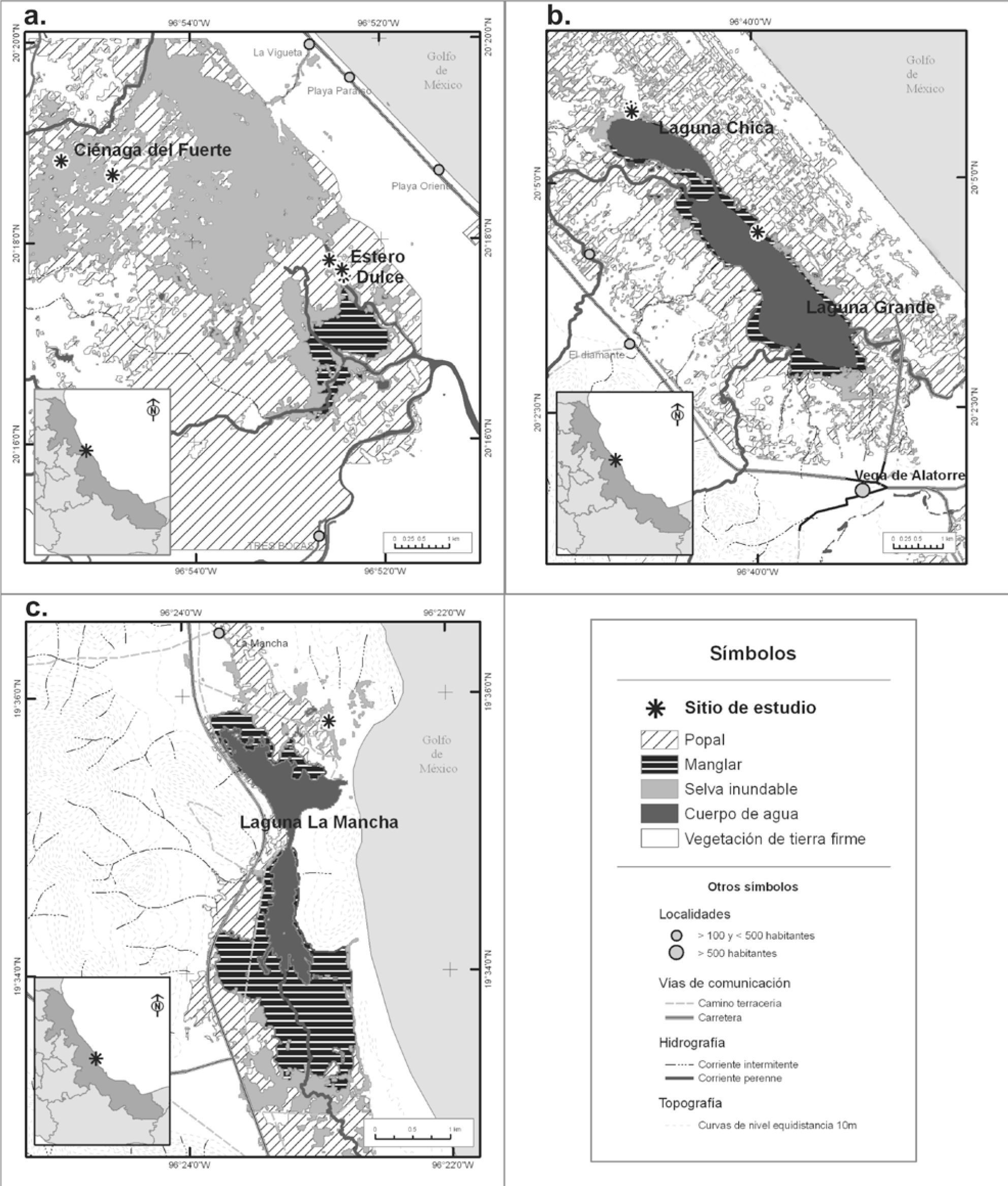
Área de estudioSe trabajó en 5 selvas inundables ubicadas en la planicie costera del golfo de México en el estado de Veracruz. Las áreas fueron de norte a sur Ciénaga del Fuerte, municipio de Tecolutla; laguna Chica, Vega de Alatorre; La Mancha, Actopan; laguna La Apompal, Jamapa y El Salado, Alvarado (Fig. 1). También se trabajó en los manglares de 3 de estos sitios: La Mancha, con 2 sitios de muestreo; El Caño en la parte sur de la laguna y en el manglar de la zona norte, ubicado cerca de la apertura de la boca de la laguna, Actopan; Estero Dulce, Tecolutla; y laguna Chica; Vega de Alatorre.
Áreas de estudio mostrando el climograma para cada región (Imta, 2007).
Además, para comparar las características de estos sitios con los de un manglar, también se consideró la información existente sobre el manglar de la laguna La Mancha (Contreras-Espinosa y Warner, 2004; Yetter, 2004; Flores-Verdugo et al., 2007) y del manglar de la laguna El Llano (Moreno-Casasola et al., 2009).
Muestreo de la vegetaciónSe realizaron cuadros de 10x10 m para determinar las especies presentes y se utilizó la escala de abundancia-cobertura de Westhoff y Van der Maarel (1978) para cuantificar la importancia de cada especie en las 5 selvas inundables y en los 3 manglares arriba mencionados. Se elaboró una matriz con los datos de abundancia/cobertura por especie y cuadro. En total se registraron 111 especies en 69 cuadros de muestreo. La matriz fue sometida a una clasificación jerárquica con el método de Ward, utilizando como medida de similitud la distancia euclidiana relativa. Para los análisis multivariados se utilizó el programa PC-ORD versión 5 (McCune y Mefford, 1999).
Elaboración de mapas de humedalesSe elaboraron mapas de los humedales de la laguna La Mancha, de laguna Grande-laguna Chica y de Ciénaga del Fuerte, utilizando como base imágenes SPOT de 10m/pix 4 bandas. Para cada sitio de estudio se calculó una segmentación multiresolución (Ecognition Developer 8.0) con parámetro de escala 50, lo que limita el tamaño máximo de los polígonos resultantes; el parámetro de forma utilizado correspondió a 0.1, lo que otorga flexibilidad de forma a los polígonos resultantes. Para evitar cualquier sesgo en la parte espectral se usaron las 4 bandas con el mismo factor de peso en el procedimiento. Se exportó el resultado de la segmentación a formato shapefile (SHP).
En Arcview 3.2 se incorporó el shapefile resultado de la segmentación. Los polígonos resultantes de la segmentación no son etiquetados, así que se procedió a asignar su categoría correspondiente, las cuales fueron manglar, selva inundable, zona inundable, cuerpo de agua y zona urbana. Para esto, se realizó una fotointerpretación de las imágenes en la pantalla. Los polígonos de la segmentación se desplegaron sobre la imagen, y de esta manera se asignaba la categoría correspondiente a cada polígono de manera directa, utilizando los criterios numéricos de las estadísticas de la segmentación; media y desviación estándar por polígono para cada una de las 4 bandas; la textura y color en la imagen, además de los criterios de posición, tamaño y adyacencia dentro de cada tipo de humedal. Paralelo a este proceso de etiquetado se unieron los polígonos adyacentes que tenían la misma etiqueta para reducir el número de polígonos que se manejaron. Finalmente, se editó el mapa de tipos de vegetación.
Geomorfología y parámetros ambientalesPara la geomorfología de cada zona se recurrió al trabajo de Infante-Mata et al. (2011) y Moreno-Casasola et al. (2012). La geomorfología en la que se establecen las selvas inundables es planicie de inundación con un gradiente de salinidad que se incrementa conforme se acerca la planicie hacia el mar y en depresiones de dunas en las cuales la influencia de agua es de manto freático.
Con respeto al muestreo de parámetros ambientales, éstos se realizaron entre enero 2005 y diciembre 2006. Se determinó el potencial redox, la salinidad del agua -superficial, intersticial y subterránea- y el nivel de inundación. En cada uno de los sitios se consideraron de 10 a 12 puntos de muestreo. Para la obtención del potencial redox se utilizaron 3 electrodos de platino y un electrodo calomel de referencia (Corning 476340) siguiendo el método de López-Rosas y Tolome (2009). La obtención del agua intersticial se realizó con un tubo de cobre de 0.3 cm de diámetro y 50 cm de largo, perforado en un extremo y en el otro unido a una manguera con una jeringa de 60 ml adaptada para succionar hasta extraer agua. Para la colecta del agua subterránea se colocaron pozos de monitoreo con una profundidad de 1.5 m. Los pozos se elaboraron con tubos de PVC de 1.3 cm de diámetro y 3 m de altura. En 20 cm del extremo que quedó enterrado se hicieron ranuras alternas cada 2 cm con una segueta y éstas se cubrieron con malla Nitex, la cual quedó inmovilizada con alambre inoxidable. Finalmente, este extremo se tapó con un tornillo y cinta de aislar para evitar su contaminación. Una vez instalado el pozo de monitoreo, se extrajo el agua subterránea con una bomba de vacío manual conectada a una manguera que se introdujo en el tubo. El agua superficial se colectó directamente de la columna de agua que estaba sobre el suelo. A cada muestra de agua se le midió la salinidad con un multiparamétrico marca YSI, Mod. 550. Para medir la profundidad se utilizó una sonda graduada marca Solins con un sensor en la punta introduciéndola por el tubo de PVC.
Descripción morfológicaLas características generales de P. aquatica han sido descritas por Robyns (1963) y por Avendaño (1998). Para las características de las semillas, germinación y establecimiento de plántulas se revisaron los trabajos de Niembro (2000), Infante-Mata (2004), Infante-Mata y Moreno-Casasola (2005). Se realizó una comparación del tipo de fruto, semillas y contrafuertes con las especies de los géneros de los manglares indo-australianos Ceriops, Camptostemon, Xylocarpus y Heritiera (Duke, 2006) por ser los que presentan la forma de tronco, frutos y semillas del tipo de P. aquatica. Se hicieron observaciones en campo y se fotografiaron flores, frutos, semillas, troncos de los árboles, raíces adventicias y lenticelas.
Experimentos de germinaciónPara probar la capacidad de las semillas de P. aquatica para germinar en condiciones de salinidad se utilizaron las concentraciones de 0.6 (2.4 ups –unidades prácticas de salinidad), 12 (4.8 ups), 25 (9.2 ups) y 50% (18.4 ups) de agua de mar. Se colocaron 3 réplicas con 10 semillas por tratamiento. Las semillas permanecieron flotando -simulando dispersión- por 12 días en agua con cada concentración. Posteriormente, las semillas se colocaron en camas de arena inundada por agua con la misma concentración en la que permanecieron flotando. Se monitorearon las semillas cada 5 días por un periodo de 65 días para determinar la fecha en que comenzó la elongación de la raíz, es decir, cuando el propágulo inició su fase de establecimiento. Para analizar los datos se empleó un análisis de varianza de medidas repetidas y para detectar diferencias significativas entre las medias se usó una prueba de Tukey con p< 0.05 (Zar, 1996). El paquete estadístico utilizado fue Statistica (Stat Soft Inc., 1999).
ResultadosDistribución, agrupaciones florísticas y geomorfologíaLos muestreos realizados en las selvas y manglares mostraron que P. aquatica se encuentra presente a lo largo de un gradiente de salinidad, mezclada con especies de selvas inundables y de manglares. En estos últimos forma asociaciones con R. mangle, L. racemosa y A. germinans.
La clasificación identificó 2 grupos, los caracterizados por vegetación de selvas inundables (A) y los de manglar (B) (Fig. 2). A su vez cada grupo se conformó por 2 subgrupos:
Clasificación jerárquica de Ward utilizando los cuadros de vegetación de las selvas inundables, mixtas selva-manglar y manglares de la planicie costera central de Veracruz en el golfo de México. A, selva La Apompal; B, selva Ciénaga del Fuerte; C, selva en laguna interdunaria La Mancha; D, selva El Salado; E, selva laguna Chica; F, manglar laguna Chica; G, manglar laguna El Llano; H, manglar La Mancha; I, manglar El Caño; J, manglar Estero Dulce.
A. Selvas inundables: grupo I, selvas dominadas por P. aquatica sobre planicies acumulativas fluviales. A este grupo pertenecen las selvas de La Apompal, Ciénaga del Fuerte y los cuadros de la selva inundable de laguna Chica dominados por P. aquatica; grupo II, selvas dominadas por P. aquatica y A. glabra, establecidas en depresiones de dunas. A este grupo pertenecen las selvas inundables de las lagunas interdunarias de La Mancha y El Salado. B. Manglares: grupo III, manglares de P. aquatica, R. mangle, A. germinans y L. racemosa sobre una superficie acumulativa fluvial y perilacustre, comunicadas con el mar. Es el tipo de vegetación que se presenta en Estero Dulce y el manglar de laguna Chica. Estos 2 lugares reciben influencia de la marea, pues tienen comunicación al mar (Fig. 3); grupo IV, manglar de R. mangle, A. germinans y L. racemosa sobre superficie perilacustre de lagunas costeras. Este grupo está compuesto por los manglares de la laguna El Llano, La Mancha (zona norte) y su afluente El Caño (zona sur), todos ellos manglares localizados en las planicies de las lagunas costeras.
Distribución de los manglares y selvas inundables de Pachira aquatica. a, Ciénaga del Fuerte y Estero Dulce (Tecolutla); b, laguna Chica y laguna Grande (Vega de Alatorre) y c, La Mancha (Actopan). La categoría “Humedales herbáceos y remanentes de selva inundable” incluye, por la dificultad de su fotointerpretación, las zonas donde actualmente hay humedales herbáceos (popales y tulares), potreros inundables mezclados con humedales arbóreos y con árboles en pie de P. aquatica, o bien, con tocones rebrotando de esta especie. Representan áreas donde P. aquatica se distribuía formando un continuo con los manglares.
La geomorfología muestra que las selvas de Pachira se establecen en las superficies acumulativas fluviales, fluviobiógenas, lacuno-fluviales, perilacustres acumulativas y lacuno-biógenas. Si tienen una mayor influencia de agua dulce se combinan con otras especies de selvas inundables como Pithecellobium latifolium, Ficus insipida subsp. insipida, Attalea liebmannii. Pero en el mismo tipo de superficie, si hay influencia de agua marina, todas las otras especies desaparecen y quedan áreas donde P. aquatica es dominante hasta que forma comunidades con las especies de mangle (R. mangle, L. racemosa y A. germinans) como en laguna Chica y Estero Dulce.
En la figura 3 se presentan los mapas de distribución de los manglares y selvas inundables de Ciénaga del Fuerte (Fig. 3a), de laguna Grande y Chica (Fig. 3b) y laguna La Mancha (Fig. 3c). En cada uno de ellos se indican 3 zonas: i, las áreas donde dominan las especies de manglar; ii, donde domina P. aquatica y iii, las zonas inundables donde actualmente hay potreros inundables mezclados con parches de humedales herbáceos y con árboles en pie de P. aquatica o tocones rebrotando. Son superficies en las que existieron selvas inundables, pero fueron taladas para convertirlas en potreros y hoy sólo quedan vestigios de estas comunidades. Se platicó con los pobladores de la zona para confirmar que antes habían sido zonas arboladas. Estos mapas muestran como las selvas de apompo se distribuían alrededor de los manglares, formando una masa arbórea continua.
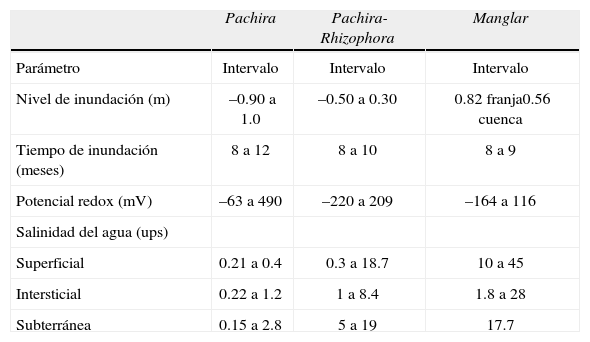
Parámetros ambientalesEl Cuadro 1 muestra los valores de los parámetros ambientales registrados en los sitios de monitoreo, agrupados en 3 tipos de comunidades conforme a su composición florística: selvas inundables, mezcla de P. aquatica-R. mangle y manglar típico. P. aquatica soporta un intervalo amplio de salinidad del agua (superficial, intersticial y subterránea), que va de 0.02 a 18 ups. El tiempo de inundación mínimo en los 3 tipos de comunidades es de 8 meses y el rango de inundación es más amplio en las selvas inundables. Con respecto al potencial redox, éste disminuye considerablemente en la comunidad de P. aquatica-R. mangle (−220 mV) indicando que el proceso de óxido-reducción se encuentra en la fase de desaparición del ión sulfato (SO42−) y muy cerca de la aparición de metano (CH4). Por el contrario, para el ecosistema de selva inundable, el valor es de –63 mV indicando la aparición del ión ferroso (Fe2+). En la temporada de secas el potencial redox de P. aquatica-R. mangle (209 mV) sigue siendo bajo, lo que no permite que se oxigene el suelo, a diferencia de la selva de Pachira que registra hasta 490 mV (Ciénaga del Fuerte). Para el manglar el potencial redox del suelo en temporada de secas es de 116 mV y en temporada de barra cerrada en La Mancha, laguna Chica y laguna Grande, que es cuando se registra la mayor inundación, es de −164 mV. Estos valores indican que el suelo del manglar permanece durante todo el año en condiciones de anoxia.
Parámetros ambientales obtenidos de enero 2005 a diciembre 2006 en selvas inundables y manglares de la planicie costera central del golfo de México
| Pachira | Pachira-Rhizophora | Manglar | |
| Parámetro | Intervalo | Intervalo | Intervalo |
| Nivel de inundación (m) | –0.90 a 1.0 | –0.50 a 0.30 | 0.82 franja0.56 cuenca |
| Tiempo de inundación (meses) | 8 a 12 | 8 a 10 | 8 a 9 |
| Potencial redox (mV) | –63 a 490 | –220 a 209 | –164 a 116 |
| Salinidad del agua (ups) | |||
| Superficial | 0.21 a 0.4 | 0.3 a 18.7 | 10 a 45 |
| Intersticial | 0.22 a 1.2 | 1 a 8.4 | 1.8 a 28 |
| Subterránea | 0.15 a 2.8 | 5 a 19 | 17.7 |
Pachira aquatica pertenece a la familia Malvaceae; la familia también contiene al género Camptostemon formado por C. schultzii Mast. y C. philippinense (Vidal) Becc. Ambas especies de manglar son de marea alta, distribuidas en el sur de Nueva Guinea-Norte de Australia y Norte de Borneo-Filipinas-Indonesia, respectivamente (Duke, 2006).
Los árboles de P. aquatica presentan raíces adventicias que se van alargando y engrosando hasta formar contrafuertes (Fig. 4a) y éstos se van ensanchando en forma de tablones. En la corteza se siguen desarrollando raíces adventicias junto con lenticelas, observación personal (Fig. 4b). Los contrafuertes desarrollados pueden tener una altura de hasta 2 m (Fig. 4c). Las hojas son compuestas con 5-9 foliolos. Entre sus características reproductivas generales están las flores solitarias o algunas veces se encuentran juntas 2 o 3 (Figs. 5a, b) y son polinizadas por murciélagos (Fleming et al., 2009). El fruto es una cápsula subglobosa dehiscente tardíamente (Fig. 5c). El tamaño del fruto es de 12.5 a 30 cm de largo, con 6 a 10 (12) cm de diámetro. El peso del fruto es de 1226.28 ±291.71 g, de los cuales 700.06 ±198.88 g corresponden a las semillas y el resto a las valvas del fruto (Infante-Mata, 2004). En la costa de Veracruz se ha encontrado que el número de semillas por fruto es de 18 a 27, con un peso de 33.22±9.64 g por semilla (Infante-Mata, 2004). Son de forma irregular, angulosas, subcuadrado-cunadas, o polígonas por mutua presión, de unos 3 a 5 cm de largo, por 2 a 4 cm de grueso (Avendaño, 1998; Niembro, 2000) (Fig. 5d). Presentan una testa papirácea o coriácea de color castaño claro. No presentan perispermo y tampoco endospermo. El embrión es recto, masivo y llena completamente la cavidad seminal; es de color blanco. Presentan 2 cotiledones, involutoplegados (Fig. 5d). El sistema hipocótilo-radícula se encuentra cubierto completamente por los cotiledones, es claviforme, recto o ligeramente inclinado y glabro (Fig. 5e). Se presenta una plúmula completamente desarrollada (Niembro, 2000) cubierta por 3 o 4 brácteas, ya que el embrión continúa su desarrollo dentro del fruto antes de que sea liberado. Presenta viviparidad (Vázquez-Torres, 1998). Los cotiledones están conformados por tejido aerenquimatoso (Corner, 1976a, b). La semilla es dispersada por agua y puede desarrollar su raíz mientras permanece flotando (Infante-Mata, 2004). En esta especie existe una sincronía entre la producción de semillas y la temporada de lluvias, ya que cuando ocurre una elevación del nivel de agua se produce la dispersión de las semillas por agua, siendo las semillas hidrócoras (Infante-Mata et al., 2011).
Después de liberada la semilla, ésta pierde los restos de la delgada testa papirácea y los cotiledones quedan expuestos cambiando de un color verde claro o amarillo a un color verde intenso. El propágulo puede permanecer flotando por 3 meses, desarrolla lenticelas en la superficie e incluso inicia el crecimiento de la raíz (López, 2001; Infante-Mata y Moreno-Casasola, 2005). Cuando el propágulo se deposita sobre el suelo la raíz principal comienza una elongación de 3 a 4 cm en aproximadamente 10 días y un crecimiento del epicótilo, mostrando en el tallo las brácteas triangulares en cada entrenudo. Las primeras hojas son dígito-compuestas (Figs. 5f, g). Los cotiledones permanecen adheridos a la parte basal del tallo de la plántula (a nivel del suelo), por lo que el crecimiento del propágulo es hipógeo.
A los 5 días, el tratamiento de 2.4 ups de salinidad registró la mayor cantidad de propágulos con elongación de la raíz, con 43±12% (F=4.14; p=0.03); con respecto a las concentraciones 0, 4.8 y 9.2 ups de salinidad, éstas registraron entre el 20-26% de los propágulos con elongación de la raíz. Sin embargo, después de 2 meses, los propágulos de los tratamientos de 0, 2.4, 4.8 y 9.2 ups de salinidad registraron un desarrollo radicular de 93±6%, 96±3%, 96±3% y 66±12%, respectivamente y sólo difirió el tratamiento de 18.4 ups (50% de agua de mar), ya que los propágulos no mostraron desarrollo radicular (F=29.67; p< 0.001) (Fig. 6).
Similitudes morfológicas con las especies de mangle indo-australianosEl tallo de P. aquatica muestra una anatomía similar a los mangles Ceriops spp., Campstostemon schultzii, Xylocarpus granatum y Heritiera littoralis (Fig.7). El fruto P. aquatica es similar al de los mangles X. granatum y X. moluccensis (Fig. 8). Con respecto a C. schultzii, que al igual que P. aquatica pertenecen a la familia Malvaceae, las semillas se encuentran inmersas en fibras sedosas (kapot) (Fig. 8), como ocurre en miembros de esta familia de tierra firme; por ejemplo, Ceiba spp.
La fisonomía de las comunidades de mangle australianos donde se mezclan las especies que poseen raíces modificadas a contrafuertes (Ceriops spp., C. schultzii, X. granatum y H. littoralis) con las especies que poseen zancos (Rhizophora) y las que presentan neumatóforos (Avicennia) es muy similar a las comunidades de manglar en México en las que coexiste P. aquatica, R. mangle, A. germinans y L. racemosa (Fig. 9, observaciones personales).
DiscusiónLa especie P. aquatica en la planicie costera sur del golfo de México forma comunidades de manglar mixtas con R. mangle, A. germinans y L. racemosa, las cuales se diferencian claramente de las selvas inundables, donde también domina esta especie (Infante-Mata et al., 2011).
Estudios de palinología indican que el género Pachira se encuentra en los manglares de América desde hace 35 millones de años (Oligoceno) coexistiendo con Rhizophora mucho antes que los géneros Laguncularia y Avicennia, los cuales se registran hasta el Mioceno tardío hace 5.2 millones de años, aproximadamente (Graham, 1995).
La distribución de P. aquatica se extiende desde México hasta Brasil y ha sido considerada como un elemento acompañante del manglar en varios países de América. Por ejemplo, en México ha sido reportada en asociación con las especies de mangle del lado de la vertiente del océano Atlántico en el estado de Veracruz en la laguna de Sontecomapan (Menéndez, 1976; Lot y Novelo, 1990; Medina et al., 1995; Santiago-Cervantes et al., 1998), en los manglares del sistema lagunar de Alvarado (Rodríguez, 2002), en la laguna de Mandinga (Vázquez-Yanes, 1968), en la zonas estuarinas del municipio de Tecolutla y en laguna Chica (Infante-Mata et al., 2011), en el estado de Tabasco (Ascencio, 1994, García-López et al., 2006) y en Quintana Roo (Tovilla-Hernández et al., 2009). En la vertiente del océano Pacífico la asociación R. mangle-P. aquatica ha sido reportada en La Encrucijada (Chiapas) (Montes-Cartas et al., 1999), así como en el sistema lagunar Chantuto-Teculapa-Panzacola (Segura, 1997; Tovilla y Orihuela, 2005).
En otros países como Guyana, Panamá, Honduras, Cuba y Venezuela, P. aquatica (algunas ocasiones con el sinónimo Bombax aquaticum o P. glabra) también se encuentra mezclada con los manglares, formando ecotonos o detrás de éstos en ciénagas o en las orillas de los ríos (Standley, 1928, 1931; Fanshawe, 1952; Müeller, 1959; Vann, 1959; Porter, 1973; Holdridge y Poveda, 1975; Huber y Alarcón, 1988; Lacerda et al., 1993; Bacon, 1990; Ellison, 2004; Moreno-Casasola et al., 2012). En Colombia los manglares forman ecotonos, conforme disminuye la salinidad, con Mora megistosperma y P. aquatica-Euterpe oleracea (Sánchez, 1994). Las condiciones donde crece P. aquatica son salobres y se menciona una salinidad de 15 ups para el tipo de comunidad donde se encuentra mezclada con P. officinalis (Febvay y Kermarrec, 1978).
Los mapas de distribución muestran que los manglares y las selvas forman un continuo de vegetación arbórea a lo largo de gradientes de salinidad e inundación (Fig.3). P. aquatica soporta una amplio rango de salinidad del agua (superficial, intersticial y subterránea), lo que le permite establecerse en cuerpos de agua con condiciones mixohalinas (30-0.5 ups), oligohalinas (0.5-5 ups) y de agua dulce (< 0.5 ups) (Cuadro 1).
Diversas características biológicas son compartidas por P. aquatica y otras especies de mangles. Presenta contrafuertes que también son característicos de los mangles H. littoralis y X. granatum (Duke, 2006). Las raíces adventicias y las lenticelas en el tronco de P. aquatica también son características compartidas con la mayoría de las especies de mangle. Las hojas compuestas están presentes en los mangles Dolichandrone spathacea (L. f.) Seem., Cyrometra iripa Kostel., X. granatum y X. moluccensis. La polinización de las flores de P. aquatica es realizada por murciélagos, al igual que en Sonneratia caseolaris (L.) Engl. (Tomlinson, 1986).
El propágulo de P. aquatica muestra que puede establecerse en el suelo de los ecosistemas maduros donde la luz es escasa (Infante-Mata, 2004) como sucede al interior de los manglares, invirtiendo sus recursos en aumentar su crecimiento en altura y área foliar para captar la luz (Foster, 1986; Venable y Brown, 1988). Ello indica que el propágulo de P. aquatica se establece en el suelo sombreado e inundado por agua salobre, requisito que deben de cumplir los mangles para su regeneración (Lugo, 1980; Snedaker y Lahmann, 1988).
Una de las principales características que diferencian a las especies de mangle de otras especies que se pueden establecer en las mismas condiciones ambientales, es la germinación de la semilla, la cual ocurre cuando todavía está unida a la planta madre. Esta característica es conocida como viviparismo (Goebel, 1905) o criptoviviparismo, si la germinación ocurre dentro del fruto (Cuatrecasas, 1958; Tomlinson, 1986). Una especie ejemplo de viviparidad es R. mangle, la cual germina cuando está unida al árbol y como ejemplo de criptoviviparismo están P. aquatica, L. racemosa y A. germinans. Estas semillas se consideran vivíparas porque la transición de semilla a plántula es continua, dando origen a propágulos (Elmqvist y Cox, 1996) al igual que ocurre con la semillas de P. aquatica (Vázquez-Torres, 1998; Niembro, 2000). El fruto en forma de cápsula y las semillas angulares tetraédricas de P. aquatica son compartidas con X. granatum y X. moluccensis. La germinación de estas 3 especies es hipogea y desarrollan una raíz principal. Sin embargo, las especies de Xylocarpus no tienen diferenciados los tejidos de su semilla, por lo que no se les considera vivíparas y sus cotiledones permanecen dentro de la testa (Tomlinson, 1986, Clarke et al., 2001). En cambio P. aquatica ya tiene el hipocótilo-radícula desarrollado y los cotiledones libres (Niembro, 2000). Las semillas de P. aquatica son capaces de flotar en agua salada, permanecer viables y establecerse en condiciones de salinidad de hasta 25% de agua de mar (9.2 ups). Ello indica que aún la parte del ciclo de vida de la germinación puede darse en zonas donde coexiste con manglares.
La dispersión de los propágulos de manglar es por vía hidrócora (Tomlinson, 1986) al igual que P. aquatica (Infante-Mata y Moreno-Casasola, 2005). Esta última puede permanecer flotando hasta 3 meses, y mientras el propágulo se mantiene flotando desarrolla lenticelas. Las semillas que se dispersan por agua poseen adaptaciones para flotar, por ejemplo, frutos con paredes fibrosas, testas de corcho o espacios de aire entre la testa y la semilla (Howe y Smallwood, 1982; Tomlinson, 1986; Hogarth, 1999). Tienen la capacidad para permanecer flotando por largo tiempo (Rabinowitz, 1978; Clarke et al., 2001), recorrer grandes distancias acarreadas por las corrientes de agua, los vientos y huracanes y seguir siendo viables (Hogarth, 1999). Algunos propágulos pueden medir 12 cm como Mora megistosperma (Fabaceae) (Tomlinson, 1986) y pesar hasta 86.2 g como el propágulo de Pelliciera rhizophora (Rabinowitz, 1978).
La capacidad de dispersión, el crecimiento rápido y la gran reserva de almidón de los cotiledones de P. aquatica la hacen una especie competitiva en zonas de baja o nula salinidad. Por ejemplo, el epicótilo de P. aquatica se desarrolla 10-15 días después de que la radícula comenzó a crecer y en 2 meses alcanza una altura entre 30 y 40 cm (Infante-Mata y Moreno-Casasola, 2005). Frecuentemente se puede asociar en la planicie inundable con otras especies que se consideran de selva baja o mediana inundable, por ejemplo, en Ciénaga del Fuerte. Sin embargo, conforme se acorta la distancia al mar y la salinidad aumenta, van desapareciendo las otras especies y P. aquatica forma bosques monoespecíficos con elementos acompañantes como las lianas Rhabdadenia biflora, Hippocratea celastroides y Dalbergia brownei (laguna Chica en Vega de Alatorre, Veracruz). Finalmente en zonas de mayor influencia marina, como en laguna Grande, esteros Dulce y Tres Bocas en Tecolutla y en la laguna de Mandinga, se forma un manglar de P. aquatica, R. mangle, A. germinans y L. racemosa.
Otra comparación importante entre los sitios de selvas de apompo y los manglares es la cantidad de hojarasca que producen. Considerando que la producción de hojarasca en las selvas de Pachira es de 9.33 a 14.85 t ha−1 año−1 (Infante-Mata et al., 2012) y en los manglares de la Mancha es de 9.05-13.5 t ha−1 año−1 (Rico-Gray y Lot, 1983; Utrera-López y Moreno-Casasola, 2008) y en Sontecomapan de 11.2 t ha−1 año−1 (Aké-Castillo et al., 2006), se puede considerar a estos ecosistemas igual de productivos en lo que a hojarasca se refiere. Otro ejemplo es el de los manglares ubicados en la parte sur de la planicie costera del golfo de México en la laguna de Términos en Campeche, donde Coronado-Molina (2000) registra la producción de hojarasca en un manglar de borde (R. mangle y A. germinans) y en un manglar de cuenca (A. germinans y R. mangle) con 11.16 t ha−1 año−1 y 5.36 t ha−1 año−1, respectivamente (Cuadro 2).
Comparación de las características ambientales, ecológicas y biológicas de R. mangle, A. germinans, L. racemosa y P. aquatica
| Rhizophora mangle | Avicennia germinans | Laguncularia racemosa | Pachira aquatica (este estudio) | |
| Familia | Rhizophoraceae | Acanthaceae | Combretaceae | Malvaceae |
| Condiciones hidro-geomorfológicas | ||||
| Hábitat principal | Borde de canales, orilla arbolada de lagunas, cuencas entre distribuidores1,2 | Planicies y cuencas lodosas inactivas o en crecimiento por azolve, orilla de arroyos abandonados, cuencas entre distribuidores1,2 | Cuencas entre distribuidores, hondonadas interdunarias, borde de canales1,2, borde hacia tierra adentro3 | Planicies de inundación, orillas de lagunas, zonas ribereñas y estuarinas, depresiones interdunarias. |
| Clasificación con base en su ubicación en el estuario y la distancia al mar (Duke 2006) | Intermareal bajo, posición estuarina río abajo e intermedia4 | Intermareal alto-medio, posición estuarina río abajo e intermedia4 | Intermareal alto-medio, posición estuarina río abajo e intermedia4 | Intermareal alto, posición estuarina río arriba e intermedia |
| Tiempo de inundación al año (meses) | 8 a 96 | 97 | 4 a 8 | 8 a 1230,30,31,32 |
| Rango de inundación (m) | 0.82 borde, 0.56 cuenca6 | 0.90 a 0.40 | 0.20 a 0.505 | 0.90 a 1.0 |
| Potencial redox del suelo (mV) | 164 a 1168 | 320 a 100 | 126 a 628 | 63 a 490 |
| Salinidad del agua (ups) | ||||
| Superficial | 10 a 4510.66 a 2310 a 35 (La Mancha5) | 9.1690.55 a 16.3713.5 a 32 (Mandinga5) | 7.0892 a 25 (Tuxpan5) | 0.21 a 18.7 |
| Intersticial | 1.8 a 280 a 65100 a 37-6511,12 | 12 a 65 (La Mancha, Pueblo Viejo5)0 a 100100 a 65-10013 | 0 a 90100.2 a 53 (La Mancha, El Llano5)0 a 42-8010 | 0.22 a 1.2 selva de Pachira 1 a 8.4Pachira-Rhizophora |
| Adaptaciones para soportar estrés por salinidad | Excluyen la sal del agua a nivel de la interfase raíz-sustrato3,14,15 | Toma el agua salina por las raíces y excreta el exceso de sal por poros localizados en la superficie de las hojas3,14,15 | Glándulas en el peciolo de las hojas que secretan sal, acumula el excedente de sal en las hojas senescentes15,16,17 | Se desconoce |
| Características ecológicas | ||||
| Dispersión | Hidrócora18 | Hidrócora | Hidrócora17 | Hidrócora20 |
| Tiempo que pueden flotar los propágulos | Flotan en agua salada aproximadamente un año sin enraizarse15 | Flotan en agua salada aproximadamente 110 días16 | Flotan en agua salada aprox. 31-35 días16,17 | Las semillas pueden flotar en agua dulce 60 días y mantenerse viables20,21. Se desconoce el tiempo que puede flotar en agua salina |
| % de protrusión de la raíz de los propágulos en condiciones de salinidad | 80%34 | 90-9522 98%34 | 98%34 | Con 0, 6, 12, y 25% de agua de mar 93±6%, 96±3%, 96±3% y 66±12%, respectivamente |
| Establecimiento de plántulas (tasa de supervivencia) | 38%3358-68%3523-55%36 | 80 a 85%35 | 21%37 | 73 a 98%20 |
| Producción de hojarasca (t ha −1 año −1) | 11.1623 | 5.731, 6.1424 5.3625 | 9.676, 11.0026 | 9.33-14.8529 |
| Características biológicas | ||||
| Adaptaciones del propágulo para flotar Tamaño del propágulo (cm) | Hipocótilo con tejido de aerénquima1622 a 4022 | Fruto con cubierta esponjosa222 a 43,18 | Fruto con cubierta esponjosa3,1923,10 | Cotiledones con tejido de aerénquima283 a 5 cm largo y grosor 2 a 4cm20 |
| Peso del propágulo (g) | 14 a 5017,22 | 1.117 | 0.517 | 33±920; 57±221 |
| Almacén de reservas | Hipocótilo16,19 | Cotiledones | Cotiledones | Cotiledones |
| Germinación | Vivípara3,10 | Criptovivípara3,10 | Criptovivípara3,10 | Criptovivípara |
| Adaptaciones morfológicas para soportar inundación-anoxia | Raíces de zanco, lenticelas | Neumatóforos, lenticelas | Neumatóforos, raíces adventicias, lenticelas | Contrafuertes, raíces adventicias, lenticelas |
Referencia:
27. Infante-Mata, 2004;
De acuerdo con la capacidad que tienen las especies de mangle para soportar la salinidad y la inundación se clasifican como de marea alta, media o baja (Thom, 1967), correspondiendo con la zonación dentro del estuario y la distancia al mar (Duke, 2006). En este sentido, las características de P. aquatica permiten considerarla como una especie de marea alta.
Las especies de mangle varían en su tolerancia a la salinidad y a la inundación (Allen et al., 2003); algunos mangles son halófitos facultativos y otro se adecuan mejor a una salinidad del 50% o menos del agua de mar (Tomlinson, 1986). Este rango de tolerancia es uno de los factores que genera los patrones de zonación en las comunidades de mangle en la zona intermareal (Macnae, 1968; Jayatissa et al., 2002). La tolerancia de los mangles en su estado de plántula también varía de acuerdo con la especie; por ejemplo, Soneratia caseolis se desarrolló mejor en salinidades de 4-5 ups y en salinidades de 25-26 ups muere; incluso especies del mismo género pueden variar ampliamente en su tolerancia a la salinidad (Jayatissa et al., 2008). Otro ejemplo es el de R. mucronata que como plántula se desarrolla mejor en agua dulce (Hoppe-Speer et al., 2011). Se ha demostrado que las especies de mangle A. officinalis, B. sexangula y S. caseolaris están restringidas a comunidades de manglar con influencia ribereña (Jayatissa et al., 2002), situación similar a la que ocurre con P. aquatica. Esta especie es altamente competitiva, por lo que puede establecerse en zonas estuarinas poco salinas y coexistir con especies de selva inundable, lo que no es posible para las otras especies de los manglares americanos.
Los mangles han desarrollado mecanismos asociados con la anatomía y características fisicoquímicas para regular la absorción y exclusión de sal, tal como la ultrafiltración, secreción de sal y secuestro de iones (Tomlinson, 1986; Kura-Hotta et al., 2001; Mimura et al., 2003). En especies de mangles que no excluyen la sal como son Ceriops tagal (Shan et al., 2008) se ha observado un mecanismo de osmoregulación en el cual se acumulan iones orgánicos y se equilibran con el Na que absorben. Éste tal vez sea el mecanismo que esté utilizando P. aquatica, la cual es capaz de mantener una proporción de K/Na de 16 con respecto a R. mangle que mantiene una proporción de 0.9 y L. racemosa de 0.30 (Medina et al., 1995), aunque éste es un tema que aún requiere investigación.
Actualmente, se considera a C. erectus como la especie que se distribuye en el extremo más terrestre del manglar, zonas menos inundables y salinas del manglar (Mitsch y Gosselink, 2000; Cronk y Fennesy, 2001) y ha desaparecido en muchísimos sitios, ya que estas zonas han sido convertidas en terrenos agropecuarios (Moreno-Casasola et al., 2009) o se les ha alterado el flujo hidrológico por la construcción de carreteras como ha ocurrido en Quintana Roo (López-Portillo y Ezcurra, 2002). En el presente trabajo se plantea que cuando existe inundación por agua dulce -como en las planicies de inundación donde se ubican muchas de las lagunas costeras y esteros- los extremos del manglar hacia tierra adentro están o estaban ocupados por selvas inundables, donde dominaba P. aquatica y que hoy en día se han convertido en potreros. La tolerancia de esta especie a la inundación, a la salinidad y su presencia como acompañante de manglares, permite concebir un gradiente desde la orilla de las lagunas donde predomina R. mangle, hasta las planicies de inundación donde domina P. aquatica, a lo largo del cual la salinidad va disminuyendo y la inundación permanece, pero con un hidroperiodo distinto, ya que no hay influencia de las mareas. Esto ocurre en las planicies costeras de Veracruz, Tabasco y Chiapas, donde se forman extensas zonas inundables por el agua de escurrimiento superficial y subsuperficial, como lo demostró Yetter (2004) para La Mancha. Por tanto, ecológicamente estos manglares y selvas forman un continuo, en el cual se ha puesto una delimitación artificial denominando manglar a las zonas donde predominan las 4 especies más frecuentes de mangle en México.
Se han ubicado selvas de P. aquatica más tierra adentro, por ejemplo, en La Apompal (19°1’19.39” N, 96°17’6.61” O). Ello muestra que es una especie que puede adentrarse en la planicie costera si las condiciones ambientales son adecuadas. En este caso, el río Jamapa tiene una extensa planicie de inundación, como lo demuestra al desbordarse actualmente e inundar extensas zonas de los municipios de Jamapa, Medellín, Veracruz y Boca del Río. Esta región constituye una extensa zona de humedales en la cual hay restos de actividades prehispánicas de agricultura de humedales sobre terrazas elevadas (río San Juan: Siemens, 1998; La Apompal: Moreno-Casasola e Infante-Mata, 2010) y posiblemente, formó una enorme extensión de popales y selvas que finalmente rodeaban al manglar. Actualmente solo queda un pequeño manchón de manglar en Arroyo Moreno y de selvas inundables de P. aquatica en La Apompal, pero ello debió haber sido un continuo que se extendía tierra adentro sobre la orilla del Jamapa y sus planicies de inundación. En otros casos como el de su presencia en depresiones interdunarias como La Mancha y en zonas colindantes con los sistemas de dunas como El Salado, los valores de salinidad superficial son de 0.3 ups e intersticial de 0.5 ups. Sin embargo, por ejemplo la zona de La Mancha, que ahora está ocupada por humedales de agua dulce y salobre, fue un ecosistema de manglar como lo demostró Primeau (2004) utilizando análisis palinológicos. Ello muestra que son sistemas sumamente dinámicos donde la salinidad fluctúa en el tiempo (Yetter, 2004). Por otro lado, hay avistamientos de la presencia de R. mangle río arriba en el interior de Campeche a una distancia de 50 km en el río La Candelaría (F. Flores-Verdugo, comunicación personal).
La inclusión de P. aquatica como una especie de mangle y con potencial para delimitar zonas de manglares tiene un impacto en el aumento de áreas de manglar en México y en países donde se distribuye. En algunos países donde los manglares están protegidos se esperaría que las leyes de protección se ampliaran a las zonas donde se establece esta especie. Su rápido crecimiento, alta tasa de germinación y tolerancia a diversos niveles de salinidad la hacen una especie apta para reforestar los límites actuales de los manglares de cuenca y zonas riparias con cierta influencia de las mareas. Como lo muestran los mapas presentados, en muchos de los espacios talados de los alrededores del manglar en la planicie costera del golfo de México quedan aún árboles remanentes que demuestran el área de establecimiento potencial de esta especie.
Jayatissa et al. (2002) hacen una revisión detallada de la composición de especies de manglares reportadas en distintos trabajos para Sri Lanka y determinan que más de una docena de especies son más bien acompañantes que mangles verdaderos. Lo inverso también es factible y en este sentido, el presente trabajo ha reunido y generado información que permite sustentar la propuesta de considerar a P. aquatica como una especie del manglar en el continente americano y considerarla como el límite de dicho ecosistema hacia los terrenos menos salinos. Este planteamiento incluye las bases e ideas para revisar los límites de la comunidad de manglar, lo que desde luego tiene repercusiones normativas, ya que P. aquatica no tiene protección legal. Así, el presente trabajo sienta las bases para una discusión académica profunda que permita avanzar en la definición de los humedales mexicanos.
Este trabajo se realizó con el financiamiento otorgado a los proyectos: Criterios para el ordenamiento de manglares y selvas inundables en la planicie costera central de Veracruz, México: un instrumento de manejo comunitario, ITTOConafor (PD 349/05 Rev. 2 (F)) e Inventario, delimitación, caracterización y uso sustentable de los humedales de la cuenca del río Papaloapan, México (Conacyt-Conagua 48247), así como por el Instituto de Ecología, A. C. (902-17). Agradecemos el apoyo de Rosario Landgrave y Roberto Monroy Ibarra por la elaboración de los mapas y a Christian Samuel Castillo Flores por la elaboración de los dibujos. Agradecemos a Conacyt (164467), ITTO y a WWF-Russell E. Train por las becas otorgadas al primer autor.