Los quironómidos son dípteros comunes en los ecosistemas acuáticos, importantes consumidores de materia orgánica particulada y parte de la dieta de peces, insectos y aves. La mayoría de sus larvas son dulceacuícolas, pero el género Clunio es exclusivamente marino y frecuentemente, asociado a costas rocosas y sustratos duros. Durante el periodo de marzo del 2011 a febrero del 2012, se realizaron 6 muestreos bimensuales en la comunidad coralina del Parque Nacional Islas Marietas; para tal efecto, se utilizó esqueleto calcáreo como sustrato de reclutamiento. Se encontraron 89 larvas y 1 imago farado del género Clunio. Las larvas presentaron una densidad promedio anual de 0.015 indcm-2, con una máxima de 0.033 indcm-2 durante el inicio de la temporada cálida. De manera simultánea, se caracterizó el microsustrato adherido al esqueleto de coral, sin embargo, no se encontró relación entre el tipo de sustrato y la densidad de larvas (R=0.61, p=0.197). Este estudio constituye el primer registro de Clunio y de sus cambios anuales de abundancia para el Pacífico mexicano.
Chironomids are common dipterans found in aquatic ecosystems. These organisms are ecologically important as consumers of particulate organic matter and they are consumed by fish, insects and birds. Most of the larvae are from fresh-water, but Clunio is exclusively marine and frequently associated with rocky shores and hard substrates. Six bimonthly samplings were conducted at Islas Marietas National Park during March 2011 to February 2012, using calcareous skeleton as a recruitment substrate. We found 89 larvae and 1 imago of the genus Clunio. The larvae showed a mean density of 0.015 indcm-2, with a maximum value of 0.033 indcm-2 during June-July, coinciding with the period with the highest sea surface temperature registered. Simultaneously, the micro-substrate adhered to the coral skeleton was identified and quantified; however, no relationship between the type of substrate and larval density was found (R=0.61, p=0.197). This study is the first record of Clunio, as well as the annual changes in abundance at the Mexican Pacific.
La familia Chironomidae constituye un taxón abundante y diverso, con distribución amplia en todo tipo de ambientes dulceacuícolas y algunos hábitats semiacuáticos y marinos del mundo. Su presencia contribuye a la buena salud de los ecosistemas, debido a que son consumidores importantes de materia orgánica particulada; detritos, restos en descomposición de plantas, algas y animales, y además, enriquecen la dieta de los peces, crustáceos, odonatos, coleópteros y hemípteros que se alimentan de ellos, pues sus tejidos contienen altos niveles de proteína (Hashimoto, 1976; Cranston y Martin, 1989; Cranston, 1995; Alí, 1996; Andersen et al., 2000; Navarrete et al., 2004; Ferrington, 2008).
Hasta el momento, se han descrito alrededor de 4 147 especies de quironómidos, correspondientes a 339 géneros (Ferrington, 2008). Sin embargo, se estima que esta familia podría estar constituida por hasta 20 000 especies (Ashe et al., 1987; Cranston, 1995; Andersen et al., 2000) que en su mayoría se caracterizan por llevar a cabo el desarrollo larval en ambientes dulceacuícolas y una minoría de aproximadamente 60 especies con larvas estuarinas, intermareales y marinas (Hashimoto, 1976; Newman, 1988; Murray, 1996; Huang y Cheng, 2011). Dentro de los géneros exclusivamente marinos, se encuentra Clunio con 26 especies; de éstas, 7 se han registrado en América y 4 en Hawai, uno de los archipiélagos más grandes y cercanos al continente americano (Cuadro 1).
Listado de quironómidos marinos del género Clunio y su distribución
| Especie | Descriptor y año | Distribución | Sustrato (larvas) | Registros |
| C. marinus | Haliday, 1855 | Europa, norte de África, Egipto | Costa rocosa, camas de ostiones y almejas, llanuras fangosas | Neumann y Honegger, 1969; Sæther y Spies, 2009; Ta demir, 2010. |
| C. adriaticus | Schiner, 1856 | Mediterráneo, islas Baleares | Stone y Wirth, 1947 | |
| C. pacificus | Edwards, 1926 | Japón, islas Marianas, Samoa | Stone y Wirth, 1947 | |
| C. tsushimensis | Tokunaga, 1933 | Hawai, Japón | Hypnea sp. | Stone y Wirth, 1947; Hashimoto, 1976 |
| C. setoensis | Tokunaga, 1933 | Japón | Stone y Wirth, 1947 | |
| C. africanus | Hesse, 1937 | África, océano Índico, archipiélago de Santa Elena | Stone y Wirth, 1947; Oliveira, 1950; Sæther y Andersen, 2011 | |
| C. aquilonius | Tokunaga, 1938 | Japón | Stone y Wirth, 1947 | |
| C. takahashii | Tokunaga, 1938 | Japón, Taiwán | Stone y Wirth, 1947 | |
| C. littoralis | Stone y Wirth, 1947 | Hawai | Stone y Wirth, 1947 | |
| C. vagans | Stone y Wirth, 1947 | Hawai | Costa rocosa, Ulva sp. | Stone y Wirth, 1947 |
| C. brevis | Stone y Wirth, 1947 | Hawai | Stone y Wirth, 1947 | |
| C. schmitti* | Stone y Wirth, 1947 | América del Sur, islas Galápagos | Stone y Wirth 1947 | |
| C. marshalli* | Stone y Wirth, 1947 | América del Norte, Florida | Balanos | Stone y Wirth, 1947 |
| C. brasiliensis* | Oliveira, 1950 | América del Sur, Argentina, Brasil, Chile | Oliveira, 1950; Paggi, 1981 | |
| C. fuscipennis* | Wirth, 1952 | América del Sur, Chile | Wirth, 1952; Hashimoto, 1976 | |
| C. purpureus | Hashimoto, 1962 | Japón | Gelidium divaricatum | Hashimoto, 1976 |
| C. tuthilli | Tokunaga, 1964 | Micronesia | Hashimoto, 1976 | |
| C. mediterraneus | Neumann, 1966 | Europa, Medio Oriente, Turquía | Ta demir, 2010;Sather y Spies, 2009 | |
| C. martini | Hashimoto, 1973 | Australia | Hashimoto, 1976 | |
| C. californiensis* | Hashimoto, 1973 | América del Norte, California | Hashimoto 1976 | |
| C. balticus | Heimbach, 1978 | Alemania, Dinamarca, Finlandia | Costa rocosa | Heimbach, 1978;Sæther y Spies, 2009 |
| C. ponticus | Michailova, 1980 | Bulgaria | Sæther y Spies, 2009 | |
| C. chilensis* | Paggi, 1985 | América del Sur, Chile | Paggi, 1985 | |
| C. virginianus* | Paggi, 1985 | Caribe, islas Vírgenes | Paggi, 1985 | |
| C. gerlachi | Sæther, 2004 | Indopacífico, islas Seychelles | Sæther, 2004 | |
| C. jonesi | Sæther y Andersen, 2011 | Sudáfrica, archipiélago de Santa Elena | Sæther y Andersen, 2011 |
Este género cosmopolita presenta una especialización ecológica y morfológica que le ha permitido adaptarse a la vida litoral en zonas rocosas de todos los continentes, a excepción de la Antártida, e incluso en algunos casos a ambientes pelágicos, siendo sus límites de distribución latitudinal Tromso, Noruega al norte (Clunio marinus) e Is. Mornington, Chile, al sur (C. chilensis) (Hashimoto, 1976; Paggi, 1985). La gran riqueza específica del género y la amplia tolerancia a las variaciones ambientales de algunas especies como C. marinus (Neumann y Honegger, 1969) y C. brasiliensis (Oliveira, 1950;Roback, 1971;Paggi, 1981, 1985; Spies y Reiss, 1996), indican posiblemente que el género posee una distribución incluso mayor a la registrada. La distribución amplia de Clunio está asociada con características como: 1) su alimentación detritívora y poco selectiva, que le permite aprovechar recursos de baja energía y no limita su distribución a una sola fuente de alimento (Hashimoto, 1976; Berg, 1995; Andersen et al., 2000); 2) su comportamiento como epi y endobionte facultativo de tortugas marinas, moluscos, peces, crustáceos y mamíferos, que facilita su dispersión (Dinamani, 1986; Tokeshi, 1993; Schärer y Epler, 2007); 3) su ciclo de vida corto que favorece una rápida colonización; 4) tallas pequeñas (<5mm), que lo hacen imperceptible para algunos depredadores; 5) su capacidad de asentamiento en diversos tipos de sustratos: grietas en las rocas, estructuras artificiales (desagües), fragmentos de coral, macroalgas (comúnmente Ulva sp.), tapete algal, arena, sedimento, detritos e incluso animales (Stone y Wirth, 1947; Neumann, 1976; Hashimoto, 1976; Epler, 2001; Schärer y Epler, 2007) y 6) la habilidad de modificar su conducta reproductiva y velocidad de desarrollo, influenciado por ciclos circadianos y lunares, cambios en el nivel del mar y variaciones de temperatura (Hashimoto, 1976; Neumann, 1976; Neumann y Heimbach, 1984; Saigusa y Akiyama, 1995).
Si bien el género Clunio se distribuye en todos los continentes, cada especie se ha adaptado fisiológica y morfológicamente a las condiciones ambientales locales, por lo que cada población presenta distintos rangos de sensibilidad a las variaciones como la temperatura, cambios de mareas, la desecación y la exposición a la luz y, con ello, distintos comportamientos en la selección de hábitat, estacionalidad en los eventos reproductivos, duración del ciclo de vida y la frecuencia reproductiva (Hashimoto, 1969; 1975; Heimbach, 1978; Saigusa y Akiyama, 1995). Mientras que en Europa y Asia la biología de Clunio y de otros géneros marinos ha sido profundamente estudiada, en México el estudio de los quironómidos se ha enfocado a aquellos distribuidos en ecosistemas dulceacuícolas (Andersen et al., 2000; Navarrete et al., 2004). Por ello, el conocimiento de los géneros marinos es limitado, salvo algunos registros puntuales (Oregon State University y Renfro, 1971; Cheng y Hogue, 1974). Esta tendencia se debe a la falta de especialistas en quironómidos en México y al desconocimiento general de la entomofauna marina del país.
En el presente trabajo se registra por primera vez el género Clunio para en región del Pacífico mexicano y se analiza la variación de la densidad anual en relación con la temperatura y el sustrato de reclutamiento. Este estudio constituye un avance importante en el conocimiento de la entomofauna marina de México y aporta datos iniciales sobre el comportamiento ecológico de Clunio.
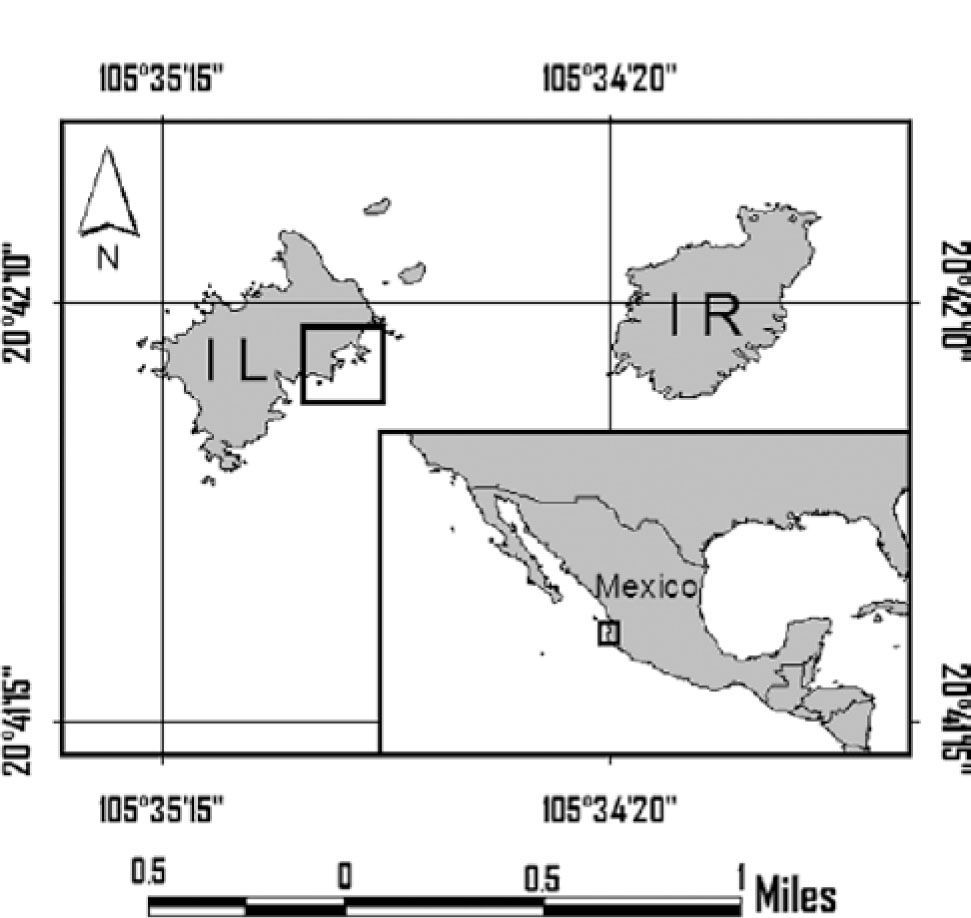
Materiales y métodosÁrea de estudioEl trabajo de campo se llevó a cabo en el Parque Nacional Islas Marietas, Nayarit, México localizado en el extremo noroeste de la Bahía de Banderas (20°42’47”-20°41’11” N, 105°33’18”-105°36’00” O; Fig. 1). El clima en la región es del tipo cálido subhúmedo con lluvias en verano y vientos predominantes que corren en dirección sureste durante el día (García, 1998). Cabe destacar que no hay presencia de riachuelos ni depósitos de agua dulce. La temperatura promedio superficial del agua es de 26.4° C, con una mínima promedio de 23° C en marzo, a una máxima promedio de 30° C en septiembre; dichas condiciones están asociadas a la influencia de la Corriente de California que acarrea aguas frías durante los meses de noviembre a abril y la Corriente Costera de Costa Rica que trae aguas cálidas de mayo a octubre. La salinidad promedio es de 35 ups y el pH es casi constante a lo largo del año (Espino-Barr et al., 2004, 2008; Conanp, 2007; Ulloa-Ramírez et al., 2008).
Trabajo de campoSe realizaron 6 muestreos bimensuales de marzo del 2011 a febrero del 2012, en el sitio, Área de Restauración de la Isla Larga (Fig. 1). Se utilizó como sustrato de reclutamiento 144 fragmentos de esqueleto coralino de aproximadamente 5cm de largo previamente tratados con una solución de hipoclorito de sodio al 10% por 24 h para eliminar tejido y residuos orgánicos. Se enjuagaron con agua dulce durante 8 h y se secaron en una estufa Precision Scientific® a 60° C por 24 h. Previo a los muestreos, en el sitio, fueron colocadas 2 estructuras semiesféricas con 12 varillas cada una; las estructuras se acomodaron cerca de colonias de coral del género Pocillopora. A cada varilla se fijaron 2 fragmentos, 24 fragmentos en total por estructura, y permanecieron por 2 meses, después de los cuales fueron recolectados y sustituidos por el siguiente grupo. Los fragmentos recuperados se almacenaron de manera individual en bolsas plásticas, cerradas in situ y transportadas al laboratorio donde fueron almacenadas a -20° C para su preservación hasta su análisis.
La temperatura fue registrada in situ cada 25minutos con un termógrafo HOBO-Pendant®. Los datos obtenidos fueron promediados por bimestre.
Trabajo de laboratorioCada fragmento fue descongelado individualmente y las larvas y el imago farado fueron preservados en etanol al 70%. Los organismos fueron contados, medidos e identificados a nivel de género, utilizando los trabajos de Stone y Wirth (1947), Epler (2001), Bolton (2007) y Cranston (2010). Para las observaciones se utilizó un microscopio estereoscópico Carl Zeiss® Stemi DR 1040 y un microscopio compuesto LABO® JAZ-ANZ, cada organismo fue fotodocumentado con la cámara LABO® DIGITAL CCD. Se utilizó el software Axiovisión Rel® 4.8 para Windows para medir la longitud corporal de los ejemplares y de sus estructuras corporales. El área de sustrato se obtuvo estimando la superficie por fragmento con el método del papel aluminio (Marsh, 1970) y se calculó la densidad de individuos por unidad de área (indcm-2). Asimismo, de cada fragmento se separaron y clasificaron los distintos tipos de microsustrato en: tapete algal; algas filamentosas, algas carnosas, arena y detritos; algas costrosas; algas coralinas costrosas y reticuladas; Ulva sp.; y briozoos. Cada sustrato fue individualmente colocado en una charola de aluminio previamente pesada y fue secado en estufa a 60° C por 24 h, tiempo después del cual fueron pesados en una balanza analítica de precisión Explorer Ohaus®. El porcentaje de incidencia de microsustrato por fragmento se calculó con la fórmula: incidencia (%)=(peso seco del microsustrato “X” / Peso seco total) • 100
Análisis estadísticosDebido a la naturaleza de los datos se aplicaron pruebas estadísticas no paramétricas. Las diferencias en densidad de organismos promedio e incidencia de sustrato entre bimestres de muestreo se evaluaron con ANOVA por rangos Kruskal-Wallis y una prueba a posteriori Dunn´s (p<0.05).?? corrgir. La relación entre la temperatura, incidencia de microsustrato y las variaciones de densidad de organismos se estimó por medio de pruebas de regresión lineal y se consideró un valor de α <0.05 (Zar, 1996). Los cálculos fueron realizados con el software SigmaPlot®, versión 11.0 para Windows.
DescripciónClunioHaliday, 1855
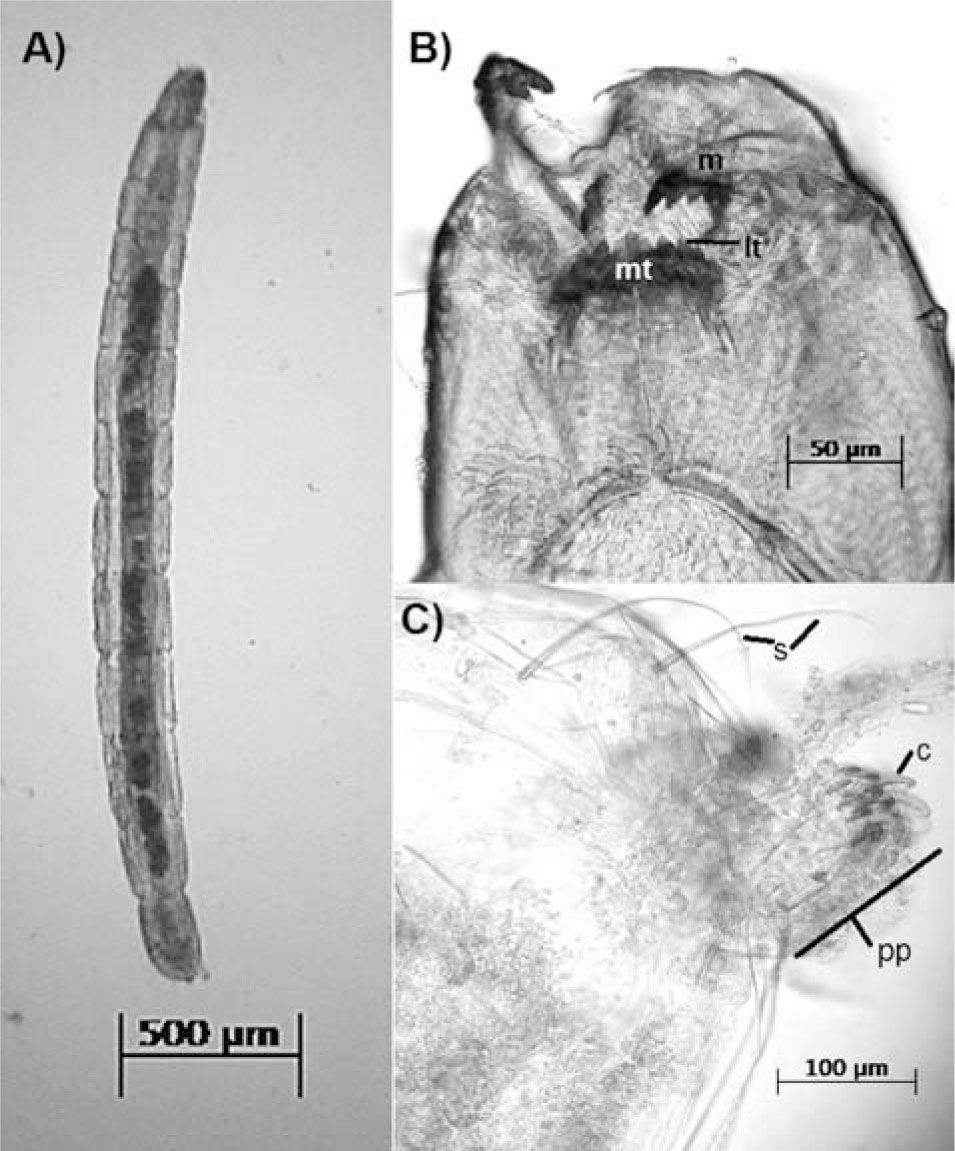
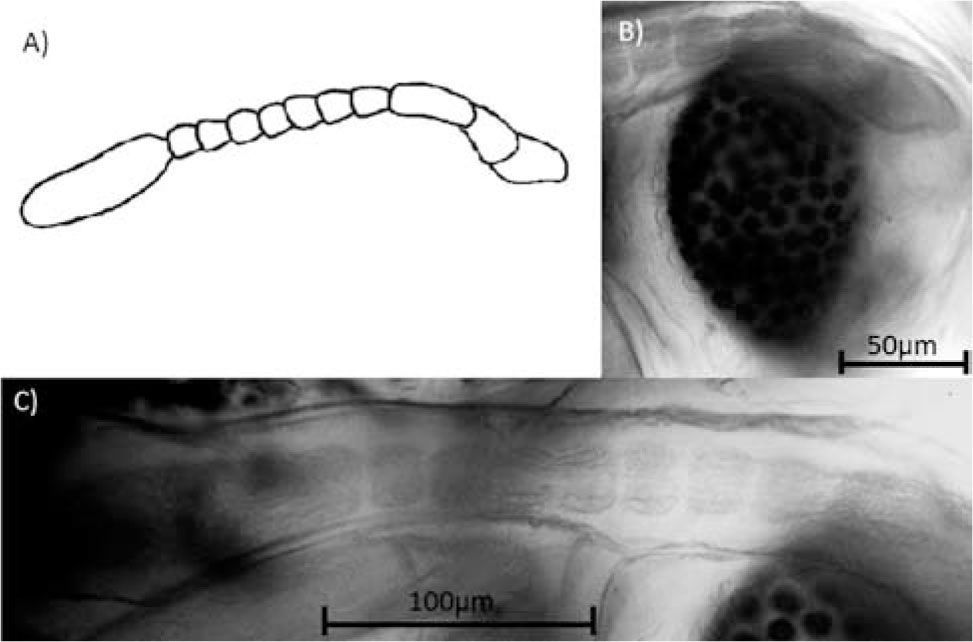
Caracteres diagnósticosLarva (modificada de: Epler, 2001; Bolton, 2007; Craston, 2010). Las larvas de Clunio se identifican por la presencia de la siguiente combinación de caracteres: hábitats exclusivamente marinos, común en costas rocosas, aunque puede presentarse en mar abierto, frecuentemente asociado a comunidades de algas o corales. Antena: dividida en 5 segmentos con presencia de hoja antenal que se extiende hasta el segmento 4 (Figs. 3B, D). Mandíbula: con un diente apical más cortó que la anchura combinada de los dientes internos 3 y 4 (Figs. 2B, 3C). Labro: con la primera (SI) y segunda sedas (SII) plumosas, tercera (SIII) y cuarta sedas (SIV) normales (Fig. 3C). Premandíbula: con un diente apical romo y ancho y dientes internos romos (Fig. 3C). Mentón: con un diente central en forma de cúpula, del doble del ancho que el primer diente lateral, 4 pares de dientes laterales (Fig. 2B). Cuerpo: Procerco ausente, sustituido por sedas anales (Fig. 2C). Túbulos anales y ventrales ausentes (Fig. 2A).
Larva: A, vista ventral del cuerpo: dividido en 12 segmentos y una cápsula cefálica esclerotizada. B, detalle de la cápsula cefálica: piezas bucales. mt: mentón, se evidencia la esclerotización (regiones oscuras) de los dientes y las estrías en sentido vertical; lt: diente lateral del mentón; m: mandíbula, también fuertemente esclerotizada en los dientes. C, vista lateral de la región anterior del cuerpo. ap: parápodo posterior; c: garras del parápodo posterior; s: sedas anales.
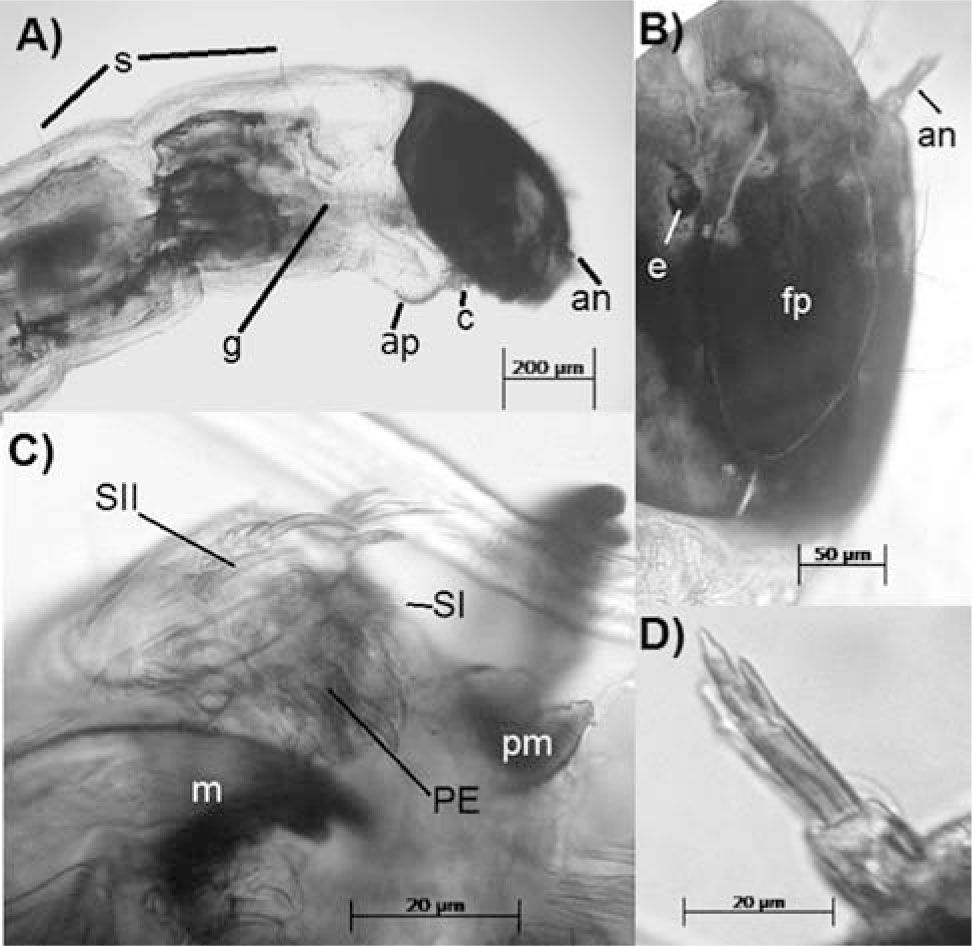
Larva, detalles del cuerpo y la cápsula cefálica: A, vista lateral del cuerpo. s: sedas corporales; g: intestino; ap: parápodos anteriores; c: garras de los parápodos anteriores; an: antena. B, vista dorsal de la cápsula cefálica. e: ojo; fp: apoptoma frontal; an: antena. C, vista ventral del labro. SI: primera seda plumosa; SII: segunda seda plumosa; PE: pecten epifagris; m: mandíbula; pm: pre mandíbula. D, antena.
Imago macho (modificado de Stone y Wirth, 1947; Cranston et al., 1989) ojos: facetados, bien desarrollados y pubescentes -excepto en C. schmitti- (Fig. 4B). Antena: con 11 segmentos. Escapo (primer segmento) triangular, pedicelo (segundo segmento) grande y bulboso, tercer segmento alongado; flagelo antenal: cuarto a décimo segmento subiguales en longitud y ancho, último segmento alongado y ligeramente claviforme (Fig. 4A y 4C). Palpo maxilar bisegmentado. Alas bien desarrolladas. Hipopigio grande, representa casi la mitad de la longitud del abdomen, rotados sobre el eje antero-posterior del cuerpo de 100 a 180°. Gonocoxitos y gonostilos prominentes (Fig. 5B).
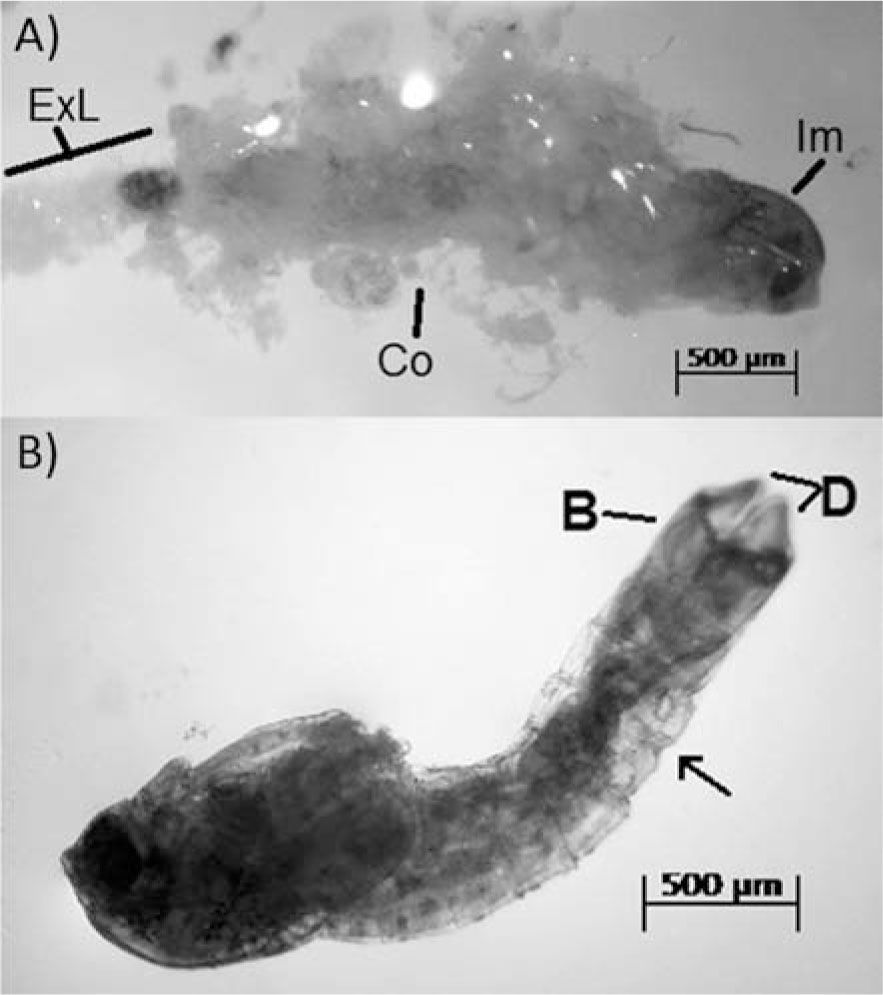
Se encontraron 89 organismos y una pupa con imago macho farado asociados a la comunidad coralina de la isla Larga, Parque Nacional Islas Marietas, Nayarit, México. Los muestreos se realizaron de marzo del 2011 a febrero del 2012, por A. P. Rodríguez-Troncoso y R. C. Sotelo-Casas. El material recolectado se encuentra depositado en la colección del Laboratorio de Ecología Marina del Centro de Investigaciones Costeras, Departamento de Ciencias Biológicas, Centro Universitario de la Costa, Universidad de Guadalajara.
LarvasCuerpo: longitud corporal mínima 0.85mm y máxima 4.83mm (n=89). Coloración clara, que varió de un tono blanquecino en los ejemplares más jóvenes a un tono pardo amarillento con una ligera pigmentación oscura en el segmento posterior a la cápsula cefálica en individuos en estadios avanzados. Manchas oculares presentes, aunque poco evidentes, con forma de alubia y una pequeña mancha secundaria o accesoria en el extremo inferior externo (Fig. 3B). Apoptoma frontal con 3 pares de sedas en la región anterior, 3 pares de sedas rodean el apoptoma en su parte posterior (Fig. 3B).
Imago machoCuerpo: color castaño claro. Hipopigio: gonocoxitos y gonostilos prominentes, rotados aproximadamente 100° (Fig. 5B). El imago recolectado pertenece al muestreo de octubre-noviembre del 2011. Se encontró resguardado dentro de un capullo formado por detritos, restos de sus mudas larvales y sedimento, entre el microsustrato del fragmento (Fig. 5A). En total, se encontraron 89 organismos y una pupa con imago macho farado entre el microsustrato del fragmento (Fig. 5A), formadas patas, antenas y alas; pero aún protegido por la cápsula pupal (Figs. 5A, B).
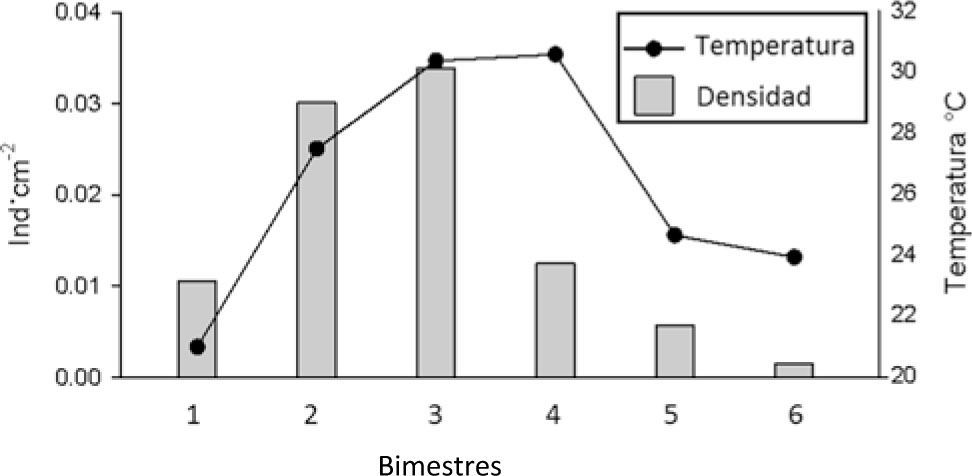
Relación de la densidad anual de Clunio con la temperatura y microsustratoEn el sitio se registró una temperatura superficial promedio de 26.3±1.5° C, teniendo las máximas durante el periodo de septiembre-octubre (30.5° C) y las mínimas en el bimestre marzo-abril (20.9° C). La densidad promedio anual de Clunio en el Pacífico central mexicano (Fig. 6) fue de 0.015 indcm-2, presentando variaciones significativas a lo largo del año (Kruskall-Wallis, H=35.42, p<0.001), asociadas a los muestreos de noviembre-diciembre (0.005 indcm-2) y enero-febrero (0.001 indcm-2) que exhibieron las densidades más bajas, mientras que el resto del año se mantuvo con densidades superiores a 0.01 indcm-2, con un pico máximo en julio-agosto de 0.033 indcm-2 (Dunn´s p<0.05). Al comparar la temperatura promedio bimensual con la densidad de individuos, se encontró una relación positiva (R=0.61), pero no significativa (p=0.197).
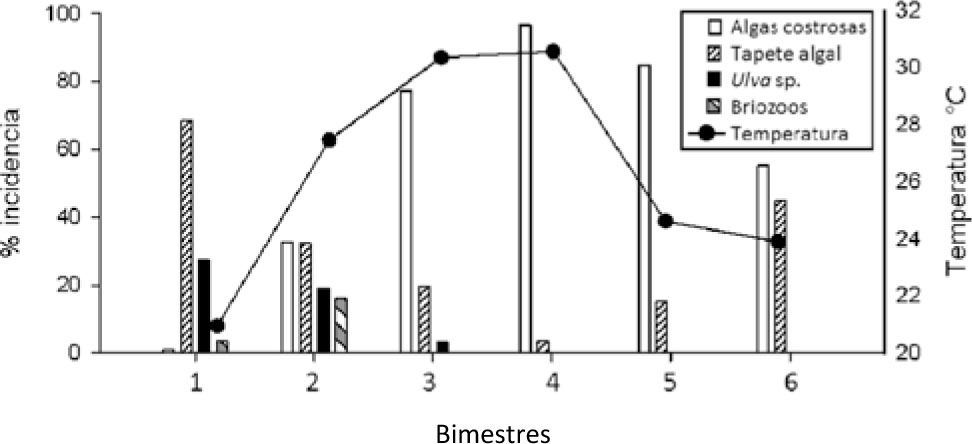
Con respecto al microsustrato, se encontró que las algas costrosas presentaron los mayores valores durante todo el año, excepto en el bimestre marzo-abril, donde representaron el 0.93% y contrastantemente tuvieron sus valores más altos durante septiembre-octubre (96.43%). Por otro lado, el máximo de abundancia del tapete fue registrado durante marzo-abril (68.26%) y su mínimo en septiembre-octubre de 3.56%; el alga Ulva sp. presentó una menor proporción, tuvo picos de abundancia durante marzo-abril (27.31%) y mayo-junio (19.02%) con una importante reducción durante el resto del año (<5%); los briozoos mostraron abundancias muy bajas durante todo el año (<3%), pero durante el bimestre mayo-junio su presencia fue del 16.03% (Fig. 7). El tapete mostró una relación negativa respecto al incremento de temperatura (R=0.82, p=0.043). Mientras que el alga costrosa presentó una correspondencia positiva ante el aumento de temperatura (R=0.69), pero sin diferencias significativas (p=0.124). Al buscar la relación entre la densidad de individuos y la incidencia de microsustrato no se encontraron resultados significativos ni a nivel individual ni por la interacción (R=0.66, p=0.163), debido a que tanto la incidencia de tapete como de algas calcáreas presentaron altos valores de colinealidad (VIF>5).
DiscusiónClunio es un taxón con hábitos marinos poco estudiado, pero de amplia distribución mundial, por lo que se cuentan con una gran cantidad de registros, pero de tipo puntual tanto en el Pacífico como en las costas del Atlántico Americano (Cuadro 1). El éxito de este grupo se puede atribuir a que la familia Chironomidae presenta amplios intervalos de tolerancia a diferentes variables fisicoquímicas como temperatura, ya que se distribuye desde zonas polares hasta la franja ecuatorial; salinidad, encontrándose en sistemas hipersalinos como mares interiores y lagunas costeras e hiposalinos como ríos y lagos, y desecación, al encontrarse en charcas temporales, musgos, bromeliáceas y plantas halófitas (Neumann, 1976; Hashimoto, 1976; Cranston, 1995; Andersen et al., 2000). Aunque la mayoría de las especies marinas se asocia a costas rocosas, Hashimoto (1976), Oliveira (1950), Cranston (2000) y Schärer y Epler (2007) registraron el asentamiento de Clunio en arrecifes coralinos y ecosistemas contiguos, al igual que en este estudio, donde el sustrato calcáreo estuvo relacionado con la recolecta exitosa de quironómidos, ya que sus características cubrieron los requerimientos ambientales del género: 1) un sustrato firme y similar a la roca; 2) una estructura compleja que suministró refugio y camuflaje contra depredadores y 3) una fuente de alimento constante gracias al asentamiento de otros organismos bentónicos sobre los fragmentos como biopelículas bacterianas, algas -entre ellas Ulva sp.- e invertebrados, y a que éstos propician que parte del detritos de la columna de agua quede atrapado en los fragmentos. El conjunto de condiciones favorables, más la disponibilidad de sustrato, permitió que las larvas se mantuvieran presentes durante todo el año, demostrando que Clunio es un organismo asociado directamente a la comunidad coralina del Pacífico central mexicano.
Debido a que no se ha estandarizado una metodología de recolecta para todas las especies de quironómidos ni para su comparación en relación con la superficie, volumen o tiempo, es complicado comparar la densidad de Clunio sp. encontrada en islas Marietas con otros sitios. Sin embargo, existen datos contrastantes en los que en cultivos artificiales y lagunas naturales se pueden encontrar abundancias de Clunio de hasta el 76 y 95%, respectivamente, en relación con el total de invertebrados recolectados (Navarrete et al., 2004; Espinoza y Morales, 2008); mientras que en nuestro estudio, Clunio representó menos del 1%. La presencia de este género en los ecosistemas es de gran relevancia por su papel como reciclador de nutrientes y fuente de alimento para especies carnívoras, siendo un factor determinante en la productividad de los ecosistemas (Cranston, 1995; Brodin y Andersson, 2009); sin embargo, es importante que las condiciones ambientales mantengan en control su densidad, ya que los casos en que su presencia es de tipo invasora o hay un aumento desmedido de la población son potencialmente perjudiciales, pudiendo desplazar a especies locales, provocar pérdidas económicas por daños estructurales a infraestructura costera y generar eventos reproductivos nocivos para el hombre, convirtiéndose en un problema de salud pública y ambiental (Alí et al., 2008). De aquí que el conocimiento de su dinámica poblacional sea tan importante, llegando incluso a utilizarse como indicadores del estado de salud de los ecosistemas (Lobinske y Alí, 2006; Alí et al., 2008).
Aunque en el presente estudio no se encontró relación directa entre la variación de la temperatura y la densidad de organismos, se observó un incremento de larvas en la temporada cálida de mayo a agosto, coincidiendo con el primer incremento en la temperatura, lo cual es un disparador del inicio de la actividad reproductiva (Neumann y Heimbach, 1984) y posteriormente, un decremento abrupto en septiembre-octubre, cuando se registraron picos de temperatura superiores a 30° C, ya que, aunque la temperatura alta se relaciona con la reproducción, ésta pudo exceder los límites térmicos del género (McKie et al., 2004). Durante el muestreo de octubre-noviembre se encontró un imago macho farado dentro de su cápsula pupal en un capullo formado de detritos y exuvias larvales, que constituye evidencia de que en la región los organismos del género Clunio sp. alcanzan la madurez sexual y completan su ciclo reproductivo. El que sólo se haya capturado 1 imago no debe interpretarse como signo de bajos índices de reproducción, ya que los estadios pupales y adultos de Clunio en las islas Marietas pueden estar asociados en mayores abundancias a otros grupos bentónicos como macroalgas, o roca, y mantenerse suspendidos en la columna de agua antes del ritual reproductivo y por lo tanto, la técnica de recolecta empleada posiblemente no resulta adecuada para su captura (Hashimoto, 1976). Del mismo modo que la temperatura, se deben considerar otros aspectos como los ciclos lunares, las mareas y la interacción sincronizada de todas estas variables, que influyen en los picos reproductivos de Clunio (Neumann y Heimbach, 1984) y que estudios posteriores nos permitirán caracterizar para entender una parte fundamental de la dinámica poblacional del género en la región.
En el caso de islas Marietas, Clunio registró densidades bajas a pesar de estar presente todo el año, posiblemente controlado por diferentes factores ecológicos. Inicialmente, se debe de considerar si su presencia es de tipo estacional o residente. Aunque a nivel de familia, los quironómidos presentan una alta tolerancia a diferentes variables oceanográficas, cada especie está adaptada a condiciones específicas dependiendo de su distribución y de su historia de vida, como mecanismo de aclimatación local ante el ambiente en el que se está desarrollando (Somero, 2005), por lo que a nivel poblacional, la mayor densidad de individuos se encontrará concentrada en el sitio con las condiciones óptimas para su desarrollo, generando un gradiente negativo hacia la periferia hasta su límite de distribución, en donde las condiciones son subóptimas una gran parte del año (Sanford y Kelly, 2011). El área de estudio se encuentra en el límite entre 2 regiones biogeográficas: Pacifico Templado Este y Pacifico Tropical Noreste, y anualmente presenta condiciones oceanográficas mixtas y poco estables, con marcada influencia estacional de la Corriente de California y la Corriente Costera de Costa Rica (Wyrtki 1965, 1967; Spalding et al., 2007). Dichas condiciones generan una gran variedad de ambientes potencialmente colonizables, pero pueden producir estrés en los organismos que encuentran su límite de tolerancia ambiental en esta zona de transición.
Otro factor determinante en el éxito y presencia de Clunio es la cantidad de recursos accesibles, de forma que la disponibilidad y competencia por alimento y refugio limitan su densidad. Los arrecifes coralinos se caracterizan por ser sistemas de aguas claras y pobres en nutrientes (Charpy, 2001), a los cuales está asociada una gran abundancia de organismos detritívoros (e. g. poliquetos, holoturoideos, crustáceos) que compiten directamente con Clunio por alimento. Estos organismos bentónicos también se reclutan en el esqueleto coralino, junto con distintas especies formadoras de microsustrato, como algas filamentosas, Ulva, algas calcáreas y briozooarios, creando en conjunto un estrés por espacio. De tal forma que, aunque el esqueleto coralino genera condiciones adecuadas para la supervivencia de Clunio, la microcomunidad asociada al sustrato regula la densidad por medio de la competencia. Esta hipótesis es apoyada por el hecho de que ningún microsustrato se relacionó positivamente con la de densidad de Clunio.
Cabe resaltar que los organismos encontrados corresponden al primer registro de Clunio asociado a una comunidad coralina del Pacífico mexicano. Clunio es un organismo clave para muchos procesos poblacionales, ya que tiene funciones primarias como reciclador, interacciones tróficas como depredador y competidor con otros invertebrados, y es consumido por peces, insectos, crustáceos y aves (Hashimoto, 1967; Alí, 1996; Andersen et al., 2000; Navarrete et al., 2004). Su actividad en la comunidad coralina es esencial y se vuelve prioritario identificar las implicaciones ecológicas de su presencia en el área de estudio, y las posibles consecuencias en sus cambios de densidad poblacional sobre otros taxones.
RCSC agradece al Conacyt por la beca de doctorado (Núm. 291281). El presente estudio fue financiado por el proyecto “Programa de Monitoreo Ambiental Marino de los Parques Nacionales Islas Marietas e Isla Isabel, Nayarit, México” a cargo de ALCM y se llevó a cabo en el Laboratorio de Ecología Marina del Centro de Investigaciones Costeras, de la Universidad de Guadalajara. Los autores agradecen a las autoridades del Parque Nacional Islas Marietas por las facilidades otorgadas para el muestreo. Asimismo, a los estudiantes que contribuyeron con el procesamiento de las muestras. Finalmente, agradecemos a P. S. Cranston por la asesoría durante la identificación de los quironómidos recolectados.