El bosque mesófilo de montaña (BMM) en México es el ecosistema con mayor riqueza de flora por área, donde destacan los helechos y licófitos por su riqueza y abundancia. Sin embargo, existen pocos estudios comparativos de cómo cambian la riqueza y composición de especies en las diferentes áreas de BMM, siguiendo una metodología estándar. Con este fin, se muestrearon 10-13 parcelas de 20×20m cada una, en 3 áreas de BMM en los 2 volcanes principales de la región de Los Tuxtlas, Veracruz. Se comparó la riqueza de especies y se analizó la similitud florística mediante Anosim y escalamiento multidimensional (NMDS); además, se identificaron las especies que contribuyen más a la disimilitud. Se registraron 71 especies de helechos y 3 de licófitos, en 37 géneros y 15 familias. Las diferencias en la riqueza en las 3 áreas no fueron significativas, mientras que la composición de especies sí mostró diferencias significativas. Estas diferencias se explican por especies exclusivas o con frecuencias contrastantes entre áreas, cuyas características parecen estar fuertemente relacionadas con el microclima y los suelos, así como con la intensidad de perturbación antropogénica. La alta variación en la composición florística por área constituye información relevante para plantear estrategias de conservación de estas plantas a nivel regional.
The humid montane forest in Mexico, where ferns and lycophytes are diverse and abundant, is the richest ecosystem floristically per unit area. However, there are few comparative studies using a standard methodology on how richness and species composition change in different areas of this type of forest. Therefore, we sampled 10-13 plots of 20×20m each in 3 areas of this forest at the 2 main volcanoes in the region of Los Tuxtlas, Veracruz. We compared species richness and analyzed floristic similarity by Anosim and non-metric multidimensional scaling (NMDS); we also identified the species that contribute most to the dissimilarity. Within our plots, we recorded 71 species of ferns and 3 of lycophytes in 37 genera and 15 families. Differences in species richness in the 3 areas were not significant, whereas species composition showed significant differences. These differences can be explained by the presence of unique species or contrasting frequencies between areas whose characteristics appear to be strongly related to the microclimate and soil, as well as to the degree of anthropogenic disturbance. The high variation in the floristic composition per area is relevant for proposing conservation strategies of these plants at the regional level.
Los helechos y licófitos son un grupo de plantas vasculares que tienen su mayor representación taxonómica en los bosques templados húmedos de las montañas tropicales (Kessler, Kluge, Hemp y Ohlemüller, 2011; Kreft, Jetz, Mutke y Barthlott, 2010; Kreft, Köster, Küper, Nieder y Barthlott, 2004). Uno de los tipos de bosque de esta zona ecológica en México es el denominado bosque mesófilo de montaña (BMM); se trata de la formación vegetal con mayor riqueza de flora con relación al área que ocupa (aprox. 0.4% del territorio nacional) (Gual-Díaz y Gonzáles-Medrano, 2014; Rzedowski, 1996; Villaseñor, 2010). Los helechos y licófitos constituyen el 10% (630 spp.; Tejero-Díez, Torres-Díaz y Gual-Díaz, 2014) del total de las plantas vasculares consideradas para este tipo de vegetación (6,163 spp.; Villaseñor y Gual-Díaz, 2014). En una escala más reducida, el BMM en el estado de Veracruz es uno de los 3 más diversos en México, junto con los de Oaxaca y Chiapas. En él habitan al menos 375 especies (50 de manera exclusiva) de helechos y licófitos. Esta cifra representa el 66% de las 564 especies de estas plantas registradas para esta entidad, y el 59% de las consideradas a nivel nacional para este tipo de vegetación (Krömer, Carvajal-Hernández, Acebey y Smith, 2015; Tejero-Díez, Torres-Díaz, Mickel, Mehltreter y Krömer, 2011).
Debido a la elevada contribución de la pteridoflora en las regiones montañosas del trópico, así como a su sensibilidad a las condiciones ambientales e impacto antrópico, este grupo ha sido referido como indicador para medir aspectos relacionados con la biodiversidad y sus cambios por efecto de la transformación de los ecosistemas (Paciencia y Prado, 2005; Williams-Linera, Palacios-Ríos y Hernández-Goméz, 2005), incluso en el BMM de Veracruz (Carvajal-Hernández y Krömer, 2015; Carvajal-Hernández, Krömer y Vázquez-Torres, 2014). En el BMM de la región central de Veracruz, Williams-Linera et al. (2005) observaron que la riqueza de helechos y licófitos no está correlacionada positivamente con la de los árboles, sino que más bien su composición florística fue altamente complementaria. Posteriormente, un estudio en la zona capital de Veracruz constató que las diferencias en la composición de las especies arbóreas influyen en la composición de las especies de helechos y licófitos, aunque en términos de riqueza presentaron valores similares (Hernández-Rojas, 2010).
En el BMM de la región de Los Tuxtlas, en el sureste de Veracruz, se presentan diferentes asociaciones de especies arbóreas dominantes (p. ej., bosques de Podocarpus-Alfaroa), las cuales varían con relación a la orientación de las vertientes de los volcanes San Martín Tuxtla y Santa Marta (Conabio, 2010; Ramírez, 1999). A la fecha, no existen estudios comparativos de la pteridoflora del BMM de estos 2 volcanes, a pesar de la gran importancia de este hábitat para estas plantas (Acebey, Krömer, Vázquez-Torres y Tejero-Díez, 2015). Se ha mencionado que el BMM es el tipo de vegetación mejor conservado de esta región (Castillo-Campos y Laborde, 2004), sin embargo, está amenazado y en peligro de desaparecer como en otras regiones de México (Conabio, 2010; Williams-Linera, 2002). El presente estudio pretende contribuir a una mejor comprensión de cómo la heterogeneidad vegetal influye en los patrones de diversidad y composición de los helechos y licófitos en las distintas asociaciones del BMM. Para ello, se plantearon las siguientes preguntas: i) ¿Cómo cambia la riqueza y composición de especies en 3 diferentes áreas de BMM en los 2 volcanes principales de Los Tuxtlas? ii) ¿Cuáles especies contribuyen a estas diferencias y por qué?
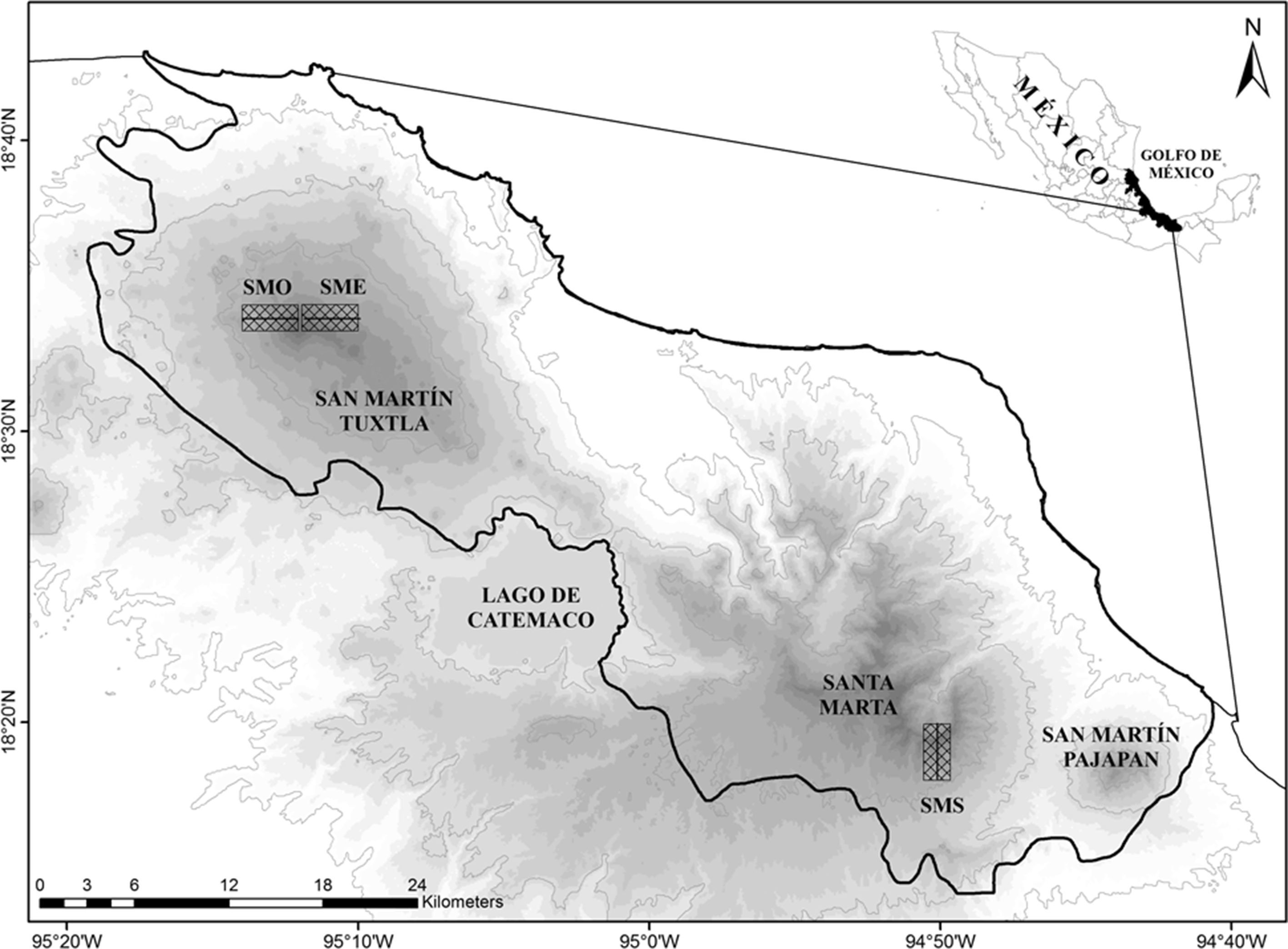
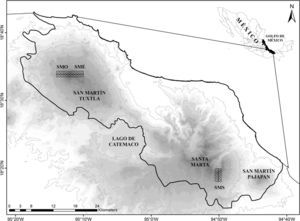
Materiales y métodosEl área de estudio se localiza en la sierra de Los Tuxtlas, la cual emerge sobre la llanura costera del golfo de México, ubicada al sureste del estado de Veracruz (Conabio, 2010). La región tiene una superficie de 315,525ha, de las cuales 155,122 forman parte de la Reserva de la Biosfera Los Tuxtlas (Laborde, 2004). Esta sierra está constituida por 2 grandes macizos volcánicos separados en la parte central por una caldera volcánica que alberga al lago de Catemaco. El macizo noreste está constituido por el volcán San Martín Tuxtla (1,680m) y el macizo sureste es conocido como la sierra de Santa Marta (1,680m) (Guevara, Laborde y Sánchez-Ríos, 2004).
El clima de esta región está fuertemente influido por el pronunciado gradiente altitudinal, su topografía compleja y la proximidad al mar del golfo de México. Estos volcanes interceptan los vientos dominantes que provienen del norte, los cuales propician precipitación sobre las cuestas de barlovento y la producción de una sombra de lluvia sobre el lado opuesto (Soto, 2004). Por lo tanto, la precipitación es de 3,000-4,500 (7,000 en las partes altas)mm/año en las vertientes de exposición barlovento, mientras que en las de sotovento es de 1,500-3,500mm/año (Gutiérrez-García y Ricker, 2011; Soto, 2004). A pesar de que llueve durante casi todo el año, el régimen lluvioso es marcadamente estacional, con una época húmeda de junio a febrero, y una seca entre marzo y mayo. De acuerdo con la clasificación climática de Köppen modificada por García (1981), el clima del BMM, por encima de los 1,000m de altitud, es semicálido húmedo, con una temperatura media superior a los 18°C ((A) C (fm)); mientras que, por encima de los 1,500m, el clima es templado con temperaturas inferiores a los 18°C (C (fm)). En ambos casos el clima es muy húmedo y en el mes más seco caen al menos 40mm de lluvia (Soto, 2004). Las frecuentes neblinas características de este tipo de vegetación, y la consiguiente alta humedad atmosférica, suplen la escasez de lluvia en el periodo seco del año (Gual-Díaz y González-Medrano, 2014).
Según Campos (2004), a nivel regional, los volcanes San Martín Tuxtla y Santa Marta presentan tipos de suelo distintos; los de la sierra de Santa Marta son geológicamente más antiguos: luvisol (739km2), acrisol (360km2) y cambisol (65km2). En la vertiente norte y noreste, que es más húmeda, la textura de los suelos es franco arcillo limosa y franco limosa (Conanp, 2006). Los suelos del área de influencia del volcán San Martín Tuxtla, de geología más reciente, son predominantemente de tipo andosol (689km2), la textura de los suelos es de franco arcillo arenosa a franco arcillosa y franca, poseen una capacidad alta para retener agua y tienen altos contenidos de materia orgánica (Conanp, 2006).
Castillo-Campos y Laborde (2004) caracterizaron 9 tipos de vegetación para la región de Los Tuxtlas, donde tanto el BMM como la selva mediana perennifolia son los más conservados, por encontrarse en sitios poco accesibles en las laderas de los volcanes. Sin embargo, el área actual que ocupa el BMM es muy reducida (11,518ha en la sierra de Santa Marta y 1,072ha en San Martín Tuxtla; Conabio, 2010), y se encuentra encima de los 1,000m de altitud (Castillo-Campos y Laborde, 2004). Se ha observado que entre los (750−) 800m y 1,100m de altitud existe una zona de transición entre la selva alta y mediana perennifolia y el BMM (Acebey et al., 2015; Castillo-Campos y Laborde, 2004), cuya amplitud varía dependiendo de la orientación y del suelo. Para evitar las transiciones, en este estudio se eligieron 3 áreas de BMM por encima de los 1,000m en los 2 volcanes principales, y en diferente orientación.
La primera área de estudio (SME) se localizó sobre la ladera noreste del volcán San Martín Tuxtla (18°33′34″N, 95°10′12″O), abarcando un intervalo altitudinal entre 1,060-1,670m (fig. 1). Aquí el BMM se caracteriza por tener un estrato arbóreo de 20-30m con dosel cerrado y otro con árboles emergentes de cobertura abierta que sobrepasan los 40m. Los géneros arbóreos más comunes son Carpinus, Ulmus y Quercus. Un tercer estrato que crece por debajo de los árboles de dosel o sotobosque está caracterizado por palmas del género Chamaedorea y helechos arborescentes. Se destaca también la gran biomasa de epífitas vasculares (orquídeas, helechos, bromelias, peperomias y aráceas), y musgos sobre los troncos y ramas más gruesas. En este estudio, de acuerdo con la clasificación de Castillo-Campos y Laborde (2004), se consideró como parte del BMM la vegetación de la cima del volcán, señalada por otros autores (Ramírez, 1999sensuMiranda y Hernández, 1963; Sousa, 1968) como selva baja perennifolia (SBP) o bosque enano (elfin forest), debido a que está dominada por Oreopanax xalapensis y Clusia salvinii, las cuales son comúnmente aceptadas como indicadoras de BMM (Rzedowski, 1978). Esta última asociación del BMM se caracteriza por presentar una altura de dosel de 8-10m, una gran abundancia de epífitas vasculares y no vasculares, así como palmeras y helechos en el sotobosque a causa de la presencia de neblina persistente por su posición altitudinal encima de 1,500m.
La segunda área (SMO) fue establecida sobre la ladera suroeste del volcán San Martín Tuxtla (18°33′N, 95°12′O) entre 1,060-1,660m. Por debajo de 1,000m no se observaron fragmentos de BMM naturales, ya que la vegetación natural ha sido transformada en potreros. Debido a la exposición de sotavento, principalmente en la parte inferior, el BMM se aprecia más seco comparado con el de la primera área, y con una menor abundancia de epífitas no vasculares. Sin embargo, la estructura y composición del bosque es similar.
La tercera área (SMS) fue ubicada sobre la ladera suroeste del volcán de Santa Marta (18°18′19″N, 94°49′50″O) entre 1,000-1,570m. La estructura del BMM de esta área es similar a la de las anteriores, el bosque es poliestratificado denso con árboles de dosel entre 20-25m y árboles emergentes de hasta 35m, con 2-3 estratos inferiores. La pteridoflora se destaca por su riqueza y abundancia de especies, principalmente en los estratos herbáceo y arbustivo (Ramírez, 1999). El epifitismo alcanza un alto grado de exuberancia, donde los troncos y las ramas de los árboles están cubiertos por musgos, helechos, bromelias, aráceas y orquídeas. Los géneros arbóreos forman asociaciones que están relacionadas con el intervalo altitudinal, por ejemplo: alrededor de los 1,000m dominan Liquidambar y Quercus, por encima de 1,200m los géneros dominantes son Podocarpus, Alfaroa, Quercus, y Liquidambar en las cañadas (Ramírez, 1999). A partir de 1,500m se presenta, al igual que en el volcán San Martín Tuxtla, una asociación de baja altura (bosque enano), aunque florísticamente la dominancia está dada por especies como Hedyosmum mexicanum, Podocarpus matudae y Weinmannia pinnata.
El muestreo fue realizado entre abril y diciembre de 2005 en el volcán San Martín Tuxtla, y entre agosto y septiembre de 2006 en el volcán de Santa Marta. En el área 1 (SME) se muestrearon en total 13 parcelas, en el área 2 (SMO) 10 parcelas, y en el área 3 (SMS) 12 parcelas. Las parcelas fueron georreferenciadas (coordenadas y elevación) y tuvieron mayormente una forma cuadrada (20×20m); ocasionalmente la forma se adecuó a la topografía de los sitios a muestrear. Este tamaño corresponde al área mínima recomendada por Kessler y Bach (1999), que mantiene un criterio de homogeneidad tanto fisionómico como ecológico de las parcelas. En cada parcela se registraron (presencia/ausencia) todas las especies de helechos y licófitos terrestres y epífitos del sotobosque (troncos, arbustos y árboles jóvenes hasta una altura de 8m en el forófito) (Gradstein, Nadkarni, Krömer, Holz y Nöske, 2003). Para cada especie se indicó la forma de crecimiento de acuerdo con el sustrato según Grayum y Churchill (1987): terrestre (T), epífita (E), hemiepífita (HE), rupícola (R). Se recolectaron especímenes por triplicado o tetraplicado y se herborizaron siguiendo las recomendaciones en Lorea y Riba (1990). Los ejemplares se clasificaron de acuerdo con Christenhusz, Zhang y Schneider (2011) y los nombres de las especies se modernizaron de acuerdo con estudios taxonómicos recientes. Se confirmó la adecuada determinación por comparación con especímenes del Herbario Nacional de México (MEXU) y del herbario del Instituto de Ecología, A.C. (XAL), así como con la consulta de especialistas. Un juego completo de ejemplares fue depositado en MEXU y duplicados fueron donados a los herbarios XAL y UC de la Universidad de California.
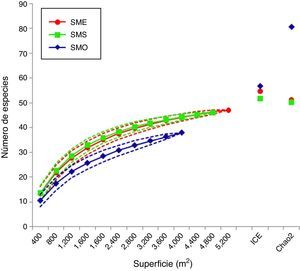
Para analizar el esfuerzo de muestreo se realizaron curvas de acumulación de especies (Colwell, Mao y Chang, 2004) mediante los estimadores de riqueza no paramétricos ICE y Chao2, los cuales están basados en datos de presencia-ausencia y toman en cuenta las especies raras (únicas y duplicadas). Estos estimadores son considerados más confiables por mantener un crecimiento inicial rápido en la curva y una asíntota bien definida, además de presentar un menor sesgo (López-Gómez y Williams-Linera, 2006; Villaseñor, Maeda, Colín-López y Ortíz, 2005). Los valores promedio de riqueza observados se ajustaron mediante el modelo de Clench (Soberón y Llorente, 1993) para evaluar la representatividad del muestreo; este método es el más utilizado y ha demostrado un buen ajuste en la mayoría de las situaciones reales y con la mayoría de los taxones (Soberón y Llorente, 1993). Dado que el número de parcelas de muestreo en cada sitio fue distinto, se utilizó el método de rarefacción para compararlas (Gotelli y Colwell, 2001).
La representación gráfica de la similitud florística entre las 3 áreas de estudio se realizó mediante un análisis de escalamiento multidimensional no-paramétrico (NMDS), basado en los registros de incidencia (presencia-ausencia) de especies en cada parcela por sitio de muestreo. La similitud de la composición de especies de helechos y licófitos en las áreas se comparó mediante el análisis no-paramétrico de similitudes (Anosim) (Clarke, 1993), cuya prueba para determinar las diferencias significativas se basó en el índice de Jaccard como una medida de distancia. Este índice es el más utilizado en análisis ecológicos cuando los datos son de incidencia (Legendre y Legendre, 1998). Además, se utilizó la corrección secuencial de Bonferroni para la prueba post-hoc (Zar, 1996). Para identificar cómo cada especie contribuye a la disimilitud se utilizó el análisis no-paramétrico SIMPER, que usa generalmente el valor de Bray-Curtis como medida de similitud (Clarke, 1993). Si bien este tipo de análisis emplea de forma general una variable cuantitativa para determinar la importancia, en este trabajo se utilizó la distancia euclidiana, y lo que se comparó fueron las frecuencias de las especies. Finalmente, se calculó el índice de biodiversidad taxonómica (IB), definido por el número de especies dividido entre el logaritmo natural del área en km2 (IB=S/lnA, donde S es el número de especies registradas y A el tamaño del área) (Ponce, Mehltreter y de la Sota, 2002; Squeo et al., 1998). Este índice fue empleado tanto para comparar la riqueza de la pteridoflora, entre los fragmentos de BMM estudiados, como con otros en la zona central de Veracruz. Los análisis se realizaron mediante los programas EstimateS Win 9.00 (Colwell, 2009), Statistica (StatSoft, versión 7) y la aplicación Past.exe (Hammer, Harper y Ryan, 2001).
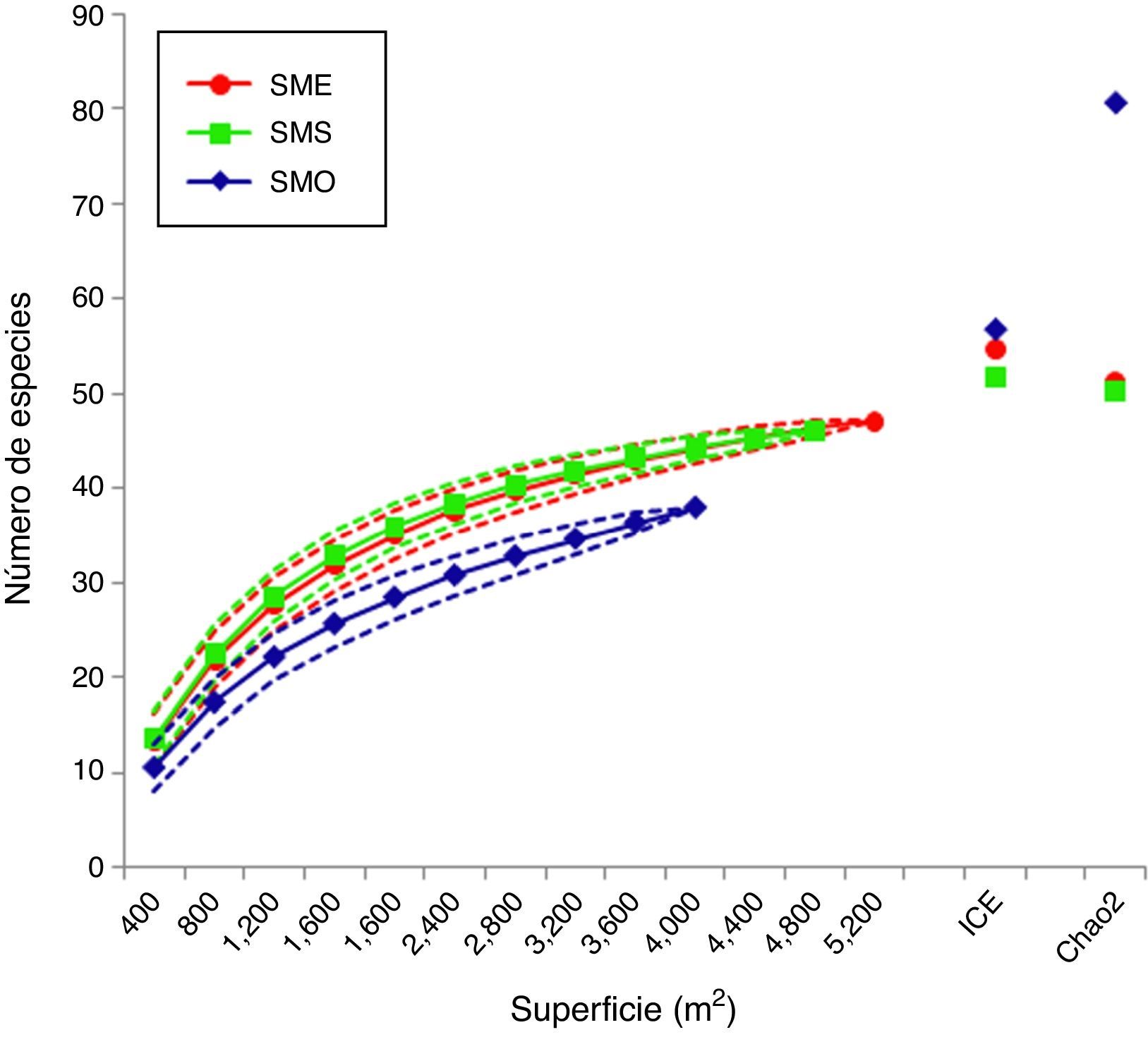
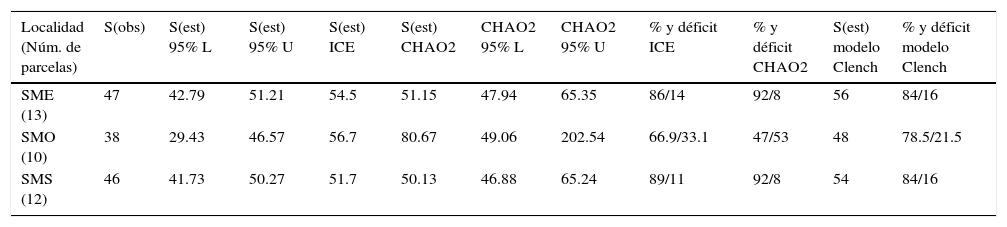
ResultadosLas curvas de acumulación de especies observadas se aproximaron a la asíntota esperada, con excepción de la de SMO (fig. 2). De acuerdo con el análisis de rarefacción, el traslape de los límites de confianza (95%) en SME y SMS muestra que las diferencias en la riqueza no fueron significativas, mientras que la disparidad del valor para SMO sí lo fue. De acuerdo con los estimadores de riqueza ICE y Chao2, el déficit de muestreo para SME y SMS fue del 8-14%, mientras que para SMO fue del 33-53% (tabla 1). Tanto para SME y SMS, los valores observados son muy similares a los de los límites de confianza inferiores, a diferencia de SMO. Sin embargo, se obtuvo un buen ajuste de las curvas al modelo de Clench para las 3 áreas (con un coeficiente de determinación R2=0.99). De acuerdo con este modelo, para que la curva alcance la asíntota, se estima la presencia de 56 especies en SME, 54 en SMS y 48 en SMO, de las cuales se registraron 47, 46 y 38, respectivamente (tabla 1). Por lo tanto, el déficit de muestreo correspondería al 16% para SME y SMS, y al 21.5% para SMO.
Riqueza de especies registradas S(obs) en cada área de estudio así como las estimadas S(est) por ICE, CHAO2 y el modelo de Clench, porcentaje/déficit del muestreo alcanzado para ICE, CHAO2 y el modelo de Clench, y límites de confianza.
| Localidad (Núm. de parcelas) | S(obs) | S(est) 95% L | S(est) 95% U | S(est) ICE | S(est) CHAO2 | CHAO2 95% L | CHAO2 95% U | % y déficit ICE | % y déficit CHAO2 | S(est) modelo Clench | % y déficit modelo Clench |
|---|---|---|---|---|---|---|---|---|---|---|---|
| SME (13) | 47 | 42.79 | 51.21 | 54.5 | 51.15 | 47.94 | 65.35 | 86/14 | 92/8 | 56 | 84/16 |
| SMO (10) | 38 | 29.43 | 46.57 | 56.7 | 80.67 | 49.06 | 202.54 | 66.9/33.1 | 47/53 | 48 | 78.5/21.5 |
| SMS (12) | 46 | 41.73 | 50.27 | 51.7 | 50.13 | 46.88 | 65.24 | 89/11 | 92/8 | 54 | 84/16 |
SME: ladera noreste San Martín Tuxtla; SMO: ladera suroeste San Martín Tuxtla; SMS: ladera suroeste Santa Marta.
En total se registraron 71 especies de helechos y 3 de licófitos, distribuidas en 37 géneros y 15 familias de acuerdo con la clasificación de Christenhusz et al. (2011) (apéndice). En la ladera noreste del volcán San Martín Tuxtla (SME) se encontraron 47 especies, distribuidas en 23 géneros y 11 familias; las familias con 5 o más especies fueron: Polypodiaceae (13 spp., 27%), Dryopteridaceae (9, 19%), Aspleniaceae e Hymenophyllaceae (6, 13% cada una). Los géneros mejor representados fueron Elaphoglossum (8, 17%) y Asplenium (6, 13%). La mayor parte de las especies fueron registradas como epífitas (32, 68%), y terrestres (6, 13%) (apéndice). En la ladera suroeste del volcán San Martín Tuxtla (SMO) se encontraron 38 especies, distribuidas en 20 géneros y 9 familias. Las familias con 5 o más especies fueron: Polypodiaceae (11, 29%), Dryopteridaceae (8, 21%) y Aspleniaceae (6, 16%). Los géneros mejor representados fueron Elaphoglossum y Asplenium (6, 16% cada uno). Las especies en su mayoría fueron epífitas (22, 58%), y terrestres (8, 21%). En la ladera suroeste de la sierra de Santa Marta (SMS) se encontraron 46 especies, distribuidas en 27 géneros y 12 familias. Las familias con 5 o más especies fueron: Polypodiaceae (21, 45%), Dryopteridaceae (8, 17%) e Hymenophyllaceae (5, 11%). Los géneros mejor representados fueron Elaphoglossum (7, 15%) y Pleopeltis (6, 13%). Las especies en su mayoría fueron epífitas (30, 65%), y terrestres (10, 22%). El IB, es decir, el número de especies con relación al área, osciló entre 4.58 a 5.49 para las 3 áreas de estudio (tabla 2).
Comparación de la riqueza y el índice de biodiversidad taxonómica (IB) para distintas áreas de bosque mesófilo de montaña (BMM) del centro del estado de Veracruz y las 3 áreas de estudio.
| Autor | Localidad/municipio | Altura (m) | Especies | Superficie (m2) | IB |
|---|---|---|---|---|---|
| Hernández-Rojas (2010) | Xocoyolapan, Tlalnelhuayocan | 1,500 | 39 | 1,000 | 5.64 |
| Carvajal-Hernández et al. (2014) | Loma de Santa Rita, Yecuatla | 1,200-1,300 | 53 | 1,200 | 7.47 |
| Carvajal-Hernández y Krömer (2015) | Los Capulines, Tlalnelhuayocan | 1,500 | 44 | 2,000 | 5.79 |
| Williams-Linera et al. (2005) | Parque Ecológico, Xalapa | 1,250 | 29 | 1,000 | 4.19 |
| Williams-Linera et al. (2005) | Las Cañadas, Huatusco | 1,340 | 34 | 1,000 | 4.92 |
| Williams-Linera et al. (2005) | Xolostla, Tlalnehuayocan | 1,450 | 21 | 1,000 | 3.04 |
| Williams-Linera et al. (2005) | Rancho Viejo, Tlalnelhuayocan | 1,500 | 34 | 1,000 | 4.92 |
| Williams-Linera et al. (2005) | Banderilla, Banderilla | 1,470 | 22 | 1,000 | 3.18 |
| Este estudio | San Martín Tuxtla noreste, San Andrés Tuxtla | 1,060-1,670 | 47 | 5,200 | 5.49 |
| Este estudio | San Martín Tuxtla suroeste, San Andrés Tuxtla | 1,060-1,660 | 38 | 4,000 | 4.58 |
| Este estudio | Santa Marta suroeste, Mecayapan | 1,000-1,570 | 46 | 4,800 | 5.43 |
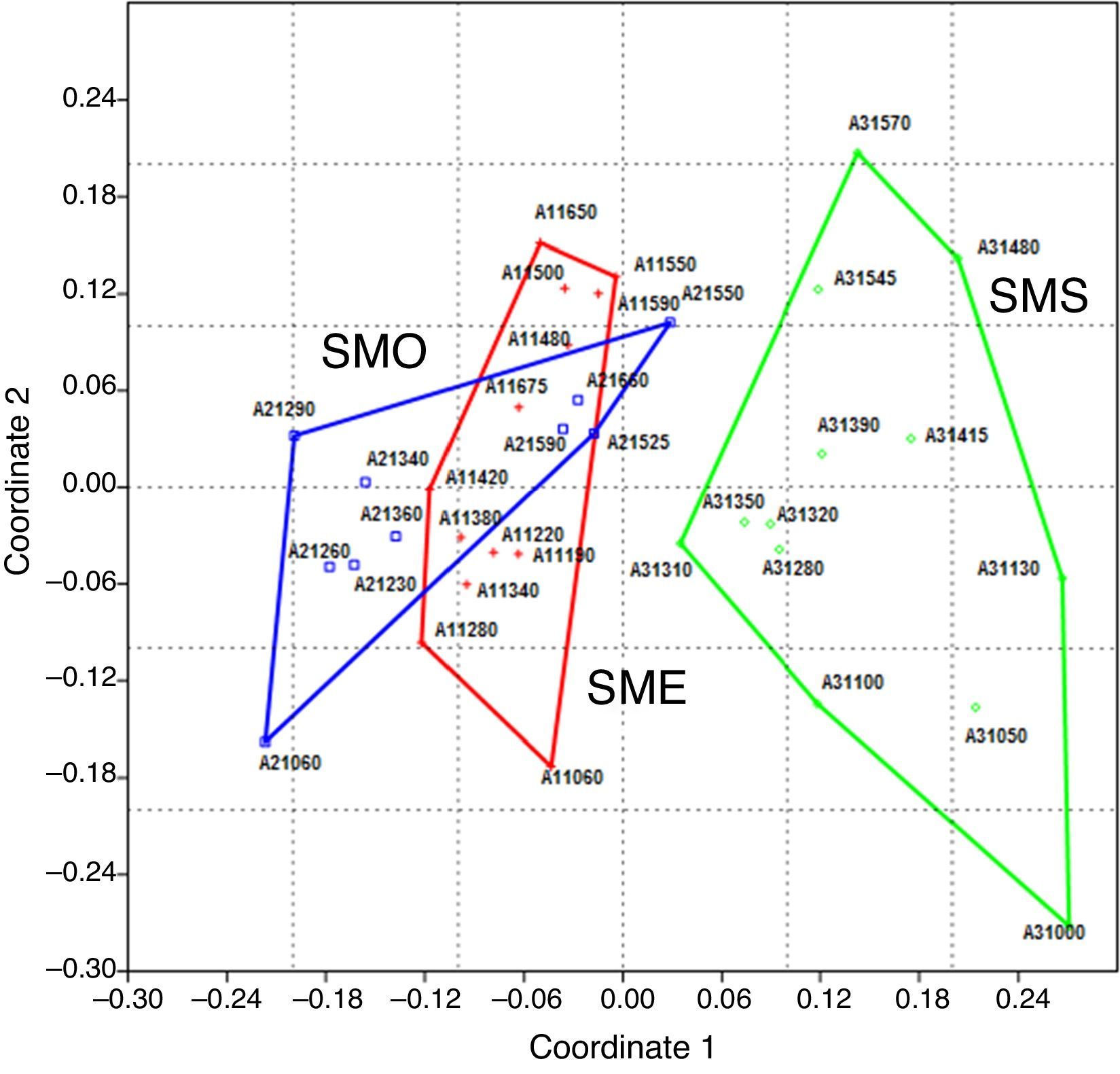
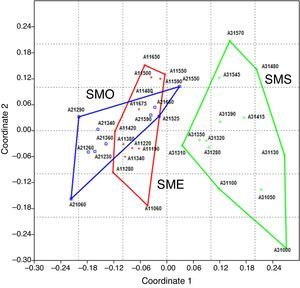
El análisis NMDS de la presencia/ausencia de las especies por parcela en las 3 áreas de estudio (fig. 3) muestra una marcada separación entre el ensamblaje de especies en el BMM en Santa Marta (SMS) con respecto a las áreas del BMM estudiadas en el volcán San Martín Tuxtla (SME y SMO) (stress: 0.1411). Esta separación es confirmada por el análisis Anosim, donde se indica una diferencia significativa entre las 3 áreas de BMM estudiadas (R=0.4014 global, p<0.001). Las comparaciones entre pares de áreas fueron significativamente distintas (p<0.001), tanto para SME-SMS (R=0.593) como para SMO-SMS (R=0.5325); mientras que entre las laderas opuestas del volcán San Martín Tuxtla (SME y SMO) la diferencia no fue significativa (R=0.073, p=0.3423). De forma particular para cada área de BMM estudiada, en SME y SMO las parcelas con mayor similitud son esencialmente aquellas dispuestas en las laderas altas entre 1,450 y 1,675m, mientras que las de los límites altitudinales inferiores son relativamente diferentes. Dicha relación entre altitud y ensamblaje de especies también se refleja en SMS, donde las parcelas entre 1,000 y 1,100m tienen mayor similitud, en segundo lugar las ubicadas entre 1,200 a 1,400m y finalmente las que se encuentran entre 1,480 y 1,570m (fig. 3).
Ordenación de las parcelas en el NMDS proyectado con el primer y el segundo eje. Los grupos marcados comprenden las parcelas de las 3 áreas: cruces rojas (SME) ladera noreste San Martín Tuxtla; cuadrados azules (SMO) ladera suroeste San Martín Tuxtla y círculos verdes (SMS), ladera suroeste Santa Marta, stress=0.1411.
El análisis de similitud (SIMPER) mostró una disimilitud total entre las 3 áreas de BMM del 19.5%. Estos valores están dados por la contribución de especies con frecuencias muy distintas y algunas exclusivas de cada área (tabla 3). En la comparación de áreas por pares encontramos que SME-SMO obtuvo un promedio de disimilitud del 15.1%, SME-SMS del 22.5%, y SMO-SMS del 20.8% (tabla 3). Estas diferencias se explican principalmente por la contribución porcentual de especies exclusivas (Pleopeltis polypodioides, Polypodium fraternum, Elapholossum pringlei y Blechnum occidentale registradas solo para SMS), o con frecuencias contrastantes entre áreas (tabla 3). El área que presentó el mayor número de especies exclusivas fue SMS (22), seguida de SME (10) y SMO (4). Por otro lado, las áreas de BMM estudiadas compartieron entre sí 19 especies (25.7%), de las cuales 8 fueron epífitas, 7 epífitas/terrestres, 3 epífitas/rupícolas y 1 terrestre.
Promedio de disimilitud, contribución de las especies que contribuyen al 57% de disimilitud entre áreas y contribución porcentual (%) por pares de localidades.
| Especies | Promedio disimilitud | Contribución % | Acumulativo % | Contribución porcentual (%) por pares de localidades | ||
|---|---|---|---|---|---|---|
| SME-SMO | SME-SMS | SMO-SMS | ||||
| Polypodium longepinnulatum | 0.641 | 3.28 | 3.28 | 3.82 | 3.299 | |
| Polypodium rhodopleuron | 0.5594 | 2.863 | 6.143 | 4.459 | 2.371 | 2.389 |
| Asplenium auriculatum | 0.5571 | 2.851 | 8.993 | 3.588 | 1.972 | |
| Asplenium cuspidatum | 0.5571 | 2.851 | 11.84 | 2.255 | 2.871 | 3.261 |
| Vittaria graminifolia | 0.5431 | 2.779 | 14.62 | 3.28 | 2.397 | 2.958 |
| Campyloneurum xalapense | 0.5315 | 2.719 | 17.34 | 3.332 | 2.465 | |
| Elaphoglossum vestitum | 0.5291 | 2.708 | 20.05 | 3.434 | 2.134 | 2.996 |
| Elaphoglossum sartorii | 0.5152 | 2.636 | 22.69 | 3.28 | 2.292 | 2.655 |
| Hymenophyllum polyanthos | 0.5105 | 2.612 | 25.3 | 3.178 | 2.345 | 2.579 |
| Elaphoglossum guatemalense | 0.5082 | 2.6 | 27.9 | 3.485 | 2.266 | 2.427 |
| Pleopeltis polypodioides | 0.4942 | 2.529 | 30.43 | 2.95 | 3.413 | |
| Elaphoglossum pringlei | 0.4825 | 2.469 | 32.9 | 3.082 | 3.413 | |
| Polypodium fraternum | 0.4825 | 2.469 | 35.36 | 3.082 | 3.413 | |
| Pteris orizabae | 0.4662 | 2.385 | 37.75 | 2.255 | 2.318 | 2.579 |
| Melpomene xiphopteroides | 0.4639 | 2.374 | 40.12 | 2.661 | 2.92 | |
| Pleopeltis collinsii | 0.4639 | 2.374 | 42.5 | 3.075 | 2.028 | 2.351 |
| Elaphoglossum erinaceum var. erinaceum | 0.4592 | 2.35 | 44.85 | 2.717 | 2.187 | 2.313 |
| Pecluma sursumcurrens | 0.4452 | 2.278 | 47.13 | 2.661 | 3.034 | |
| Cochlidium linearifolium | 0.4382 | 2.242 | 49.37 | 2.307 | 2.16 | 2.313 |
| Blechnum occidentale | 0.4289 | 2.195 | 51.56 | 2.74 | 3.034 | |
| Asplenium miradorense | 0.4149 | 2.123 | 53.69 | 3.793 | 3.082 | 2.958 |
| Phlegmariurus taxifolia | 0.4056 | 2.075 | 55.76 | 1.949 | 2.124 | |
| Scoliosorus ensiformis | 0.4033 | 2.063 | 57.82 | 3.537 | 2.397 | |
SME: ladera noreste San Martín Tuxtla; SMO: ladera suroeste San Martín Tuxtla; SMS: ladera suroeste Santa Marta.
Para las áreas SME y SMS se obtuvieron altos porcentajes de completitud (>84%), por lo cual el muestreo fue satisfactorio. Incluso para SMO, que presentó valores más bajos con relación a los estimadores de riqueza, se registraron el 79% de especies estimadas por el modelo de Clench (tabla 1). Los menores valores obtenidos por los estimadores no paramétricos se relacionan con el cálculo de la riqueza total pronosticada mediante la estimación de las especies no observadas, que se basa en el número de especies raras únicas (singletons) o duplicadas (doubletons) registradas dentro de las muestras (Chao, Chazdon, Colwell y Shen, 2005). Por lo tanto, en SMO existe una alta incidencia de especies únicas, lo que influye en un bajo porcentaje de especies pronosticadas. Esto podría estar relacionado con un menor tiempo de colonización y con un ambiente más seco en SMO, que promueve la escasez de hábitats favorables para los helechos, sobre todo los higrófilos como grammitidáceas e himenofiláceas (Krömer, García-Franco y Toledo-Aceves, 2014; Mehltreter, 2010). En este sentido, solo pocos individuos de ciertas especies con alta especificidad pudieron establecerse, y por lo tanto son raras.
El número de especies de helechos y licófitos registrados entre SME y SMS es muy similar, mientras que en SMO fue significativamente menor. Esto podría deberse al microclima más seco de SMO por el tipo de exposición de la ladera en sombra de lluvia. Este clima más seco se evidencia también por un menor número de especies epífitas, cuya diversidad y abundancia están fuertemente correlacionadas con la precipitación y el aumento de la humedad relativa (Kreft et al., 2004, 2010; Krömer, Acebey, Kluge y Kessler, 2013; Krömer, Kessler, Gradstein y Acebey, 2005). El hecho de que los BMM del volcán Santa Marta (SMS), que presentan también una exposición a barlovento, tengan una riqueza mayor a la ladera oeste del San Martín Tuxtla (SMO) podría deberse a su mayor estabilidad histórica relacionada con una mayor edad de sus suelos y bosques. Teóricamente, esta mayor edad permite la colonización de los nichos disponibles por parte de especies provenientes de fuentes cercanas, lo que ocurre de una forma paulatina a través de una escala de tiempo mayor (Emerson y Gillespie, 2008). Se sabe que las erupciones más recientes del volcán Santa Marta datan de hace 2.4 y 1.0 millones de años atrás, y están cubiertas por suelos de hasta 2m de espesor (Martín-del Pozzo, 1997). En contraste, las últimas erupciones del volcán San Martín Tuxtla ocurrieron en 1664 y 1793 (Lozoya, 1984). Especialmente esta última destruyó la vegetación de los flancos del volcán. En este sentido, a pesar de las condiciones relativamente secas de SMS, las especies han tenido mayor tiempo para establecerse.
Las similitudes en términos de riqueza de especies en SME y SMS, a pesar de las diferencias climáticas y con asociaciones distintas del BMM, coinciden con los resultados obtenidos por Hernández-Rojas (2010), quien también obtuvo valores de riqueza iguales o muy similares al comparar bosques diversos y mixtos con bosques dominados por Oreomunnea mexicana y Fagus, respectivamente. Así lo demuestra también el IB para las 3 áreas de este estudio, el cual oscila entre 4.58 y 5.49, muy similar a la variación de este mismo índice (4.92 a 5.79) calculado para algunas localidades de BMM natural en el municipio de Tlalnelhuayocan, región central de Veracruz (tabla 2), mientras que los valores más bajos (3,04 a 4,19) de dicho índice corresponden a 3 localidades (Parque Ecológico, Xolostla y Banderilla) cercanas a la ciudad capital de Xalapa (Williams-Linera, 2002), donde el BMM está sometido a un mayor impacto antrópico. Estudios recientes han demostrado que la riqueza de helechos y licófitos se pierde entre el 40 y el 70% en la vegetación perturbada o secundaria derivada de BMM (Carvajal-Hernández y Krömer, 2015; Carvajal-Hernández et al., 2014), por lo que su evaluación es un indicador confiable del estado de conservación del bosque.
El ordenamiento NMDS por parcelas para cada área distingue claramente entre la pteridoflora de SME y SMO del San Martín Tuxtla y SMS del Santa Marta, lo cual es corroborado por el análisis de similitud Anosim (R=0.4014 global, p<0.001). La diferencia de similitud florística más obvia es que SMS tiene casi el doble de especies de Polypodiaceae que las otras 2 áreas. Especialmente el género Pleopeltis fue el más numeroso después de Elaphoglossum en SMS, mientras que en SME y SMO fueron Elaphoglossum y Asplenium (apéndice). En su mayor parte Polypodiaceae se caracteriza por contener especies epífitas de dosel adaptadas a tolerar condiciones de sequía estacional (Hietz, 2010; Kessler, 2010; Watkins, Cardelus, Colwell y Moran, 2006). Parece ser que estas diferencias en la composición entre los volcanes San Martín Tuxtla y Santa Marta son reflejo de las diferencias climáticas a las que están sometidas las 3 áreas estudiadas. De acuerdo con el estudio de Krömer, Acebey, Kluge et al. (2013), la precipitación en SMS y SMO es menor comparada con SME, principalmente a menores altitudes, donde notaron además una menor cobertura de briófitas epífitas, la cual sirve como indicador de humedad atmosférica (Karger et al., 2012). Además, durante el invierno, la vertiente continental suroeste del volcán Santa Marta es más caliente y seca que la vertiente del golfo de México debido a que los «nortes» fríos y húmedos son interceptados por la sierra (Soto, 2004).
Las áreas del volcán San Martín Tuxtla (SME y SMO) comparten el 63% de las especies registradas. Las diferencias más notables en composición entre ambas áreas se dan hacia los límites inferiores del intervalo altitudinal (fig. 3). Esto podría deberse a que en SMO el clima es más contrastante por un mayor grado de intervención humana a menor altitud, mientras que en SME todavía existe un continuo de vegetación natural hacia las tierras bajas de la Estación de Biología Tropical, (Krömer, Acebey, Kluge et al., 2013). La mayor similitud de composición entre ambas áreas se da a partir de los 1,400m en las laderas altas del volcán, lo que está relacionado probablemente con su cercanía física, como lo mencionan Ruiz-Jiménez, Téllez-Valdés y Luna-Vega (2012) en su clasificación de los BMM de México a nivel de floras. No obstante, los helechos y licófitos por su alta capacidad de dispersión difieren en sus patrones de distribución comparados con los de las plantas con semilla, por lo cual no se pueden hacer generalizaciones a nivel regional (Sanginés-Franco, Luna-Vega, Alcántara-Ayala y Contreras-Medina, 2011). Incluso para algunas localidades de BMM no se ha encontrado una mayor similitud florística con relación a la cercanía (Ruiz-Jiménez et al., 2012; Carvajal-Hernández et al., 2014). Es decir, a pesar de su dispersión efectiva por esporas, factores climáticos e históricos, así como el disturbio antropogénico, tienen un papel preponderante para permitir su establecimiento (Karst, Gilbert y Lechowicz, 2005; Ruiz-Jiménez et al., 2012).
En concordancia con las diferencias en composición de especies, el análisis de SIMPER mostró disimilitud en los promedios de abundancia relativa de las especies. Las especies que marcan la disparidad fueron aquellas que reflejan las condiciones climáticas de cada área; por ejemplo, Asplenium auriculatum y Scoliosorus ensiformis en SME podrían tener altos requerimientos de humedad debido a que se encontraron asociadas a lugares umbrosos y húmedos (A.R. Acebey, obs. pers.). En SMO destacan especies terrestres probablemente relacionadas con preferencias específicas del suelo, por ejemplo, Asplenium miradorense y Asplenium achilleifolium. En SMS destacan especies generalistas (Hymenophyllum polyanthos y Melpomene xiphopteroides) y xerotolerantes (P. polypodioides), así como indicadoras del grado de perturbación antropogénica como B. occidentale, que es una especie de lugares abiertos y secundarios (Carvajal-Hernández et al., 2014; Mickel y Smith, 2004).
Las 3 áreas comparten una sola especie terrestre, Pteris orizabae, mientras que Polystichum mickelii se comparte entre SMO y SMS. Esta disimilitud se explica por la heterogeneidad en la composición de los suelos a nivel local y regional (Poulsen, Tuomisto y Balslev, 2006; Tuomisto y Poulsen, 1996; Tuomisto y Ruokolainen, 1994; Tuomisto, Ruokolainen, Poulsen, Mouran, Quintana, Cañas y Celi, 2002), dado que las partes altas de los volcanes San Martín Tuxtla y Santa Marta presentan tipos de suelos distintos (Campos, 2004; Flores-Delgadillo, Sommer-Cervantes, Alcalá-Martínez y Álvarez-Sánchez, 1999).
Finalmente, el grado de intervención humana afecta además de a la riqueza de especies a la composición de los helechos y licófitos en el BMM (Carvajal-Hernández y Krömer, 2015; Carvajal-Hernández et al., 2014), ya que las modificaciones en la estructura del bosque causan un microclima más seco y caliente por la mayor entrada de luz (Köster, Friedrich, Nieder y Barthlott, 2009; Paciencia y Prado, 2005). Por la larga historia de uso de la tierra y mayor densidad poblacional (Guevara et al., 2004), la sierra de Santa Marta, a diferencia del volcán San Martín Tuxtla, presenta una mayor cantidad de especies consideradas secundarias, tales como Pteridium caudatum, Sticherus palmatus, Macrothelypteris torresiana y Gleichenella pectinata. Asimismo, aunque algunas especies higrófilas estaban presentes en Santa Marta, su frecuencia fue más baja, confirmando así la sensibilidad de los helechos y licófitos a las condiciones microclimáticas (Krömer et al., 2014; Larrea y Werner, 2010).
Se concluye que la riqueza de especies de las asociaciones del BMM en los 2 volcanes fue similar, aunque esta puede variar considerablemente entre áreas de acuerdo con la orientación de la vertiente y sus condiciones ambientales. Estos factores afectan principalmente a la disimilitud en la composición entre ambos volcanes, lo que indica una diversidad beta alta, que enfatiza la importancia de la región de Los Tuxtlas para la conservación de estas plantas y la biodiversidad en general.
A E. Otto, A. Perez-Peña y E. Velasquez-Sinaca, así como a la gente del ejido Plan Agrario y los miembros del Grupo Ecoturístico «Los Clarines» en Ruiz Cortínez por su apoyo en el trabajo de campo. A J. T. Mickel y A. R. Smith por su apoyo con la identificación de ejemplares, a C. I. Carvajal-Hernández por la revisión del manuscrito y sus valiosos comentarios y a S. Armenta-Montero por la elaboración del mapa. A R. Coates y M. Ricker por el apoyo logístico en la EBT, UNAM. La investigación fue financiada con una beca doctoral del Conacyt (N.o 249766) otorgada a A. R. Acebey, así como una beca posdoctoral de la UNAM y fondos de PROMEP (PROMEP/103.5/07/2753) otorgados a T. Krömer.
FC=Formas de crecimiento según Grayum y Churchill (1987): E=epífita, He=hemiepífita, R=rupícola, T=terrestre, T (A): terrestre arborescente. La nomenclatura científica se uniformizó según el tratamiento de Christenhusz et al. (2011) y actualizaciones taxonómicas (Ebihara, Dubuisson, Iwatsuki, Hennequin e Ito, 2006; Jørgensen, Nee y Beck, 2014; Krömer, Acebey y Smith, 2013; Moran, Labiak y Sundue, 2010; Øllgaard, 2012; Salino, Almeida y Smith, 2015; Smith y Tejero-Díez, 2014).
| Familia/Taxón | FV | SME | SMO | SMS |
|---|---|---|---|---|
| Lycopodiaceae | ||||
| Phlegmariurus pithyoides (Schltdl. et Cham.) B. Øllg. | E | X | X | |
| Phlegmariurus pringlei (Underw. et F. E. Lloyd) B. Øllg. | E | X | X | |
| Phlegmariurus taxifolius (Sw.) Á. Löve et D. Löve | E | X | X | X |
| Aspleniaceae | ||||
| Asplenium abscissum Willd. | T,R | X | X | |
| Asplenium achilleifolium (M. Martens et Galeotti) Liebm. | T | X | ||
| Asplenium auriculatum Sw. | E | X | X | |
| Asplenium cuspidatum Lam. | T,E,R | X | X | X |
| Asplenium fragrans Sw. | T,E | X | ||
| Asplenium miradorense Liebm. | T,R | X | X | |
| Asplenium monanthes L. | T | X | ||
| Asplenium pteropus Kaulf. | E | X | ||
| Athyriaceae | ||||
| Diplazium striatastrum Lellinger | T | X | X | |
| Blechnaceae | ||||
| Blechnum appendiculatum Willd. | T | X | X | |
| Blechnum occidentale L. | T,R | X | ||
| Blechnum schiedeanum (Schltdl. ex C. Presl) Hieron. | T | X | ||
| Woodwardia spinulosa M. Martens et Galeotti | T | X | ||
| Cyatheaceae | ||||
| Alsophila firma (Baker) D. S. Conant | T | X | ||
| Dennstaedtiaceae | ||||
| Pteridium caudatum (L.) Maxon | T | X | ||
| Dryopteridaceae | ||||
| Arachniodes denticulata (Sw.) Ching | T | X | ||
| Elaphoglossum erinaceum (Fée) T. Moore var. erinaceum | E,R | X | X | X |
| Elaphoglossum glabellum J. Sm. | E | X | ||
| Elaphoglossum guatemalense (Klotzsch) T. Moore | E | X | X | X |
| Elaphoglossum muscosum (Sw.) T. Moore | E | X | ||
| Elaphoglossum peltatum (Sw.) Urb. fo. peltatum | E | X | X | |
| Elaphoglossum petiolatum (Sw.) Urb. | E | X | X | |
| Elaphoglossum pringlei (Davenp.) C. Chr. | E | X | ||
| Elaphoglossum sartorii (Liebm.) Mickel | E | X | X | X |
| Elaphoglossum vestitum (Schltdl. et Cham.) Schott ex T. Moore | E | X | X | X |
| Elaphoglossum viride (E. Fourn.) C. Chr. | T,E | X | X | |
| Mickelia bernoullii (Kuhn ex Christ) R. C. Moran, Labiak et Sundue | HE | X | ||
| Polystichum mickelii A. R. Sm. | T | X | X | |
| Gleicheniaceae | ||||
| Gleichenella pectinata (Willd.) Ching | T | X | ||
| Sticherus palmatus (W. Schaffn. ex E. Fourn.) Copel. | T | X | ||
| Hymenophyllaceae | ||||
| Didymoglossum hymenoides (Hedw.) Copel. | E | X | ||
| Hymenophyllum fucoides (Sw.) Sw. | E | X | X | |
| Hymenophyllum maxonii Christ ex C. V. Morton | E | X | X | |
| Hymenophyllum myriocarpum Hook. | E | X | ||
| Hymenophyllum polyanthos (Sw.) Sw. | E | X | X | X |
| Hymenophyllum trapezoidale Liebm. | E | X | ||
| Hymenophyllum tunbrigense (L.) Sm. | E | X | ||
| Polyphlebium hymenophylloides (Bosch) Ebihara et Dubuisson | E | X | ||
| Vandenboschia radicans (Sw.) Copel. | E | X | X | |
| Lomariopsidaceae | ||||
| Lomariopsis mexicana Holttum | HE | X | ||
| Lindsaeaceae | ||||
| Odontosoria schlechtendalii (C. Presl.) C. Chr. | T | X | ||
| Nephrolepidaceae | ||||
| Nephrolepis pectinata (Willd.) Schott | T | X | ||
| Polypodiaceae | ||||
| Campyloneurum angustifolium (Sw.) Fée | E | X | ||
| Campyloneurum xalapense Fée | E | X | X | X |
| Cochlidium linearifolium (Desv.) Maxon ex C. Chr. | E | X | X | X |
| Melpomene xiphopteroides (Liebm.) A. R. Sm. et R. C. Moran | E | X | X | X |
| Moranopteris trichomanoides (Swartz) R. Y. Hirai et J. Prado | E | X | ||
| Niphidium crassifolium (L.) Lellinger | E,R | X | ||
| Pecluma consimilis (Mett.) M. G. Price | E | X | X | X |
| Pecluma sursumcurrens (Copel.) M. G. Price | E | X | X | X |
| Phlebodium pseudoaureum (Cav.) Lellinger | T,E | X | X | X |
| Pleopeltis angusta var. stenoloma (Fée) Farw. | E | X | ||
| Pleopeltis collinsii (Maxon) A. R. Sm. et Tejero | E,R | X | X | X |
| Pleopeltis crassinervata (Fée) T. Moore | E | X | X | X |
| Pleopeltis furfuracea (Schltdl. et Cham.) A. R. Sm. et Tejero | E | X | ||
| Pleopeltis plebeia (Schltdl. et Cham.) A. R. Sm. et Tejero | E | X | X | X |
| Pleopeltis polypodioides var. acicularis (Weath.) E. G. Andrews et et Windham | E | X | X | |
| Polypodium echinolepis Fée | E | X | X | |
| Polypodium fraternum Schltl. et Cham. | E | X | ||
| Polypodium longepinnulatum E. Fourn. | E | X | X | X |
| Polypodium rhodopleuron Kunze | E | X | X | X |
| Serpocaulon triseriale (Sw.) A. R. Sm. | E | X | ||
| Stenogrammitis prionodes (Mickel et Beitel) Labiak | E | X | ||
| Pteridaceae | ||||
| Polytaenium feei (W. Schaffn. ex Fée) Maxon | E | X | ||
| Pteris orizabae M. Martens et Galeotti | T | X | X | X |
| Scoliosorus ensiformis (Hook.) T. Moore | E | X | X | |
| Vittaria flavicosta Mickel et Beitel | E | X | ||
| Vittaria graminifolia Kaulf. | E | X | X | |
| Thelypteridaceae | ||||
| Goniopteris paucipinnata (Donn. Sm.) Salino et T. E. Almeida | T | X | ||
| Goniopteris tuxtlensis (T. Krömer, Acebey et A. R. Sm.) Salino et T. E. Almeida | T | X | X | |
| Macrothelypteris torresiana (Gaudich.) Ching | T | X | ||
| Total 74 | 47 | 38 | 46 | |
La revisión por pares es responsabilidad de la Universidad Nacional Autónoma de México.