La variación de rasgos foliares integrantes de un tipo funcional de plantas (TFP) para conocer el desempeño de la planta en términos de carbono ha sido muy poco estudiado. El estudio determinó el TFP que mejor predice el carbono almacenado en la biomasa aérea del bosque seco del Caribe colombiano, a través de: a) evaluar 4 rasgos funcionales asociados a carbono, b) caracterizar y comparar los TFP de acuerdo con los rasgos y c) determinar el TFP que mejor predice carbono. En 5 parcelas permanentes de 1ha y árboles≥10cm de diámetro se midieron área foliar específica, contenido foliar de materia seca, concentración foliar de nitrógeno y concentración foliar de carbono. Con análisis de conglomerados jerárquico se obtuvieron 2 TFP. Los valores de carbono obtenidos en cada TFP y estimado por ecuación alométrica se compararon con el estimado para la comunidad arbórea de la parcela. El TFP1 fue el que mejor predijo el carbono para las 5 parcelas, con una tendencia de uso conservativo de recursos. El estudio contribuye a soportar medidas que incentiven la vinculación del bosque seco a mercados de carbono.
Functional traits variation, as part of a plant functional types (PFT) for knowing carbon plant performance, has been poorly studied. The objective of this research was to establish the best PFT for carbon store prediction, in aboveground biomass in Colombian Caribbean dry forest, through a) evaluation of 4 functional traits associated with the stored carbon, b) characterizing and comparing PFT according with the variation of functional traits, and c) to determine PFT that better predicts carbon. In 5 permanent parcels of 1ha, and trees with a diameter≥10cm, measurements of specific leaf area; leaf dry matter, leaf nitrogen concentration and leaf carbon concentration were taken. Two PFT were generated with analysis of hierarchical conglomerates. The obtained values of carbon in every single PFT, and estimated by the allometric equation are compared with the estimated for the arboreal community of the parcel. The PFT 1 was the best carbon predictor in the 5 parcels with conservative use of resources. This study contributes to support actions over the entailment of dry forest in carbon markets.
Los tipos funcionales de plantas (TFP) pueden ser definidos como conjuntos de especies que exhiben respuestas similares a condiciones ambientales y tienen efectos análogos en procesos ecosistémicos dominantes (Lavorel, McIntyre, Landsberg y Forbes, 1997). Agrupar especies de plantas sobre la base de rasgos funcionales puede aportar información sobre la contribución relativa de cada rasgo a la biomasa total del ecosistema (Hoorens, Stroetenga y Aerts, 2010). La variación interespecífica de los rasgos puede ayudar en la clasificación de especies de plantas en TFP (Díaz y Cabido, 1997; Powers y Tiffin, 2010; Semanova y van der Maarel, 2000). Estos grupos se definen a partir de los rasgos funcionales que mejor describen la función de interés (Fonseca y Ganade, 2001).
La contribución de la diversidad de especies a los procesos ecosistémicos ha sido abordada en varios estudios. Por un lado, se postula que la diversidad afecta procesos ecosistémicos como la fijación de carbono. Comunidades con alta diversidad de especies (Tilman, 1999) o rasgos funcionales (Díaz et al., 2011) hacen un uso óptimo de recursos disponibles debido a la alta diferenciación de nichos y facilitación interespecífica, por lo cual la diversidad puede incrementar la biomasa de la comunidad (Zhang, Chen y Reich, 2012). Otro acercamiento postula que los efectos de las especies o de los rasgos de las especies son proporcionales a su abundancia. En este sentido, los efectos de especies raras sobre procesos ecosistémicos son menores respecto a los efectos de especies y sus rasgos dominantes (Grime, 1998), lo que indicaría que comunidades dominadas por especies adquisitivas de rápido crecimiento tendrían mayor cantidad de biomasa y alta área foliar específica (AFE) como resultado de una alta captación de luz a través de fotosíntesis y una alto ingreso de carbono (Poorter y Bongers, 2006). Estas 2 formas de representar la diversidad sugieren alternativas de análisis por las cuales las variables de comunidad afectan los procesos del ecosistema.
Se sabe que algunos rasgos de hoja capturan muchos aspectos fundamentales de la economía foliar asociada a la dinámica del carbono. Rasgos como concentración foliar de nitrógeno (NF), AFE, concentración foliar de carbono (CF) y contenido foliar de materia seca (CFMS) están asociados con alto ingreso de carbono, a través de la fotosíntesis (Conti y Díaz, 2013; Finegan et al., 2015; Ruiz-Jaen y Potvin, 2011; Wright et al., 2004). Las combinaciones de rasgos de AFE y NF como componentes de especies pueden tener un impacto significativo sobre la productividad primaria y ciclo de nutrientes a nivel de ecosistema (Aerts y Chapin, 2000; Cornelissen et al., 1999; Reich, Walters y Ellsworth, 1992). Estos 2 rasgos están relacionados con el tiempo de vida de la hoja y podrían predecir con precisión la máxima tasa fotosintética de un amplio rango de especies (Reich, Walters y Ellsworth, 1997). Sin embargo, pocos avances se han logrado con el uso de rasgos funcionales de plantas como integrantes de TFP para predecir carbono. En China, se identificaron 8 tipos funcionales mediante rasgos vegetativos, regenerativos, fenológicos y fisiológicos para evaluar 3 funciones ecosistémicas entre ellas, el almacenamiento de carbono; este estudio utilizó análisis de correspondencia para identificar los TFP (Wang y Ni, 2005). En el ártico se evaluaron 21 rasgos, entre ellos, masa foliar y concentración NF para predecir efectos y respuesta de la vegetación sobre los procesos ecosistémicos; un análisis de clúster permitió agrupar en TFP las 37 especies evaluadas (Chapin, Bret-Harte, Hobbie y Zhong, 1996).
El bosque tropical almacena más carbono que los bosques templados y boreales y su estudio es fundamental para contribuir a la comprensión del ciclo global del carbono y el cambio climático (Bonan, 2008). Los avances en investigación sobre este tema se han desarrollado principalmente en bosque húmedo tropical y han buscado mejorar las estimaciones de carbono en biomasa aérea (CBA) mediante modelos alométricos (Chave et al., 2014); menor número de estudios han relacionado la diversidad funcional con carbono almacenado en biomasa y productividad en el trópico húmedo (Finegan et al., 2015; Lohbeck, Poorter, Martínez-Ramos y Bongers, 2015), mientras que para el bosque seco son aún más escasos los análisis de estas relaciones (Becknell y Powers, 2014; Prado-Junior et al., 2016). Los bosques secos de Colombia son los ecosistemas más amenazados, quedando una extensión no mayor a 717,000ha en el país. En el Caribe colombiano se encuentra el 51% del total nacional y los mayores remanentes en mejor estado de conservación (Pizano y García, 2014). Sin embargo, se desconoce la dinámica del carbono en este ecosistema.
Una posible forma de aproximarse al carbono almacenado en los bosques secos y su relación con la diversidad funcional es a través de la definición de TFP. Las especies que comparten varios atributos pueden conformar un tipo funcional y ser definidos respecto a su contribución a procesos ecosistémicos (Lavorel et al., 2007) como la fijación de carbono. Así que agrupar especies de plantas sobre la base de rasgos funcionales puede aportar información sobre la contribución relativa de cada rasgo a la biomasa total del ecosistema (Hoorens et al., 2010). En este marco se plantea como pregunta de investigación: ¿es posible obtener TFP a partir de rasgos asociados a carbono en el bosque seco del Caribe colombiano? El objetivo de este estudio fue determinar el TFP que mejor predice el carbono almacenado en biomasa aérea en el bosque seco del Caribe colombiano, a través de: a) evaluar 4 rasgos funcionales asociados a carbono almacenado, b) caracterizar y comparar los TFP obtenidos de los rasgos asociados a carbono y c) determinar el TFP que mejor predice carbono.
Materiales y métodosEl estudio se realizó en 5 parcelas permanentes de 1ha del bosque seco del Caribe colombiano (fig. 1). Se seleccionaron estas parcelas porque disponen de bases de datos sobre inventarios forestales realizados entre 2007-2012 (Álvarez, Benítez, Velásquez y Cogollo, 2013) y permitieron estimar el CBA. La región tiene una temperatura media anual que varía entre 26 y 29°C; su precipitación media anual está entre 1,000 y 1,245mm, es bimodal, con 4 meses de sequía, de diciembre a marzo, con menos de 100mm por mes (IDEAM, 2014). El rango altitudinal está entre 2 a 800m snm. Las parcelas se encuentran ubicadas en los bosques del Ecoparque Los Besotes (10°53′N, 73°3′O), la hacienda El Ceibal (10°68′N 75°3′O), la Reserva Natural Kalashe (11°26′N 74°1′O), el Parque Nacional Islas del Rosario (10°16′N 75°40′O) y la Reserva Natural Sanguaré (9°71′N 75°7′O) (de aquí en adelante Besotes, Ceibal, Kalashe, Islas del Rosario y Sanguaré); fueron establecidas en la década pasada con el apoyo de varias instituciones colombianas (Álvarez et al., 2013) y cuya información es actualmente administrada desde la plataforma FORESTPLOTS.net del proyecto RAINFOR. Las 3 primeras están ubicadas en fragmentos de bosque natural. La parcela Islas del Rosario se encuentra en bosques secundarios regenerados a partir de huertos agroforestales caseros. Finalmente, la parcela Sanguaré fue un potrero arbolado denso.
La composición florística se obtuvo a partir del inventario de todos los árboles con diámetro a la altura del pecho>10cm.
Se seleccionaron 4 rasgos funcionales asociados a almacenamiento de carbono, a saber: 1) AFE, 2) concentración NF (Becknell y Powers, 2014), 3) CFMS (Garnier et al., 2004) y 4) concentración CF (Sandquist y Cordell, 2007). Las especies muestreadas in situ fueron las siguientes: en Besotes, Anacardium excelsum (Kunth) Skeels, Aspidosperma dugandii Standl, Astronium graveolens Jacq, Brossium utile (Kunth) Pittier y Hura crepitans L.; en Ceibal, Astronium graveolens Jacq, Brossium utile (Kunth) Pittier, Capparis odorota, Capparis odoratissima Jacq. y Guazuma ulmifolia Lam; en Islas del Rosario, Astronium graveolens Jacq, Capparis odoratissima Jacq., Crecentia cujete L., Manilkara sapota (L.) P. Royen. y Gliricidia sepium (Jacq.) Walp.; en Kalashe, Anacardium excelsum (Kunth) Skeels, Brosimum utile (Kunth) Pittier, Guazuma ulmifolia Lam., Maclura tinctoria (L) D. Don ex Steud y Sterculia apetala (Jacq.) H. Karts.; en Sanguaré, Enterolobium cyclocarpum (Jacq.) Griseb, Guazuma ulmifolia Lam., Nectandra cuspidata Nees y Mart, Spondias mombin L. y Sterculia apetala (Jacq.) H. Karts. Las hojas se recolectaron en campo entre los meses de febrero y marzo de 2014, durante el periodo de sequía, en el que solo algunas especies conservan sus hojas. En consecuencia, los rasgos se midieron y se caracterizaron en solo 5 especies perennifolias con diámetro a la altura del pecho >10cm; de cada especie se seleccionaron aleatoriamente 5 individuos (Castellanos-Castro y Newton, 2015; Pérez-Harguindeguy et al., 2013). Para los casos donde el número de individuos por especie en la parcela fue inferior a 5, las muestras foliares se buscaron en sitios adyacentes con proximidad máxima de 200m.
Para el muestreo de rasgos foliares se tomaron 5 hojas por árbol; cada hoja se hidrató en un tubo con agua y se marcó con un código. El conjunto de hojas hidratadas se almacenó en una bolsa térmica, previamente depositada durante 8h en refrigerador, a 4°C. Las muestras permanecieron en promedio 3h en la bolsa a 4°C, mientras se recolectaba el resto de la jornada (Pérez-Harguindeguy et al., 2013). Cada hoja, incluyendo el peciolo, se secó y se pesó en balanza electrónica con precisión de 0.01g (BSH 6000); el AFE y el CFMS incluyeron el peciolo; enseguida se realizó un registro fotográfico con cámara digital (fig. 2); con el uso del programa ImageJ se determinó el área foliar. Posteriormente, cada hoja se introdujo en bolsas de papel marcadas para depositarlas en horno de secado a 70°C por 72h; enseguida se obtuvo la masa seca con uso de la balanza. La concentración de NF y de CF se determinó con analizador elemental TruSpec marca Leco, en los laboratorios de Corpoica (Mosquera, Cundinamarca, Colombia).
El análisis de datos se realizó con el programa estadístico SPSS, versión 21 (George y Mallery, 2012). Se evaluó la normalidad de los datos a través de la prueba de Kolmogorov-Smirnov; los valores de carbono no presentaron distribución normal por lo que se aplicó la prueba de Kruskal y Wallis para determinar si los datos provienen de la misma población o de poblaciones idénticas con la misma mediana; se estimó la media, mediana, desviación estándar, valor mínimo y máximo de cada rasgo; se aplicó la prueba de Chi-cuadrada para identificar si hay diferencias de los rasgos entre individuos y especies. Se aplicó la prueba F para determinar diferencias significativas de rasgos entre parcelas; asimismo, se adelantó el análisis de correlación de Spearman para identificar correlaciones entre los rasgos medidos en las 5 parcelas.
Los TFP se obtuvieron mediante el análisis de conglomerados jerárquico, utilizando la media por especie de cada rasgo medido; se utilizó el método de vinculación de Ward o vinculación intergrupos (Ward, 1963) y la distancia euclideana; se aplicó la prueba de Levene para determinar homocedasticidad de los datos y la t de Student para comprobar diferencias entre los TFP obtenidos. Además, con el fin de confirmar los grupos encontrados se realizó un análisis discriminante; este permite establecer cuáles rasgos son los que tienen más peso discriminante en la diferenciación de los grupos (Balzarini y di Rienzo, 2004).
Para comparar el carbono almacenado por cada TFP se utilizó como dato de referencia el carbono total por parcela, que corresponde a la suma de biomasa aérea de todos los individuos de la parcela multiplicado por un factor de 0.5 (Brown, 1997); la biomasa de cada individuo se obtuvo a través de la ecuación alométrica de Álvarez et al. (2012), desarrollada para las mismas parcelas de estudio, la cual tiene un error estándar residual de 0.336 y R2 de 0.958, a saber:
ln (AGB)=−3.652−1.697 ln (D)+1.169 (ln (D))2−0.122 (ln (D))3+1.285 ln(ρ).
Donde, AGB: biomasa aérea (Mgha-1), D: diámetro a la altura del pecho (cm) y ρ, densidad de la madera (g/cm3). El carbono de cada TFP por parcela se obtuvo mediante la sumatoria de biomasa de las especies de cada grupo, el resultado se multiplicó por 0.5 para obtener el carbono de cada tipo funcional.
Con el fin de evaluar cuál de los tipos funcionales tiene mayor capacidad de predecir carbono a nivel de parcela en el bosque seco, se realizó un modelo lineal generalizado (Lane, 2002). Con los valores de rasgos de cada individuo integrante del TFP y los valores de carbono estimados para el individuo se realizó una regresión lineal; el método empleado fue paso a paso; se utilizó coeficiente de determinación (R2) como criterio de decisión en la asociación; el coeficiente de determinación ajustado se empleó como criterio final para elegir el mejor modelo, dado que no está influenciado por el número de variables; el error típico de predicción indicó la parte de la variable dependiente que se deja de explicar.
ResultadosDurante la estación seca se identificaron 16 especies perennifolias en las parcelas estudiadas. Las especies fueron: A. graveolens (diomate), A. dugandii (carreto), B. utile (guaimaro), H. crepitans (ceiba), G. sepium (matarraton), G. ulmifolia (guácimo), E. cyclocarpum (orejero), S. mombin (hobo), A. excelsum (caracolí), S. apetala (camajón), C. odoratissima (olivo), C. odorata (blanco), C. cujete L. (totumo), M. tinctoria (dinde), M. sapota (níspero) y N. cuspidata (laurel).
En algunos casos los rasgos medidos tuvieron una considerable variación. El AFE estuvo en el rango 65.58 y 367.59 (cm2/g); esta diferencia resultó de altos valores de AFE de M. tinctoria, respecto a bajos en C. odoratissima; mientras que el CF presentó un valor mínimo del 34.74% (C. odorata) y máximo del 52.91% (S. apetala); el NF presentó poca variación, menor que 1.02 (M. sapota) a 5.31% (E. cyclocarpum). Finalmente, el CFMS fluctuó entre 0.14 (H. crepitans) y 0.56 (mg g-1) (A. graveolens) (tabla 1). Se encontraron diferencias significativas entre especies (tabla 2) para todos los rasgos medidos; mientras que entre árboles por especie no hubo variación significante.
Valores mínimos, máximos, media, mediana y desviación estándar en 5 parcelas del bosque seco del Caribe colombiano.
| Rasgo | n | Media | Mediana | DE | Mínimo | Máximo |
|---|---|---|---|---|---|---|
| AFE (cm2/g) | 125 | 156.48 | 134.98 | 68.83 | 65.58 | 367.59 |
| CF (%) | 125 | 42.98 | 43.05 | 3.57 | 34.74 | 52.91 |
| NF (%) | 125 | 2.38 | 2.22 | 0.77 | 1.02 | 5.31 |
| CFMS (mg g-1) | 125 | 0.37 | 0.38 | 0.09 | 0.14 | 0.56 |
AFE: área foliar específica; CF: concentración de carbono foliar; CFMS: contenido foliar de materia seca; DE: desviación estándar; NF: concentración de nitrógeno foliar.
Análisis de varianza de 4 rasgos funcionales en especies e individuos en 5 parcelas del bosque seco del Caribe colombiano.
| Rasgos | Especies | Árboles | ||
|---|---|---|---|---|
| Chi-cuadrada | p | Chi-cuadrada | p | |
| AFE | 77.38 | 0.00 | 113.24 | 0.37 |
| CF | 97.25 | 0.00 | 116.41 | 0.30 |
| NF | 75.78 | 0.00 | 117.69 | 0.27 |
| CFMS | 61.53 | 0.00 | 111.21 | 0.42 |
AFE: área foliar específica; CF: concentración de carbono foliar; CFMS: contenido foliar de materia seca; NF: concentración de nitrógeno foliar.
En negritas, los valores fueron significativos para todos los rasgos (p<0.05).
Entre parcelas se evidencia cierta variación. El AFE fue significativamente diferente entre parcelas, siendo más alta en Kalashe e islas del Rosario (tabla 3); el CF también fue significativamente diferente, siendo mayor en Sanguaré y menor en Kalashe; la concentración de NF no presentó diferencias significativas entre sitios; el CFMS máximo se obtuvo en Ceibal (0.45mg/ g) y el menor en Sanguaré (0.33mg/g) y presentó diferencias significativas entre sitios.
Media de rasgos funcionales, desviación estándar y Anova para 5 parcelas del bosque seco del Caribe colombiano.
| Rasgo funcional | Besotes | El Ceibal | Islas del Rosario | Kalashe | Sanguaré | F | p | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| x | DE | x | DE | x | DE | x | DE | x | DE | |||
| AFE (cm2/g) | 145.05 | (±50.50) | 114.16 | (±37.87) | 174.87 | (±72) | 178.3 | (±68.13) | 170.02 | (±63.42) | 4.25 | 0.00* |
| CF (%) | 44.15 | (±3.28) | 42.05 | (±4.43) | 42.00 | (±3.38) | 41.59 | (±2.64) | 45.11 | (±1.21) | 5.43 | 0.00* |
| NF (%) | 2.60 | (±1.05) | 2.21 | (±0.15) | 2.22 | (±0.67) | 2.28 | (±0.53) | 2.58 | (±0.65) | 1.59 | 0.18 |
| CFMS (mg g-1) | 0.36 | (±0.11) | 0.45 | (±0.04) | 0.34 | (±0.09) | 0.39 | (±0.06) | 0.33 | (±0.04) | 7.86 | 0.00* |
AFE: área foliar específica; CF: concentración de carbono foliar; CFMS: contenido foliar de materia seca; DE: desviación estándar; F: valor prueba F; NF: concentración de nitrógeno foliar; p: valor p; x: media.
Correlaciones significativas se encontraron entre los rasgos de las plantas (tabla 4): AFE y NF estuvieron positivamente correlacionadas (rs=0.35; p=0.00); en contraste AFE y CFMS se correlacionaron negativamente (rs=−0.43; p=0.00), así como NF y CFMS (rs=−0.24; p=0.00). Los resultados sugieren que hojas con alta AFE tienen altos contenidos de NF y bajos de CFMS como se observó en M. tinctoria, G. ulmifolia y C. cujete.
Correlaciones de Spearman para los rasgos funcionales medidos en 5 parcelas de muestreo del bosque seco del Caribe colombiano.
| rs | p | |
|---|---|---|
| AFE-CF | −0.000 | 0.980 |
| AFE-NF | 0.350 | 0.000** |
| AFE-CFMS | −0.430 | 0.000** |
| CF-NF | −0.014 | 0.873 |
| CF-CFMS | 0.001 | 0.993 |
| NF-CFMS | −0.246 | 0.006** |
AFE: área foliar específica; CF: concentración de carbono foliar; CFMS: contenido foliar de materia seca; NF: concentración de nitrógeno foliar; p: nivel de significación; rs: coeficiente de correlación de Spearman.
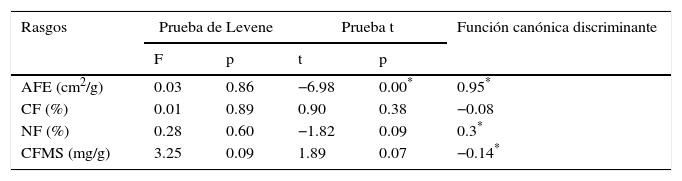
A partir de los rasgos analizados por especie, se encontraron 2 TFP bien diferenciados (fig. 3). El TFP1 quedó integrado por 10 especies; se compone de especies con tendencia conservativa de recursos, con baja AFE y alto CFMS (tabla 5); presenta intervalos intermedios para CF (37.22-48.19%) y bajos para NF (1.32-3.51%); ejemplos de especies de este grupo son A. excelsum, C. odorata, A. dugandii y E. cyclocarpum. El TFP2 está conformado por 6 especies, tiene rangos altos de AFE y baja CFMS (tabla 5); tiene valores intermedios de CF (38.61-46.7%) y altos de NF (1.83-4.13%); especies con estas características son C. cujete, G. sepium y N. cuspidata. Los 2 TFP presentaron varianzas homogéneas con la prueba de Levene (tabla 6) porque para todos los rasgos el valor p resultó mayor que 0.05; se encontraron diferencias significativas solamente para AFE (prueba t=−6.98, p=0.00). La función canónica discriminante evidencia que las variables con alto coeficiente, en valor absoluto, tuvieron alto poder discriminante; es decir, el AFE (0.95) es el rasgo más importante en la separación de los 2 TFP obtenidos; esto puede ser explicado por los altos valores de AFE que integraron el TFP2 con especies con tendencia adquisitiva y de rápido crecimiento como G. ulmifolia, C. cujete y G. sepium; mientras que en el TFP1 la tendencia de las especies fue conservativa con valores bajos de AFE como E. cyclocarpum, C. odorata y C. odoratissima, entre otras.
Media, mediana, valores máximos y mínimos y desviación estándar de TFP en 5 parcelas del bosque seco del Caribe colombiano.
| Rasgo | Media | Mediana | Mínimo | Máximo | DE | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| TFP1 | TFP2 | TFP1 | TFP2 | TFP1 | TFP2 | TFP1 | TFP2 | TFP1 | TFP2 | |
| AFE (cm2/g) | 120.45 | 229.4 | 115.8 | 221.91 | 76.4 | 196.89 | 161.7 | 283.57 | 29.08 | 32.14 |
| CF (%) | 43.41 | 41.83 | 44.41 | 41.2 | 37.22 | 38.46 | 48.19 | 46.90 | 3.42 | 3.34 |
| NF (%) | 2.19 | 2.82 | 2.26 | 2.68 | 1.32 | 1.83 | 3.51 | 4.13 | 0.60 | 0.76 |
| CFMS (mg/g) | 0.38 | 0.30 | 0.38 | 0.33 | 0.26 | 0.17 | 0.45 | 0.40 | 0.05 | 0.09 |
AFE: área foliar específica; CF: concentración de carbono foliar; CFMS: contenido foliar de materia seca; DE: desviación estándar; NF: concentración de nitrógeno foliar; TFP: tipo funcional de planta.
Prueba de Levene, prueba t, y función canónica discriminante de los rasgos calculados de acuerdo con los valores mostrados por las especies dentro de cada tipo funcional.
| Rasgos | Prueba de Levene | Prueba t | Función canónica discriminante | ||
|---|---|---|---|---|---|
| F | p | t | p | ||
| AFE (cm2/g) | 0.03 | 0.86 | −6.98 | 0.00* | 0.95* |
| CF (%) | 0.01 | 0.89 | 0.90 | 0.38 | −0.08 |
| NF (%) | 0.28 | 0.60 | −1.82 | 0.09 | 0.3* |
| CFMS (mg/g) | 3.25 | 0.09 | 1.89 | 0.07 | −0.14* |
AFE: área foliar específica; CF: concentración de carbono foliar; CFMS: contenido foliar de materia seca; F: valor prueba F; NF: concentración de nitrógeno foliar; p: valor p.
El TFP1 fue el que mostró mayor contenido de carbono por parcela, mientras que el TFP2 presentó menores valores (tabla 7). El modelo relacionó el CBA con los valores de rasgos funcionales para los TFP1 y TFP2 (tabla 8); el primer modelo para TFP1 es de tipo simple; los rasgos CFMS (0.00) y NF (0.015) explicaron el CBA; el coeficiente de determinación (R2) como criterio de decisión en la asociación fue de 0.18; el coeficiente de determinación ajustado (R2=0.161) se empleó como criterio final para elegir el mejor modelo, dado que no está influenciado por el número de variables; el error típico o parte del CBA no explicado por los rasgos CFMS y NF es del 23%. El modelo encontrado con el TFP1 parece sugerir que por cada incremento en un mg/g de CFMS, el CBA disminuye en 1.263kg/ha, mientras que por aumento en 1% de NF el CBA disminuye en 0.092kg. En el segundo modelo, para TFP2, ninguno de los rasgos explicó el CAB, porque las variables no fueron significativas; la tendencia que muestra el modelo del TFP1 puede explicarse porque en 2 parcelas (El Ceibal y Kalashe) se observan valores altos de CFMS con respecto a bajos valores de carbono almacenado en la biomasa aérea.
Comparación por parcela entre el carbono almacenado (Mg/ha) para cada tipo funcional, en 5 parcelas del bosque seco del Caribe colombiano.
| Tipo funcional/total parcela | Besotes | El Ceibal | Isla Rosario | Kalashe | Sanguaré | Media |
|---|---|---|---|---|---|---|
| 1 | 12.01 | 4.38 | 35.35 | 8.20 | 14.47 | 14.88 |
| 2 | 4.17 | 5.86 | 7.45 | 7.10 | 7.76 | 10.78 |
| Total parcela | 34.37 | 33.52 | 54.70 | 44.05 | 46.07 | 42.54 |
Modelación de carbono en biomasa aérea mediante tipo funcional de plantas 1 y 2.
| Modelo | R2 | R2 corregida | p | n | e |
|---|---|---|---|---|---|
| Modelo general: TFP1 | |||||
| CBA=0.889−1.263CFMS−0.092NF | 0.181 | 0.161 | Constante: 0.00 | 85 | 0.23 |
| CFMS: 0.00 | |||||
| NF: 0.015 | |||||
| Modelo general TFP2 | |||||
| CBA=−0.573−0.001AFE+0.024CF+0.013NF−0.572CFMS | 0.137 | 0.038 | 40 | 0.26 | |
| Constante: 0.434 | |||||
| AFE: 0.486 | |||||
| CF 0.120 | |||||
| NF: 0.863 | |||||
| CFMS: 3.04 |
AFE: área foliar específica; CBA: carbono en biomasa aérea; CF: concentración de carbono foliar; CFMS: contenido foliar de materia seca; e: error típico de predicción; n: número de muestras; NF: concentración de nitrógeno foliar; p: nivel de significación; R2: coeficiente de determinación; TFP: tipo funcional de plantas.
Durante el periodo seco del área estudiada se identificaron 2 TFP bien diferenciados, asociados a carbono. El AFE fue el rasgo principal que determinó la separación de los TFP; el TFP1 quedó integrado por 10 especies con baja AFE y alto CFMS (conservativas); mientras que TFP2 está conformado por 6 especies con alto AFE y baja CFMS (adquisitivas); el TFP1 fue el que mejor predijo carbono. El TFP1 se caracteriza por hojas pesadas y con alto contenido de lignina, por lo cual las de este grupo son más resistentes y duraderas; una hoja densa está relacionada con alto contenido de agua por unidad de masa seca (Garnier y Laurent, 1994), lo que refleja inversión de altas cantidades de energía en la protección de la hoja para garantizar su larga vida; probablemente su baja AFE y hojas gruesas le permiten permanecer en funcionamiento durante el periodo de sequía. Estos resultados coinciden con los hallados por Prado-Junior et al. (2016) en bosque seco de Brasil. Posiblemente, los bajos contenidos de NF y CF hacen tener bajas tasas fotosintéticas y dedicar recursos a almacenar reservas y soportar el tronco del árbol, lo que indicaría que el balance de carbono está controlado por la capacidad bioquímica (Farquhar, von Caemmerer y Berry, 1980); los bajos valores de NF, CF y AFE en especies como A. graveolens que representan el 62.50% de la biomasa, en Islas del Rosario, sugieren que hay una relativa baja capacidad bioquímica para ganar carbono (Sandquist y Cordell, 2007).
El TFP2 con altos AFE, NF y CF así como bajo CFMS coincide con estrategias adquisitivas. Son especies con rápida adquisición de nutrientes, con hojas más delgadas ricas en nitrógeno y en carbono foliar y crecimiento rápido; es el caso de M. tinctoria que maximiza la captura de recursos para realizar fotosíntesis por unidad foliar y la invierte en carbono almacenado en la planta (Poorter, Remkes y Lambers, 1990; Wright et al., 2004). A pesar del bajo número de especies muestreadas, los resultados muestran las tendencias en diversidad funcional en los sitios muestreados de este ecosistema y permiten una discusión desde la teoría actual.
Los valores de rasgos concordaron con los reportados por otros estudios en bosque seco tropical. El rango del AFE y CFMS de este estudio coincide con el de la región Totumo de la Costa caribe colombiana (Castellanos-Castro y Newton, 2015); asimismo, los valores de CF y NF hallados en bosque seco en este estudio se encuentran dentro de los valores mínimos reportados para bosque seco de Costa Rica (Powers y Tiffin, 2010). Valores mínimos de AFE se hallaron en A. dugandii, M. Sapota y A. excelsum; la diferencia entre valores de rasgos posiblemente se explique por las diferencias entre especies (Hulshof y Swenson, 2010).
Los valores máximos de AFE se relacionaron con altos valores de NF. Esta relación bivariada se observó en M. tinctoria, C. cujete, H. crepitans y N. cuspidata; los resultados coincidieron con los obtenidos en bosque seco de Costa Rica donde se encontró la relación bivariada entre AFE y NF, en TFP diferenciados, especies deciduas y siempre verdes (Powers y Tiffin, 2010). Probablemente se debe a que los rasgos no actúan de manera independiente; es posible que para realizar fotosíntesis y garantizar un abastecimiento en el árbol de rápido crecimiento se requieran grandes superficies foliares y altas concentraciones de nitrógeno (Sterck y Schieving, 2011); los rasgos interactúan con otros rasgos de manera conjunta para orientar los procesos que determinan la ganancia total de carbono en la planta; así, en la medida en que crecen los árboles la cantidad de luz interceptada es mayor, lo que optimiza la fotosíntesis, la concentración de NF, así como el incremento de la madera (Sterck y Schieving, 2011).
Se encontró relación opuesta entre NF y CFMS. Esta puede deberse a características del TFP2 de bajo CFMS junto a alto NF; características que son propias de hojas livianas con alta capacidad fotosintética y por ende procesamiento de carbono; en este grupo, la prioridad es contribuir a una rápida adquisición y procesamiento de carbono lo cual debe estar asociado a órganos que conducen a la planta a un rápido crecimiento del árbol, por lo que en sitios con alta disponibilidad de luz, agua y nutrientes, propician especies con rasgos de rápida adquisición de recursos (Reich et al., 2014). Esta asociación coincide con la encontrada para estos 2 rasgos en bosque seco de Costa Rica (Powers y Tiffin, 2010).
El AFE y CFMS se caracterizaron por una fuerte correlación negativa, es decir, plantas con atributos como alta AFE presentaron baja CFMS. Los rasgos con estas características muestran una rápida tasa de crecimiento, propia de especies adquisitivas; esta relación bivariada probablemente obedezca a la estrategia para ganancia de carbono, lo que sugiere que especies con grandes áreas foliares y delgadas disponen de mayor superficie para captar luz, sintetizarla y convertirla en carbono (Garnier et al., 2004). Estos resultados son consistentes con la relación bivalente entre AFE y CFMS identificada en el sector Totumo del bosque seco del Caribe colombiano (Castellanos-Castro y Newton, 2015).
El carbono almacenado por parcela presentó contrastes respecto al calculado para los TFP. Los rangos de carbono obtenidos en cada parcela son comparables con los valores globales de bosque seco (Becknell, Kissing-Kucek y Powers, 2012); el carbono estimado mediante TFP1 presentó valores próximos a los de la parcela; probablemente los valores inferiores obtenidos mediante TFP1 se deben a que, en solo 2 de las 5 parcelas, el porcentaje de biomasa acumulada por las especies muestreadas alcanzó más del 70% de la biomasa (Pérez-Harguindeguy et al., 2013).
El modelo muestra que de los valores de rasgo dominantes en el TFP1, solamente el CFMS y NF estuvieron relacionados con CBA, lo que sugiere que hojas delgadas con bajo contenido de nitrógeno almacenarían altos contenidos de carbono en la planta (Poorter et al., 1990, Wright et al., 2004). Se presentan bajos valores de R2 probablemente porque hay diferencia en número de especies y valores de rasgos entre sitios; por ejemplo, en Islas del Rosario se presenta alto valor de CBA para TFP1 (tabla 7); al mismo tiempo, se identifica el máximo número de especies por parcela y bajos valores de CFMS y NF (tabla 3); mientras que en el Ceibal el porcentaje de biomasa es bajo con menor número de especies en la parcela y alto valor de CFMS.
Las anteriores relaciones confirman que los procesos ecosistémicos son en parte controlados por el número de especies presentes en un sitio (hipótesis de la función diversidad ecosistema) (Finegan et al., 2015) o por los rasgos de las especies más abundantes (hipótesis de la proporción de masas) (Mokany, Ash y Roxburgh, 2008). Probablemente si se amplía el muestreo por parcela hasta el 70-80% del área basal de las especies dominantes por sitio (Díaz, Fargione, Chapin y Tilman, 2006) y el registro de hojas se realiza durante el periodo húmedo, cuando todas las especies disponen de hojas, el carbono estimado para el TFP1 se acercaría aún más al estimado para todas las especies de la parcela.
En las 5 parcelas del bosque seco del Caribe colombiano se identificaron 2 TFP asociados al servicio ecosistémico de secuestro de carbono; el principal rasgo que determinó la separación de los 2 grupos fue el AFE; el modelo derivado de TFP1 fue el que mejor predijo carbono, donde el TFP1 lo conformaron especies con tendencias conservativas en el uso de recursos; ejemplos de especies que conformaron este TF1 son A. graveolens, E. cyclocarpum y S. mombin; mientras que el del TFP2 lo integraron especies con tendencias adquisitivas, como M. tinctoria, H. crepitans y G. ulmifolia.
Aunque el modelo que mejor predice carbono es el TFP1, este no se puede considerar como una tendencia general en el bosque seco del Caribe colombiano debido a la diferencia en rasgos y diversidad de especies entre sitios. Este aspecto amerita un estudio posterior en el que se incremente el número de especies por sitio hasta más del 80% de la biomasa por parcela; dicho estudio requiere adelantarse en la estación húmeda, cuando todas las especies disponen de hojas; lo anterior, para conocer el comportamiento de los TFP durante el periodo húmedo y determinar si el valor del TFP1 alcanza mayor proximidad del valor de carbono almacenado por todas las especies de la parcela.
Expresamos nuestro agradecimiento a la Universidad Nacional Abierta y a Distancia por la financiación de este proyecto; al Jardín Botánico de Medellín Joaquín Antonio Uribe por facilitar los contactos para acceder a las parcelas permanentes y a las bases de datos utilizadas en este proyecto; a la empresa Interconexión Eléctrica S.A. por financiar el establecimiento algunas de las parcelas estudiadas. Al profesor Andrés Felipe Díaz de la Universidad Distrital Francisco José de Caldas por su orientación en la estadística del estudio; al director del parque Islas del Rosario y funcionarios del área que facilitaron el acceso al área de estudio; a los propietarios, administradores y personal de apoyo de las reservas naturales de Besotes, Kalashe, Sanguaré y hacienda El Ceibal por permitir el acceso y realización del estudio en sus predios. Las parcelas permanentes fueron establecidas parcialmente con fondos de la Fundación Moore, a través del Convenio JBMED-Universidad de Leeds (2009) con el apoyo de RAINFOR y fondos del Convenio Colciencias-JBMED2011 (contrato núm. 393 del 2012) que sirvieron para estudiar la composición de florística de las parcelas.
La revisión por pares es responsabilidad de la Universidad Nacional Autónoma de México.