Se amplía la distribución de Pleurobrachia pileus del norte del océano Atlántico al suroeste del golfo de México con el primer registro en aguas tropicales en 3 sistemas estuarino lagunares del estado de Veracruz: La Mancha (enero 2013), Mandinga y del Ostión (mayo de 2014). La altura promedio en las poblaciones de La Mancha (X¯=7.36 mm) y del Ostión (X¯=7.31 mm) fueron significativamente mayores que en la población de Mandinga (X¯=5.78 mm), sin embargo, son menores que las tallas que presenta en latitudes mayores.
This record expands the distribution of Pleurobrachia pileus from northern Atlantic Ocean to the southwest of the Gulf of Mexico, with the first record of the species in tropical waters in 3 estuarine lagoon systems in the state of Veracruz: La Mancha (January 2013), Mandinga and del Ostión (May 2014). The average height in the populations from La Mancha (X¯=7.36 mm) and del Ostión (X¯=7.31 mm) were significantly higher than in the population from Mandinga (X¯=5.78 mm), however, they are smaller than those present at higher latitudes.
Pleurobrachia pileus se distribuye en el océano Atlántico oriental desde el fiordo de Gulmar (Suecia) (Møller, Martínez-Canon y Tiselius, 2010) hasta la bahía St. Helena (Sudáfrica) (Gibbons, Buecher y Thibault-Botha, 2003), incluyendo los mares Mediterráneo, Adriático, Negro y de Mármara (Biggs et al., 1986; Cinar, Yokeş, Açik y Bakir, 2014; Mutlu et al., 1994; Shiganova y Malej, 2009), mientras que en el océano Atlántico occidental Bigelow (1915) la registra desde el mar de Labrador hasta Pamlico Sound, en Carolina del Norte (Nelson, 1925), y en Argentina hasta la plataforma continental de la Patagonia (Mianzan y Guerrero, 2000).
En el presente estudio se amplía el intervalo de distribución de P. pileus hacia la parte centro y sur del estado de Veracruz, además de comparar las poblaciones de la laguna La Mancha, el sistema lagunar de Mandinga y la laguna del Ostión, a través de un análisis morfométrico.
La laguna La Mancha se ubica en la parte central del estado de Veracruz (19°35’-19°33’ N, 96°23’-96°22’ O) y tiene un clima de tipo Aw2, cálido subhúmedo con lluvias en verano (García, 2004). El sistema lagunar de Mandinga (19°00’-19°06’ N, 96°02’-96°06’ O) tiene un clima que corresponde al tipo Aw2, al igual que la laguna La Mancha. La laguna del Ostión, al sur del estado (18°07’-18°15’ N, 94°42’ O), posee un clima Amw’(i)g cálido-húmedo con un régimen de lluvias en verano y un porcentaje de lluvias invernales de un 5 a un 10.2% de la anual.
Los ejemplares fueron recolectados con redes de zooplancton de 50cm de diámetro y luz de malla de 250 o 500μm, en la laguna de La Mancha en enero de 2013, y en el sistema lagunar de Mandinga y la laguna del Ostión en mayo del 2014. Todas las muestras se fijaron con formaldehído al 4% neutralizado con borato de sodio. Los ejemplares fueron determinados a nivel específico considerando los trabajos de Agassiz (1865), Greve (1975), Mianzan (1999) y Mortensen (1912).
Para el análisis morfométrico se tomaron al azar 50 ejemplares de cada una de las localidades, los cuales se midieron en altura, diámetro tentacular y diámetro sagital (fig. 1); se analizaron las siguientes relaciones: altura-diámetro tentacular y altura-diámetro sagital. Las diferencias significativas del tamaño (altura) entre las poblaciones de los 3 sistemas fueron determinadas por medio de un análisis de varianza de una vía (Anova), seguida de la prueba de comparaciones múltiples de Tukey en los casos significativos (Zar, 2010). Se aplicó la prueba de t de Student para muestras pareadas con el propósito de determinar si el diámetro sagital era menor que el diámetro tentacular. Para determinar la ecuación que define la relación entre variables morfométricas (altura-diámetro tentacular y altura-diámetro sagital) se utilizó un análisis de regresión. Posteriormente, las pendientes derivadas de estos análisis se compararon con un valor hipotético de 1 (bh=1), por medio de la t de Student (Kutner, Nachtsheim y Neter, 2004).
Pleurobrachia pileus se recolectó en aguas con temperaturas mayores (20 a 30°C) a lo observado en otras latitudes, como en el estuario Seine, Canal de la Mancha (11.4-15.7°C) (Wang, Thiébaut y Dauvin, 1995), o en la bahía St. Helena, en la República de Sudáfrica (9.5-18.9°C) (Buecher y Gibbons, 2000; Gibbons et al., 2003). Con respecto a la salinidad del agua superficial, esta especie se registró en un intervalo de 20-33 en Veracruz, generalmente mayor a lo observado en la bahía Kiel, en Alemania, y en el estuario Seine, en el norte de Europa (12.5-20.5 y 15-33, respectivamente) (Schneider, 1987; Wang et al., 1995), mientras que en la bahía St. Helena (Sudáfrica) fue mayor (35) (Buecher y Gibbons, 2000). Estos resultados indican que P. pileus tiende a ser euritérmica y eurihalina, por lo que puede ser un habitante común en sistemas estuarinolagunares.
Mayer (1912) señaló que esta especie se distribuía de manera abundante en aguas frías de Norteamérica y Europa. En el golfo de México solo se ha registrado como Pleurobrachia sp. por Biggs, Smith, Bidigare y Johnson (1984) en la zona oceánica frente a Texas y Tamaulipas, al igual que en sistemas lagunares de Veracruz, como Tamiahua y Alvarado, por Gómez-Aguirre (1977), La Mancha (Ruíz-Guerrero y López Portillo-Guzmán, 2006) y Mandinga (Ocaña-Luna, Sánchez-Ramírez y Aguilar-Durán, 2015), así como en ambientes salobres en la zona costera de Yucatán (Ordóñez-López, Ornelas-Roa, Uicab-Sabido y Escamilla-Sánchez, 2010) y en el mar Caribe en Cuba (Lalana, Ortiz y Varela, 2001), por lo que los ejemplares de P. pileus recolectados en el presente estudio representan los primeros registros en el golfo de México y en aguas tropicales.
En relación con el tamaño de los organismos, se observó que la altura promedio entre las poblaciones de las 3 lagunas (La Mancha, X¯=7.36 mm; Mandinga, X¯=5.78 mm; del Ostión X¯=7.31 mm) mostró diferencias significativas (F=12.788, g. l.=2/147, p>0.0005), y de acuerdo con una prueba de Tukey no existieron diferencias entre las poblaciones de La Mancha y del Ostión (q=0.216, g. l.=3/147, p<0.9); sin embargo, ambas fueron significativamente mayores a la población de Mandinga (q=6.299, g. l.=3/147, p<0.0005; q=6.050, g. l.=3/147, p<0.0005, respectivamente).
El mayor diámetro tentacular de P. pileus se presentó en la laguna de La Mancha (1.88-12.31mm); sin embargo, es menor a los registrados en latitudes mayores donde las temperaturas son bajas; por ejemplo, en el oeste del mar de Wadden, en los Países Bajos, fue de 1-20mm (van der Veer y Sadée, 1984), y de 1 a 30.6mm en el mar Negro (Mutlu y Bingel, 1999).
Con respecto a las otras variables morfométricas, el promedio del diámetro sagital también fue menor al promedio del diámetro tentacular; estas diferencias fueron significativas en Mandinga (t=−2.213, g. l.=49, p=0.016) y del Ostión (t=−2.078, g. l.=49, p=0.021), pero no en La Mancha (t=−0.788, g. l.=49, p=0.217). Esto coincide, de manera general, con lo reportado por Greve (1975), quien menciona que en P. pileus el diámetro sagital es ligeramente menor que el diámetro tentacular.
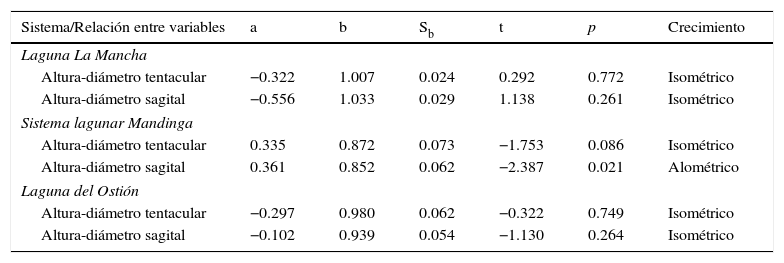
El análisis de regresión simple mostró que la relación entre la altura y el diámetro tentacular fue significativo para las 3 poblaciones (La Mancha: F=1,727.1, g. l.=1/48, p<0.0005, R2=0.973; Mandinga: F=144.41, g. l.=1/48, p<0.0005, R2=0.751; del Ostión: F=249.57, g. l.=1/48, p<0.0005, R2=0.839). De manera similar, para cada sistema las relaciones altura-diámetro sagital fueron significativas (La Mancha: F=1,244.6, g. l.=1/48, p<0.0005, R2=0.963; Mandinga: F=190.97, g. l.=1/48, p<0.0005, R2=0.799; del Ostión: F=300.51, g. l.=1/48, p<0.0005, R2=0.862). Con respecto al tipo de crecimiento corporal de los individuos, se observó que las poblaciones de La Mancha y del Ostión, donde los individuos alcanzan tallas mayores, en las relaciones altura-diámetro tentacular (fig. 2) y altura-diámetro sagital presentaron un crecimiento isométrico (tabla 1), por lo que su forma tiende a ser esférica. En el caso de la población del sistema lagunar de Mandinga, la relación altura-diámetro tentacular (fig. 2) también presentó un crecimiento de tipo isométrico (tabla 1), mientras que la relación altura-diámetro sagital mostró un crecimiento alométrico negativo (tabla 1), por lo que su forma tiende a ser ovoide; Greve (1975) mencionó que la forma que presenta P. pileus va de ovoide a esférica a lo largo de su desarrollo.
Tipo de crecimiento de Pleurabrachia pileus en 3 sistemas lagunares de Veracruz, bajo la hipótesis de b=1 (isometría) y b≠1 (alometría) de las regresiones entre las variables consideradas en cada sistema.
| Sistema/Relación entre variables | a | b | Sb | t | p | Crecimiento |
|---|---|---|---|---|---|---|
| Laguna La Mancha | ||||||
| Altura-diámetro tentacular | −0.322 | 1.007 | 0.024 | 0.292 | 0.772 | Isométrico |
| Altura-diámetro sagital | −0.556 | 1.033 | 0.029 | 1.138 | 0.261 | Isométrico |
| Sistema lagunar Mandinga | ||||||
| Altura-diámetro tentacular | 0.335 | 0.872 | 0.073 | −1.753 | 0.086 | Isométrico |
| Altura-diámetro sagital | 0.361 | 0.852 | 0.062 | −2.387 | 0.021 | Alométrico |
| Laguna del Ostión | ||||||
| Altura-diámetro tentacular | −0.297 | 0.980 | 0.062 | −0.322 | 0.749 | Isométrico |
| Altura-diámetro sagital | −0.102 | 0.939 | 0.054 | −1.130 | 0.264 | Isométrico |
a: ordenada al origen; b: pendiente; p: probabilidad; Sb: error estándar de la pendiente; t: t de Student.
Grados de libertad=48, en todos los casos.
Agradecemos al Instituto Politécnico Nacional por las becas otorgadas a AOL y MSR a través de los programas de Estímulo al Desempeño de los Investigadores y Comisión de Operación y Fomento a las Actividades Académicas. Al Conacyt, por la beca de estudios de doctorado a AMH. A los miembros del Laboratorio de Peces de la Universidad Autónoma Metropolitana, Unidad Iztapalapa, por su colaboración en la toma de muestras, y a la cooperativa pesquera de la laguna La Mancha, por su permiso y apoyo en la recolecta de material biológico.
La revisión por pares es responsabilidad de la Universidad Nacional Autónoma de México.