El carcinoma basoescamoso o metatípico es una neoplasia con origen en las células basales pluripotenciales, y con diferenciación gradual hacia un tumor de células escamosas. Los tumores basocelulares tienen un muy bajo grado de metástasis, menor del 1%, mientras que el carcinoma basoescamoso ha reportado cifras de metástasis a 20 años del 5%. En la bibliografía se han reportado muy pocos casos de afección ocular de este tipo de tumor, y el diagnóstico final se realiza por medio de histopatología, debido a la falta de características clínicas propias.
En este caso, un hombre de 80 años es enviado al servicio de oftalmología para valorar un tumor en zona conjuntival tarsal, bulbar y en esclera de crecimiento de al menos un año en ojo izquierdo; después de su resección se llega al diagnóstico histopatológico de carcinoma metatípico o basoescamoso.
Basosquamous carcinoma or metatypical carcinoma is a neoplasya with origin in pluripotencial basall cells, and with gradual diferenciation to squamous cell tumor. Basocelular tumors has a very low grade of metastasys, less than 1%, but basosquamous carcinoma has a metastasys range of 5% to 20 years. In bibliography has been reported a few cases with ocular implication of this kind of tumor, and the final diagnosis is realiced by histopathology, because of lack of clinical characteristics.
In this case, a man of 80 years comes to ophthalmology service to evaluate a tumor in tarsal, and bulbar zone of conjunctiva, plus scleral growing at least since one year ago, after its resection, the histopatological diagnosis of metatypical or basosquamous carcinoma is confirmed.
La existencia de un carcinoma de células basales con características de carcinoma de células escamosas fue descrito por primera vez en 1903 y postulado como una entidad patológica de rasgos propios por primera vez en 1922, y se describió como «epitelioma metatípico»1.
Se considera el origen celular del carcinoma basoescamoso (CBE) al carcinoma basocelular, el cual tiene más de 20 subtipos histológicos, pero con incidencia de infiltración escleral o intraocular extremadamente baja, en cualquiera de sus presentaciones2. La incidencia del CBE es del 80-90% de todos los tumores de párpados3. El CBE es un tumor maligno raro con un total del 1-2% de todos los cánceres de piel, tiene diversos sinónimos como: carcinoma metatípico, carcinoma basaloide escamoso, epitelioma basal escamoso; o en otros casos, y de forma menos común es llamado tumor de colisión en el caso de que tejido escamoso y basocelular se presenten juntos al lado3,4.
La tasa de metástasis de un carcinoma basocelular es cercana a cero, mientras que en un CBE se ha reportado un rango de metástasis del 5% hasta a 20 años4. Este tipo de carcinoma implica aspecto histológico de un carcinoma basocelular con zonas de diferenciación que corresponden al linaje de un carcinoma escamoso3.
El CBE no tiene una presentación específica, y el diagnóstico suele hacerse a través de la biopsia4. Algunos casos han reportado su presentación como tumores ulcerados en canto interno5, masa visible o palpable, o una masa que se expande a conjuntiva bulbar, con datos que pueden indicar afección orbitaria: fijación ósea, limitación de movimientos oculares, desplazamiento de globo ocular, en ocasiones epifora, ptosis, fístula en piel3. Se debe tomar en cuenta que el carcinoma de células basales ocurre con más frecuencia en el párpado inferior con un 66%, párpado superior 16%, canto medial 3%6. También se debe tomar en cuenta su coexistencia con un carcinoma de células escamosas cuyas características clínicas oftalmológicas son sensación de cuerpo extraño, dolor, prurito, epifora, fotofobia, ocasionalmente diplopía7, aparece como un nódulo elevado con induración en cuadrante nasal inferior, con queratinización o ulceración, la zona de aparición más común es el área interpalpebral de la conjuntiva perilimbar, coexistiendo con pingüeculas y pterigiones en algunas ocasiones8.
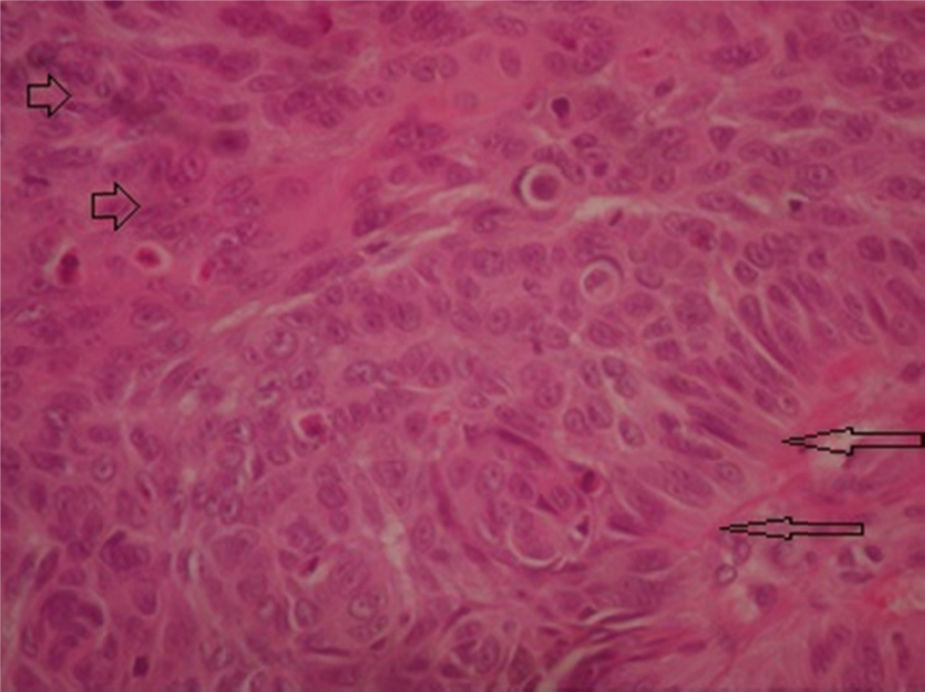
El diagnóstico clínico y patológico de CBE puede ser problemático; suele ser un tumor de lento crecimiento, sin una diferenciación clara de carcinoma basocelular o escamoso. Histológicamente hay áreas de carcinoma basocelular con células basaloides que son más largas, pálidas y más redondeas que un carcinoma basocelular, con áreas de carcinoma escamoso con células escamoides que contienen abundante citoplasma eosinofílico. Se puede ver una zona de células transicionales intermedias entre el área de ambos tipos celulares, las células en palizada intermedias son raras, y hay mínima retracción estromal9. El diagnóstico histopatológico debe considerar diferenciarse con un carcinoma de células escamosas superpuesto con un carcinoma de células basales10. En ocasiones se ha puesto en duda la separación del carcinoma metatípico como un tumor con características propias y se mantuvo como un «tumor mixto de tipo intermedio», entre una úlcera rodent y carcinoma escamoso11. Por eso la importancia de etiquetarlo adecuadamente, además de que se considera con un mayor grado de metástasis y agresividad que el carcinoma de células escamosas10,11.
Para hacer un diagnóstico definitivo y diferenciarlo con un carcinoma basocelular queratinizante, el cual es histológicamente el más parecido, se debe teñir la muestra en bloques de parafina con anticuerpos específicos, como AE1/AE3, bcl-2. TFG-A, Ver-EP4, p53. En la tinción con estos anticuerpos se puede apreciar mejor la zona de transición del carcinoma metatípico, y se observa el decremento en la intensidad de la tinción, y un decremento en el número de células teñidas, de todos los anticuerpos; este fenómeno se observa mejor con Ber-EP4, la cual es una glucoproteína detectada en tumores de origen basocelular12. La célula primaria puede ser una célula pluripotencial, capaz de diferenciarse en este tumor; el mecanismo en el cual existe esta diferenciación es aún desconocido, probablemente sea una mutación genética. Esto podría producir diversas células capaces de metástasis13.
Las opciones de tratamiento para pacientes con carcinoma metatípico son la resección, radioterapia y microcirugía de Mohs3.
La microcirugía de Mohs es idealmente elegida en el tratamiento de neoplasias no melanomas de piel y región periorbitaria, como el carcinoma basocelular y carcinoma escamoso, que permite la revisión cercana al 100% de los bordes del tumor. Se requiere anestesia local, se identifica la extensión clínica del tumor, realizando raspado, un histotecnólogo marca la orientación del tumor respeto a su sitio de resección, se corta el tumor en diferentes grosores y se tiñen para ser seccionadas por congelamiento; la muestra es procesada e interpretada y el cirujano va resecando guiándose por el mapa creado por el patólogo14.
En el caso de tratamiento inicial de toda lesión no pigmentada en el párpado, con sospecha de carcinoma, se recomienda resección quirúrgica con un control de márgenes por congelamiento, que se puede extender de acuerdo al tipo histológico de 2-3mm, en carcinomas agresivos como el carcinoma escamoso; se pueden requerir márgenes más amplios. Para carcinomas en superficie ocular el margen de seguridad es más pequeño que para los casos que involucran la piel15. Puede considerarse la excenteración si hay invasión a globo ocular o a órbita, y combinarse con radioterapia en caso de que los márgenes no queden libres o exista afección perineural3.
En el caso de que la lesión involucre conjuntiva se ha descrito la técnica «no touch», que consiste en evitar el contacto directo del tumor con los instrumentos quirúrgicos, en la cual se debe desvitalizar la córnea con alcohol absoluto. Tocar el tumor directamente puede causar disrupción del epitelio viable, y liberación de las células a tejido adyacente16. La crioterapia igualmente ayuda a reducir la tasa de recurrencia15.
El cáncer que no puede resecarse es principalmente tratado con radioterapia y quimioterapia. En el caso de la radioterapia se debe realizar tomografía para planear el grosor del tumor, el volumen-objetivo, y órganos periféricos en riesgo17. En el caso de la quimioterapia, se puede usar doxorubicina, cisplatino, y fluoracilo, en varios ciclos, dependiendo de la respuesta y remisión18. El tratamiento con radioterapia muestra menor índice de recurrencias si se administra en menos de 6 semanas posquirúrgicas19.
Reporte de casoPaciente masculino de 80 años de edad, residente de Tepic, enviado por sensación de cuerpo extraño, dolor tipo punzante, y ptosis en ojo izquierdo, desde hace al menos un año. El ojo derecho no presenta datos relevantes para el caso. Como antecedente personal patológico familiar el paciente refiere antecedente de linfoma tratado medicamente y aparentemente remitido; ignoran detalles de tratamiento.
Se encuentra en ojo derecho una agudeza visual de cuenta dedos a 50cm, con presión intraocular por tonómetro de Goldmann 19mmHg, catarata senil, resto de exploración normal.
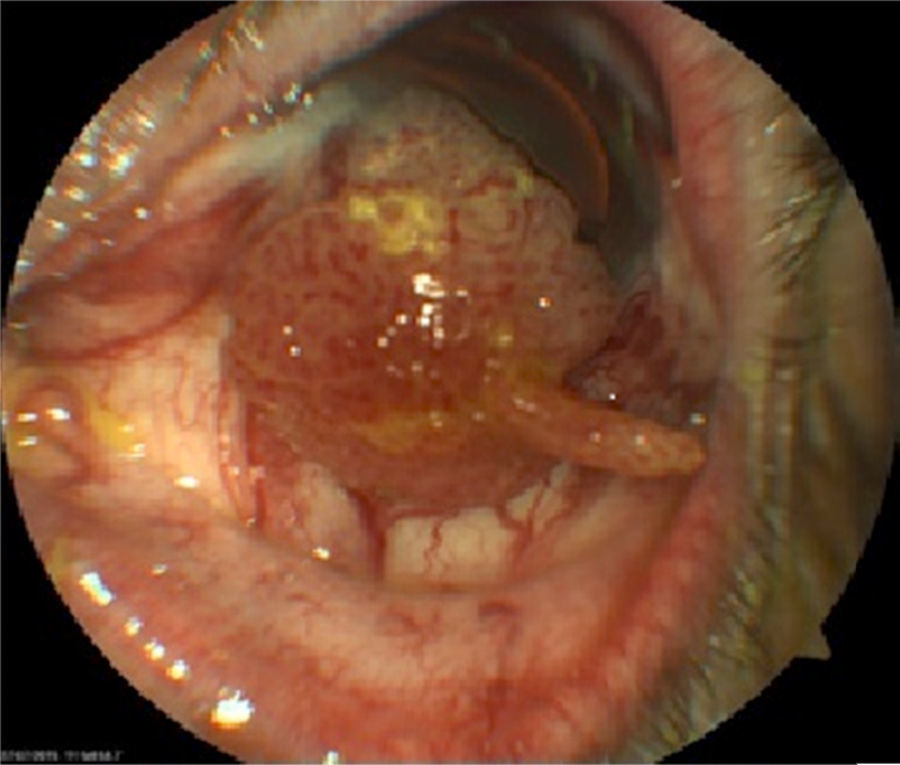
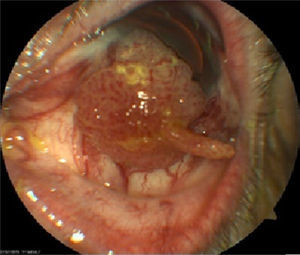
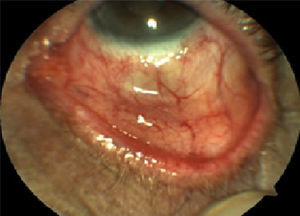
El ojo izquierdo mostró una tumoración de base ancha, que abarca conjuntiva bulbar inferior, tarsal inferior y corneal, coloración rosada, con abundantes vasos visibles, de consistencia sólida, hiperemia conjuntival (fig. 1), catarata senil, limitación a la infraversión. Resto de segmento anterior normal. No se encuentran ganglios en exploración de cabeza y cuello.
En el fondo de ojo izquierdo se encuentra excavación de nervio óptico de 0.6, vítreo claro, sin datos de invasión tumoral
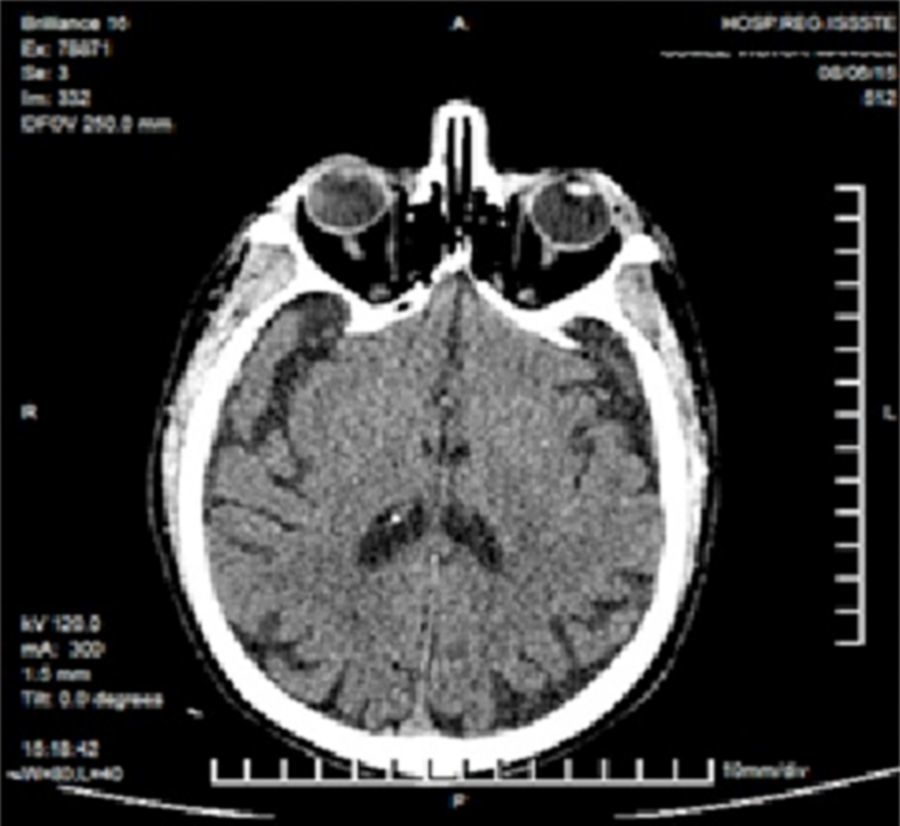
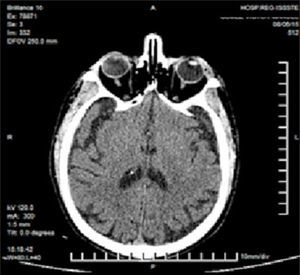
Ante antecedente de linfoma y para descartar diagnóstico de lesión infiltrante se tomó una TAC de cabeza y cuello. En la revisión de la tomografía, no se observa compromiso de órbita o globo ocular, solo se llega a apreciar el tumor como una imagen isodensa con leve aumento de volumen en zona de septum orbitario en su ángulo externo, sin afección de senos paranasales, y tampoco se observan ganglios (fig. 2).
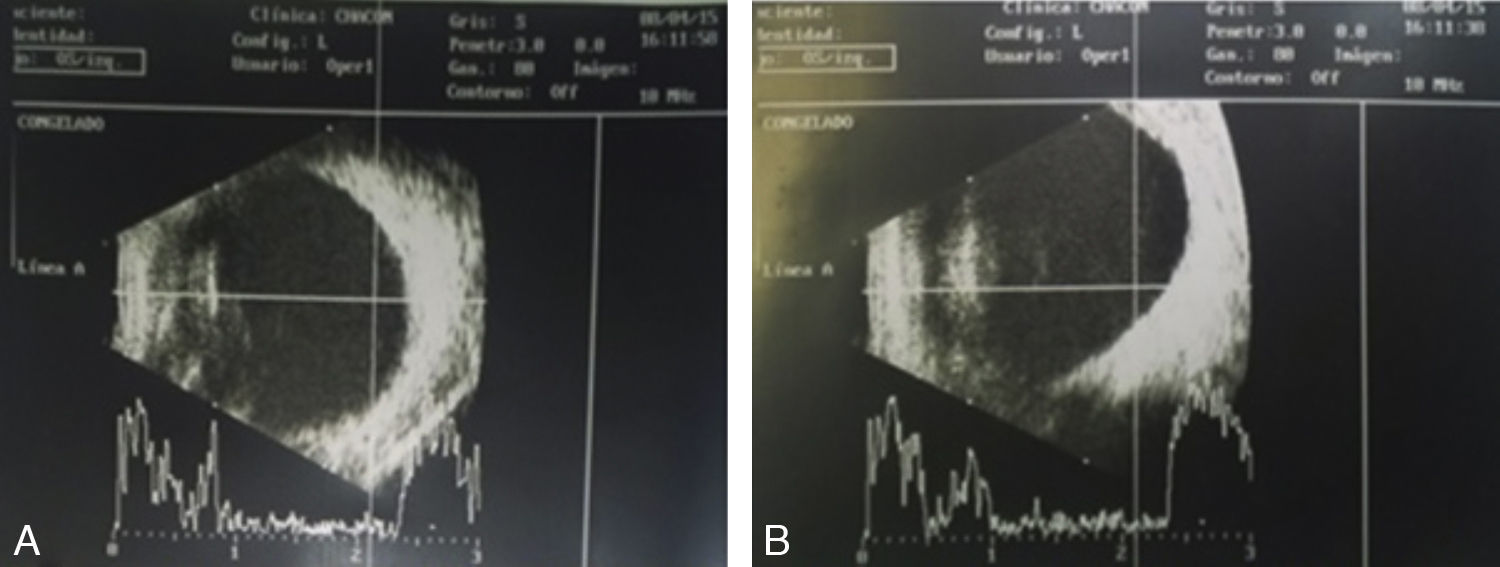
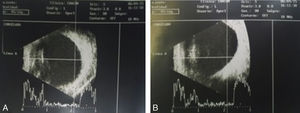
También se tomó USG modo B, axial y paraaxial inferior (fig. 3), el cual reportó globo ocular fáquico, con retina aplicada; no se observa lesión intraocular revisando 360 grados con un eje anteroposterior de 23mm.
Por antecedente de linfoma ya remitido se realizó biometría hemática, que reportó 9,870 leucocitos, hemoglobina de 12.8g/dl, hematocrito del 42.1%, con porcentaje diferencial de células blancas normales. Pruebas de coagulación normal-
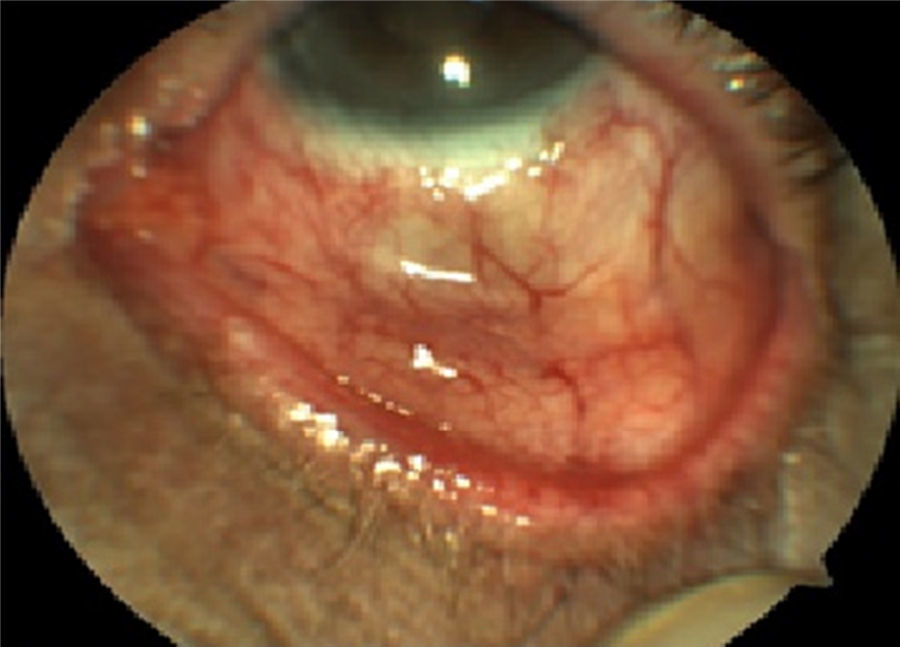
Se decidió realizar una resección de masa tumoral, sin resección por criocirugía debido a reparación del equipo; en el procedimiento quirúrgico se incluye superficie corneal, conjuntiva tarsal, burbar, y de fórnix, sin dejar lesión residual macroscópicamente (fig. 4). Se realiza sin complicaciones.
Hallazgos patológicos macroscópicos: Se realiza resección de masa rojo-blanquecina con puntilleo hemorrágico, abarcando aproximadamente 2mm de córnea, y base total de 10mm hasta llegar a conjuntiva tarsal inferior
Hallazgos microscópicos: Se reportó en una primera ocasión una lesión tumoral con elementos histopatológicos de carcinoma epidermoide, con áreas de queratinización individual y grupal, moderadamente diferenciado e invasivo, con límites quirúrgicos no valorables. Sin embargo al comentarle al médico patólogo las características clínicas macroscópicas del tumor y antecedentes previos del paciente, se realiza nueva revisión de pieza patológica y se llega al diagnóstico de carcinoma metatípico o CBE. Se descartan componentes linfomatosos.
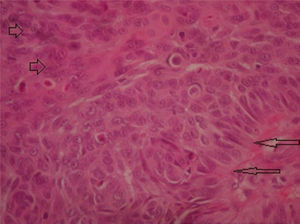
Se describió proliferación de células basaloides que circundan vasos, con nidos de células diferenciadas a células escamosas con actividad mitótica, además de zonas con nidos de queratinización (fig. 5).
DiscusiónPara este caso clínico se deben mencionar las características histológicas de la conjuntiva: una membrana mucosa continua, con su superficie interna limitando con la superficie interna de los párpados, con lo cual la conjuntiva permite el suave movimiento de los párpados sobre la superficie ocular. El epitelio conjuntival se compone de 2-5 capas de células columnares y descansa sobre una lámina basal, la capa laxa fibrovascular subepitelial de la conjuntiva estromal, contiene músculo liso, nervios, melanocitos, y glándulas lagrimales accesorias, junto con tejido linfoide. Se consideran 3 áreas distintas de conjuntiva: a) bulbar, b) de los fórnices y c) la palpebral; esta última se encuentra firmemente adherida a la superficie interna de los párpados, lugar en el que el epitelio conjuntival emerge de forma abrupta hacia la dermis de la superficie anterior de los párpados20.
El CBE es una tumoración rara, con baja frecuencia entre los tumores de párpado, reportándose los casos de afección de globo ocular de forma aún más rara. Se ha descrito histológicamente un tipo mixto, con queratinización focal, perlas de coloide o centro paraquerático, y un tipo intermedio, que presenta una estrecha banda de 2 tipos celulares, la primera banda de células basales de tinte oscuro y la segunda con celularidad mejor definida, más brillante y células más largas1.
En este caso clínico, de acuerdo a la clasificación TNM de tumores conjuntivales, se trata de un tumor T2 (mayor de 5mm de diámetro mayor, sin invasión de estructuras adyacentes), N0 (sin ganglios regionales positivos), M0 (sin metástasis a distancia), con un grado histológico G2 (moderadamente diferenciado) y no consta de un grupo de estadificación. Se encuentra registrado bajo los nombres de CBE, carcinoma metatípico y carcinoma basaloide escamoso. Los sitios regionales de ganglios linfáticos afectados son los preauriculares, submandibulares, y cervicales21, los cuales fueron revisados en el paciente.
También se tenía el antecedente de un linfoma referido por familiares del paciente, que se encontraba remitido, y el aspecto clínico de la lesión tenía características que hacían sospechar de una lesión linfoproliferativa (color rosa-salmón, con una superficie suave)22.
Se han reportado algunas características particulares como una edad de diagnóstico más frecuente en mayores de 60 años (64%), la mayoría masculinos (75%), tamaño de la lesión al momento de diagnóstico mayor de 10mm, con buen grado de diferenciación (58%) y el tiempo promedio de recurrencia de 3.2 años11. Se ha encontrado invasión perineural en el 8.1% de los pacientes con afección de nódulos regionales; para estos casos se recomienda radioterapia después de la resección quirúrgica3.
En cuanto a las metástasis, el CBE tiene mayor riesgo que el basocelular, sin embargo este último tiene un muy bajo potencial. Además, por su baja frecuencia, aún no se ha estudiado con exactitud qué tan grande debe ser su escisión, tratamiento, y conducta a seguir23.
En este caso y por observarse un compromiso claro de conjuntiva, y un paciente sin datos de afección hematológica, afección de tejidos adyacentes o metástasis, se decide realizar solamente resección de la lesión con márgenes de seguridad de hasta 3mm; tomando en cuenta la anatomía implicada, en este caso por falta de equipo por reparación no se pudo realizar crioterapia a los bordes de la resección, con lo cual también se ha documentado una menor tasa de recurrencia15.
En sus revisiones subsecuentes al día siguiente, 7 días y al mes, mientras se esperaban resultados de patología, se observó una evolución estable del paciente, la agudeza visual, segmento anterior y fondo de ojo no mostraron alteraciones. Se le dio cita de revisión a oncología para valorar estudios de imagen, de laboratorio y exploración física; en dicha interconsulta se refiere que no existe afección tumoral. Igualmente por el elevado riesgo de desarrollar metástasis, se debe verificar en cada revisión los mayores factores de riesgo asociado que son la invasión linfática, la afección perineural o recurrencia local3.
ConclusionesEl carcinoma metatípico o CBE es un tumor que tiene una baja frecuencia entre todas las neoplasias de piel y anexos; histológicamente proviene de un carcinoma de células basales, que tiene un muy bajo riesgo de metástasis o invasión, pero con una diferenciación hacia carcinoma de células escamosas, lo cual incrementa su potencial daño. Se debe tener en cuenta que siempre existe una posibilidad de que aparezcan este tipo de tumores, y hacer un mejor seguimiento de la evolución del paciente.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciamientoNo se recibió patrocinio para llevar a cabo este artículo.
Conflicto de interesesNo existe ningún conflicto de intereses.