En los últimos 20 años, las células troncales han sido del interés de muchos grupos de investigación, y el ámbito oftalmológico no es la excepción. Sin embargo, la gran cantidad de información existente y la existencia de resultados contradictorios pueden llegar a ser confusos, haciendo que a los profesionales de la salud les sea difícil mantenerse actualizados. En este trabajo se presentan algunos de los aspectos básicos que es necesario entender sobre las propiedades de las células troncales, así como las dificultades asociadas a su empleo en la terapia oftalmológica. Está claro que a pesar de que las células troncales pueden ser una herramienta muy útil en el tratamiento de diversas enfermedades, aún desconocemos muchas de sus propiedades y de los mecanismos que las regulan. Asimismo es notable la carencia de técnicas que permitan el aislamiento con certeza de una población de células troncales puras y el trasplante al paciente de poblaciones celulares completamente diferenciadas, hechos que implican un riesgo real para el candidato a ser tratado con este tipo celular. Por el momento, la terapia que implica el uso de células troncales se ha enfocado en el tratamiento de la DMRE húmeda o seca, así como en la LSCD. No obstante, al considerar las dificultades existentes, se puede concluir que tal vez sea el momento de hacer una pausa en las posibles aplicaciones terapéuticas adicionales, y dedicarnos a entender mucho mejor este tipo celular, antes de dar un paso más en el tratamiento de problemas oftalmológicos.
During the last 20 years, stem cells became a central issue for many research groups, and the ophthalmologic field is not the exception. Under such scenario, the huge amount of available information together with contradictory results may lead to confusion; making the continuous updating by health professionals difficult and challenging. Here, we describe some of the essential properties of stem cells, as well as the intricacies associated with their use in ophthalmic therapy. It is clear that despite stem cells may be a very useful tool in the treatment of several diseases, we still ignore many of their properties as well as the mechanisms that regulate them. Also, it is significant the lack of procedures that could allow their isolation as a pure stem cell population and their subsequent controlled transplantation into patients as completely differentiated cells; facts that imply a real risk for the candidate to this kind of treatment. At present, therapies that involve the use of stem cells have focused on treatment of wet or dry AMD, as well as LSCD. However, considering the current difficulties, one can conclude that maybe it is time to pause possible additional therapeutic uses and gain a better understanding of stem cells before we continue treating ophthalmologic disease.
A pesar de los avances tecnológicos, quirúrgicos y médicos ocurridos a partir del siglo pasado, aún existen diversos trastornos que desde el punto vista clínico presentan una mala o nula respuesta al tratamiento. En oftalmología, muchas de estas enfermedades carecen de tratamiento debido a la naturaleza de los tejidos afectados, o debido a que su integridad es vital para mantener la visión. Como ejemplo están las opacidades corneales de distintas etiologías o la neovascularización de la superficie ocular con la subsecuente conjuntivalización de la córnea. En la actualidad, estas 2 enfermedades pueden tratarse mediante una queratoplastia penetrante; sin embargo, en ocasiones el daño de la superficie ocular es tan severo que el problema recidiva después de la cirugía, y por cada queratoplastia subsecuente, el riesgo de fracaso aumenta1. Asimismo, cuando existen comorbilidades como el glaucoma, se presenta una situación similar2.
Debido a lo anterior, es muy importante desarrollar alternativas para el tratamiento de las numerosas enfermedades visuales que incapacitan al paciente. Entre estas destaca el uso terapéutico de las células troncales, que, dadas sus características y capacidad de expresión genética abren la posibilidad de reponer y/o reparar tejidos que de otra forma no podrían regenerarse; y por lo tanto, generan la posibilidad de establecer terapias para diferentes procesos patológicos e incapacitantes3. Por ello, en las últimas 2 décadas, la investigación enfocada a localizar, identificar y aislar las células troncales alcanzó un auge impresionante, conduciendo a la comprensión de la participación de estas en procesos de reparación y regeneración tisular4–6.
No obstante, a medida que crece el conocimiento sobre las características de este tipo celular surgen inquietudes éticas sobre su uso potencial en humanos7. En los párrafos subsecuentes revisaremos las características fundamentales de las células troncales y su posible localización. Asimismo, se discutirán los avances en el campo, así como las ventajas y desventajas de su uso en la terapia oftalmológica. A lo largo de esta discusión se describirán algunos de los ensayos clínicos realizados o que se encuentran en desarrollo.
Las células troncalesConcepto de célula troncalCaracterísticas generalesLas células troncales adultas son células no diferenciadas con capacidad de renovación ilimitada, y que presentan cualidades que no comparten con otros tipos celulares: una de ellas es la autorrenovación, y otra, la división asimétrica4. Las células troncales tienen la capacidad de dividirse por mitosis: ya sea simétricamente para formar 2 células troncales idénticas y aumentar el tamaño del reservorio (o «pool») de células troncales, u originando 2 células que inician el proceso de diferenciación terminal; o bien, dividiéndose asimétricamente para generar 2 células hijas, una que mantiene las propiedades de célula troncal, y otra que inicia el proceso de diferenciación, convirtiéndose en una célula especializada8. Considerando esta cualidad, es posible deducir otra de las propiedades de las células troncales: estas tienen un estado «indiferenciado», ya que no se detecta en ellas la expresión de marcadores moleculares de fenotipos terminales, y poseen la capacidad de originar a una gran variedad de tipos celulares9. Otra de sus características es la baja frecuencia con la que pasan por el ciclo celular10, ya que la mayor parte del tiempo se encuentran en la fase G0 del mismo, hecho que es interpretado como una estrategia para disminuir el riesgo de daños mutagénicos que puedan alterarlas. Como última característica, las células troncales se localizan en un microambiente que proporciona el alojamiento anatómico, la protección, la información posicional y la señalización, esenciales para mantener sus propiedades y funciones11,12. A este microambiente especializado se le conoce como «nicho»
Con base en todos estos conceptos, en el caso específico del ojo del mamífero adulto, se postula la localización de las células troncales en varias regiones anatómicas que revisaremos más adelante.
ClasificaciónLas células troncales se clasifican de varias maneras, basándose en su comportamiento in vitro o in vivo, o en sus propiedades o en su origen:
Según su potencialBasándonos en la capacidad o potencial de las células troncales para dar origen a diferentes tipos celulares con fenotipos especializados, estas se clasifican en 4 tipos básicos:
- a)
Células unipotenciales. Estas dan origen a un solo tipo celular, y como ejemplos específicos se pueden mencionar las oogonias, las espermatogonias o a las células troncales específicas de tejido.
- b)
Células totipotenciales. Tienen la capacidad de generar un organismo completo, dando lugar a todas las células diferenciadas que lo constituyen, incluyendo las que forman los anexos embrionarios. La únicas células con esta capacidad son el cigoto y los blastómeros resultantes de la segmentación temprana del cigoto de aquellas especies con huevos indeterminados.
- c)
Células pluripotenciales. Son aquellas que no pueden formar un organismo completo, pero tienen la capacidad de diferenciarse en cualquiera de las poblaciones celulares que se derivan de las 3 capas germinales embrionarias (ectodermo, endodermo o mesodermo) y sus derivados. Las células embrionarias son el mejor ejemplo de células pluripotenciales.
- d)
Células multipotenciales. Estas últimas solo tienen la capacidad de generar células diferenciadas que expresan fenotipos únicamente asociados a los derivados de su misma capa o linaje embrionario. El ejemplo típico de estas lo constituyen las células troncales hematopoyéticas.
Las células troncales específicas de tejido pueden ser multipotenciales, aunque en la mayor parte de los casos las observaciones muestran que solo se diferencian hacia el fenotipo terminal asociado al tejido donde se localizan13–16. Actualmente se ha discutido la posibilidad de que todas las células troncales específicas de tejido son multipotenciales. Aunque existen pocas evidencias experimentales al respecto, entre las células multipotenciales específicas de tejido con capacidad de generar los diferentes tipos celulares terminalmente diferenciados de un tejido particular, se encuentran las células epiteliales localizadas en los reservorios del folículo piloso17–19, en posiciones específicas del epitelio intestinal20,21 y en el epitelio conjuntival22. En cualquier caso, estas células troncales dan origen a una progenie que reemplaza a las células que se diferencian terminalmente o mueren; o bien participan en la reparación tisular subsecuente al daño.
Clasificación de las células troncales de acuerdo a su origenEn estado natural se encuentran 2 tipos de células troncales: las células troncales adultas humanas (SC, por sus siglas en inglés), que son uni- o multipotenciales, y solo están presentes en compartimentos celulares restringidos23; y por otra parte, las células troncales embrionarias humanas (hESC, por sus siglas en inglés), las cuales fueron aisladas por primera vez en 1998 por Thomson et al.24, son pluripotenciales, y relativamente fáciles de mantener en cultivo, aunque tienen la desventaja de ser alogénicas, lo que dificulta su posible uso terapéutico25.
De manera adicional, el trabajo realizado por Takahashi y Yamanaka en 2006 permitió la reprogramación in vitro de células somáticas adultas para la expresión de un fenotipo similar al de las células troncales26,27. A estas células reprogramadas se les denomina células troncales pluripotenciales inducidas (iPS por sus siglas en inglés). Para obtenerlas, este grupo de investigadores estudió inicialmente la capacidad de 24 factores de transcripción para inducir y mantener la pluripotencialidad en fibroblastos de ratón y de humano, tanto embrionarios como de adulto26,27. De este análisis se concluyó que la expresión ectópica de 4 factores de transcripción (Oct4, Sox2, Klf4 y c-Myc) permite la reprogramación de una célula somática, dando lugar a células con un fenotipo similar al de las células troncales26,27.
Reservorios oculares de células troncalesDefinición de nichoEl nicho es una estructura no solo anatómica sino también fisiológica. Este reúne características que mantienen y controlan la supervivencia y las funciones de las células troncales. A nivel fisiológico, en el nicho existen señales externas o factores extrínsecos, que en conjunto regulan la autorrenovación de la población28. Estas señales extrínsecas parecen corresponder a componentes de matriz extracelular, a factores de crecimiento y citocinas, entre otros, que en conjunto determinan las propiedades y comportamiento de las células alojadas en el nicho, conduciendo al establecimiento de propiedades microambientales que no se encuentran en el resto del tejido12,29. De manera adicional, el nicho protege las células troncales tanto de agentes mecánicos como del efecto de agentes físicos o químicos, además de que regula la disponibilidad de oxígeno y provee a la población celular con irrigación sanguínea suficiente para la obtención de nutrientes y otros factores30,31.
¿Dónde se encuentran los nichos en los diferentes tejidos oculares?Diversos autores han tratado de localizar los sitios oculares donde se alojan las poblaciones de células troncales. Para ello, han obtenido evidencia experimental de su localización mediante técnicas basadas en las propiedades predichas para estas. De esta manera, la retención de análogos de las bases que componen al ADN, basada en la predicción de que las células troncales tienen una baja frecuencia de paso a través del ciclo celular32–34, o la distribución de marcadores moleculares que permiten distinguir a las células que han iniciado la expresión del programa de diferenciación, se han convertido en herramientas esenciales para localizar a la población de células troncales28,35,36.
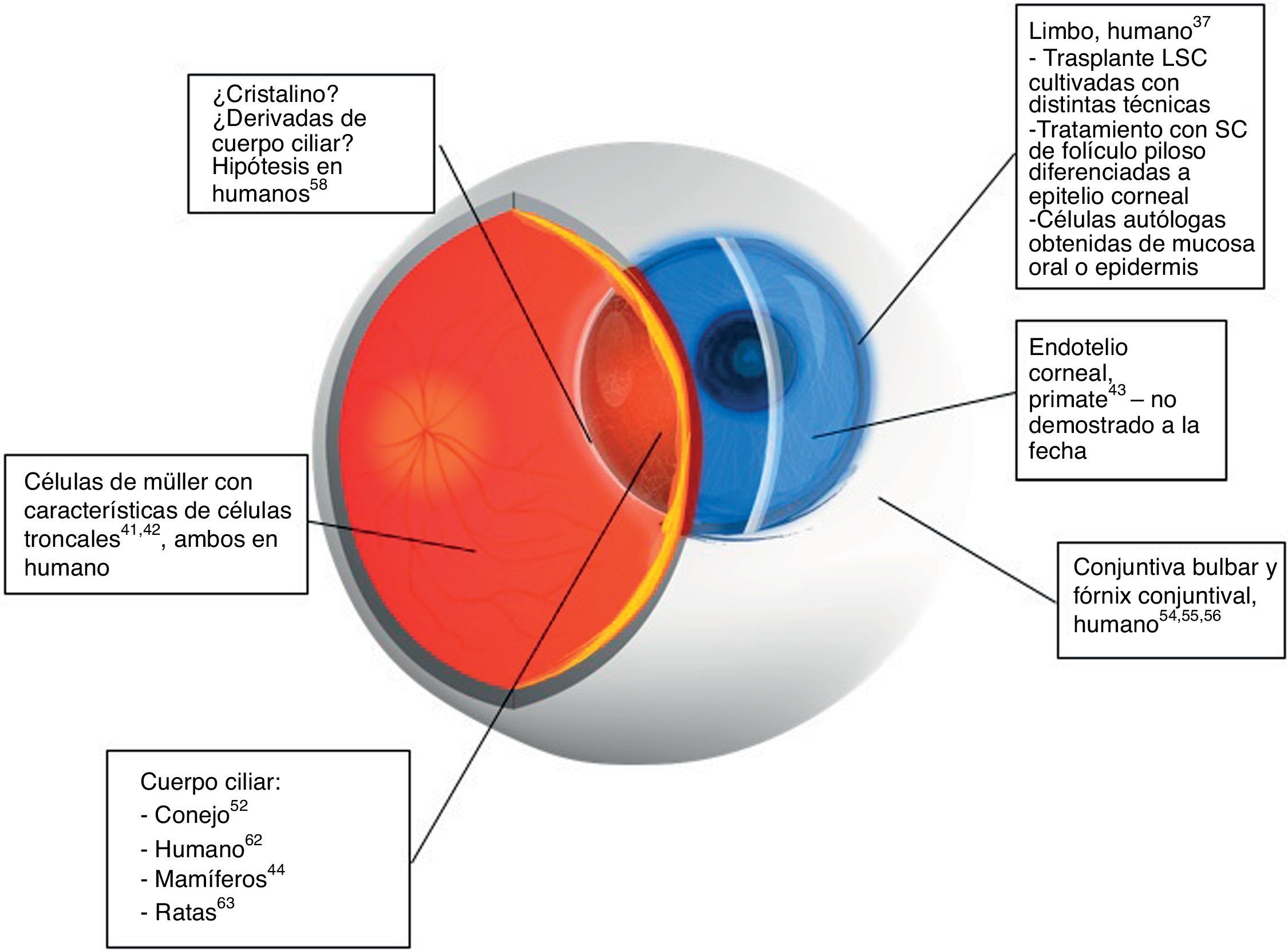
Con base en los resultados obtenidos, se han propuesto diferentes sitios de localización de las células troncales en tejidos oculares. De esta manera, en el segmento anterior, específicamente en el caso del epitelio que recubre la córnea, se sabe que las células troncales se encuentran en el estrato basal del epitelio del limbo. La evidencia que apoya esta localización proviene de las observaciones iniciales hechas por Davanger y Evensen, quienes las situaron preferentemente en los «rete-pegs» de las Palisadas de Vogt en el humano37. Esta propuesta fue reforzada posteriormente por experimentos que demostraron la distribución de marcadores de diferenciación terminal típicos del epitelio corneal38–40 (fig. 141–44). Observaciones posteriores confirmaron estos resultados y llevaron a proponer que las células troncales del limbo se extienden mucho más hacia el centro de la córnea, tanto en el limbo superior como en el inferior45,46, localización que les confiere protección al ser regiones cubiertas directamente por los párpados47. De manera adicional, el limbo presenta una serie de mecanismos protectores adicionales, como la intensa pigmentación de las células basales del limbo, derivada de los melanocitos localizados en las Palisadas de Vogt37,48, y que se sugiere, protege a esta población de los efectos de la radiación ultravioleta37,49.
Esquema que ilustra los posibles sitios de localización de las células troncales de los diferentes tejidos oculares. Estos sitios presuntivos se han propuesto con base en evidencias experimentales basadas en las propiedades de las células troncales, tales como retención de precursores del ADN, ausencia de marcadores de diferenciación, entre otros. Se indican aquellos sitios que han servido como fuente de células troncales tanto a nivel experimental como para uso terapéutico, o algunas alternativas de terapia mediante el uso de células troncales obtenidas de otros tejidos. Se debe tener en cuenta que el trasplante de células del epitelio limbal es el único procedimiento validado a la fecha.
Asimismo, otros sitios presuntivos de localización de las células troncales en el segmento anterior del ojo corresponden a la región adyacente a la línea de Schwalbe en el caso de la red trabecular y del endotelio corneal50–52, el fórnix para el epitelio conjuntival52–56, y la región limbal localizada por debajo del epitelio, para los queratocitos del estroma corneal57.
Por otra parte, para el polo posterior, los posibles sitios de alojamiento de células troncales para el cristalino parecen corresponder al cuerpo ciliar, estructura propuesta como fuente potencial de células troncales58. No obstante, en otros estudios donde se analizó la expresión de algunos marcadores de proliferación como el antígeno nuclear de proliferación celular y la ciclina D1, se concluyó que la zona germinativa del cristalino es el asiento de las células troncales de este tejido59. Puesto que existen otros resultados que sugieren que el sitio de albergue de las células troncales corresponde a la zona germinativa60, para el caso del cristalino aún existe una controversia que tardará en resolverse.
Desde hace varios años, diversos autores reportaron el aislamiento de células troncales de la retina del ratón61, de humanos62, conejos52 y ratas63, entre otros. Como característica común, estos estudios sugieren que las células troncales de la retina se encuentran en el margen ciliar de la misma. Sin embargo, un estudio reciente propuso que las células a las que se refieren estos trabajos en realidad son células del epitelio ciliar pigmentario ya diferenciadas, y no una población de auténticas células troncales64.
¿Es factible la aplicación terapéutica de las células troncales?La pasada década nos ha permitido ser testigos del progreso que permitió entender algunos de los mecanismos moleculares que subyacen en una amplia gama de enfermedades oftalmológicas. A pesar de ello, las opciones para el tratamiento de estos padecimientos son limitadas y solo permiten retrasar el inicio de la enfermedad, o disminuir su progresión. Por ello, la mayor parte del esfuerzo en investigación se ha enfocado en el desarrollo de nuevas estrategias terapéuticas que incluyen intentos de reemplazar las células dañadas mediante el trasplante. Entre estas destaca la activación de las células troncales endógenas para generar tejido funcional nuevo. Este enfoque es potencialmente atractivo debido a la capacidad regenerativa limitada de los tejidos, en especial de la retina65,66; no obstante, el poco conocimiento existente sobre la fisiología y la localización de las células troncales en el ojo, dificulta esta estrategia. Como enfoque alternativo, se ha intentado generar in vitro células de reemplazo que faciliten la reparación del daño ocular65–67 mediante el empleo de células troncales de diversas fuentes como las provenientes del estroma del tejido adiposo68, de la médula ósea69, o se ha recurrido al uso de células troncales embrionarias70 o a la reprogramación de células somáticas71 para su posterior inducción hacia procesos de diferenciación específicos.
La utilización de las células troncales abre un gran número de posibilidades en la terapia regenerativa debido su potencial de diferenciación y a su capacidad ilimitada de autorrenovación. No obstante, para el aislamiento de las células troncales existen dificultades metodológicas intrínsecas a la población misma. Una de estas es la carencia de marcadores moleculares específicos y confiables. Aunque se han identificado proteínas que podrían ser marcadores del carácter «stemness», parece ser que una célula troncal no puede clasificarse y aislarse mediante la detección de un solo marcador debido al sobrelapamiento existente en la expresión de estos marcadores entre las células troncales, células precursoras comprometidas y células en las etapas iniciales de la diferenciación terminal. Por la misma razón, en la actualidad, las metodologías existentes solo permiten el enriquecimiento de células troncales a partir de un tejido y, en el mejor de los casos, el trasplante terapéutico implica que el paciente reciba una mezcla de poblaciones celulares.
Bajo estas circunstancias, la complejidad biológica de las células troncales, así como la posibilidad de implantar en un paciente poblaciones celulares no bien caracterizadas, incluyendo el riesgo de trasplantar células que generen tumores asociados al alojamiento de las células implantadas en sitios no adecuados para la expresión del proceso de diferenciación, han llevado a la preocupación por establecer medidas que aseguren la identidad, pureza y potencial de la población a implantar.
Por otra parte, la obtención de células troncales a partir de tejidos oculares es técnicamente complicada, sobre todo para el segmento posterior. Para el segmento anterior, en la actualidad se realiza el trasplante de células del limbo contralateral, o en el caso de que este no sea posible, se lleva a cabo el trasplante de limbo proveniente de un donador compatible72,73. Ambas técnicas, ampliamente utilizadas, no se encuentran exentas de complicaciones, y en el caso del trasplante de células alogénicas, se requiere el uso de tratamientos inmunosupresores, lo que conlleva un mayor riesgo. Por este motivo, los esfuerzos terapéuticos se han dirigido a otras fuentes de células troncales para intentar la reparación de tejidos oculares. Entre estas, se ha pensado en la utilización de hESC6,74, de iPS75,76, de células troncales obtenidas de epitelio bucal77,78, o de células troncales de origen mesenquimal79,80.
No obstante, el desconocimiento existente sobre la regulación y características biológicas de las células troncales y de las iPS determinan que los intentos de trasplante y tratamiento de pacientes con esta tecnología se lleven a cabo con cautela y estableciendo medidas regulatorias estrictas que, esperemos, se apliquen en todos los países.
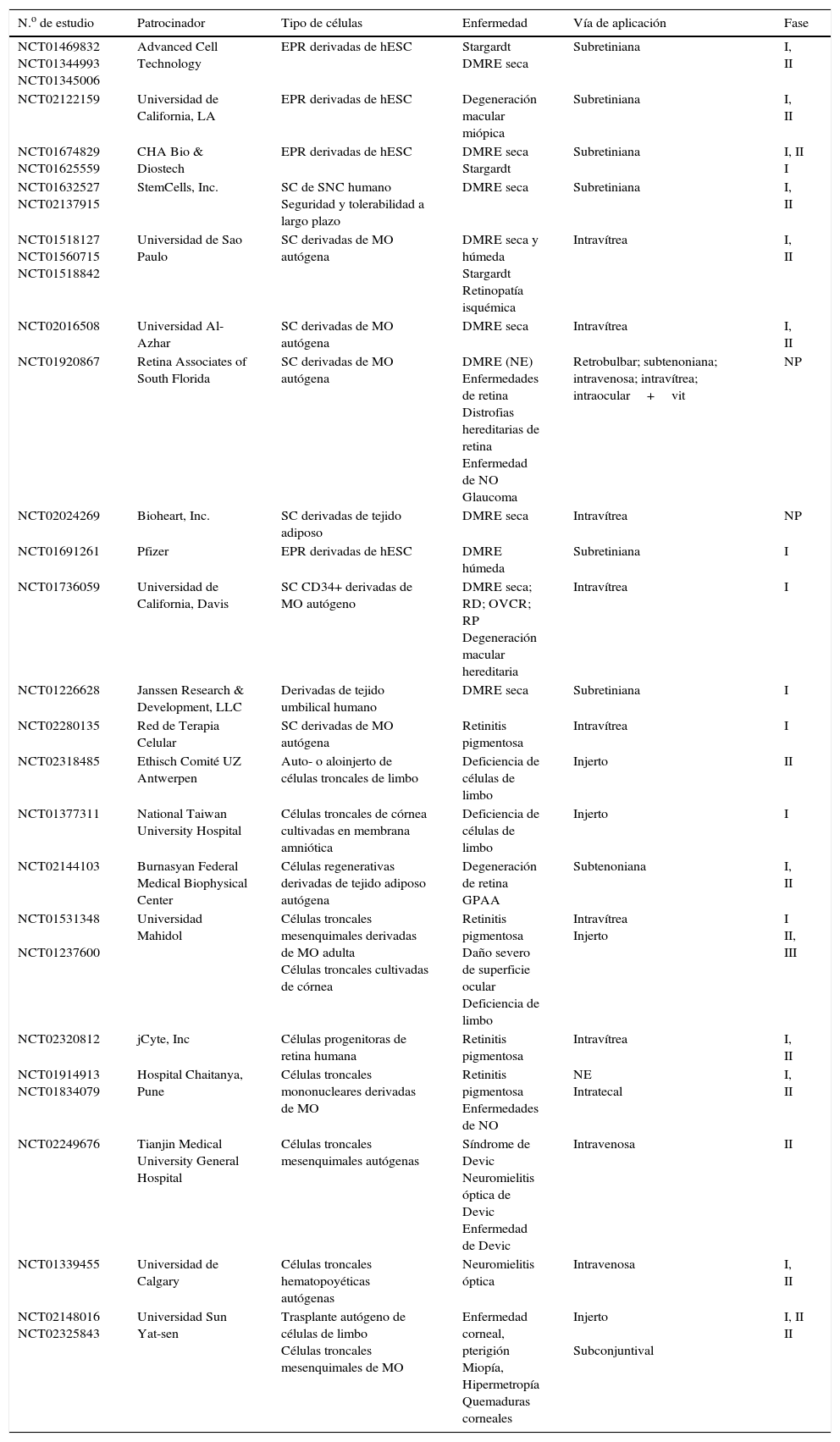
Enfermedades oculares tratables mediante células troncalesComo mencionamos anteriormente, a pesar del amplio campo de investigación abierto por las células troncales, su aplicación terapéutica se ha hecho con cautela, estableciendo medidas y regulaciones estrictas que intentan evitar las complicaciones previstas o ya detectadas en pacientes en los que se han implantado los derivados de estos tipos celulares. Sin embargo, a continuación enumeraremos algunos de los tratamientos existentes o que se encuentran en la etapa de ensayo clínico, para diferentes padecimientos oculares. De manera adicional, en la tabla 1 se enlistan los ensayos clínicos en marcha, que utilizan a las células troncales como posibles herramientas en la terapia oftalmológica.
Lista de estudios con células troncales de aplicación oftalmológica registrados en clinicaltrials.gov
| N.o de estudio | Patrocinador | Tipo de células | Enfermedad | Vía de aplicación | Fase |
|---|---|---|---|---|---|
| NCT01469832 NCT01344993 NCT01345006 | Advanced Cell Technology | EPR derivadas de hESC | Stargardt DMRE seca | Subretiniana | I, II |
| NCT02122159 | Universidad de California, LA | EPR derivadas de hESC | Degeneración macular miópica | Subretiniana | I, II |
| NCT01674829 NCT01625559 | CHA Bio & Diostech | EPR derivadas de hESC | DMRE seca Stargardt | Subretiniana | I, II I |
| NCT01632527 NCT02137915 | StemCells, Inc. | SC de SNC humano Seguridad y tolerabilidad a largo plazo | DMRE seca | Subretiniana | I, II |
| NCT01518127 NCT01560715 NCT01518842 | Universidad de Sao Paulo | SC derivadas de MO autógena | DMRE seca y húmeda Stargardt Retinopatía isquémica | Intravítrea | I, II |
| NCT02016508 | Universidad Al-Azhar | SC derivadas de MO autógena | DMRE seca | Intravítrea | I, II |
| NCT01920867 | Retina Associates of South Florida | SC derivadas de MO autógena | DMRE (NE) Enfermedades de retina Distrofias hereditarias de retina Enfermedad de NO Glaucoma | Retrobulbar; subtenoniana; intravenosa; intravítrea; intraocular+vit | NP |
| NCT02024269 | Bioheart, Inc. | SC derivadas de tejido adiposo | DMRE seca | Intravítrea | NP |
| NCT01691261 | Pfizer | EPR derivadas de hESC | DMRE húmeda | Subretiniana | I |
| NCT01736059 | Universidad de California, Davis | SC CD34+ derivadas de MO autógeno | DMRE seca; RD; OVCR; RP Degeneración macular hereditaria | Intravítrea | I |
| NCT01226628 | Janssen Research & Development, LLC | Derivadas de tejido umbilical humano | DMRE seca | Subretiniana | I |
| NCT02280135 | Red de Terapia Celular | SC derivadas de MO autógena | Retinitis pigmentosa | Intravítrea | I |
| NCT02318485 | Ethisch Comité UZ Antwerpen | Auto- o aloinjerto de células troncales de limbo | Deficiencia de células de limbo | Injerto | II |
| NCT01377311 | National Taiwan University Hospital | Células troncales de córnea cultivadas en membrana amniótica | Deficiencia de células de limbo | Injerto | I |
| NCT02144103 | Burnasyan Federal Medical Biophysical Center | Células regenerativas derivadas de tejido adiposo autógena | Degeneración de retina GPAA | Subtenoniana | I, II |
| NCT01531348 NCT01237600 | Universidad Mahidol | Células troncales mesenquimales derivadas de MO adulta Células troncales cultivadas de córnea | Retinitis pigmentosa Daño severo de superficie ocular Deficiencia de limbo | Intravítrea Injerto | I II, III |
| NCT02320812 | jCyte, Inc | Células progenitoras de retina humana | Retinitis pigmentosa | Intravítrea | I, II |
| NCT01914913 NCT01834079 | Hospital Chaitanya, Pune | Células troncales mononucleares derivadas de MO | Retinitis pigmentosa Enfermedades de NO | NE Intratecal | I, II |
| NCT02249676 | Tianjin Medical University General Hospital | Células troncales mesenquimales autógenas | Síndrome de Devic Neuromielitis óptica de Devic Enfermedad de Devic | Intravenosa | II |
| NCT01339455 | Universidad de Calgary | Células troncales hematopoyéticas autógenas | Neuromielitis óptica | Intravenosa | I, II |
| NCT02148016 NCT02325843 | Universidad Sun Yat-sen | Trasplante autógeno de células de limbo Células troncales mesenquimales de MO | Enfermedad corneal, pterigión Miopía, Hipermetropía Quemaduras corneales | Injerto Subconjuntival | I, II II |
Hasta ahora, son pocos los tratamientos con células troncales derivadas del limbo (LSC) aceptados por la comunidad médica y las autoridades regulatorias. La deficiencia de células de limbo (LSCD, por sus siglas en inglés) es una entidad oftalmológica frecuente que se asocia con inflamación crónica, neovascularización superficial, cicatrización y un epitelio corneal de mala calidad24,81. El procedimiento más aceptado y utilizado para resolver esta deficiencia es el trasplante de LSC42,82, utilizando autoinjertos en casos unilaterales, y aloinjertos de familiares o donadores cadavéricos en casos bilaterales. En el caso de los aloinjertos, se infiere la transferencia de células troncales provenientes del tejido donador, sin comprometer al tejido limbal de un ojo sano72, aunque los resultados obtenidos son mejores cuando se aplican autoinjertos83, por lo que incluso se han diseñado dispositivos para facilitar la procuración de LSC al tomar una biopsia de limbo73. Sin embargo, ambas técnicas no están exentas de complicaciones como pueden ser: i) el tamaño incorrecto del injerto, ii) la colocación en una posición inadecuada, iii) el grosor inapropiado del tejido implantado, iv) la generación de granuloma piógeno, v) y conjuntivalización, entre otros84,85; por lo que en ocasiones, es necesario realizar más de un trasplante para lograr buenos resultados86.
También se ha propuesto el uso de LSC cultivadas, tomando una pequeña biopsia de un limbo sano, y expandiendo las células ex vivo para después ser trasplantadas en un ojo con LSCD87–90. Se han reportado variaciones de esta técnica, diseñadas para mejorar la calidad y/o cantidad de las células trasplantadas, ya que se demostró que la cantidad de LSC obtenidas por cultivo in vitro es afectada por las condiciones91, es decir, se obtienen diferentes resultados que dependen de las diferentes técnicas utilizadas como el cultivo de las LSC sin capas de células alimentadoras ni suero92, así como el cultivo de LSC en un gel de fibrina93,94, o sobre lentes de contacto que contienen una capa de células alimentadoras95, o bien, LSC cultivadas sobre una membrana amniótica96–98. Incluso se ha descrito que las células troncales del folículo piloso se diferencian hacia células de epitelio corneal cuando estas se suplementan con medio condicionado por fibroblastos corneales, lo que hace de esta estrategia una alternativa para el trasplante autógeno de LSC99,100, así como también se propone el uso de células autógenas expandidas a partir de mucosa oral101–103 o epidermis104, para el tratamiento de la LSCD.
En estos procedimientos, la obtención de resultados aceptables parece ser una consecuencia de la participación de las células trasplantadas en la diferenciación epitelial y en la reparación tisular. Esto es apoyado por estudios de citometría de flujo y pruebas de ELISA, que de manera adicional sugieren que las células trasplantadas modulan la angiogénesis y la integridad de la matriz extracelular, facilitando el mantenimiento de un epitelio corneal sano y funcional105.
Por otra parte, para la reparación del epitelio conjuntival, se ha propuesto el uso de las células troncales de conjuntiva aisladas del fórnix y cultivadas in vitro para trasplantarse como reemplazo conjuntival después de una cirugía de pterigión, o para reparar una filtración de una vesícula filtrante cicatrizada25, sin embargo, su uso no ha sido extendido y no existe una técnica validada para su obtención.
RetinaEn varias enfermedades como la degeneración macular relacionada con la edad (DMRE), la enfermedad de Stargardt y la retinitis pigmentosa, se ha observado la disfuncionalidad del epitelio pigmentario de la retina (EPR). Estas enfermedades comparten una disminución visual severa secundaria a la pérdida de fotorreceptores en la mácula.
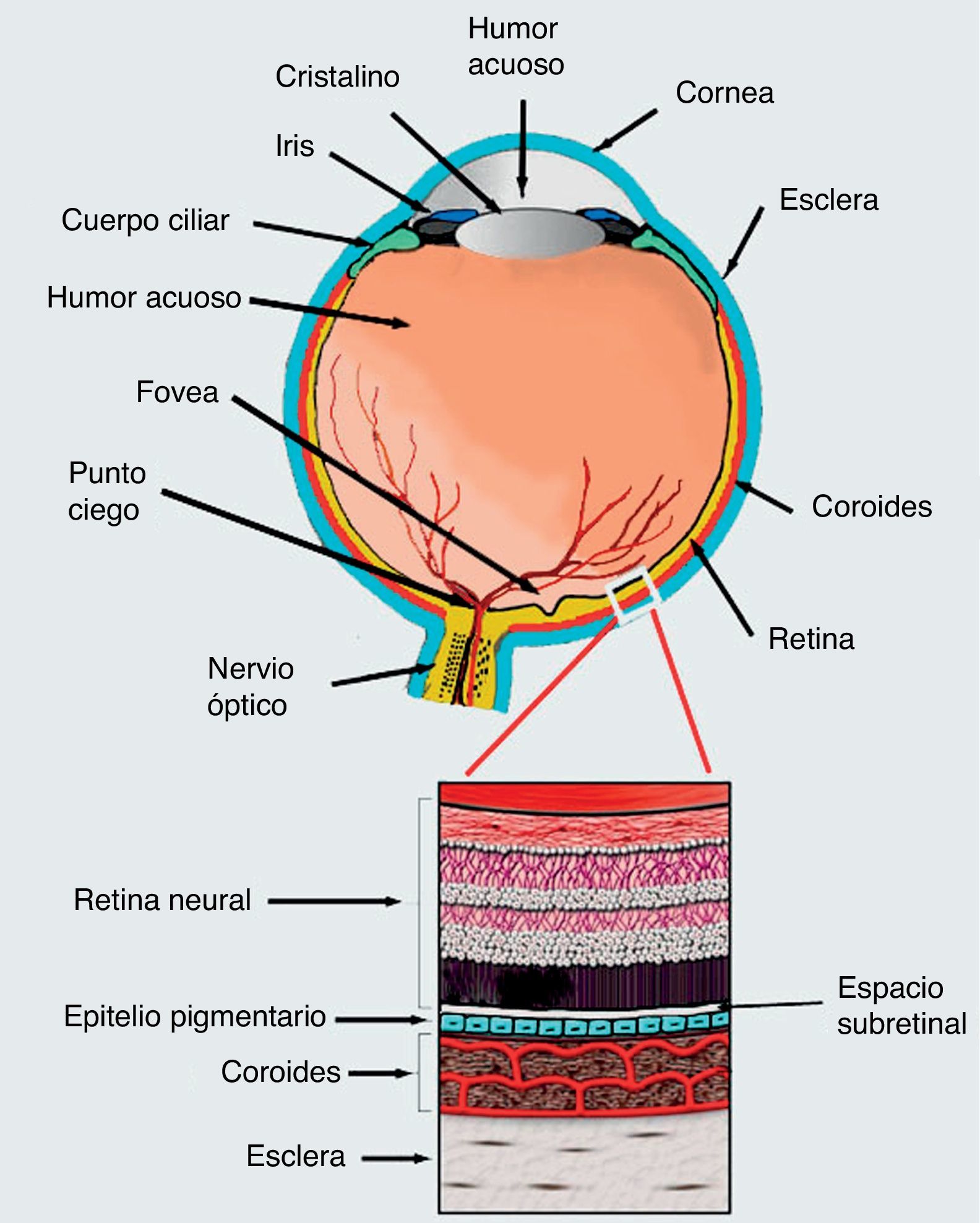
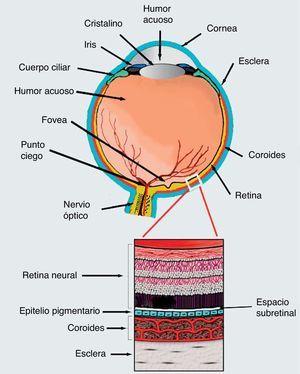
Para tratar estas enfermedades se ha propuesto la aplicación de células troncales como terapia alternativa a la fotocoagulación láser y a la terapia fotodinámica. Sin embargo, aún se debate acerca del tipo de célula troncal más adecuado para tratar la DMRE106. Hasta ahora, se han realizado varios estudios para evaluar esta posibilidad (tabla 1). Uno de los mejores ejemplos de factibilidad del uso de células troncales en enfermedades de retina proviene de los experimentos hechos por el grupo de Robert Lanza107,108. En este trabajo se evaluó la inyección de células de RPE obtenidas por diferenciación de hESC, en el espacio subretiniano de 2 pacientes; de estos pacientes, uno padecía enfermedad de Stargardt y otro DMRE. Se demostró que ambos pacientes tuvieron una mejoría en la agudeza visual de 5-7 letras de la cartilla. Sin embargo, los pacientes debieron mantenerse inmunosuprimidos para evitar complicaciones a nivel ocular107,108 (ensayo NCT01345006, tabla 1). En otro estudio realizado en un modelo de ratones con amaurosis congénita de Leber, hESC fueron inducidas a diferenciación para obtener células retinianas que, posteriormente, fueron trasplantadas en el espacio subretiniano (fig. 2), logrando la diferenciación de estas hacia fotorreceptores funcionales y restaurar la respuesta de los animales experimentales a la luz109.
Corte transversal del ojo. En la parte inferior se muestra un esquema de la estructura de la retina. Precisamente en el espacio subretiniano se inyectan las células embrionarias inducidas hacia diferenciación en epitelio pigmentario, y utilizadas exitosamente por el grupo de Robert Lanza de las células para el tratamiento de la DMRE húmeda o seca.
Recientemente, después de experimentar en monos y ratones para demostrar que los trasplantes de iPS a diferenciación no generan una respuesta inmune ni parecen formar tumores110,111; un equipo liderado por Yasuo Kurimoto del Hospital General del Centro Médico, y Masayo Takahashi del RIKEN Center for Developmental Biology, ambos de la Ciudad de Kobe, Japón, realizó el primer trasplante en humanos de epitelio pigmentario derivado de iPS reprogramadas a partir de fibroblastos dérmicos para tratamiento de la DMRE112,113. Aunque este primer intento de terapia regenerativa para pacientes con DMRE aún debe someterse a un seguimiento estrecho, los resultados se consideran un primer paso en la medicina basada en células troncales.
Por otro lado, se demostró que la aplicación intravítrea de células troncales mesenquimales de médula ósea tiene un efecto neuroprotector sobre las células ganglionares de la retina en un modelo de ratas con glaucoma114. Asimismo, Akrami et al. demostraron que el cultivo de células de EPR obtenidas de cadáver puede ser una fuente de células troncales de la retina115. No obstante, los resultados obtenidos en diferentes laboratorios sugieren fuertemente que las hESC y las iPS pueden generar EPR cuando se cultivan siguiendo un protocolo definido74–76,116,6.
A pesar de todos estos esfuerzos, los tratamientos en la retina se ven limitados debido a que los fotorreceptores no pueden sobrevivir si no están sobre un EPR funcional, y el EPR no crece sobre una membrana de Bruch dañada, por tanto, cualquier estrategia que pretenda aplicar una terapia dirigida contra una de las capas de la retina forzosamente tendrá que tomar en cuenta el estado general de la misma y necesariamente implica el diagnóstico temprano de la enfermedad5 (fig. 2).
En la tabla 1 se enlistan 30 ensayos clínicos actualmente en marcha, enfocados a la utilización de células troncales en enfermedades oculares. Como puede apreciarse, la mayor parte de estos son pruebas que tienen como objetivo el tratamiento de la DMRE húmeda o seca, aunque también se presentan otros tipos de terapias.
ConclusionesA pesar de las grandes expectativas generadas por el uso de las células troncales en medicina regenerativa, ya sea de origen embrionario, provenientes de tejidos adultos, o bien reprogramadas por introducción de genes específicos, el desconocimiento de la biología y de la fisiología de las células troncales se convierte en uno de los obstáculos más grandes para su aplicación terapéutica inmediata.
Entre las principales dificultades se encuentra la complejidad para purificar a la población, ya que los resultados experimentales obtenidos en diferentes laboratorios muestran que las células troncales comparten un gran número de marcadores de superficie con su progenie ya programada a diferenciarse en tejidos específicos, lo que lleva al riesgo de trasplantar células programadas hacia destinos diferentes al deseado, o de trasplantar células no diferenciadas que al localizarse en ambientes no adecuados inicien procesos de expresión genética que lleven a la formación de tumores.
Asimismo, existe el riego generado por el personal que considera al manejo de las células troncales como una metodología más. Debemos ser conscientes de que los procesos de diferenciación son mucho más complejos de lo que aparentan, y evitar confundir la expresión de un fenotipo con un proceso de diferenciación completo.
Es opinión de los autores que la terapia con células troncales debe retrasarse lo necesario, hasta que se disponga de un panorama mucho más completo sobre las formas de aislamiento, propiedades biológicas y regulación por componentes del nicho, que permita el tratamiento del paciente sin poner en riesgo su seguridad, visión y supervivencia.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciamientoEste trabajo fue financiado en parte por el donativo 138/2012 del Instituto de Ciencia y Tecnología del Distrito Federal (ICyTDF); por el Donativo del Consejo Nacional de Ciencia y Tecnología (CONACyT) No. 219601. Rosario Gulias Cañizo es becario de CONACyT (No 423634).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen el apoyo de la M. en C. Erika Sánchez Guzmán y al Sr José Juan Prado Barajas por su valiosa colaboración en el trabajo diario del laboratorio. También agradecen la colaboración de Santiago Gulias Cañizo por elaborar el diseño de la figura 1.