Mediante una simulación de campaña de diagnóstico a gran escala para glaucoma primario de ángulo abierto, determinar su prevalencia en colaboradores mayores de 40 años de edad en la Universidad de Monterrey. Describir el perfil clínico epidemiológico que presentan los sujetos portadores de glaucoma y conocer los beneficios y las limitaciones del diagnóstico de glaucoma a gran escala.
MétodosEstudio descriptivo, transversal, de tipo prevalencia, con una muestra de 92 sujetos. La muestra se obtuvo de la población total de colaboradores de la Universidad de Monterrey. Se determinó con un análisis de prevalencia simple la prevalencia de glaucoma primario de ángulo abierto con las siguientes variables: características de nervio óptico al observar fondo de ojo, índice de fibras nerviosas, técnica de van Herick y consentimiento por 2 oftalmólogos de los casos considerados como diagnóstico.
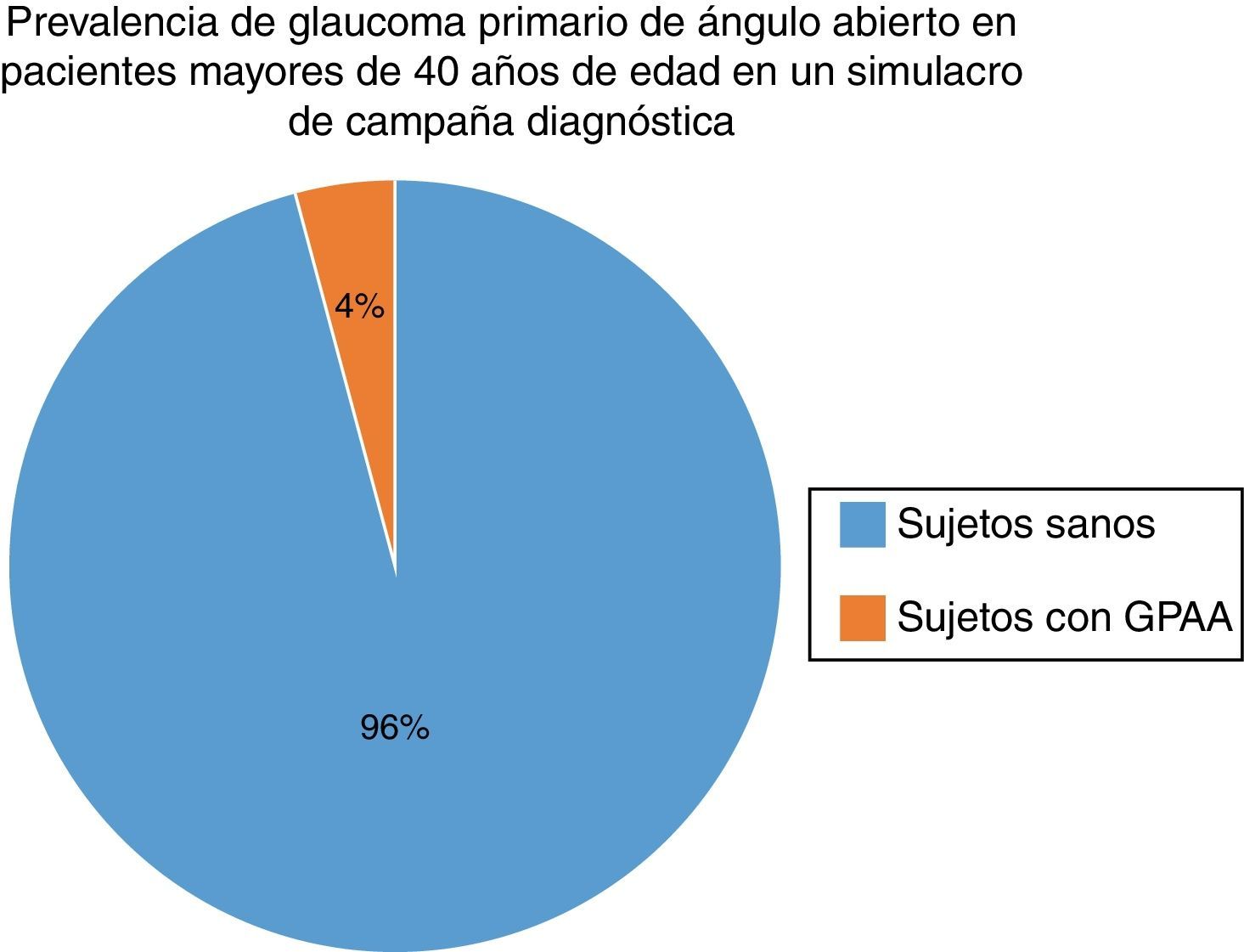
ResultadosSe identificó una prevalencia del 4.3% de sujetos portadores de glaucoma primario de ángulo abierto.
ConclusionesExisten escasos datos sobre la prevalencia de glaucoma de ángulo abierto en México. Los resultados de nuestro estudio coinciden con la bibliografía preexistente a nivel internacional. La evaluación completa y el diagnóstico de un gran número potencial de pacientes que presentan glaucoma son un trabajo muy complejo en términos de logística e impacto socioeconómico, es por eso que es imprescindible elaborar un método de tamizaje eficaz para posteriormente elegir qué pacientes necesitan un estudio completo.
By means of a simulation of a large-scale diagnostic campaign for primary open angle glaucoma, to determine its prevalence in subjects over 40 years of age in the University of Monterrey. To describe the clinical and epidemiological profile of the patients diagnosed with glaucoma and to learn the benefits and limitations of large-scale glaucoma diagnosis.
MethodsCross-sectional, descriptive, prevalence study with a 92-subject sample. The sample was obtained from the total population of collaborators over 40 years of age in University of Monterrey. By a simple proportion analysis the prevalence of primary open angle glaucoma was obtained with this variables: Van Herick iridocorneal angle depth estimation, evaluation through eye-fundus of optic nerve characteristics, Nerve Fiber Index by scanning laser polarimetry, and consent in diagnosis by two ophthalmologists in the cases that fulfill the requirements before mentioned.
ResultsA prevalence of 4.3% of primary open-angle glaucoma was identified.
ConclusionsThere is unreliable data over the prevalence of primary open-angle glaucoma in Mexico. The results of our study match consistently with the preexistent worldwide bibliography. The complete evaluation and diagnosis of patients with potential glaucoma is costly and logistically challenging work. Therefore, it is essential to develop an efficient and cost-effective screening method to further select which patients need a full evaluation.
El glaucoma es una patología ocular neurodegenerativa que se caracteriza por afectar, progresivamente, de manera estructural al nervio óptico y de manera funcional al campo visual1-3. Afecta aproximadamente a un 2 a 4% de la población mayor de los 40 años en el mundo4,5. Se considera la segunda causa más frecuente de ceguera en el mundo, después de la catarata, pero la primera que lo hace de manera irreversible6,7. El glaucoma se divide en 2 grupos: glaucoma primario y glaucoma secundario6. El primario tiene mayor relevancia epidemiológica por ser el más prevalente; se divide en glaucoma primario de ángulo abierto (GPAA) y glaucoma primario de ángulo cerrado4,8. El GPAA representa del 80 al 85% de los casos totales de glaucoma y tiene pocas manifestaciones clínicas que pasan desapercibidas por el paciente. La pérdida de visión se manifiesta en el campo visual y se detecta hasta en los estadios más avanzados, ya que la visión central suele estar preservada en etapas tempranas, por lo que el GPAA representa un reto para su detección temprana e inicio de un tratamiento oportuno9.
Estudios de prevalencia para GPAA se han realizado en todo el mundo, pero existe poca información confiable sobre su prevalencia en países latinoamericanos5-7,10,11. Según la Organización Mundial de la Salud, la prevalencia de ceguera en América Latina ronda entre el 1 y el 4%; en México esta es del 1.5%, pero no especifica hasta qué grado se debe a glaucoma12. Los resultados de los estudios en Latinoamérica muestran diversidad en la forma en que se hizo el diagnóstico, por lo que hace que se dude de la prevalencia obtenida, desconociéndose la misma en una población del noreste de México.
De conocer el comportamiento y el perfil clínico del glaucoma en población mexicana se podrán proponer estrategias de prevención, diagnóstico y manejo oportuno. Por eso es nuestro objetivo llevar a cabo una intervención de diagnóstico de GPAA abierto, que simule una campaña masiva de detección de la enfermedad, con la intención de determinar su prevalencia en colaboradores mayores de 40 años de edad en la Universidad de Monterrey. Es nuestra meta, al mismo tiempo, describir el perfil clínico-epidemiológico que presentan los sujetos portadores de glaucoma y finalmente conocer los beneficios y las limitaciones del diagnóstico de glaucoma a gran escala.
Material y métodosDiseño del estudio, población y muestreoMediante un estudio transversal, descriptivo, de tipo prevalencia, se obtuvo la proporción de pacientes con diagnóstico de glaucoma en la Universidad de Monterrey durante los días 12 a 16 del mes de octubre del 2015. Con un cálculo de muestra de tipo estimación de proporciones para una prevalencia esperada del 4%, intervalo de confianza del 95% y precisión del 5%, se estimó necesaria una muestra mínima de 56 pacientes. El mes de octubre del 2015 se invitó a todos los colaboradores de la Universidad de Monterrey (la universidad contaba con una base de 1,054 colaboradores en el año 2015)13 a una consulta oftalmológica completa gratuita, y por medio de este muestreo por cuotas obtuvimos una muestra de 101 pacientes. Los colaboradores de la Universidad de Monterrey son todos aquellos que trabajan para ella y no estudian: profesores, administrativos, guardias, jardineros, intendencia y cocineros. Los colaboradores de la Universidad de Monterrey son en su mayoría de nacionalidad mexicana, aunque al igual, que en una ciudad cosmopolita como es la ciudad de Monterrey y su área metropolitana, encontramos gente de diversas nacionalidades.
Criterios de inclusión, exclusión y eliminaciónCriterios de inclusión: sujetos mayores de 40 años de edad, de cualquier sexo y raza, que acudan a valoración durante los días 12 a 16 de octubre del 2015.
Criterios de exclusión: sujetos con alteraciones mentales o discapacidad que no permita la cooperación con el estudio, sujetos menores de 40 años.
Criterios de eliminación: sujetos que no firmen el consentimiento informado o decidan no continuar con evaluación en cualquier momento, sujetos con patologías que no permitan evaluar fondo de ojo y ángulo iridocorneal, sujetos que no cuenten con resultados mínimos de diagnóstico, que serían: sistema de clasificación de van Herick para ángulo iridocorneal, valores de polarimetría láser y mediciones de nervio óptico.
Procedimientos del estudioDurante 5 días se obtuvieron las variables de los participantes. Cada día se citó aproximadamente a 20 pacientes, de los cuales un equipo de 3 oftalmólogos, 2 médicos generales, un técnico en enfermería y 2 técnicos en optometría obtuvieron: consentimiento informado, historia clínica, paquimetría corneal central (Accupach VI; Accutome, Inc., Malvern, EE. UU.), tonometría portátil (Tono-Pen AVIA; Reichert, Buffalo, EE. UU.), autorrefracción (R-22; Canon, Tokio, Japón), exploración con lámpara de hendidura (Haag-Streit Bern; Haag-Streit AG, Koeniz, Suiza), estimación de ángulo iridocorneal de van Herick, perimetría automatizada (Humphrey Matrix; Carl Zeiss Meditec AG, Jena, Alemania), polarimetría láser (GDxPro; Carl Zeiss Meditec AG, Jena, Alemania), fotografía de nervio óptico (Pictor Plus; Volk, Mentor, EE. UU.) y tonometría de Goldmann (H03; Haag-Streit AG, Koeniz, Suiza). Todo el equipo contaba con experiencia previa en el manejo de todos los procedimientos de estudio. Todos los equipos estaban previamente calibrados con los estándares de fábrica.
El protocolo se llevó de la siguiente manera:
- 1.
La historia clínica y la explicación del consentimiento informado se realizaron por 2 médicos generales.
- 2.
Autorrefracción por 2 técnicos en optometría.
- 3.
La paquimetría corneal central (el paquímetro automáticamente arroja el promedio de 10 mediciones) y tonometría portátil se realizaron los primeros 3 días por un médico general y los últimos 2 días por un médico oftalmólogo.
- 4.
La perimetría y la polarimetría láser fueron supervisadas por una enfermera con experiencia previa en estos estudios. Se llevó a cabo perimetría FDT 24-2.
- 5.
Exploración con lámpara de hendidura, estimación de ángulo iridocorneal de van Herick y tonometría de Goldmann por 2 diferentes oftalmólogos cada día. La tonometría de Goldmann se realizó en 3 ocasiones por paciente y se promediaron las tomas.
- 6.
Fotografía de nervio óptico por 2 médicos generales.
Se consideró definición conceptual para GPAA «enfermedad ocular neurodegenerativa que se caracteriza por afectar, progresivamente, de manera estructural al nervio óptico y de manera funcional al campo visual, y que presenta un ángulo iridocorneal abierto». Como el daño a nervio óptico precede al del campo visual y como en todo campo visual alterado debe existir un daño nervioso glaucomatoso previo, se consideró el diagnóstico de GPAA cuando existiera documentación de daño a nervio óptico de tipo glaucomatoso sin ninguna otra patología que lo provoque, incluso al no haber alteración en campo visual, y al hallarse un ángulo iridocorneal abierto14.
Por lo tanto, la definición operacional para glaucoma fue cualquier paciente que presentara necesariamente:
- 1.
En uno o ambos ojos: índice de fibras nerviosas (IFN) en polarimetría láser > 51 y/o relación papila/disco óptico vertical > 0.5 y/o asimetría papila/disco óptico > 0.2 entre ambos ojos. Sin ninguna causa identificable que lo provoque14.
- 2.
En el paciente que cumplió el criterio número 1: ángulo iridocorneal abierto (equivalente a clasificación de van Herick grados iii o iv) en ambos ojos.
- 3.
En el paciente que cumplió los criterios número 1 y 2: que 2 oftalmólogos previamente entrenados, ciegos, coincidieran en el diagnóstico de glaucoma en los pacientes que presentaron los 2 puntos anteriores tomando en cuenta: edad, género, raza, antecedentes heredofamiliares, antecedente patológicos y quirúrgicos, autorrefracción, espesor corneal central, patrón de hemicampo visual, IFN de polarimetría láser, tonometría Goldmann, ángulo iridocorneal y fotografías de fondo de ojo.
La recolección de datos se llevó a cabo en un expediente individual para cada paciente en donde se documentó toda la información que se recopiló de él.
Se realizó una estadística descriptiva, el cálculo de la prevalencia y un análisis inferencial con prueba de la χ2 para buscar asociación entre las variables y el GPAA. Los cálculos y la descripción estadística se realizaron con los programas Epidat (versión 3.1; Organización Panamericana de la Salud, Galicia, España) y Excel:Mac (versión 2011; Microsoft, Albuquerque, EE. UU.).
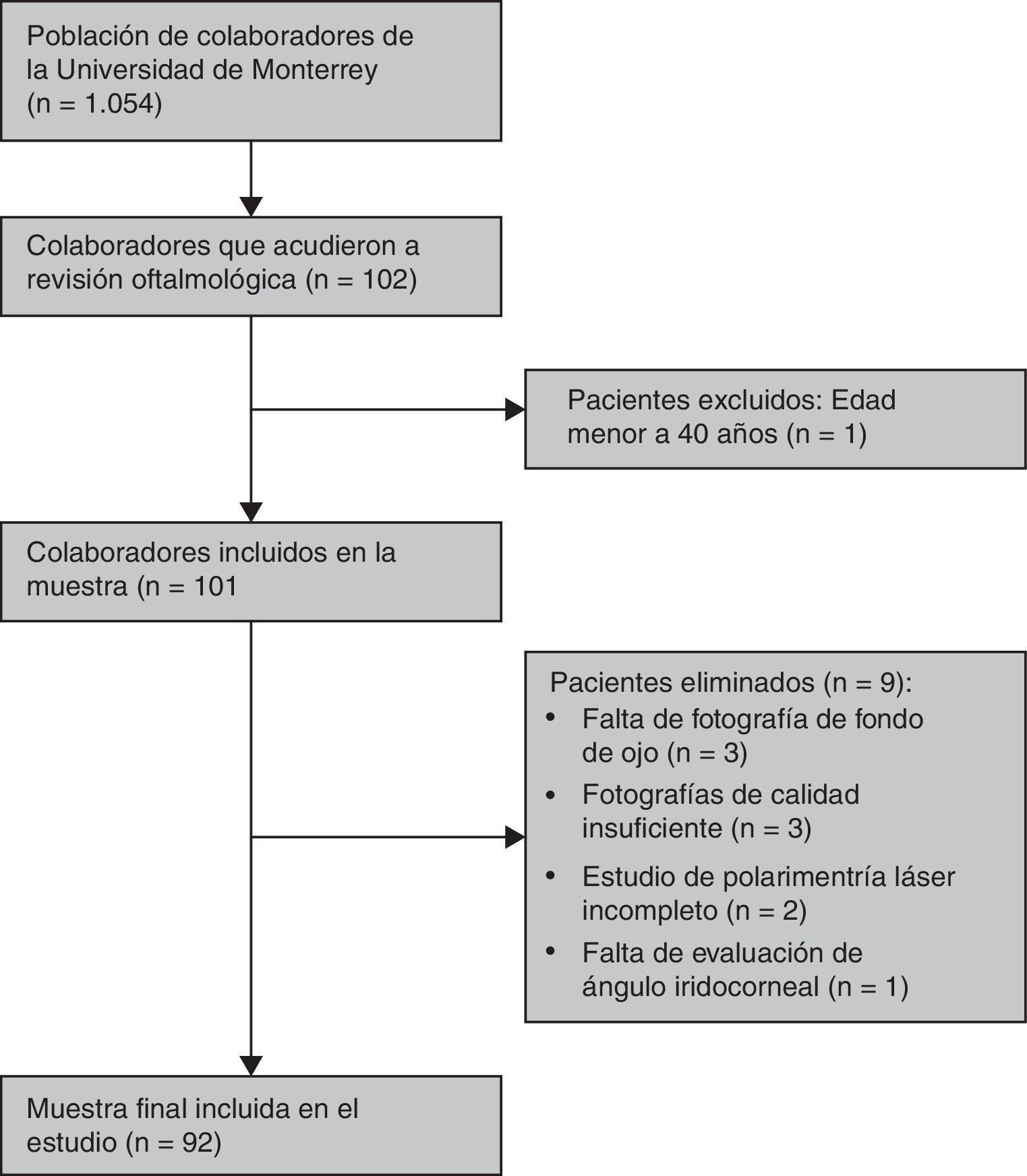
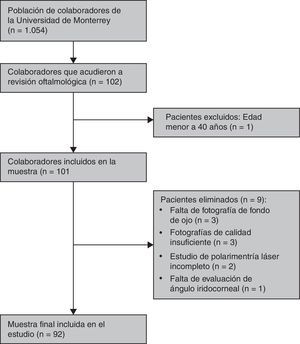
ResultadosDe los 101 sujetos incluidos en el estudio fueron eliminados 9, quedando un restante de 92 pacientes. De esos 9 sujetos eliminados, 3 fueron eliminados por faltar fotografías de fondo de ojo, 3 por fotografías de calidad insuficiente para su medición, 2 por estudio de polarimetría láser incompleto y uno por no contar con evaluación de ángulo iridocorneal (fig. 1).
La muestra definitiva incluyó 92 pacientes, 62 de género femenino (67.4%) y 30 de género masculino (32.6%). La edad mínima fue de 40 años y la máxima de 61 años, con una media de 48 años (tabla 1).
Información demográfica y clínica de pacientes evaluados para diagnóstico de glaucoma primario de ángulo abierto
| Demografía | |
| Edad, μ (DE) | 47.8 (5.5) |
| Masculino, n (%) | 30 (32.6) |
| Antecedentes | |
| APP diabetes mellitus 2, n (%) | 9 (9.8) |
| APP hipertensión arterial, n (%) | 5 (5.4) |
| APP glaucoma ya diagnosticado, n (%) | 3 (3.3) |
| APP queratocono, n (%) | 1 (1.1) |
| AHF glaucoma, n (%) | 17 (18.5) |
| Estudios diagnósticos | |
| Ángulo iridocorneal abierto, n (%) | 88 (95.7) |
| Polarimetría láser | |
| Índice de fibras nerviosas OD, Mdn (RQ) | 16 (9, 22.8) |
| Índice de fibras nerviosas OS, Mdn (RQ) | 17 (11, 26) |
| Índice de fibras nerviosas alterado, n (%) | 9 (9.8) |
| Fotografía de nervio óptico alterada, n (%) | 29 (31.5) |
| Miopía en autorrefracción, n (%) | 43 (46.7) |
| Perimetría alterada, n (%) | 20 (0.30) |
| Tonometría | |
| PIO con técnica de Goldmann OD, μ (DE) | 13.68 (2.55) |
| PIO con técnica de Goldmann OS, μ (DE) | 13.65 (2.47) |
| PIO fuera de límites normales, n (%) | 1 (1.1) |
AHF: antecedente heredofamiliar; APP: antecedente personal patológico; OD: ojo derecho; OS: ojo izquierdo; PIO: Presión intraocular.
De acuerdo con los criterios preestablecidos, se realizó un diagnóstico definitivo de GPAA en 4 de los 92 pacientes, resultando una proporción final de 4.348% mediante un cálculo de prevalencia simple.
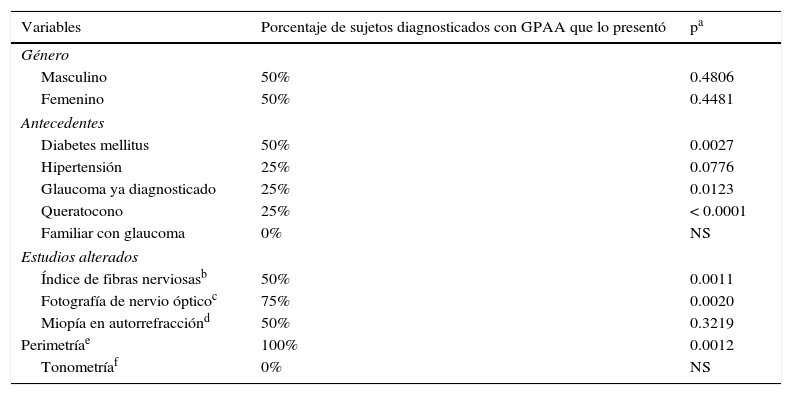
Con un análisis de la χ2 para análisis de asociación utilizando tablas de contingencia 2×2 simples se hallaron las siguientes correlaciones: las características con una relación estadísticamente significativa con GPAA fueron polarimetría láser con IFN > 51 en uno o ambos ojos (p=0.0011), nervios ópticos alterados con relación excavación/disco vertical > 0.5 en uno o ambos ojos o asimetría entre discos > 0.20 en uno o ambos ojos (p=0.0020), reporte verbal de antecedente patológico de glaucoma ya diagnosticado (p=0.0123), campimetría con un resultado determinado como «fuera de límites normales» en uno o ambos ojos (p=0.0012), reporte verbal de antecedente patológico de queratocono (p=< 0.0001) y reporte verbal de antecedente patológico de diabetes mellitus (p=0.0027). Las características que no mostraron correlación significativa fueron presión intraocular > 21mmHg en uno o ambos ojos (0% de pacientes diagnosticados con glaucoma presentó una tonometría alterada), reporte verbal de antecedente patológico de hipertensión arterial (p=0.0776), sexo masculino (p=0.4806), sexo femenino (p=0.4481), miopía por autorrefracción ≥ 1 dioptría en uno o ambos ojos (p=0.3219) y reporte verbal de antecedente heredofamiliar de glaucoma (0% de pacientes diagnosticados con glaucoma presentó un antecedente heredofamiliar positivo) (los resultados se muestran en la tabla 2).
Variables relacionadas con glaucoma primario de ángulo abierto
| Variables | Porcentaje de sujetos diagnosticados con GPAA que lo presentó | pa |
|---|---|---|
| Género | ||
| Masculino | 50% | 0.4806 |
| Femenino | 50% | 0.4481 |
| Antecedentes | ||
| Diabetes mellitus | 50% | 0.0027 |
| Hipertensión | 25% | 0.0776 |
| Glaucoma ya diagnosticado | 25% | 0.0123 |
| Queratocono | 25% | < 0.0001 |
| Familiar con glaucoma | 0% | NS |
| Estudios alterados | ||
| Índice de fibras nerviosasb | 50% | 0.0011 |
| Fotografía de nervio ópticoc | 75% | 0.0020 |
| Miopía en autorrefracciónd | 50% | 0.3219 |
| Perimetríae | 100% | 0.0012 |
| Tonometríaf | 0% | NS |
GPAA: glaucoma primario de ángulo abierto; NS: No significativo.
La evaluación completa de los sujetos tardó entre 30 min y 45 min por individuo.
Otros resultadosDe los 92 pacientes a los que se estudió, 2 pacientes no completaron el estudio de campimetría, 24 no fueron interpretables (presentaban ≥ 0.3 pérdidas de fijación, ≥ 0.2 errores falsos negativos o ≥ 0.2 errores falsos positivos en uno o ambos ojos). Se consideró que solo 66 de los 92 (71.73%) estudios de campimetría contaban con las características para determinarlas como interpretables. Las pruebas no se repitieron para evitar atraso en la evaluación del resto de los pacientes.
Solo 2 polarimetrías láser no se realizaron debido a pacientes con poca cooperación. El 100% de los pacientes incluidos en la muestra contaba con una polarimetría láser con una puntuación Q > 7.
Ochenta y ocho pacientes presentaron ángulo abierto por técnica de van Herick (95.7%), los 4 restantes presentaban un ángulo estrecho (4.4%).
DiscusiónVarma et al. reportaron en su estudio en población latina en Los Ángeles una prevalencia de 4.74% de GPAA, Rueda et al. reportaron 3.9% en Colombia, mientras Sakata et al., 3.4% en Brasil2,5,8. Como en nuestro trabajo, todos estos estudios se realizaron en sujetos mayores de 40 años. Nuestro resultado no difiere de lo ya reportado en la población latinoamericana (fig. 2). La prevalencia suele estar en el rango de 2 a 4% para la población mundial por encima de los 40 años4.
Se encontró una asociación no debida al azar concordante con los factores de riesgo demostrados ya en bibliografías anteriores. Hallamos que las características con una relación no azarosa son una polarimetría láser alterada, campimetría fuera de límites normales, nervios ópticos con datos patológicos, antecedente personal patológico de queratocono, diabetes mellitus o glaucoma. Todos estos son considerados factores de riesgo en estudios anteriores. Todas estas variables se consideran actualmente como factores de riesgo para GPAA. Al ser este un estudio descriptivo, no podemos medir fidedignamente cuál sería el poder causativo de estos agentes, por lo que sería recomendable realizar un estudio longitudinal en la población mexicana que nos ayude a determinar si estas características tienen un efecto significativamente positivo ante la posibilidad de desarrollar GPAA15.
Las características en que no hallamos una relación no debida al azar fueron una presión intraocular elevada, un antecedente personal patológico de hipertensión arterial y miopía, el género y el antecedente heredofamiliar de glaucoma. Nuevamente recomendamos que para tener una certeza de qué poder causativo tienen estos agentes sería adecuado realizar un estudio longitudinal en la población mexicana. El antecedente personal de miopía y el antecedente heredofamiliar de glaucoma son considerados factores de riesgo para el desarrollo de glaucoma. Para la presión intraocular elevada como factor de riesgo, existe actualmente controversia para considerarla como tal. Los motivos para que en nuestro estudio no se halle una asociación probablemente están dentro de nuestras limitantes: ser un estudio transversal descriptivo y contar con una muestra recolectada por cuotas.
De todos los estudios de campimetría realizados solo el 76% se consideró útil tras descartar estudios que tuvieran una cantidad suficiente de pérdidas de fijación, falsos negativos y falsos positivos como para considerarlos no interpretables. El estudio de campimetría que se considera diagnóstico es el algoritmo FDT 24-2, el cual tiene una duración de entre 10 a 15 min y el cual requiere una curva de aprendizaje por parte del paciente; además de ser necesario que el sujeto no cuente con impedimentos físicos o mentales y requerir un ambiente de iluminación adecuado y una modificación refractiva que no siempre se tiene a la mano rápidamente. En muchos de los criterios diagnósticos descritos para diagnóstico de GPAA se considera a la campimetría como un pilar fundamental para el diagnóstico9. Es ya conocido que para que exista un daño perimétrico es necesario que ya haya un daño al nervio óptico, es por eso que nosotros consideramos realizar un diagnóstico antes que las pruebas perimétricas estén «fuera de límites normales», y así realizar un diagnóstico más temprano que evite complicaciones en la población mexicana14. Es posible que la dificultad para realizar una prueba de campimetría en una campaña de diagnóstico masivo de glaucoma no sea la mejor opción como pilar de diagnóstico, ya que en este tipo de campañas es difícil, costoso y muchas veces requiere realizar una segunda prueba de campimetría (el 24% de los sujetos en nuestro estudio). Es necesario estudiar cuáles serían los estudios mínimos necesarios para realizar el diagnóstico de GPAA y comparar su eficacia y costo (ya sea monetario o de tiempo). De los pacientes diagnosticados con GPAA, el 100% obtuvo una campimetría «fuera de límites normales» comparado con el 50% que resultó con una polarimetría láser alterada. En cambio, la ventaja que obtuvo la polarimetría láser sobre la campimetría es que el 100% de los estudios resultaron útiles. Además, la realización de una polarimetría láser solo ronda entre los 2 y 4 min y no requiere una curva de aprendizaje del sujeto evaluado. Sería muy importante saber cuál de todos los estudios realizables en un paciente a evaluar de glaucoma se puede considerar un mínimo presente para el diagnóstico. Con un estudio longitudinal que nos demostrara la relación verdadera y temporal entre los cambios en la campimetría, polarimetría láser o daño visible a nervio óptico podríamos determinar qué estudio si es imprescindible, cuál no, considerando sus pros y sus contras, y buscar una manera de realizar un tamizaje masivo para pacientes que presentan de GPAA de manera más costo-efectiva.
Es preferible que en una campaña de diagnóstico masivo de glaucoma en la que se desee utilizar la campimetría como criterio diagnóstico, se utilice un algoritmo rápido que nos permita detectar a qué pacientes se les debe realizar una perimetría completa FDT 24-2.
Al tomar las fotografías de nervio óptico con la cámara especializada para fotografías de fondo de ojo encontramos también dificultades para una campaña de diagnóstico masivo de glaucoma en la que la celeridad es prioritaria. Sin un ambiente con iluminación tenue y con ojos previamente dilatados será necesario tomar varias fotografías antes de obtener un resultado adecuado, y en algunos casos incluso, puede ser imposible obtener una fotografía de calidad. En casos en que no se toma el cuidado pertinente, las fotografías podrían resultar inutilizables por su mala calidad. En nuestro estudio, estas medidas no fueron tomadas y en ciertas ocasiones se tuvo que repetir la toma de la fotografía.
Como mencionamos antes, las limitaciones de nuestro estudio serían que es un estudio de prevalencia (descriptivo transversal) y que la muestra se recolectó por cuota. Aunque toda la población fue invitada a participar y se les facilitó la suspensión de sus labores para su revisión, menos del 10% acudió, probablemente debido a que no pudieron suspender las labores o no estuvieron interesados. Un estudio descriptivo transversal no tiene el poder de causalidad para conocer cuáles son los factores de riesgo más importantes y cuáles alteraciones de nuestros estudios diagnósticos resultan más comprometedoras para realizar el diagnóstico, es por eso que creemos sería de importancia el poder realizar un estudio que nos determine tales características. Un estudio con una muestra por cuota no tiene el poder estadístico ni de asociación adecuado y la mejor manera de obtener resultados completamente fiables sería recolectar una muestra aleatoria simple. Nuestro objetivo era conocer la prevalencia de glaucoma dentro de nuestra muestra y se realizó de manera estadísticamente satisfactoria, pero su validez externa queda comprometida. No se puede extrapolar la prevalencia de glaucoma entre 92 colaboradores de una universidad privada en una ciudad de alto nivel de ingreso a la población nacional de México. Otro de nuestros objetivos fue conocer cuáles serían los beneficios y las limitaciones más destacables al realizar una campaña masiva de diagnóstico de glaucoma, y hemos encontrado lo difícil que es considerar la campimetría como un pilar diagnóstico debido a la facilidad en que una prueba puede resultar no interpretable. La evaluación completa de nuestros sujetos tardó entre 30 min y 45 min, tiempo que se reduciría importantemente utilizando solo los estudios que se puedan considerar mínimos para el diagnóstico de glaucoma, además de disminuir el costo para las instituciones de salud. Es también de importancia recalcar que la definición de glaucoma está en constante evolución y no permite establecer aún los criterios definitivos para su diagnóstico16.
Con un 4.3% de prevalencia de glaucoma en la población mexicana significaría que de los 112,336,538 de mexicanos (en 2010) 4,830,471 están en peligro de en algún momento presentar la enfermedad y convertirse en población potencialmente ciega. La carga económica del GPAA es también de importancia, como fue reportado por García Luna Martínez et al., el GPAA puede costar hasta $ 659,000,000 USD por año a las instituciones de salud pública en México17. Es de extremada relevancia hallar la manera de diagnosticar el GPAA antes de que produzca secuelas en la visión18.
ConclusiónEs discutible si la campimetría es realmente un estudio pilar diagnóstico útil en los casos de campañas diagnósticas masivas en que no es fácil invertir tanto tiempo en cada paciente y en que repetir pruebas resulta contraproducente. Puede utilizarse un algoritmo rápido como detección de los pacientes que realmente necesitan el algoritmo diagnóstico completo FDT 24-2.
Aún conocemos muy poco sobre los procesos fisiopatológicos del glaucoma y creemos que su definición aún se halla inconclusa. Todo esto impide que podamos tener una guía para su diagnóstico y tratamiento 100% efectiva. Seguramente, mucho de lo que conocemos actualmente en glaucoma cambie en los próximos años. Si sumamos a todo esto que no existen criterios diagnósticos para glaucoma universalmente aceptados, difícilmente podremos conocer los detalles epidemiológicos de la enfermedad. Conociendo la asociación que exista entre estudios alterados podría hallarse una combinación de pruebas diagnósticas que evite pasar por alto pacientes con GPAA temprano y al mismo tiempo resultar sustentable para las instituciones de salud del país. Es de interés prioritario que se conozca la efectividad de los estudios que evalúan el daño a nervio óptico ya que este es el daño más temprano que ocurre en el glaucoma.
Existen escasos datos sobre la prevalencia de glaucoma de ángulo abierto en México. Los resultados de nuestro estudio coinciden con la bibliografía preexistente. La evaluación completa y diagnóstico de un gran número potencial de pacientes que presentan glaucoma es un trabajo muy complejo en términos de logística e impacto socioeconómico, es por eso que es imprescindible elaborar un método de tamizaje eficaz para posteriormente elegir qué pacientes necesitan un estudio completo. Recomendamos un estudio longitudinal que nos ayude a tomar dichas decisiones.
Aspectos éticosEl protocolo estuvo apegado a la buena práctica ética médica de acuerdo a las declaraciones de Helsinki y ha sido aprobado por el Comité de Ética de la Universidad de Monterrey.
Todo paciente estuvo de acuerdo y firmó un consentimiento informado antes de ser evaluado.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciamientoLos autores no recibieron patrocinio para llevar a cabo este artículo.
Institutos colaboradoresUniversidad de Monterrey, Fundación Ojos para México, Centro de Oftalmología Monterrey, Centro Oftalmológico del Valle.
Conflicto de interesesEste estudio estuvo autofinanciado por la Fundación Ojos para México. Los autores no poseen ningún interés personal o comercial en el material discutido en este artículo.