Objetivos: Reportar la frecuencia y características microbiológicas de los patógenos cornéales más comúnmente aislados en queratitis infecciosas en un centro de referencia oftalmológica en México, así como reportar los patrones de resistencia y sensibilidad in vitro a los antibióticos comúnmente usados en la comunidad.
Material y métodos: Estudio retrospectivo, muestras obtenidas de córneas con diagnóstico de queratitis infecciosa en el periodo entre enero-diciembre 2011. Se analizaron resultados de cultivos, tinciones y antibiogramas.
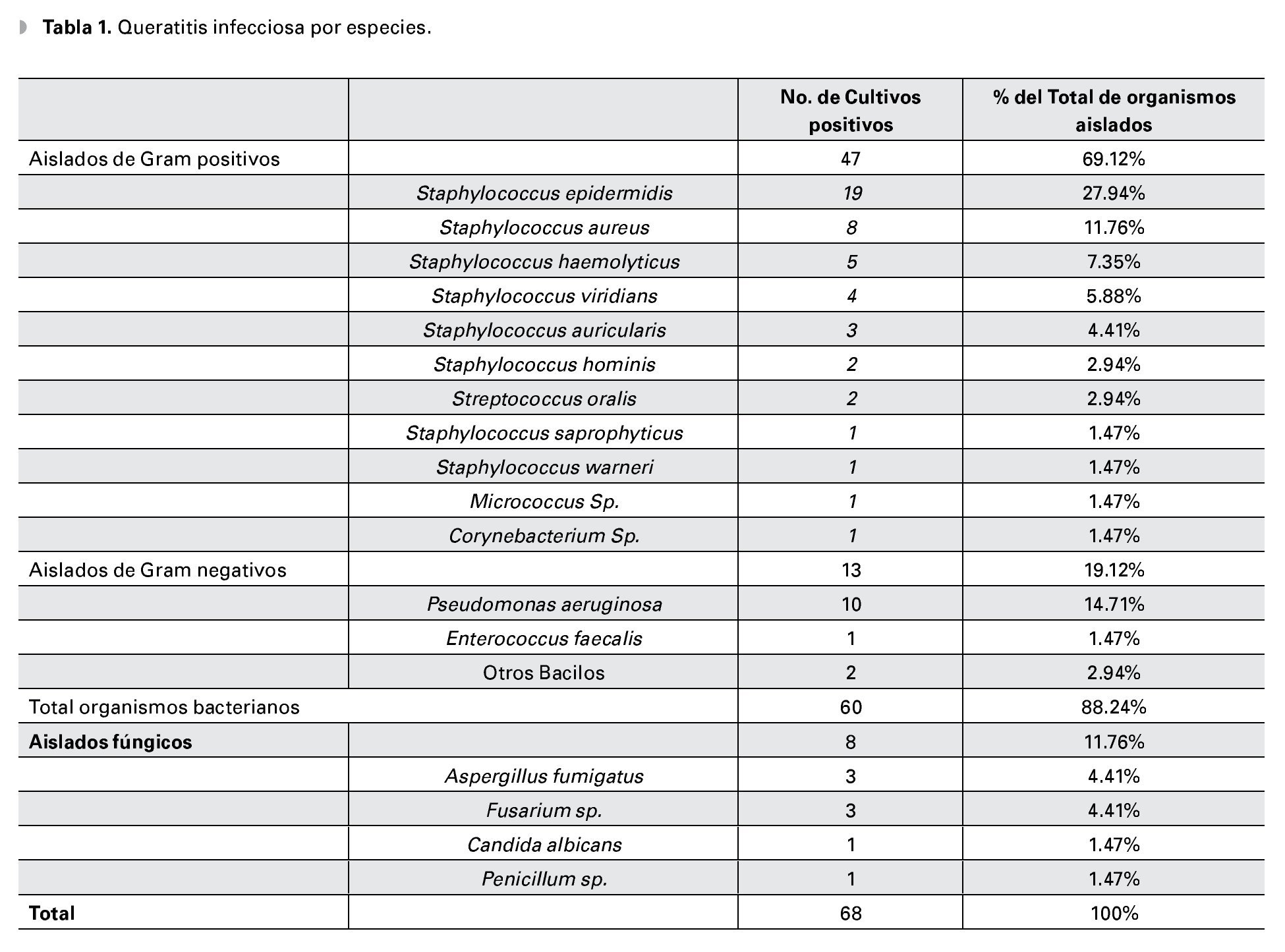
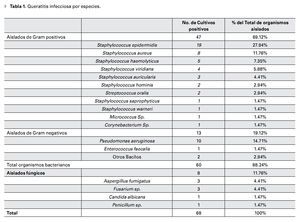
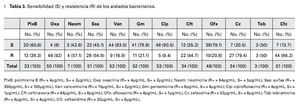
Resultados: Total de 154 raspados cornéales tomados durante el estudio. Se obtuvo patógenos en 68 muestras (44.15%), 60 (88.2%) atribuidas a organismos bacterianos. El Staphylococcus epidermidis (S. epidermidis) fue el organismo más comúnmente aislado y la Pseudomonas aeruginosa el Gram negativo más común. El 90.57%, 83.02% y 78.85% de los cultivos fueron sensibles a ciprofloxacino, vancomicina y gentamicina, respectivamente. Se mostró resistencia a ceftazidima en 86.27% de total de los cultivos y en 100% de los aislados de Pseudomonas. El 100% de los cultivos de S. epidermidis fueron resistentes a oxacilina y tobramicina.
Conclusiones: Dada la alta sensibilidad de los principales microorganismos a quinolonas, se recomiendan como tratamiento empírico inicial en queratitis infecciosas. Se observó una resistencia absoluta de los Gram positivos a tobramicina y oxacilina, así como una resistencia generalizada a cefalosporinas.
Objectives: To report the frequency and microbiological characteristics of the most commonly isolated corneal pathogens from infectious keratitis in a reference center in Mexico City. To describe the in vitro resistance and sensitivity patterns to the common use antibiotics in the community.
Material and methods: Retrospective study, samples were obtained from corneas with diagnosis of infectious keratitis in the period January-December 2011. Results of cultures, stains and antibiograms were analyzed.
Results: A total of 154 corneal scrapes were taken during the study period. Pathogens were obtained in 68 samples (44.15%), 60 (88.2%) of them attributed to bacterial organisms. Staphylococcus epidermidis (S. epidermidis) was the most common isolated organism and Pseudomonas aeruginosa the most common Gram negative. The 90.57%, 83.02% and 78.85% of the isolates were sensitive to ciprofloxacin, vancomycin and gentamicin respectively. Resistance to ceftazidime was observed in 86.27% of the isolates and in 100% of the Pseudomonas isolates. All the S. epidermidis isolates were oxacillin and tobramycin resistant.
Conclusions: The most common causative microorganisms were sensitive to quinolones; hence we recommend its use as empiric treatment in infectious keratitis. An absolute resistance to tobramycin and oxacilina was observed in Gram positives as well a generalized resistance to cephalosporins.
¿Introducción
Las úlceras corneales de origen infeccioso son una emergencia oftalmológica que amenaza la visión y la integridad estructural del ojo, por tanto requiere tratamiento inmediato. Los microorganismos causales más comunes son las bacterias. Los virus y los hongos son los patógenos responsables en un porcentaje menor de los casos. Es de suma importancia conocer el espectro de microorganismos causantes de infecciones oculares en una comunidad y su susceptibilidad a antibióticos, dada la variación en la prevalencia de los primeros dependiendo de la región geográfica y del nivel de urbanización de la población estudiada.1-3 El manejo de cualquier proceso en el que se sospeche de infección microbiana, debe comenzar con la recolección de muestras para cultivo y tinciones, para inmediatemente después comenzar con terapia antimicrobiana empírica.4,5 El tratamiento inicial puede ser realizado con un solo agente antimicrobiano o con la combinación de varios de ellos, siempre buscando proveer una cobertura de amplio espectro contra microorganismos Gram positivos y Gram negativos.6 La antibioticoterapia específica, idealmente, requiere un diagnóstico etiológico, que surge de la combinación de la observación de las características clínicas específicas y de los resultados de la investigación microbiológica iniciada previamente.1 Una vez que se logra aislar un microorganismo, es posible modificar el tratamiento de acuerdo a los patrones de sensiblidad in vitro.
Los antibióticos oftálmicos son prescritos ampliamente con finalidades terapéuticas en caso de infecciones oculares o como profilaxis previa a cualquier tipo de cirugía ocular. La exposición repetida de la flora ocular a antibióticos puede favorecer la selección de cepas bacterianas resistentes a los mismos y propiciar la formación de microorganismos multirresistentes, afectando así la estrategia terapéutica de las infecciones oculares.7 Se demostró que la exposición repetida de la flora ocular y nasofaríngea a antibióticos tópicos, condujo a la resistencia de tres y cinco antibióticos de uso común en el 82% y 68% de las cepas de estafilococo coagulasa negativa (ECN).8
En los últimos años se han observado patrones similares de multirresistencia a antibióticos en cepas de Staphylococcus aureus y Enterococcus Sp., incluso a fluoroquinolonas de cuarta generación.9 Estos reportes alertan sobre el surgimiento de multirresistencia a antibióticos usados rutinariamente en infecciones oculares en la comunidad, lo cual pudiera resultar en una mayor tasa de complicaciones oculares y un deterioro en el pronóstico visual.
El presente estudio tiene como objetivo reportar la frecuencia y características microbiológicas de los patógenos corneales más comúnmente aislados en queratitis infecciosas en un centro de referencia oftalmológica en México, así como reportar los patrones de resistencia y sensibilidad in vitro a los antibióticos comúnmente usados en la comunidad. Finalmente, se proveen recomendaciones sobre nuevas tendencias en investigación microbiológica y uso de antibióticos en la terapia de las queratitis infecciosas.
¿ Material y métodos
Estudio retrospectivo realizado en el Instituto de Oftalmología Fundación "Conde de Valenciana" de enero de 2011 a diciembre de 2011. Se analizó la base de datos del Departamento de Microbiología y Proteómica Ocular de la misma Institución, para identificar las muestras obtenidas de raspados corneales de córneas con diagnóstico de queratitis infecciosa en el periodo mencionado. La base de datos posteriormente fue utilizada para obtener información demográfica básica y resultados de las tinciones, cultivos y la posterior sensibilidad y resistencia a antibióticos.
Los cultivos corneales se tomaron de manera rutinaria utilizando un hisopo de alginato de calcio, previa instilación de anestésico tópico (tetracaína, Ponti Ofteno, Laboratorio Sophia, Zapopan, Jalisco, México). Posteriormente se inocularon cuatro medios sólidos (agar sangre, agar chocolate, sal manitol y Sabouraud) y uno líquido (caldo de infusión cerebro-corazón). Los medios fueron cultivados bajos las condiciones atmosféricas apropiadas (37ºC/5% CO2). Los cultivos fueron determinados como positivos cuando hubo crecimiento en la línea de inoculación en al menos un medio sólido. Se realizaron tinciones de Gram y Giemsa para todas las muestras, sin embargo una microscopia positiva para tinción en ausencia de crecimiento bacteriano en el cultivo fue considerado como evidencia insuficiente para crecimiento de microorganismos.
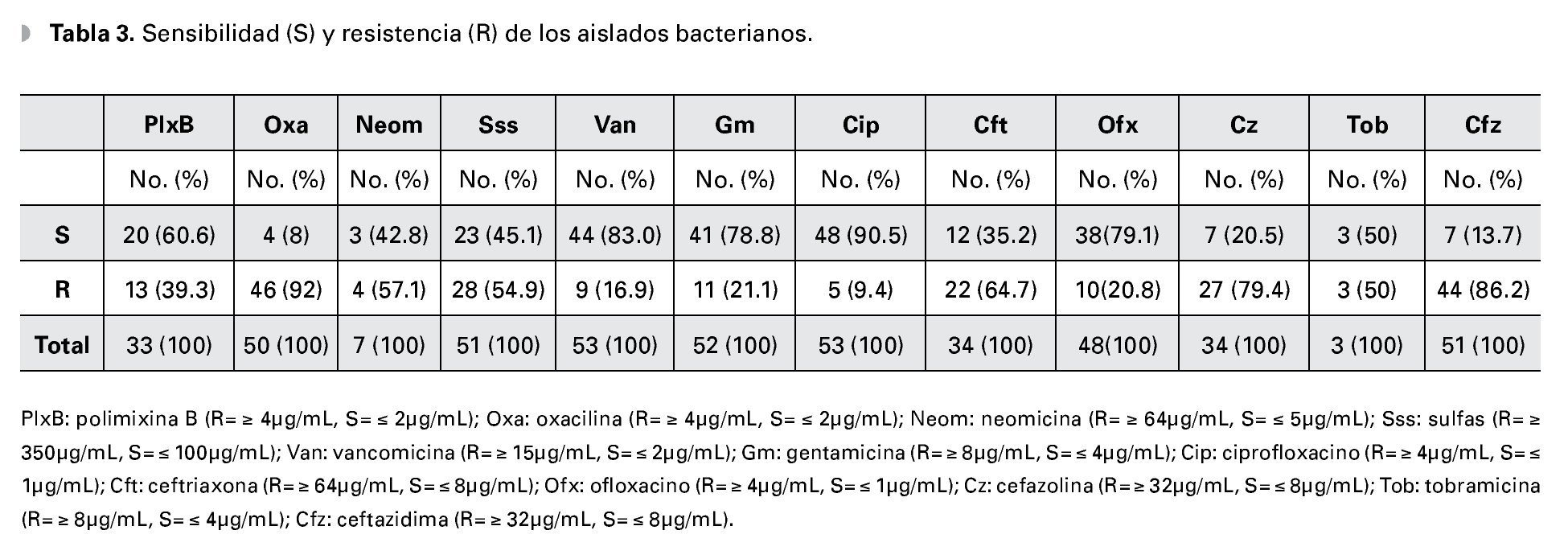
Se utilizó el sistema automatizado VITEK® (Laboratorio bioMérieux, Francia) para identificación bacteriana, y se determinó la sensibilidad antimicrobiana utilizando en método de difusión de disco de agar de acuerdo a las normas sugeridas por el Clinical and Laboratory Standard Institutes (CLSI), analizando 12 antibióticos utilizados rutinariamente en patologías infecciosas oculares: polimixina B (50 μg), oxacilina (1 μg), neomicina (30 μg), sulfas (300 μg), vancomicina (30 μg), gentamicina (30 μg), ciprofloxacino (5 μg), ofloxacino (5 μg), ceftriaxona (30 μg), cefazolina (30 μg), ceftazidima (30 μg) y tobramicina (10 μg).
¿ Resultados
Demografía
Durante el periodo comprendido entre enero de 2011 a diciembre de 2011, 154 muestras de raspados corneales fueron recolectadas de 154 pacientes. Setenta y cinco pacientes fueron mujeres (48.70%) y 79 (51.30%) fueron hombres. La edad promedio de los pacientes fue de 47.79 ± 22.44 años, con un rango de 1-88 años. El 55.8% de las muestras analizadas (86/154 muestras) tenían tratamiento con algún tipo de antibiótico tópico, previo a la realización de cultivo y tinciones.
El cultivo fue positivo en 44.15% (68 aislados) de las muestras, identificándose 18 diferentes microorganismos (Tabla 1), sin reportarse infecciones polimicrobianas.
Características clínicas
Se registraron los hallazgos relevantes (clínicos, factores de riesgo) para los cinco microorganismos bacterianos y para los organismos fúngicos más comúnmente aislados en el estudio (Tabla 2). El 47.3% (9/19) de las queratitis por Staphylococcus epidermidis tuvieron una evolución mayor a las dos semanas al momento de la presentación. Se describió un infiltrado inflamatorio denso y secreción abundante en el 62.5% (5/8) de los casos por Staphylococcus aureus. Fue observado el uso de lente de contacto blando como factor asociado en el 40% (4/10), y el antecedente de herida corneal (traumática o quirúrgica) en el 30% de los casos por queratitis por Pseudomonas, así como la presencia de hipopion en el 30% de los casos. El 60% de las queratitis por Staphylococcus haemolyticus tuvieron una evolución menor a los tres días, y el 75% de las úlceras corneales asociadas a Streptococcus viridans tuvieron una evolución mayor a tres semanas al momento de la presentación. Se describió una evolución mayor a 30 días, la presencia de un aspecto "emplumado" en el borde de la úlcera y uso previo de esteroides en el 50% de las queratitis fúngicas.
Cultivos y tinciones
Las bacterias fueron responsables del 88.2% (60 aislados) de los cultivos positivos, 11.8% (ocho aislados) de cultivos positivos para infecciones fúngicas y no hubo reportes de queratitis por parásitos.
El 69% (47) del total de los aislados fueron bacterias Gram positivos. El Staphylococcus epidermidis fue el organismo bacteriano más comúnmente cultivado (19 aislados, 27.94%), seguido de Pseudomonas aeruginosa (10 aislados, 14.71%) y Staphylococcus aureus (ocho aislados, 11.76%) (Tabla 1). En orden de frecuencia, los organismos Gram positivos después del Staphylococcusepidermidis y Staphylococcusaureus fueron el Staphylococcus haemoliticus (cinco aislados, 7.35%) y el Staphylococcus viridans (cuatro aislados, 5.88%). Después de la Pseudomonas aeruginosa, el Enterococcus faecalis fue el organismo más representativo en los aislados bacterianos Gram negativos (un aislado, 1.47%).
En todos los casos donde los cultivos fueron positivos, la tinción se correlacionó con el tipo de microorganismo aislado. En 10.46% (9/86) de los cultivos donde no se reportó desarrollo bacteriano, se reportó tinción para Gram positivo (ocho cocos Gram positivos y un bacilo Gram positivo).
Sensibilidad a antibióticos de uso común en oftalmología
- General
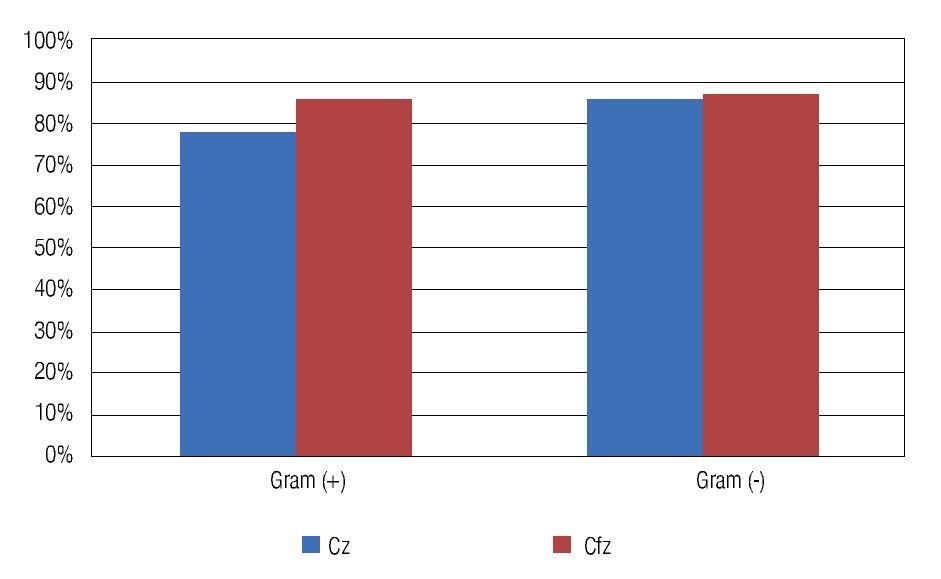
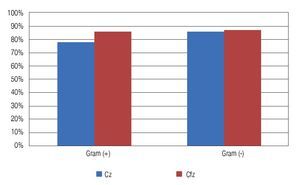
Un total de 53 cultivos fueron probados para su sensibilidad ante ciprofloxacino, de los cuales 48 (90.57%) fueron sensibles al mismo. Un comportamiento muy similar se observó en los cultivos probados ante vancomicina (53 aislados) y gentamicina (52 aislados), con una sensibilidad de 83.02% (44 aislados) y 78.85% (41 aislados), respectivamente. Se observó una resistencia de los cultivos probados ante las dos principales cefalosporinas de uso oftalmológico probadas en el antibiograma (cefazolina, 34 aislados probados y ceftazidima, 51 aislados probados); siendo resistentes a cefazolina el 79.41% (27 cultivos) y 86.27% (51 aislados) para ceftazidima (Tabla 3). Se advirtió una resistencia generalizada a las cefalosporinas en ambos Gram positivos y Gram negativos (Figura 1).
Figura 1. Porcentaje de cultivos resistentes (Gram positivos y Gram negativos) a las cefalosporinas de uso común en oftalmología estudiadas en el antibiograma. Cz: cefazolina; Cfz: ceftazidima.
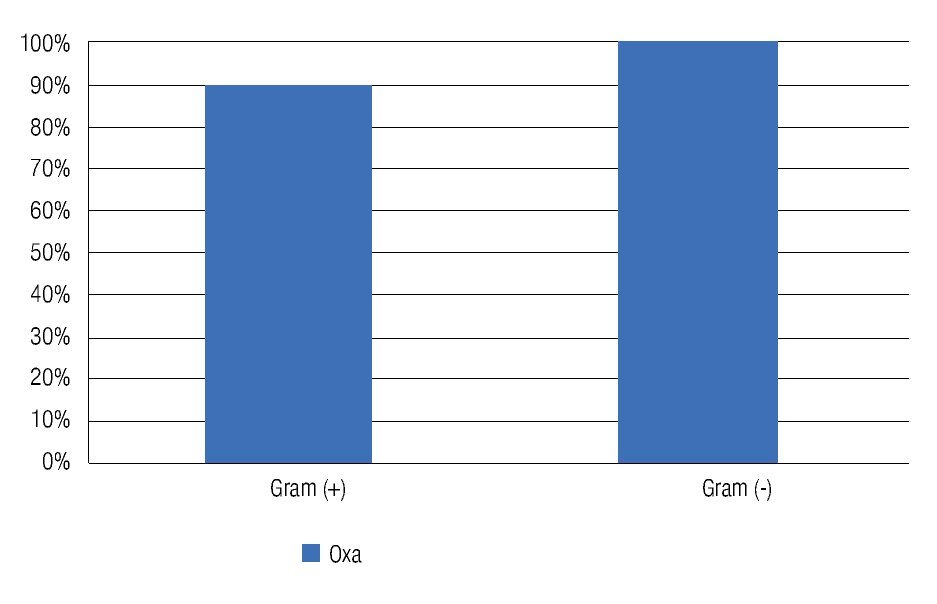
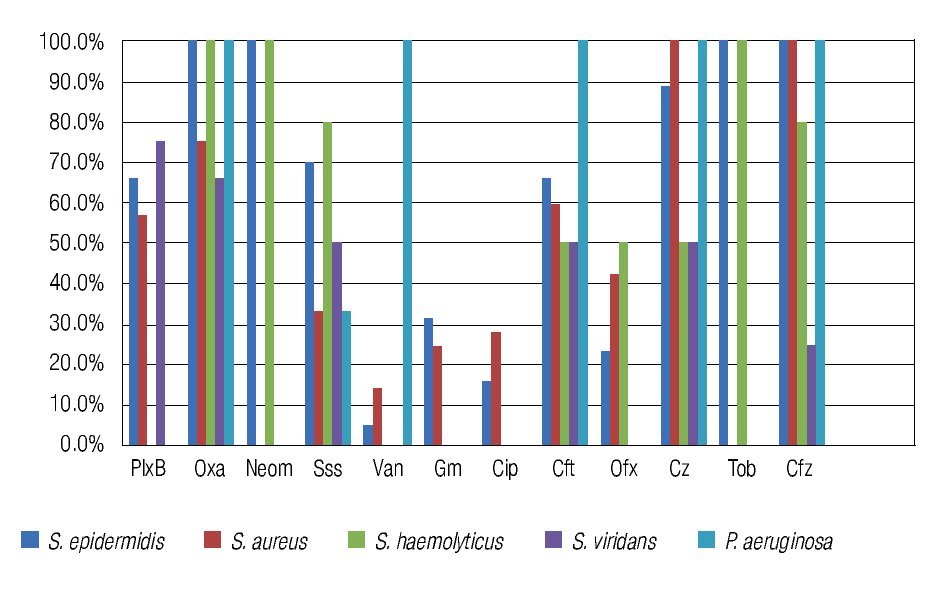
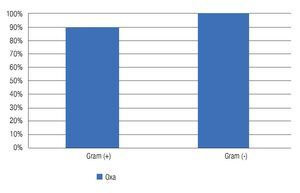
El 92% de los cultivos analizados fueron resistentes a oxacilina (Tabla 3). La resistencia a oxacilina se observó para Gram positivos en 90.24% (37/41) de los aislados, y en 100% (9/9) aislados para Gram negativos (Figura 2).
Figura 2. Porcentaje de cultivos resistentes (Gram positivos y Gram negativos) a la oxacilina/meticilina. El 90% de los cultivos Gram positivos fueron resistentes a oxacilina/meticilina.
- Resistencia por organismos
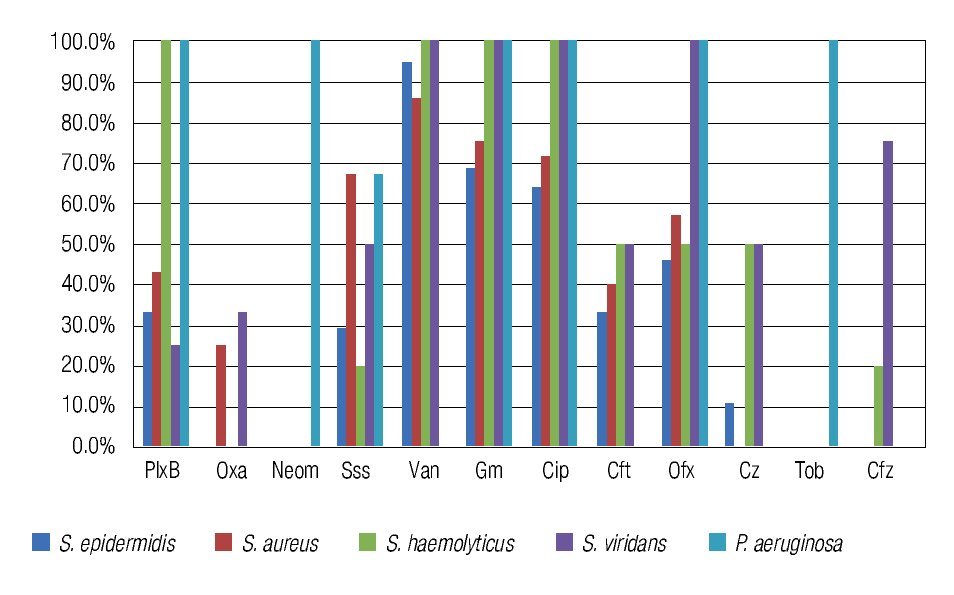
El Staphylococcus epidermidis fue sensible a vancomicina en el 94% de los aislados, seguido de ciprofloxacino 84%, ofloxacino 76% y gentamicina en el 68%, y fue en el 100% de los casos resistente a tobramicina, oxacilina, neomicina, y ceftazidima.
Los cultivos de Pseudomonas aeruginosa fueron 100% sensibles para polimixina B, neomicina, gentamicina, ciprofloxacino, ofloxacino y tobramicina, teniendo ésta una resistencia del 100% a ceftazidima, cefazolina y ceftriaxona.
El Staphylococcus aureus mostró una sensibilidad de 85.7%, 75%, 71.4% y 66.7% para vancomicina, gentamicina, ciprofloxacino y sulfas, respectivamente; con resistencias de 100% a cefazolina y ceftazidima, 75% a meticilina y 60% a ceftriaxona.
Las Figuras 3 y 4 resumen la sensibilidad y resistencia de los cinco principales microorganismos bacterianos aislados, para los antibióticos probados en el antibiograma.
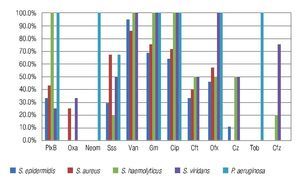
Figura 3. Porcentaje de aislados de microorganismos que mostraron sensibilidad a los diferentes antibióticos probados en el estudio. Se observó una buena sensibilidad a la vancomicina, gentamicina y ciprofloxacino de la mayoría de los aislados de Gram positivos. El 100% de los aislados para Pseudomonas aeruginosa fueron sensibles a neomicina, gentamicina, ciprofloxacino, ofloxacino y tobramicina. PlxB: polimixina B; Oxa: oxacilina; Neom: neomicina; Sss: sulfas; Van: vancomicina; Gm: gentamicina; Cip: ciprofloxacino; Cft: ceftriaxona; Ofx: ofloxacino; Cz: cefazolina; Tob: tobramicina; Cfz: ceftazidima.
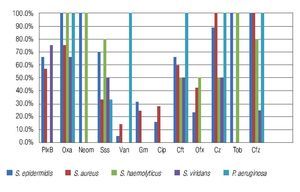
Figura 4. Porcentaje de aislados de microorganismos que mostraron resistencia los diferentes antibióticos probados en el estudio. Se observó resistencia del 100% de los aislados de Staphylococcus epidermidis y Staphylococcus haemolyticus a la oxacilina/ meticilina. Tendencia a la resistencia generalizada (Gram positivos y Gram negativos) a las cefalosporinas de uso oftálmico probadas en el estudio (cefazolina, ceftazidima). PlxB: polimixina B; Oxa: oxacilina; Neom: neomicina; Sss: sulfas; Van: vancomicina; Gm: gentamicina; Cip: ciprofloxacino; Cft: ceftriaxona; Ofx: ofloxacino; Cz: cefazolina; Tob: tobramicina; Cfz: ceftazidima.
Tendencias estacionales
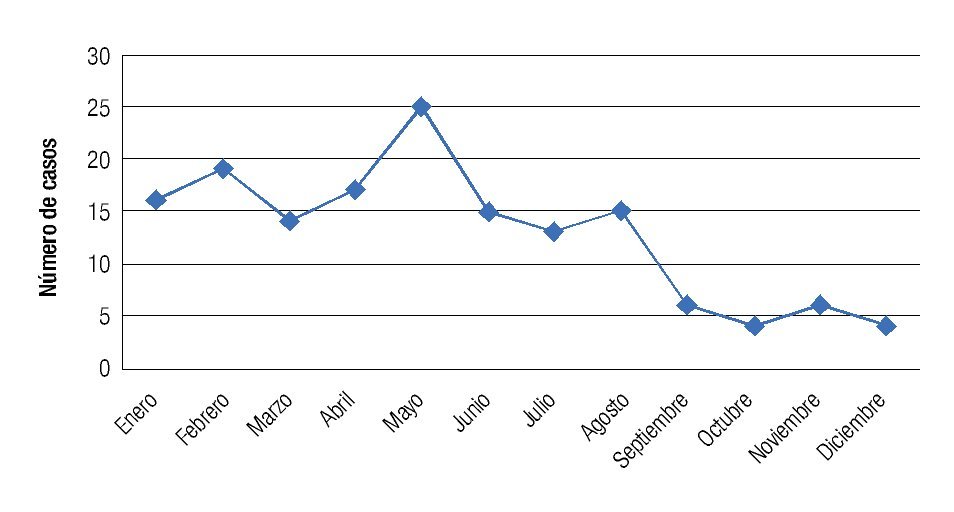
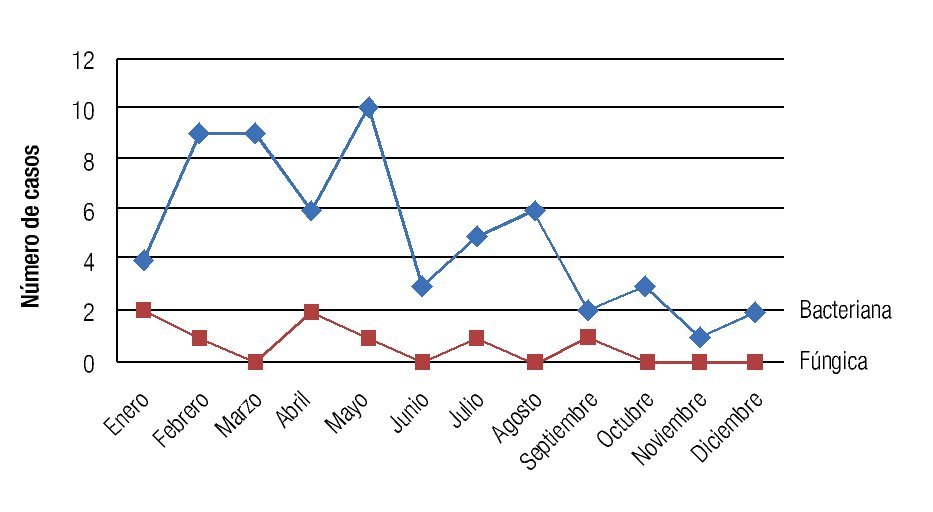
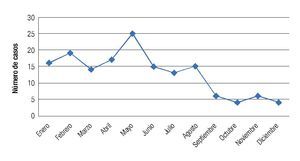
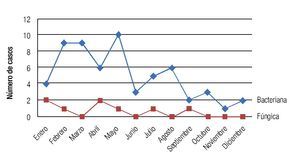
Se observó una tendencia a la disminución en la incidencia mensual de queratitis hacia los meses de otoño e invierno, con un pico de incidencia en primavera registrándose 25 casos en el mes de mayo (Figura 5). La distribución mensual de las queratitis según la etiología (bacteriana o fúngica) siguió un patrón similar, observándose una distribución no equitativa en el año con picos de incidencia en los meses de febrero, marzo y mayo para las queratitis bacterianas, y con un pico en enero y abril para las fúngicas (Figura 6). No se observó una tendencia significativa en el patrón estacional o en la incidencia mensual para los grupos específicos de microorganismos bacterianos o fúngicos.
Figura 5. Se observa disminución en la incidencia de los casos de queratitis hacia los meses de otoño e invierno, con un pico de incidencia para los meses de primavera (mayo).
Figura 6. Distribución no equitativa en el año para la distribución de queratitis según su etiología, picos de incidencia para fines de invierno e inicios de primavera para etiologías bacterianas y fúngicas.
¿ Discusión
La presentación clínica de las patologías infecciosas oculares pueden variar considerablemente, ninguna característica clínica puede ser considerada exclusiva para un determinado agente infeccioso. Es entonces labor del oftalmólogo guiar la investigación microbiológica a través de su impresión clínica, con la meta de que ésta última confirme o descarte su sospecha. Los resultados del estudio microbiológico harán posible dirigir el tratamiento antimicrobiano hacia un agente infeccioso específico, y mejorar las posibilidades de conseguir la erradicación de la infección.
El análisis de las muestras corneales derivadas de queratitis infecciosas en este estudio fue positivo para el cultivo de microorganismos en el 44.15% de los casos, ofreciendo un rendimiento diagnóstico por debajo de lo reportado en algunas otras series: Kim y colaboradores (2008) 51.8%, Garg y colaboradores (1999) 71.9%, Srinivasan y colaboradores (1997) 68.4%.10-12 Uno de los factores que pudiera incidir en la baja tasa de positividad en los cultivos de úlceras corneales es el tratamiento previo con antibiótico, que en nuestro caso se observó en el 55.8% de los pacientes, fenómeno descrito previamente.13 Comúnmente la obtención de la muestra corneal para cultivo se realiza en la lámpara de hendidura bajo anestesia tópica. Es de importancia recordar que el uso de anestésicos sin preservadores (hidrocloruro de proparacaína al 0.5%), mejora la tasa de recuperación de microorganismos, dado sus mínimos efectos bacteriostáticos comparado con otros anestésicos (tetracaína).14
Similar a lo reportado en la literatura,15,16 los organismos Gram positivos fueron los patógenos más comúnmente aislados constituyendo el 67.12% de los cultivos, predominando la especie Staphylococcus; asimismo, el organismo Gram negativo más comúnmente aislado fue la Pseudomonas aeruginosa. Las infecciones fúngicas constituyeron únicamente el 4.41% de los aislados, coincidiendo con la baja incidencia de las queratitis fúngicas (6% a 20%) comparada con las queratitis bacterianas reportada en varias series de úlceras corneales microbianas.17,18 En el caso de úlceras micóticas, los organismos aislados con más frecuencia fueron Fusarium sp. y Aspergillus fumigatus con tres aislados cada uno, y Candida albicans con un aislado. Esto es congruente con lo consignado por la literatura sajona, donde se reporta una predominancia de Aspergillus sp.,Fusarium sp., Candida sp. y Curvularia sp. en los aislados de queratitis fúngicas.17,19 Olvera y colaboradores en un estudio retrospectivo sobre úlceras micóticas en México, reportaron igualmente una predominancia para Fusarium sp., Aspergillus flavus y Curvularia sp. en sus aislados.20 La prevalencia de los organismos fúngicos en úlceras microbianas en las diferentes series ha mostrado gran variabilidad dependiendo de la zona geográfica de la muestra poblacional estudiada. Así, aunque Aspergillus sp. es considerado como el organismo responsable de la mayoría de las úlceras corneales fúngicas a nivel mundial,21Fusarium sp. continúa siendo el organismo más comúnmente reportado en grandes series de regiones como el sur de Estados Unidos, Europa, China y África.22,23
La alta sensibilidad de la gran mayoría de los cultivos a dos de los antibióticos usados de manera rutinaria en la práctica oftalmológica (ciprofloxacino y gentamicina), y a uno de los antibióticos usados de manera común como fortificado (vancomicina), sugiere una tasa de respuesta terapéutica favorable en el tratamiento de las úlceras bacterianas, al utilizar éstos antibióticos de manera empírica previa a la investigación microbiológica o cuando no se cuenta con los medios para realizar la misma.
Se han reportado cambios en las tendencias de sensibilidad a antibióticos de las queratitis bacterianas, consistentes con un aumento de la resistencia a las fluoroquinolonas (ciprofloxacino y ofloxacino), predominantemente en aislados de Staphylococcus aureus.24 Estudios similares han demostrado la emergencia de cepas de Pseudomonas resistente a ciprofloxacino.25 En nuestro estudio, se observó una buena sensibilidad (71% a 84%) en los dos principales patógenos Gram positivos (Staphylococcus aureus y Staphylococcus epidermidis) a ciprofloxacino, mientas que se reportó una sensibilidad del 100% de los aislados de Pseudomonas aeruginosa. Este análisis sugiere a la monoterapia con ciprofloxacino o con quinolonas de cuarta generación como una buena opción para el tratamiento empírico de las queratitis infecciosas, aún y cuando las características clínicas sugieran Pseudomonas sp. Es relevante mencionar que todos los microorganismos Gram positivos tuvieron una sensibilidad mayor al 85% para vancomicina, sustentando su uso como antibiótico reforzado en casos de úlceras corneales severas o con poca respuesta terapéutica a antibiótico cuando exista alta sospecha diagnóstica de estos organismos.
Los aislados de Pseudomonas aeruginosa, además de mostrar una excelente sensibilidad al ciprofloxacino, presentaron una notable sensibilidad a antibióticos de primera generación como la polimixina B, neomicina y aminoglucósidos (gentamicina y tobramicina), observándose una sensibilidad del 100% para todos ellos. Nuevamente, este hallazgo permite reafirmar a los aminoglucósidos como una buena terapia empírica inicial en casos de sospecha de queratitis por Pseudomonas aeruginosa.
Se observó una notable tendencia a la resistencia del 100% de los aislados de Staphylococcus aureus y Pseudomonas aeruginosa a la cefazolina y a la ceftazidima. Este hallazgo pudiera tener un gran impacto, ya que la ceftazidima fortificada es uno de los antibióticos de elección utilizados en el tratamiento de las queratitis donde exista sospecha clínica de Pseudomonas aeruginosa, en casos de queratitis por Pseudomonas aeruginosa con resistencia documentada a aminoglucósidos y en combinación con aminoglucósidos en queratitis severas; siendo también terapia empírica estándar en casos de endoftalmitis.16,26,27 Los resultados del presente estudio sugieren no utilizar como agente antimicrobiano único a las cefalosporinas.
La oxacilina, al compartir los mismos mecanismos de resistencia bacteriana que la meticilina,28 es el antibiótico utilizado para probar resistencia a meticilina en cepas de estafilococos desde 1990.29 En nuestro estudio, el 72.72% de los organismos Gram positivos mostraron una resistencia del 100% a oxacilina/meticilina, entre ellos dos de los principales patógenos aislados Staphylococcus epidermidis y Staphylococcus haemolitycus. El Staphylococcus aureus mostró resistencia a oxacilina en 75% de los aislados, mostrando patrón de resistencia moderado-alto. La resistencia de todos los cultivos de Staphylococcus epidermidis a la meticilina (estafilococo coagulasa negativa resistente a meticilina, ECNRM) y a la tobramicina, uno de los antibióticos tópicos de uso más común en la práctica oftalmológica en México, alerta sobre el surgimiento de cepas multirresistentes del microorganismo más comúnmente asociado a queratitis bacterianas en México y sobre la necesidad de modificar la conducta en la prescripción de antibióticos.
Es importante recordar que aunque las mediciones in vitro son útiles en proveer parámetros cuantitativos de la sensibilidad de un microorganismo a un antibiótico, debe de tenerse en mente que los análisis de sensibilidad son interpretados considerando las concentraciones séricas alcanzadas por el antibiótico. En oftalmología, este análisis no predecirá fielmente la eficacia clínica in vivo, ya que la potencia del antibiótico también dependerá de factores como la absorción corneal y otros factores farmacodinámicos. Por este mismo principio, muchos antibióticos tópicos o intravítreos son capaces de alcanzar niveles mucho mayores que los necesarios para alcanzar la concentración mínima inhibitoria de los organismos susceptibles, explicando así la eficacia en el tratamiento clínico con antibióticos que estaban clasificados in vitro como resistentes.
El presente estudio mostró la dominancia de los organismos Gram positivos como etiología causal de las queratitis microbianas, siendo la frecuencia del resto de los patógenos muy similar a la reportada en series extranjeras. Se demostró una alta sensibilidad de la mayoría de los organismos bacterianos a dos de los antibióticos de uso común en oftalmología: ciprofloxacino y gentamicina.
De manera notable, se documentó una resistencia generalizada de la mayoría de los organismos Gram positivos y de la Pseudomonas a las cefalosporinas probadas en el antibiograma, análisis que pudiera sugerir una tendencia hacia una menor efectividad in vivo de estos antibióticos en queratitis microbianas y otras infecciones oculares. Asimismo, se demostró una excelente sensibilidad de la Pseudomonas aeruginosa a los aminoglucósidos y a otros antibióticos primarios como polimixina B y la neomicina, permitiendo este hallazgo aumentar el número de opciones terapéuticas para tratar las queratitis causadas por este organismo Gram negativo.
Algunos hallazgos relevantes encontrados en el análisis de los cinco microorganismos aislados más comunes coinciden con factores de riesgo predisponentes reportados previamente en la literatura, particularmente el uso de lente de contacto y las heridas corneales (quirúrgicas o traumáticas), siendo el primer factor altamente asociado a úlceras por Pseudomonas.30 En nuestro estudio, el tiempo de la evolución prolongado de la queratitis previo a la evaluación inicial, especialmente para las asociadas a Streptococcus viridans (evolución mayor de tres semanas) y para las queratitis fúngicas (evolución mayor a 30 días) fue notorio. La Tabla 2, resume los hallazgos relevantes encontrados para los principales patógenos aislados y el antibiótico recomendado como tratamiento, según los resultados de nuestro análisis.
En cuanto al análisis de tendencias estacionales microbiológica, observamos una disposición hacia una menor incidencia de las queratitis infecciosas en los meses de otoño e invierno, y picos de mayor incidencia en los meses de final de invierno y primavera. Esto coincide con lo reportado en la literatura, donde la mayor incidencia de queratitis infecciosas se presenta en los meses con climas cálidos (comúnmente época de cosecha) y ventosos.31,32 Es de importancia entender el patrón estacional de las queratitis infecciosas, ya que sirven de guía para el tratamiento empírico de las mismas en áreas con acceso limitado de cuidado oftalmológico, y ayudan a intensificar los esfuerzos de tamizaje en áreas donde el entrenamiento oftalmológico es mínimo.32
Una limitación de nuestro estudio es que no se contempló dentro del antibiograma, el uso de fluoroquinolonas de cuarta generación como el moxifloxacino y el gatifloxacino. Dado su amplio espectro antimicrobiano, sus propiedades farmacodinámicas y su eficacia en el tratamiento de queratitis microbianas16 (comparadas incluso con las de la terapia combinada con antibióticos fortificados),33 su uso como monoterapia inicial en úlceras corneales bacterianas es muy común. Aunque los resultados de nuestro estudio muestran eficacia de las quinolonas de segunda generación (ciprofloxacino y ofloxacino) en el tratamiento de queratitis bacterianas en nuestra muestra poblacional, y su eficacia se pudiera transpolar a las quinolonas de cuarta generación, hay evidencia que muestra un aumento en la resistencia a estos antibióticos en aislados bacterianos.34,35 En nuestro caso, esto se traduce en la necesidad de una modificación del antibiograma utilizado en la investigación de sensibilidades microbianas, consistiendo en la inclusión de las fluoroquinolonas de cuarta generación al mismo.
Asimismo, a pesar de que nuestro estudio se enfoca en reportar tendencias microbiológicas y perfil de antibiograma en queratitis infecciosas en una población específica (Ciudad de México), es difícil evitar factores de confusión que aseveren que los datos reportados sean propios de esa muestra poblacional, dado que en nuestro Centro Oftalmológico son atendidos pacientes que vienen también de otras localizaciones geográficas (interior del país).
Nuestra recomendación en el manejo de queratitis infecciosas severas, es que este debe ser siempre guiado por el cultivo. En pacientes parcialmente tratados, suspender el tratamiento por 24-48 horas ayudará a aumentar la tasa de recuperación de microorganismos y mejorará la probabilidad de obtener un cultivo positivo.36 Una vez realizado el mismo, se debe de iniciar la terapia antimicrobiana empírica con un antibiótico de amplio espectro, monoterapia con fluoroquinolonas de cuarta generación preferentemente, realizando una dosis de impregnación cada minuto por los primeros cinco minutos, cada cinco minutos por los siguientes 15 minutos y cada 15 minutos por una hora.37 La dosis de antibiótico deberá continuarse cada hora durante las primeras 24-48 horas y la evaluación en casos severos (involucro estromal profundo o úlceras mayores a 2 mm con supuración y lisis extensa), idealmente deberá ser diaria hasta que se evidencie mejoría clínica.37 Nunca contemplar modificación de la terapia antes de las 48 horas de iniciado el tratamiento antimicrobiano, y considerar como signos de mejoría clínica a la reducción en el dolor, disminución de la secreción, disminución del edema palpebral e inyección ciliar, consolidación y mejor definición del perímetro del infiltrado, reducción del edema corneal y de la reacción en cámara anterior y reepitelización.5,38 Si existen signos de progresión después de 48 horas de iniciado el tratamiento, se debe sospechar de organismos resistentes o pobre apego al mismo; está recomendando suspender el tratamiento 24 horas para cultivar de nuevo.38
En conclusión, aunque nuestro estudio provee pautas sobre tendencias microbiológicas y sensibilidad a antibióticos en las queratitis infecciosas en nuestra comunidad, hay que recordar que en las queratitis microbianas así como en muchas otras patologías infecciosas, existe una variación en la prevalencia de los principales organismos causales que dependerá en gran medida de la localización geográfica, nivel de urbanización y de las características socioeconómicas de la población estudiada.
¿ Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
¿ Financiamiento
Los autores no recibieron ningún patrocinio para llevar a cabo este artículo.
Correspondencia:
Dr. Víctor M. Bautista de Lucio,
Jefe del Departamento de Microbiología y Proteómica ocular, Instituto de Oftalmologia "Conde de Valenciana", IAP. Chimalpopoca 14, Colonia Obrera, C.P. 06800, México D.F., México.
Teléfono: (52) 555442 1700, ext. 3710 (oficina). Fax: (52) 555442 1700, ext. 3701 (fax).
Correo electrónico: vbautistal@insitutodeoftalmología.org