Uno de los problemas más importantes dentro de la consulta es el control de las infecciones cruzadas. Para ello disponemos en la actualidad de la tecnología suficiente para desinfectar y esterilizar el instrumental. En la práctica odontológica se deben adoptar medidas de protección para prevenir el contagio de las enfermedades, que son establecidas para nuestro país por la Norma Oficial Mexicana (NOM-013-SSA) para la vigilancia epidemiológica, la prevención y el control de las infecciones nosocomiales.
Material y métodosPara llevar a cabo el estudio se emplearon seis diferentes marcas comerciales de brackets metálicos empaquetados. Tres de ellas corresponden a las marcas American Orthodontics (Pro-torque .018), Borgatta y GAC (Roth .022), empacadas en México; y TP Orthodontics, Inc. (MBT .022), ORMCO Corporation (Roth .022), y 3M Unitek (MBT .022), empacadas en USA.
ResultadosDe las seis cajas de Petri, solo en una, que correspondió a la marca Borgatta (Roth .022), se observó el crecimiento de colonias, el cual se determinó por microscopia óptica y la presencia de cocos grampositivos (Staphylococcus).
ConclusionesConsideramos la necesidad de que los aditamentos ortodóncicos deberían someterse a un proceso de desinfección y/o esterilización previo a su colocación para con ello garantizar la ausencia de microorganismos.
One of the most important issues within the practice is the cross infection control. We currently have enough technology to disinfect and sterilize instruments. Dental protection measures must be adopted to prevent infection and they are established in our country by the Mexican Official Norm (NOM-013-SSA) for epidemiologic surveillance, and for the prevention and control of hospital-acquired infections.
Material and methodsIn order to conduct the study, six different brands of packaged metal brackets were used. Three of them are packaged in Mexico: American Orthodontics (Protorque .018), Borgatta and GAC (Roth .022); and three are packaged in the US: TP Orthodontics, Inc. (MBT .022), ORMCO Corporation. (Roth .022), 3M Unitek (MBT .022).
ResultsOf the six Petri dishes, only one colony growth was observed and it corresponded to the brand Borgatta (Roth .022). It was determined by optical microscopy, the presence of bacilli GN and cocci (Staphylococcus).
ConclusionsOrthodontic attachments should be subjected to a disinfection process and/or sterilization prior to their placement to ensure the absence of microorganisms.
Uno de los problemas más importantes dentro de la consulta es el control de las infecciones cruzadas. Para ello disponemos en la actualidad de tecnología suficiente para desinfectar y esterilizar el instrumental.
Los aditamentos ortodóncicos como los brackets tienen la posibilidad de estar contaminados con microorganismos (MO) no propios de su ambiente.
Los MO pueden transmitirse de diversas formas, de manera indirecta o directa. Pueden ser llevados de un paciente a otro a través de instrumentos contaminados y/o procedimientos clínicos.
En los movimientos dentales son requeridas la aplicación y el control de diferentes tipos de fuerzas mediante la utilización de aditamentos intraorales sobre los dientes a través de las técnicas empleadas actualmente, el uso de aparatología fija compuesta de diferentes elementos adheridos a los dientes, bandas y brackets, para llevar a cabo movimientos ortodóncicos para conseguir el correcto alineamiento dental.
En la práctica odontológica se deben adoptar medidas de protección para prevenir el contagio de enfermedades y son establecidas para nuestro país por la Norma Oficial Mexicana (NOM-013-SSA).1
La Norma Oficial Mexicana de Emergencia NOM-EM-002-SSA2-2003, para la vigilancia epidemiológica, prevención y control de las infecciones nosocomiales define los mecanismos de infección:
- 1.
Por contacto directo. Implica el contacto de persona a persona y el indirecto implica el contacto a través de un objeto intermediario contaminado, ejemplo: agujas, guantes, etcétera.
- 2.
Transmisión por gotas. Teóricamente es una forma de transmisión de contacto; sin embargo, el mecanismo de transferencia del patógeno al huésped es a través del estornudo, la tos, el hablar o al realizar determinados procedimientos clínicos (broncoscopias, succión). El material infectivo se deposita sobre el huésped sobre las mucosas. No permanece suspendido, por lo cual no se precisan cuidados de manejo de aire ni ventilación.
- 3.
Transmisión aérea. Ocurre por la diseminación de partículas suspendidas en el aire. Aquí sí se precisan cuidados en el manejo de aire y ventilación.
- 4.
Transmisión vehículo común. Transmitidos por los alimentos, agua, medicación y equipo.
- 5.
Transmisión por vectores. Mosquitos, moscas, mamíferos, etcétera.
El control de la infección cruzada debe ser considerado parte integral de las consultas estomatológicas.
En los procedimientos dentales la transmisión de la infección va a depender de cuatro factores:
- 1.
Fuente de infección (paciente/operador).
- 2.
Medio de transmisión (sangre, saliva).
- 3.
Vía de transmisión (inoculación: hepatitis, herpes simple, VIH; inhalación: virus de la varicela, virus de la influenza, Mycobacterium tuberculosis).
- 4.
Susceptibilidad individual (estado nutricional, herencia, medicación).
Por lo tanto, el objetivo en el control de la infección es evitar la transmisión de MO.
El objetivo de este estudio es determinar si existe la presencia de MO y de qué tipo en las diferentes marcas de brackets metálicos en su empacado de origen para ser colocados en los pacientes.
Material y métodosPara llevar al cabo el estudio se emplearon seis diferentes marcas comerciales de brackets metálicos empaquetados (Figura 1). Tres de ellas corresponden a las marcas American Orthodontics (Protorque .018), Borgatta y GAC (Roth .022), las cuales son empacadas en territorio nacional; el resto de las marcas fueron TP Orthodontics, Inc. (MBT .022), ORMCO Corporation (Roth .022), 3M Unitek (MBT .022), empacadas en USA. De cada paquete se tomaron dos brackets de forma aleatoria con pinzas de curación previamente flameadas de forma directa.
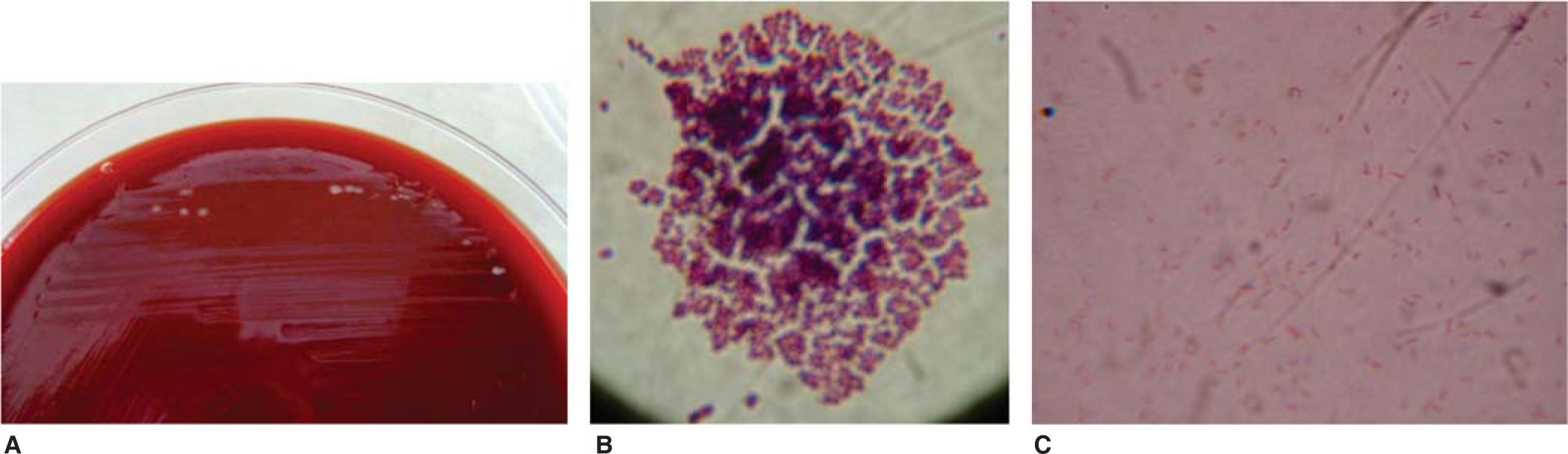
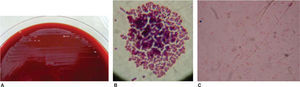
En seis tubos de ensayo previamente etiquetados con los nombres de las seis marcas comerciales de brackets, con medio líquido de infusión cerebro-corazón (BHI por sus siglas en inglés)2,3 (Rosenow y Hayden; infusión de cerebro de ternera 200g, infusión de corazón vacuno 250g, peptona 10g, cloruro de sodio 5g, glucosa 2g, fosfato disódico 2.5g, pH 7.4), se introdujeron dos brackets de cada paquete, previo flameo de la boquilla del tubo para su siembra y su incubación posterior por 24 horas a 35°C (Figura 2). Posteriormente en seis cajas de Petri (que correspondían a los tubos de ensayo etiquetados previamente) con medio de cultivo agar gelosa sangre4 (gelosa sangre de carnero al 5%), se sembraron los microorganismos (MO) obtenidos de la BHI con la técnica de estría cruzada5 en placa (inoculación y aislamiento de bacterias) (Figura 3). Se incubaron por 24 horas a 35°C para ser observados al microscopio (Olympus con el objetivo de 100X [objetivo de inmersión]) con la técnica de Gram6 (Christian Gram 1884) y determinar la taxonomía para seleccionar el nuevo medio de cultivo y a partir de éste establecer el género y la especie del MO.
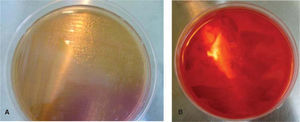
De las seis cajas de Petri solo en una, que correspondió a la marca Borgatta (Roth .022), se observó el crecimiento de colonias, el cual se determinó por microscopia óptica, la presencia de bacilos gramnegativos7–9 y cocos grampositivos (Staphylococcus) (Figura 4).
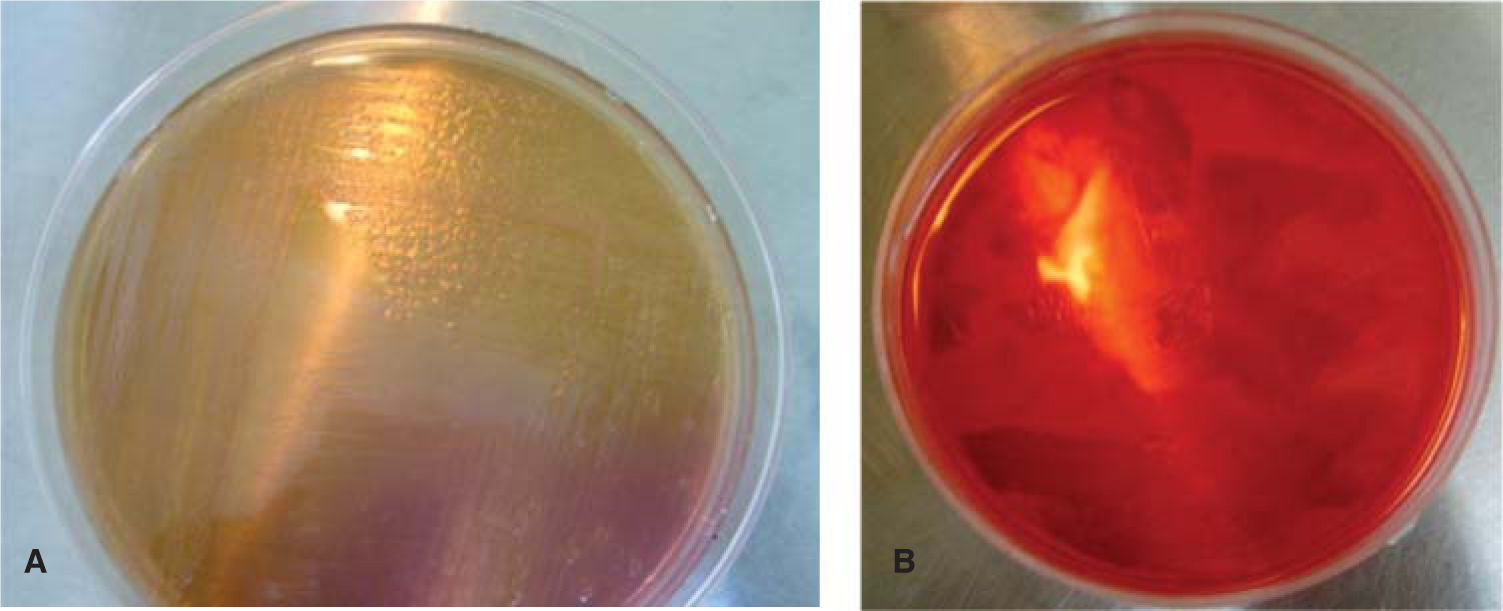
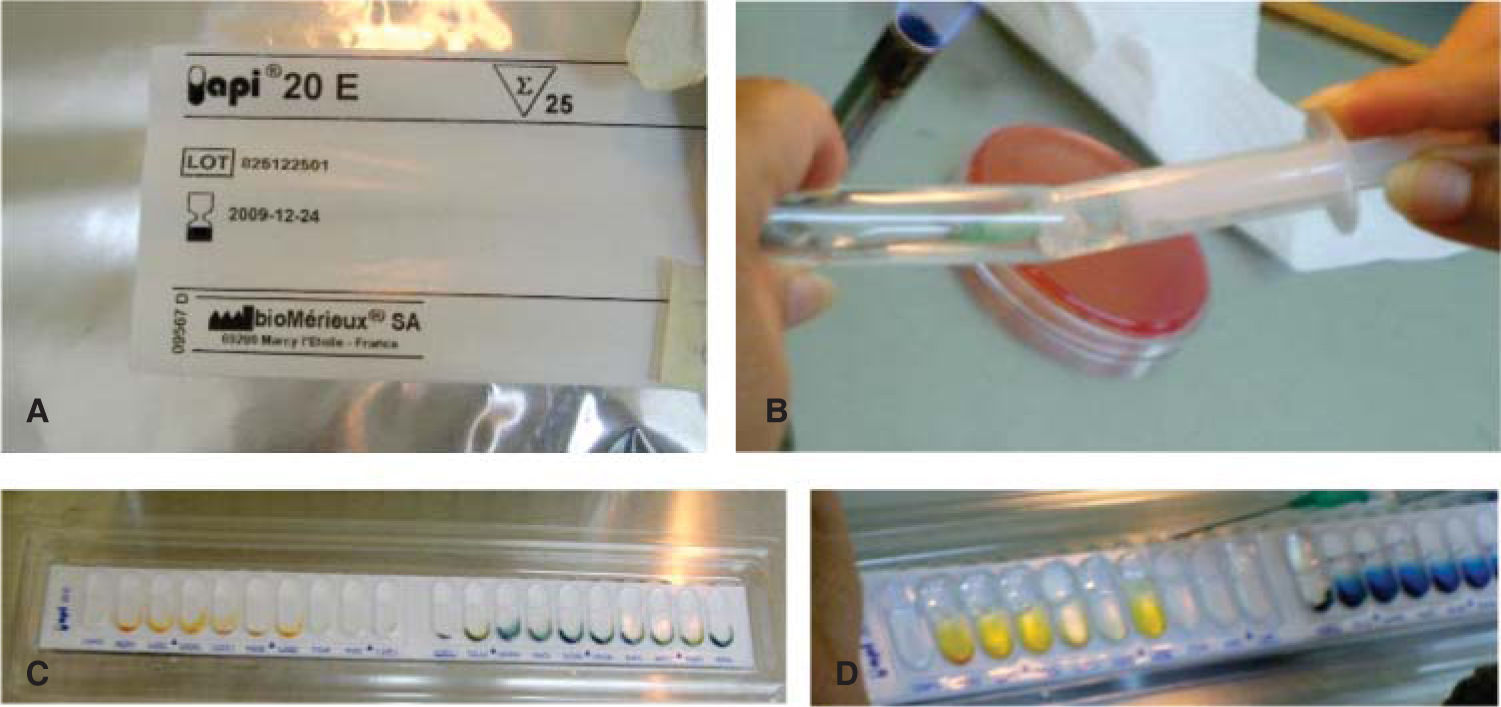
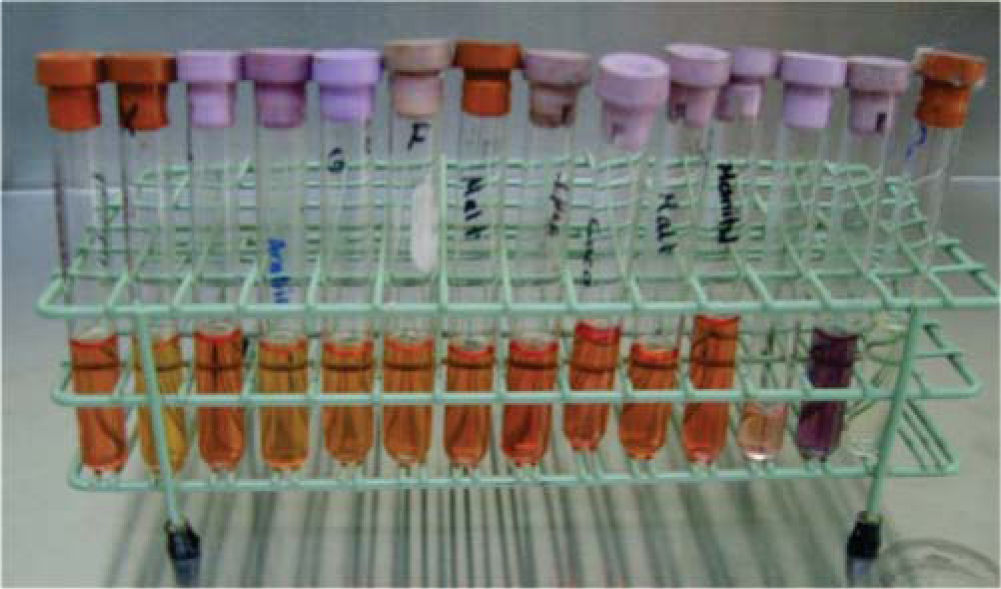
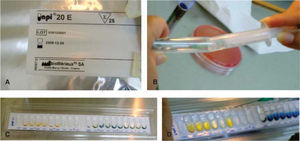
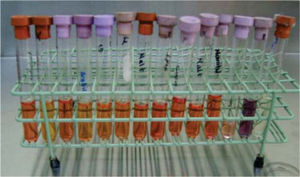
En un medio de cultivo Agar MacConkey10 (peptona 17g, polipeptona 3g, lactosa 10g, sales biliares 1.5g, cloruro de sodio 5g, agar 13.5g, rojo neutro 0.03g, cristal violeta 0.001g, agua destilada c.s.p. 1 L, pH 7.1) se sembraron los bacilos, y en un medio de cultivo agar sal y manitol11 (Chapman, agar, cloruro de sodio 7.5%, rojo de fenol y manitol) se sembró la colonia de Staphylococcus (Figura 5). Ambos se incubaron por un periodo de 24 horas a 35°C. Se realizaron las pruebas de oxidasa negativa y peroxidasa positiva a los bacilos, y prueba de peroxidasa positiva a los Staphylococcus. Mediante el sistema de identificación Enterobacteriaceae y otros bacilos gramnegativos no exigentes (api 20E bioMérieux® SA) se pudo determinar la presencia de Shigella (Figura 6). Los Staphylococcus fueron sembrados en las pruebas bioquímicas: carbohidratos (maltosa, fructosa, sacarosa, lactosa, manitol, manosa, trehalosa y xilosa), urea caldo nitrato más α naftilamina más ácido sulfanílico, MIO negativa (movilidad indol y ornitina) y coagulasa negativa; con todas ellas se identificó la especie Staphylococcus epidermidis12–14(Figura 7).
La ortodoncia en su ejercicio diario se basa en prevenir, diagnosticar y corregir las posibles alteraciones en la posición, la relación y la función de las estructuras dentomaxilofaciales mediante el empleo de múltiples aditamentos y técnicas. Hoy por hoy la ortodoncia se apoya en la utilización de elementos que se adhieren a los dientes, con especial énfasis de los brackets. Estos aditamentos, así como los arcos, las bandas, los elásticos y demás, son producidos y empaquetados por múltiples casas comerciales y en la práctica diaria son colocados por la mayoría de los profesionales sin pasar previamente por un proceso de desinfección y/o esterilización. Muchos de ellos se pueden adquirir de forma individual, con lo cual se contaminan.
Pocas bacterias resultan ser tan ubicuas como los Staphylococcus,15 microorganismos muy resistentes a las condiciones ambientales y extremadamente difíciles de erradicar. Soportan bien las condiciones extremas, aunque se inactivan a temperaturas bajas y se eliminan a temperaturas elevadas a pesar de no ser esporulados; se localizan en cualquier superficie. Esta bacteria se encuentra en la piel y tracto respiratorio, causando una gran variedad de patologias, desde infecciones menores de la piel (forúnculos, ampollas) y abscesos cutáneos, hasta enfermedades que pueden poner en peligro la vida (endocarditis, neumonía y síndrome del shock tóxico), como es el caso del S. aureus. Otra bacteria perteneciente a esta familia es el S. epidermidis, que es probablemente la especie más comúnmente hallada en análisis de laboratorio. Nosotros encontramos que en una sola de las muestras hubo crecimiento de colonias bacterianas, en las cuales mediante pruebas reactivas se determinó la presencia de S. epidermidis y una enterobacteria perteneciente al género Shigella,16 bacteria que se obtiene por contaminación fecal y causa síntomas gastrointestinales (diarrea, fiebre, mialgias, vómitos).
El envasado de los brackets por lo regular se lleva al cabo de forma automatizada, esto podría reflejar la ausencia de crecimiento bacteriano en la mayoría de las muestras, no así en una de ellas; sin embargo, ninguna de ellas son una muestra representativa de ausencia bacteriana o contaminación cruzada, y podemos inferir que esta última fue contaminada durante el envasado, que pudo realizarse de forma manual, o después del mismo.
ConclusionesConsideramos la necesidad de que los aditamentos ortodóncicos deberían someterse a un proceso de desinfección y/o esterilización previo a su colocación, para con ello garantizar la ausencia de microorganismos, así como tomar las medidas básicas de control de riesgos infectocontagiosos durante el procedimiento clínico.
Sugerimos la realización de estudios futuros con modelos y análisis científicos que aporten mayor evidencia científica.
Este artículo puede ser consultado en versión completa en http://www.medigraphic.com/ortodoncia