El uraco es un remanente embriológico del alantoides. El carcinoma de uraco es una entidad rara, con solo 400 casos descritos en la literatura. La incidencia de este tumor no se conoce debido a su baja frecuencia. El protocolo de estudio y tratamiento ideal no está estrictamente definido.
ObjetivoNuestro objetivo es mostrar y comparar los resultados de 5 series publicadas sobre adenocarcinoma de uraco para comprender la mejor ruta diagnóstica así como el óptimo tratamiento de estos tumores. Hasta la fecha sabemos poco de esta patología, salvo que la cistectomía parcial con exéresis completa del uraco está recomendada como estrategia quirúrgica de inicio. Por este motivo nos planteamos hacer una revisión de la literatura para conocer la etiopatogenia, la clínica y el mejor abordaje terapéutico de esta infrecuente estirpe tumoral.
MétodoSe realizó una búsqueda de series sobre adenocarcinoma de uraco en los últimos 10años en PubMed y MDConsult. Se seleccionaron trabajos en español, inglés y francés y se excluyeron reportes de casos. En total se seleccionaron 5 series y se realizó una revisión.
ResultadosLa mayoría de los tumores de uraco son adenocarcinomas. El diagnóstico definitivo se obtiene mediante análisis histopatológico; la tomografía y la ecografía son útiles y complementarias. El cuadro clínico se caracteriza por hematuria y una masa pélvica palpable en la mayoría de los pacientes. El sistema de estadificación más utilizado es el propuesto por Sheldon. La mayoría de los casos se diagnostican en estadios tardíos, ya que las manifestaciones no aparecen hasta entonces.
El tratamiento de elección es la cistectomía parcial con resección en bloque del ombligo y uraco. La radioterapia se puede usar en casos de enfermedad localmente avanzada con resultados en el 30%, mientras que la quimioterapia basada en cisplatino y 5-fluorouracilo puede utilizarse de forma neo y/o adyuvante y como tratamiento de la enfermedad diseminada. La supervivencia en enfermedad metastásica es de alrededor de un año.
ConclusionesDe ser posible siempre se deberá intentar la exéresis del tumor mediante cistectomía parcial y umbilectomía en bloque, junto con linfadenectomía extendida. Aún no existe un esquema de quimioterapia definitivo, aunque se han buscado diferentes combinaciones.
The urachus is an embryonic remnant of the allantois. Urachal carcinoma is a rare entity, with only 400 cases described in the literature. The incidence of this tumor is not known due to its low frequency, and its study protocol and ideal treatment are not strictly defined.
AimsOur aim was to show and compare the results of 5 published series on adenocarcinoma of the urachus in order to understand the best diagnostic course and optimum treatment for these tumors. At present, very little is known of this pathology, except that partial cystectomy with complete exeresis of the urachus is recommended as the initial surgical strategy. We therefore decided to carry out a review of the literature in order to know the etiopathogenesis, clinical manifestations, and best therapeutic approach with respect to this rare tumor.
MethodsA search of the PubMed and MDConsult databases covering the last 10 years was carried out for series that have analyzed adenocarcinoma of the urachus. Studies in Spanish, English, and French were selected, excluding case reports. A total of 5 series were selected and reviewed.
ResultsThe majority of urachal tumors are adenocarcinomas. The definitive diagnosis is made through histopathologic analysis, with tomography and ultrasound being useful complementary studies. Clinical symptoms are characterized by haematuria and a palpable pelvic mass in the majority of patients. The most widely used staging system is that proposed by Sheldon. The majority of cases are diagnosed in late stages because the manifestations do not appear until then.
The treatment of choice is partial cystectomy with en bloc resection of the urachus and umbilicus. Radiotherapy may be used in cases of locally advanced disease, with results in 30% of the patients. Chemotherapy based on cisplatin and 5-fluorouracile can be used as neoadjuvant and/or adjuvant therapy and as treatment for disseminated disease. Survival of the patient with metastatic disease is about one year.
ConclusionsWhenever possible, complete exeresis of the tumor should be attempted through partial cystectomy and en bloc resection of the urachus and umbilectomy, together with extended lymph node dissection. Despite the search for different combinations, a definitive chemotherapy regimen has yet to be established.
Begg describió el carcinoma de uraco en 1931 por primera vez1. Debido a su baja frecuencia, hoy en día el adenocarcinoma de uraco no es una patología contemplada en las guías clínicas norteamericanas o europeas. Hasta la fecha sabemos poco de esta patología, salvo que la cistectomía parcial con exéresis completa del uraco está recomendada como estrategia quirúrgica de inicio. Por este motivo nos planteamos hacer una revisión de la literatura para conocer la etiopatogenia, la clínica y el mejor abordaje terapéutico de esta infrecuente estirpe tumoral.
Actualmente no existe un protocolo terapéutico que muestre cuál es la forma más adecuada para abordar y tratar a este tipo de tumor. Con la información que se cuenta hasta el momento se pueden hacer estimaciones acerca de los resultados. Sin embargo, es importante consolidar los datos y resultados que se obtienen en cada caso con la intención de establecer principios de tratamiento.
MétodoSe realizó una búsqueda en la base de datos Pubmed® según los términos «Urinary Bladder Neoplasms» [Mesh] AND urachal carcinoma. Se excluyen los trabajos de lengua diferente a la inglesa, francesa o española y los casos clínicos aislados. Se seleccionaron un total de 5 trabajos, sobre los que se redactó el presente artículo.
EmbriologíaEl uraco es un remanente embriológico del alantoides que se identifica como una estructura o cordón fibroso que va del ombligo a la cúpula vesical y que normalmente se encuentra obliterado a partir del nacimiento, convirtiéndose en el ligamento umbilical. Durante la embriogénesis, el uraco se forma cuando la cloaca se divide en su parte anterior en el seno urogenital, que posteriormente se transformará en la vejiga y los órganos sexuales, y en la parte posterior formando el recto. Conforme crece el feto, la vejiga desciende hacia la cavidad pélvica guiada por esta estructura, que se obliterará creando el ligamento uracal o uraco2–5.
El uraco está compuesto por 3 capas: urotelio, tejido conectivo y una capa externa de tejido muscular liso. El proceso maligno puede iniciarse en cualquiera de estas estructuras y su origen puede ser mesenquimatoso o epitelial3. Hasta en un tercio de los adultos el uraco puede no estar obliterado después del nacimiento y persistir en forma de quiste o como un conducto que comunica el ombligo con la vejiga5.
Los tumores de uraco se pueden definir estrictamente como adenocarcinomas vesicales que se originan del remanente uracal6.
EpidemiologíaEl carcinoma de uraco en su mayoría es un subtipo histológico del adenocarcinoma vesical que corresponde a menos del 1% de todos los tumores vesicales y hasta al 35% de los adenocarcinomas vesicales4. Los tumores de uraco son en su mayoría adenocarcinomas7. Debido a su baja frecuencia, la incidencia es difícil de calcular. El carcinoma de uraco se presenta con mayor frecuencia en hombres de edad media, entre la 5.a y 6.a décadas de la vida2.
No existen factores de riesgo identificados para el desarrollo de estos tumores, y se ha descartado la posibilidad de que un uraco permeable sea factor predisponente para la aparición de carcinoma uracal. A diferencia de los tumores uroteliales, el tabaquismo y la exposición a sustancias químicas no se han relacionado con este cáncer.
Existen menos de 400 casos reportados en la literatura desde su primera descripción en 1931, y la conducta diagnóstica y terapéutica ideal aún es poco clara.
Clasificación histopatológicaDe acuerdo con una serie de la Clínica Mayo, los adenocarcinomas son el tipo histológico más frecuente en los tumores de uraco, alcanzando el 90%. De los adenocarcinomas, un 63.6% son productores de mucina, también llamados entéricos, y el 4.5% pueden presentar componente de células transicionales, o bien un patrón mixto microcítico, de células transicionales y adenocarcinoma en un 2.2%. El 4% son uroteliales puros, el 4% sarcomatosos y hasta en el 2% de los casos pueden ser indiferenciados7.
Con base en esta información, los tumores de uraco podrían tratarse de acuerdo con su origen con una respuesta más favorable a los esquemas de quimioterapia para cada estirpe histológica.
El origen histológico de estos tumores se atribuye a 2 teorías propuestas. La primera sugiere la presencia de remanentes embriológicos de origen entérico que persisten en la cloaca durante el desarrollo embrional. La segunda propone un origen metaplásico a partir de cistitis glandularis que se puede presentar incluso en vías urinarias altas o en vejigas extróficas, aun cuando el epitelio urotelial sea normal2,4.
ClínicaDebido a su curso silente, con frecuencia los tumores de uraco se encuentran en un estadio avanzado en el momento de diagnosticarse. Esto se atribuye a que la infiltración neoplásica avanza desde un origen extravesical hacia la vejiga, y no es hasta que logra infiltrarla totalmente que se manifiesta clínicamente. La hematuria (microscópica o macroscópica) es el síntoma predominante, y se observa hasta en el 85%. Otros signos y síntomas que pueden aparecer son el dolor en la región periumbilical en el 8.5%, secreción fétida o sanguinolenta por el ombligo, una masa palpable en el 17%, secreción mucosa por uretra en el 17%, infecciones urinarias de repetición o síntomas urinarios irritativos y obstructivos1,8. En ocasiones los síntomas pueden ser suficientemente sugestivos o sospechosos de un tumor de uraco; a pesar de esto, existen otros casos en los que el diagnóstico definitivo puede llegar a ser muy complejo.
DiagnósticoEn el estudio cistoscópico, el hallazgo más frecuente es el de una masa tumoral localizada en la cúpula vesical o en la pared anterior (91.5%). Estas localizaciones son altamente sugestivas de un origen uracal. Los tumores pueden ser macroscópicamente polipoides o ulcerados.
Los estudios de imagen más útiles para el diagnóstico inicial de estos tumores son la tomografía axial computarizada con contraste, la resonancia magnética nuclear y el ultrasonido. El hallazgo tomográfico más frecuente es la presencia de calcificaciones intravesicales, y se observa hasta en el 70%9. En la cistografía se pueden encontrar defectos de llenado o calcificaciones en la cúpula vesical. La citología urinaria es positiva en el 38% aproximadamente8.
Cuando el origen de estos tumores es entérico, puede existir elevación del antígeno carcinoembrionario. También se ha visto aumento de los niveles del Ca19-9 y del Ca-125 en algunos pacientes; sin embargo, estos no se consideran útiles para el diagnóstico o seguimiento10.
El uso de tinciones histológicas ayuda en ocasiones al diagnóstico patológico definitivo. En la serie de Gopalan et al.3 las tinciones inmunohistoquímicas con marcadores para citoqueratina20 (CK20) y el gen CDX-2 fueron positivas en el 100% de tumores de uraco, mientras que citoqueratina7 (CK7) fue positivo en el 50%. En un análisis inmunohistoquímico realizado de 39 adenocarcinomas de uraco se observaron diferentes niveles de expresión para los siguientes marcadores inmunohistoquímicos: p63 (3%), CK7 (50%), CK20 (100%), gen CDX2 (85%), catenina-βnuclear (6%), claudina-18 (53%) y RegIV (85%)11,12.
La utilidad de las pruebas inmunohistoquímicas permite diferenciar un adenocarcinoma de origen colónico de uno vesical, ya que, de acuerdo con Wang et al.13, la expresión de la catenina- βnuclear es específica para los adenocarcinomas colorrectales, mientras que la expresión de CK20 se da en el 100% de los adenocarcinomas de uraco.
Estadificación y factores pronósticosLa identificación de factores clínicos y patológicos, como la localización del tumor, la delimitación del mismo con urotelio sano y la ausencia de otro adenocarcinoma localizado en algún otro sitio que se pudiera diseminar a la vejiga, son hechos importantes al momento de realizar el diagnóstico14.
Inicialmente, Sheldon et al.4 y Mostofi et al.15 establecieron los criterios diagnósticos para el carcinoma de uraco. Estos criterios han sido cuestionados, ya que no siempre es posible cumplir con todos ellos, aun cuando los hallazgos sugieran un carcinoma de uraco. Es por esto que siempre que se encuentre un adenocarcinoma vesical por vía endoscópica, con un origen poco claro, es necesario descartar un posible carcinoma de uraco. El M.D. Anderson Cancer Center ha utilizado criterios diagnósticos más prácticos basándose en los previos16 (tabla 1) y también ha propuesto que el hallazgo patológico de cistitis quística en el tumor, displasia urotelial o una histología más clásica de cáncer urotelial deban hacer pensar en un tumor diferente a uno de uraco2.
Criterios diagnósticos alternos para diagnóstico de cáncer de uraco según el M.D. Anderson Cancer Center
| 1. Localización en el domo vesical o en la línea media de la vejiga |
| 2. Clara delimitación del tumor y el urotelio sano |
| Criterios que apoyan el diagnóstico |
| Histología de origen entérico |
| Ausencia de displasia urotelial |
| Ausencia de cistitis quística o cistitis |
| Ausencia de adenocarcinoma primario en algún otro órgano |
Fuente: Siefker-Radtke2,16.
Aunque no existe ningún sistema validado para la estadificación de estos tumores, el más conocido es el propuesto por Sheldon (tabla 2)2,4,7. La clasificación TNM, que se utiliza para estadificar los tumores vesicales, no siempre es de utilidad para muchos centros debido a que los tumores de uraco tienen su origen en una localización extravesical y la infiltración hacia la vejiga se da de forma secundaria o incluso puede llegar a estar ausente. Otras clasificaciones que han sido propuestas son la de Ontario17 y la de la Clínica Mayo (tabla 3)8.
Desgraciadamente, la gran mayoría de estos tumores son diagnosticados en estadiosIII/IV, ya que los síntomas comienzan a manifestarse una vez que el tumor se encuentra avanzado.
El grado de diferenciación ha sido motivo de controversia, ya que, de acuerdo con Pinthus et al.17, la supervivencia cáncer-específica a 5años es del 90% en aquellos pacientes con tumores bien diferenciados tratados con cirugía, mientras que los pacientes que se encuentran en un estadioIIIc-IIId, es decir, con tumores poco diferenciados, tienen un riesgo más alto de recaída únicamente con el tratamiento quirúrgico10,18.
Johnson et al.14, por su parte, concluyeron que ni el tipo histológico (adenocarcinoma coloide vs adenocarcinoma entérico), ni el grado de diferenciación ni la presencia o ausencia de células en anillo de sello se correlacionan con el pronóstico. Ashley et al.8 observaron que los factores que se correlacionaban con una menor supervivencia eran los márgenes quirúrgicos positivos, el alto grado, la presencia de ganglios, las metástasis al diagnóstico, el estadio avanzado, la cirugía sin inclusión del ombligo y el tratamiento inicial con radioterapia. En este estudio, los factores relacionados significativamente con la supervivencia fueron el estadio, el grado de diferenciación y el estado de los márgenes tumorales.
En el estudio de la Clínica Mayo se utilizó la clasificación TNM para tumores vesicales, y obtuvieron la supervivencia específica de cada estadio. La supervivencia por estadios fue la siguiente: estadioi (>10años), estadioii (7.5años), estadioiii (1-2años) y estadioiv (<2 años)7.
TratamientoHoy en día, el tratamiento de elección es la cistectomía parcial con resección completa del uraco y el ombligo en bloque. En distintos estudios se ha visto que la supervivencia con la cistectomía parcial es semejante a la de la cirugía radical, por lo que el manejo deberá ser siempre con la intención de preservar la vejiga8,19,20. Este tipo de resección permite hacer una exéresis en bloque del complejo ombligo-uraco-vejiga. La resección incompleta del uraco o del ombligo da origen a una mayor posibilidad de recidiva. En aquellos casos en que no es factible alcanzar márgenes negativos con la cistectomía parcial deberá hacerse una cistectomía radical.
La radioterapia se ha utilizado en casos con márgenes positivos, o bien en los casos irresecables quirúrgicamente. En estos últimos la supervivencia media es únicamente de 19.5meses7. En la actualidad no hay evidencia que apoye la radioterapia o la quimioterapia como la mejor opción de tratamiento adyuvante8.
La presencia de micrometástasis empeora significativamente el pronóstico, por lo que se hace necesaria la linfadenectomía pélvica por su importante valor pronóstico y terapéutico. El papel de la linfadenectomía es importante, ya que se ha visto que la presencia de micrometástasis ganglionares conlleva cifras de supervivencia menores a 25meses posteriores al diagnóstico. El principal sitio de drenaje del uraco son los ganglios de las venas y arterias iliacas externas. Por este motivo, la extensión de la linfadenectomía debe ser la misma que para una cistectomía radical habitual, es decir, la exéresis de iliacos comunes, iliacos externos e internos, obturadores y presacros. Siefker-Radtke et al. encontraron que la presencia de adenopatías positivas se correlaciona con la supervivencia, por lo que se debe considerar la linfadenectomía extendida en todos los casos16,20.
En los pacientes con ganglios sospechosos en los estudios de imagen puede plantearse la posibilidad de quimioterapia neoadyuvante, aunque la evidencia a este respecto es escasa2.
Con lo antes mencionado, el tratamiento adyuvante con quimioterapia es imprescindible en todos los casos con ganglios regionales positivos21.
En la serie de Molina et al.7, 49 pacientes recibieron tratamiento con quimioterapia en casos localmente avanzados o metastásicos. Utilizaron distintos esquemas de quimioterapia, como 5-fluorouracilo (5-FU); 5-FU y cisplatino; 5-FU, lomustina y vincristina; taxol y cisplatino; platino y etopósido, y MVAC solo o en combinación con radioterapia. La mayor supervivencia se observó con la combinación de 5-FU, lomustina y vincristina, con un periodo de enfermedad estable de 22meses en un solo paciente. El 71% de los pacientes con un régimen con platino observaron respuesta parcial o enfermedad estable. La radioterapia en combinación con la quimioterapia mostró una media de supervivencia de 21meses.
Ashley et al.8 administraron quimioterapia adyuvante basada en cisplatino al 100% de los pacientes con ganglios positivos o márgenes positivos, paclitaxel en el 50% y doxorubicina en el 33%. No encontraron ninguna diferencia significativa en la supervivencia cáncer-específica con el uso de alguna quimioterapia adyuvante.
Desafortunadamente, las series, tanto de quimioterapia adyuvante como terapéutica, tienen un número de casos muy limitado, los esquemas terapéuticos son muy variables y no aportan ningún nivel de evidencia. Al momento, parece que los esquemas para tratar este tipo de tumores deberían incluir taxanos y los regímenes empleados en tumores gastrointestinales.
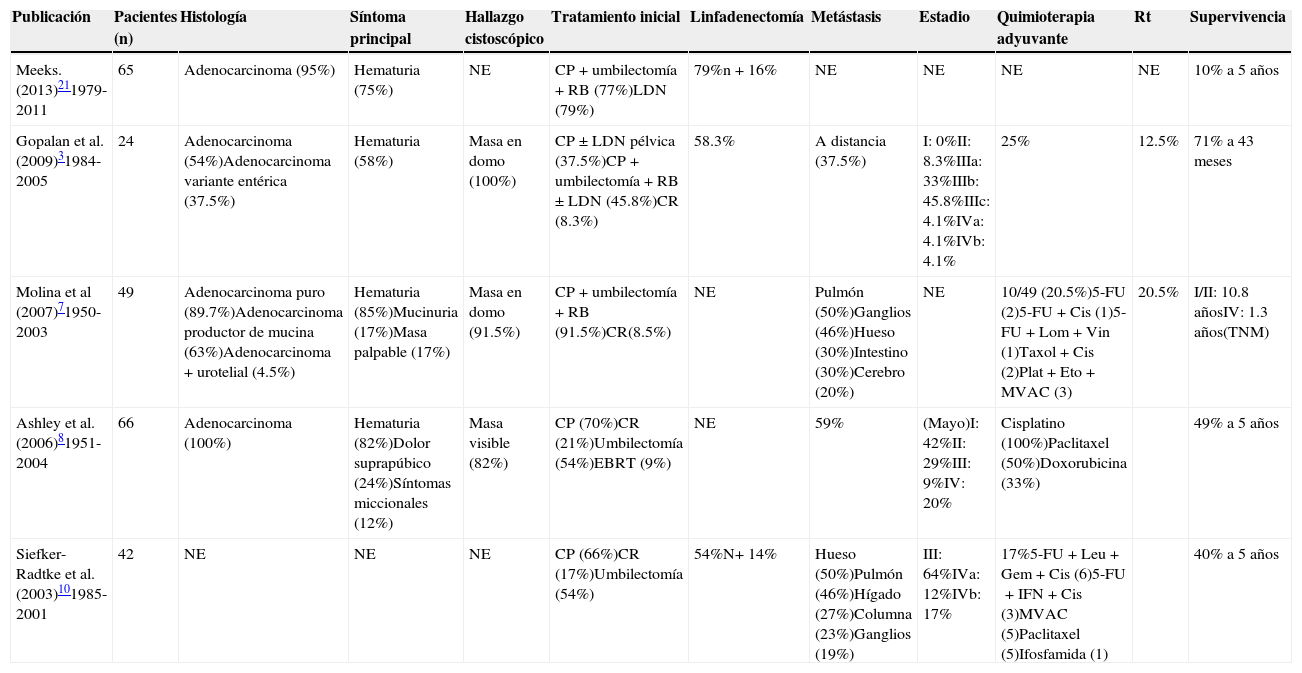
En la tabla 4 se muestran los datos resumidos de los 5 estudios en los que basamos esta revisión.
Compendio de datos de los 5 estudios
| Publicación | Pacientes (n) | Histología | Síntoma principal | Hallazgo cistoscópico | Tratamiento inicial | Linfadenectomía | Metástasis | Estadio | Quimioterapia adyuvante | Rt | Supervivencia |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Meeks. (2013)211979-2011 | 65 | Adenocarcinoma (95%) | Hematuria (75%) | NE | CP+umbilectomía+RB (77%)LDN (79%) | 79%n+16% | NE | NE | NE | NE | 10% a 5 años |
| Gopalan et al. (2009)31984-2005 | 24 | Adenocarcinoma (54%)Adenocarcinoma variante entérica (37.5%) | Hematuria (58%) | Masa en domo (100%) | CP±LDN pélvica (37.5%)CP+umbilectomía+RB±LDN (45.8%)CR (8.3%) | 58.3% | A distancia (37.5%) | I: 0%II: 8.3%IIIa: 33%IIIb: 45.8%IIIc: 4.1%IVa: 4.1%IVb: 4.1% | 25% | 12.5% | 71% a 43 meses |
| Molina et al (2007)71950-2003 | 49 | Adenocarcinoma puro (89.7%)Adenocarcinoma productor de mucina (63%)Adenocarcinoma+urotelial (4.5%) | Hematuria (85%)Mucinuria (17%)Masa palpable (17%) | Masa en domo (91.5%) | CP+umbilectomía+RB (91.5%)CR(8.5%) | NE | Pulmón (50%)Ganglios (46%)Hueso (30%)Intestino (30%)Cerebro (20%) | NE | 10/49 (20.5%)5-FU (2)5-FU+Cis (1)5-FU+Lom+Vin (1)Taxol+Cis (2)Plat+Eto+MVAC (3) | 20.5% | I/II: 10.8 añosIV: 1.3 años(TNM) |
| Ashley et al. (2006)81951-2004 | 66 | Adenocarcinoma (100%) | Hematuria (82%)Dolor suprapúbico (24%)Síntomas miccionales (12%) | Masa visible (82%) | CP (70%)CR (21%)Umbilectomía (54%)EBRT (9%) | NE | 59% | (Mayo)I: 42%II: 29%III: 9%IV: 20% | Cisplatino (100%)Paclitaxel (50%)Doxorubicina (33%) | 49% a 5 años | |
| Siefker-Radtke et al. (2003)101985-2001 | 42 | NE | NE | NE | CP (66%)CR (17%)Umbilectomía (54%) | 54%N+ 14% | Hueso (50%)Pulmón (46%)Hígado (27%)Columna (23%)Ganglios (19%) | III: 64%IVa: 12%IVb: 17% | 17%5-FU+Leu+Gem+Cis (6)5-FU+IFN+Cis (3)MVAC (5)Paclitaxel (5)Ifosfamida (1) | 40% a 5 años |
Cis: cisplatino; CP: cistectomía parcial; CR: cistectomía radical; EBRT: radioterapia de haz externo; Eto: etopósido; LDN: linfadenectomía; Lom: lomustina; MVAC: metotrexato, vinblastina, doxorubicina y cisplatino; N+: linfadenectomía positiva; NE: no especificado; Plat: platino; RB: resección en bloque; Vin: vincristina.
En el M.D. Anderson Cancer Center se ha llevado a cabo un estudio en faseii para tratar con 5-fluorouracilo, leucovorin, gemcitabina y cisplatino (Gem-FLP) a pacientes con adenocarcinoma vesical y de uraco metastásicos, donde la supervivencia media es de 24meses comparada con los 12meses de otras series2. Si estos resultados se confirman podrían convertir este esquema en el tratamiento estándar de esta enfermedad.
PronósticoEn general, la agresividad de estos tumores es característica y la supervivencia posterior al tratamiento no es muy alentadora. La supervivencia a 5años es del 40 al 49% según distintas series7,10,11,22. Henley et al.19 observaron una supervivencia global del 43% a 5años en 34 pacientes que fueron tratados con cistectomía parcial y umbilectomía radical. En el trabajo de Ashley et al.8 la mediana de tiempo de aparición de recidivas locales fue de 4.8meses. Estas recidivas en pacientes que han sido operados aparecen en la pelvis, la vejiga y la pared abdominal3,7. En más del 50% de los casos se presentan metástasis.
Las metástasis están presentes en el momento del diagnóstico inicial en el 30% de los pacientes y se localizan comúnmente en ganglios iliacos externos (que corresponden al sitio principal de drenaje linfático del uraco), hueso, pulmón y peritoneo. Los pacientes que presentan metástasis tienen una supervivencia cáncer-específica menor a un año11. Con la información del estudio de la Clínica Mayo, con 42 pacientes y un seguimiento medio de 62meses se observó una diferencia en la supervivencia global de 12años en enfermedad en estadios tempranos vs 1.7años en enfermedad avanzada.
En la misma serie se observó que los pacientes en estadiosi/ii tienen una supervivencia de 10.8años (IC95%, 6.9 a 12años) comparado con una media de supervivencia de 1.3años en aquellos con enfermedad metastásica (IC95%, 1.1 a 1.9años).
De acuerdo con la serie presentada por el M.D. Anderson Cancer Center, la supervivencia global media observada en 42 pacientes con carcinoma de uraco fue de 42meses con un seguimiento medio de 49meses, con un 40% de sobrevivientes a los 5años. De estos 42 pacientes, el 17% presentaban metástasis al momento del diagnóstico. De los que recibieron manejo quirúrgico, el 84% tenían enfermedad localmente avanzada con afectación de la vejiga, pared abdominal u órganos adyacentes (iii) y el 16% presentaban afectación ganglionar al momento de la cirugía (iv). La extensión del cáncer, la afectación ganglionar y la positividad de márgenes correlacionó significativamente con la supervivencia. En esta serie, el tiempo medio de progresión fue de 29meses. Los sitios de metástasis más comunes fueron hueso (50%), columna (23%), pulmón (46%), hígado (27%), ganglios (19%) y cerebro (19%). El tiempo medio hasta la aparición de las metástasis fue de 24meses. El tiempo promedio de supervivencia tras el diagnóstico de metástasis fue de 29meses (2 a 100meses). La supervivencia no se relacionó con el sitio de metástasis10.
De los pacientes que presentaron enfermedad metastásica (26 pacientes), 20 recibieron quimioterapia de rescate con una supervivencia de 20 meses a partir del primer ciclo. La mayoría de los pacientes que respondieron recibieron 5-fluorouracilo y cisplatino.
ConclusiónEl carcinoma de uraco es una entidad infrecuente, de la cual aún se conoce poco sobre su comportamiento y tratamiento ideal. El cuadro clínico debe hacer sospechar la posibilidad de un tumor de estas características, y el manejo deberá ser agresivo y oportuno para lograr una supervivencia prolongada. En todo caso, se deberá intentar la exéresis del tumor mediante cistectomía parcial y umbilectomía en bloque, junto con linfadenectomía extendida. Aún no existe un esquema de quimioterapia definitivo, aunque el que mejores resultados ha dado es la combinación de 5-fluorouracilo con cisplatino y taxanos. Consideramos importante continuar reportando casos y el análisis de series para en un futuro poder protocolizar la conducta en estos casos.
FinanciaciónNo se recibió patrocinio de ningún tipo para llevar a cabo este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.