INTRODUCCIÓN
El cáncer de próstata (CaP) es la segunda neoplasia más común después del cáncer de piel y la segunda causa de muerte en los varones por neoplasia después del cáncer de pulmón.1 Se han referido numerosos factores en el aumento de la incidencia del cáncer de próstata. Más de 200,000 personas en Estados Unidos se diagnostican cada año con CaP y 30,000 mueren por esta enfermedad. Después de los 50 años de edad, la incidencia de CaP se incrementa tres o cuatro veces cada 10 años.1 Los afroamericanos muestran la tasa de incidencia global más elevada de CaP, que pasó de 124 por 100,000 a 250 por 100,000, un aumento de 102%. Los hispanoamericanos presentaron una incidencia intermedia de 104 por 100,000. Los países asiáticos, sobre todo Japón y China, poseen una de las tasas más bajas de incidencia y mortalidad por CaP en el mundo. Entre 1992 y 1995, la incidencia de mortalidad por CaP en Japón fue de 4 por 100,000.2 En México, el CaP ocupó en 1998 el segundo lugar respecto de la incidencia entre las neoplasias del varón, después del cáncer de piel. En cuanto a la mortalidad, ocupó también el segundo lugar de la totalidad de las neoplasias después del carcinoma cervicouterino.3
La etiología del CaP no es del todo clara. Hasta el momento, los aspectos que se han considerado como factores de riesgo son la edad del individuo, la producción y metabolismo de los andrógenos, el área geográfica/etnia, el hábito dietético y los antecedentes familiares.
La hiperplasia prostática benigna (HPB) se define, en términos histológicos, como una enfermedad caracterizada por aumento de las células epiteliales y estromales en el área periuretral de la próstata.4,5 Es un proceso patológico que contribuye con el desarrollo de síntomas del tracto urinario inferior en individuos de edad avanzada. Las principales complicaciones de los pacientes con HPB son molestias del tracto urinario bajo, en particular nicturia, tenesmo, disminución de la fuerza y el calibre del chorro y sensación de vaciamiento vesical incompleto.6
La HPB es el tumor benigno más común en varones y su incidencia se relaciona con la edad. La prevalencia de la HPB es dependiente de la edad, con inicio en su desarrollo después de los 40 años de edad. Alrededor de los 60 años su prevalencia es de 50% y a los 85 años de edad es de 90%. Aunque los signos clínicos de la enfermedad aparecen con menos frecuencia, los síntomas de las vías urinarias bajas también se vinculan con la edad. Cerca de la mitad de todos los varones con diagnóstico histológico de HPB tiene síntomas del tracto urinario bajo de intensidad moderada a grave.7
Al igual que el CaP, existe un vínculo con la edad del individuo y requiere andrógenos para desarrollarse y crecer. En cambio, a diferencia del CaP, la HPB es una lesión benigna que rara vez progresa hacia una neoplasia maligna. Otra disimilitud respecto del CaP es la falta absoluta de evidencia indicativa de que la HPB es clonal y sólo se han encontrado algunos cambios genéticos que implican estabilidad genómica. En la HPB no se reconocen grados morfológicos en el núcleo, que son característicos en las neoplasias malignas. En la patología hiperplásica se presentan con frecuencia crecimientos variables del estroma y se ha sugerido que la secreción de factores de crecimiento por parte del mesénquima podría actuar sobre las células epiteliales adyacentes y contribuir al desarrollo de la hiperplasia de estas últimas.8
Se calcula que la dieta puede contribuir con el 35% de todos los cánceres humanos.9 La evidencia epidemiológica revela de forma consistente que una ingestión baja de antioxidantes o un nivel sanguíneo bajo de antioxidantes pueden elevar el riesgo de padecer cáncer. Tanto el tabaquismo como la inflamación crónica (dos de las principales causas de cáncer) tienen como un componente principal a los radicales libres en su mecanismo de acción.
En fecha reciente se ha señalado que el daño oxidativo desempeña una función crítica en varias anomalías clínicas, entre ellas las enfermedades malignas. Las especies reactivas de oxígeno (ERO) pueden causar oxidación del ADN y daño a proteínas, daño a genes supresores tumorales y una mayor expresión de los protooncogenes. El cáncer muestra un cambio prooxidativo en estado de oxidorreducción.
La actividad de la NADPH oxidasa fagocítica constituye una de las fuentes endógenas más importantes de las especies reactivas del oxígeno en el organismo. Este sistema enzimático se integra con varias proteínas distribuidas entre el citoplasma y la membrana plasmática. Durante la activación leucocitaria, los componentes ubicados en el citosol migran a la membrana plasmática, donde tiene lugar el ensamblaje del complejo funcional que conforma el sistema enzimático activo.10
La presencia de oxígeno es un requisito vital para la destrucción y digestión de los agentes patógenos por los fagocitos, pero no es necesaria para la fagocitosis misma. La NADPH oxidasa cataliza la transferencia de un electrón desde NADPH hacia el oxígeno con la formación del radical superóxido. El superóxido se convierte rápidamente en peróxido de hidrógeno, radical hidroxilo y ácido hipocloroso.11
La activación de los leucocitos polimorfonucleares es un suceso característico del proceso inflamatorio. De manera simultánea, con el proceso inflamatorio se observa un aumento de la producción de óxido nítrico (NO) por inducción de la óxido nítrico sintetasa inducible (iNOS). La superproducción de NO determina su reacción, mediada por difusión, con el anión superóxido, lo que tiene como resultado peroxinitrito (ONOO-), una especie altamente reactiva capaz de oxidar y nitrar componentes celulares y tisulares, tales como los residuos de tirosina de las proteínas celulares y plasmáticas. Está bien documentado el daño estructural y funcional a nivel mitocondrial, que se torna irreversible debido a la oxidación y nitración de componentes mitocondriales. El ONOO- también oxida y produce una declinación de los antioxidantes endógenos, como ascorbato, glutatión y superóxido dismutasa. La presencia de ONOO- y otras especies reactivas derivadas del nitrógeno (ERN), como el dióxido de nitrógeno (NO2), ha llevado a ampliar el concepto común de estrés oxidativo para incluir el de estrés nitrosativo.12
Los estreses oxidativo y nitrosativo actúan al perpetuar el proceso inflamatorio por diferentes mecanismos. Las ERO y las especies reactivas de nitrógeno (ERN) tienen efectos quimiotácticos, lo cual favorece el reclutamiento de neutrófilos. Además, las moléculas mediadoras del estrés oxidativo se constituyen también en mensajeros intracelulares para la transducción de señales del proceso inflamatorio. Las fuentes intracelulares de ERO incluyen los complejos I y II de la cadena mitocondrial del transporte electrónico, peroxisomas, sistemas enzimáticos de monooxigenasas y dioxigenasas y los leucocitos polimorfonucleares. En los últimos años se ha demostrado que ante diferentes estímulos fisiopatológicos, las células vasculares producen ERO y que la principal fuente de radicales libres en estas células es una oxidasa vascular que utiliza NADH y NADPH como sustratos reductores para la transferencia monoelectrónica al oxígeno molecular y producción concomitante de superóxido. Esta oxidasa vascular es, en muchos aspectos, similar a la NADPH oxidasa de los neutrófilos, aunque difiere en sus mecanismos de activación. Un aspecto en especial importante de la NADH/NADPH oxidasa vascular es que su actividad se estimula por angiotensina II, citocinas y lipoproteínas oxidadas, a través de la estimulación de dicha oxidasa vascular. La vida media corta del NO y el delicado equilibrio existente entre su síntesis, utilización por blancos biológicos normales o, por el contrario, por reacciones que median su descomposición, inactivación o transformación secundaria en ERN, determinan que haya situaciones en las que su disponibilidad esté disminuida, lo que favorece y genera procesos de daño tisular.12
El NO es un gas ligeramente soluble en algunos solventes y puede difundirse con relativa facilidad en membranas biológicas, pero su solubilidad en agua es baja.13 El NO se forma por la conversión enzimática del aminoácido L-arginina (isómero levógiro) a L-citrulina mediante la acción de las sintasas de óxido nítrico (NOS), aunque puede formarse a partir de nitritos en agua oxigenada. El NO lo producen también el endotelio o las plaquetas; el NO se sintetiza en neuronas del sistema nervioso central, donde actúa como neurotransmisor.13
En el sistema nervioso periférico, el NO es un mediador liberado por una amplia red de nervios previamente conocidos como no adrenérgicos y no colinérgicos. Estos nervios median algunas formas de vasodilatación neurogénica y regulan ciertas funciones gastrointestinales, respiratorias y genitourinarias. El NO también se genera en grandes cantidades durante los mecanismos de defensa del hospedero. Tal generación de NO se observó primero en macrófagos activados, en los que contribuye a su toxicidad contra células tumorales y microorganismos invasores.13
El NO también puede reaccionar con el radical superóxido para producir ONOO-, el cual a su vez puede nitrar tirosina y formar 3-nitrotirosina. La NOS es una enzima que contiene un grupo hem con secuencia similar a la de la citocromo P-450 reductasa. Las NOS forman homodímeros que catalizan la formación de L-citrulina y NO a partir de L-arginina con utilización de oxígeno y NADPH como sustratos y flavina adenina mononucleótido (FMN), flavina adenina dinucleótido (FAD), tetrahidrobiopterina (H4B), hem, Ca2+/calmodulina y zinc2+ como cofactores. Las NOS se expresan en casi todas las células de mamíferos, sean normales o neoplásicas.13
Se cree que los niveles elevados de NO pueden ser citostáticos o citotóxicos para algunas células tumorales y también que en algunos lugares en los que se encuentra bajo su nivel podría promoverse el crecimiento del tumor.14
El NO y sus metabolitos interactúan con ERO para generar potentes agentes nitrosativos que conducen a la formación de 3-nitrotirosina, la cual es una de las notorias modificaciones químicas que ocurren durante el estrés oxidativo/nitrosativo.14 El NO modula los niveles de ERO en parte por su reacción con el anión superóxido; al final, las proteínas que participan en la respuesta al estrés celular también son importantes en la modulación del daño oxidativo; cada componente del sistema antioxidante se localiza de forma específica en compartimientos subcelulares.15 Como las ERO, ERN, NO o sus metabolitos pueden llevar a la formación de peroxinitrito y con ello a la nitración de proteínas, además de la alteración del estado oxidorreductor celular, puede promoverse el estado neoplásico de las células; el objetivo del presente trabajo fue estudiar el grado de nitración de las proteínas en el CaP y la HPB.
MATERIAL Y MÉTODOS
Sujetos de estudio: La recolección de muestras se llevó a cabo entre diciembre del 2006 y abril del 2008 y se seleccionaron las muestras de los pacientes registrados en la libreta de cirugía del servicio de urología del Hospital Central Militar que cumplieron con los criterios de inclusión, exclusión y eliminación.
1. Criterios de inclusión: a) pacientes con diagnóstico de CaP y síndrome obstructivo urinario bajo de las vías urinarias; b) pacientes con diagnóstico de HPB con indicación de resección transuretral prostática (RTUP) y prostatectomía radical.
2. Criterios de exclusión: a) pacientes que no autorizaron su participación en el procedimiento; b) pacientes no elegibles para RTUP.
3. Criterios de eliminación: a) cantidad de tejido insuficiente; b) tejido que durante el traslado sufriera degradación.
La cantidad de tejido necesaria para la investigación fue de 1 a 5 g y la obtención de las muestras se efectuó inmediatamente después de la realización de la intervención quirúrgica. El tiempo de traslado que se tomó como máximo fue de una hora, desde la obtención de la muestra hasta el laboratorio de biología molecular de la Escuela Médico Militar, donde se mantuvo a una temperatura de -70°C en el ultracongelador Revco® (Legaci ULT2186 3-35 Dupont SVVA Refrigerants).
Inmunohistoquímica: Por microscopia de luz, las muestras de tejidos de CaP y HPB se fijaron por inmersión en formalina (pH, 7.4) y se embebieron en parafina. Para el análisis histológico se tiñeron las secciones de tejido (3 µm) con hematoxilina y eosina. Para mostrar los polisacáridos, mucopolisacáridos y glucoproteínas de la membrana celular, las secciones de tejido se sometieron a tinción con ácido peryódico de Shiff.
Los cortes se incubaron con ácido peryódico durante 5 min y se lavaron con agua destilada; luego se incubaron con el reactivo de Schiff durante 5 min y recibieron una contratinción con hematoxilina por 30 seg. El perfil histológico de cinco campos seleccionados aleatoriamente (tres muestras por paciente) se registró mediante el software KS-300 (Carl Zeiss, Jena, Germany). Se obtuvo el porcentaje de área dañada con alteraciones histopatológicas (magnificación, 400x). Para la inmunohistoquímica, las secciones de tejido (3 mm) se desparafinaron y se calentaron para revelar los sitios antigénicos; la actividad endógena de la peroxidasa se bloqueó con 0.03% de H2O2 en metanol absoluto. Las secciones de tejido se incubaron toda la noche a 4ºC a una dilución 1:200 de anticuerpo monoclonal contra 3-NT en solución TRIS. Se removió el anticuerpo primario y se realizaron dos lavados repetitivos con TRIS y los cortes se incubaron con una dilución 1:500 de anticuerpo policlonal de conejo como anticuerpo secundario y se realizaron dos lavados repetitivos con TRIS. Los anticuerpos unidos se detectaron con el complejo avidina-biotina (ABC-kit Vectatastain) y la diaminobenzidina como sustrato. Después de lavar repetidamente con TRIS los cortes se sometieron a contratinción con hematoxilina. Todos los cortes se incubaron bajo las mismas condiciones, con la misma concentración de anticuerpo y en la misma corrida, por lo cual la inmunotinción fue comparable. Todas las inmunohistoquímicas se examinaron con el microscopio de luz Axiovert 200M (Carl Zeiss, Jena, Germany). Para el análisis densitométrico automatizado, el porcentaje de área positiva (color marrón) se determinó con un analizador de imágenes computarizado KS-300 3.0 (Carl Zeiss, Jena, Germany). Este equipo detecta automáticamente las áreas positivas y determina su porcentaje por campo. Se estudiaron cinco campos aleatorios a una magnificación de 100 (área total, 1,584,000 µ2). Los resultados se expresaron como porcentaje.
Análisis de datos: Los datos de la inmunorreactividad de 3-NT se analizaron con la prueba t de Student y los datos se expresaron como media ± desviación estándar; asimismo, se compararon ambos grupos (CaP y HPB) y se consideró una p < 0.05, como diferencia estadísticamente significativa. Para la aplicación de las pruebas estadísticas se utilizó el programa Graph Prisma versión 3.32.
RESULTADOS
Se obtuvieron las muestras biológicas de un total de 70 pacientes; 40 sujetos (57.14%) tenían diagnóstico establecido de CaP, mientras que 30 (42.85%) tuvieron diagnóstico establecido de HPB.
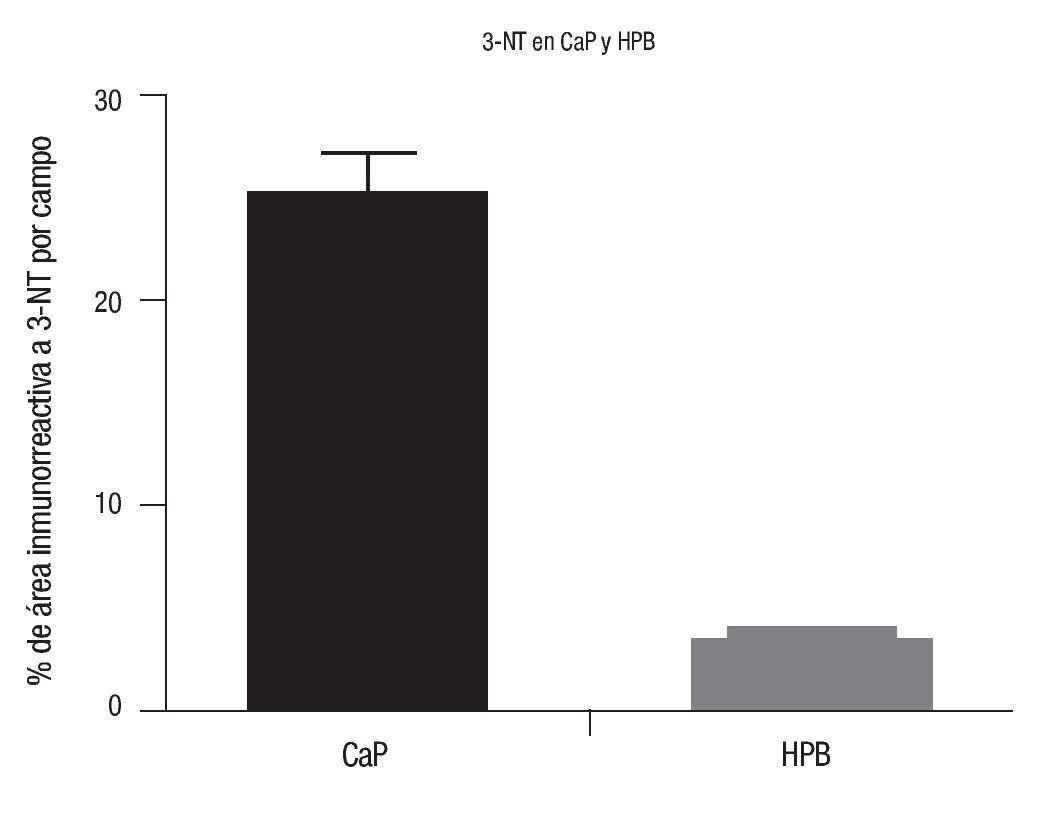
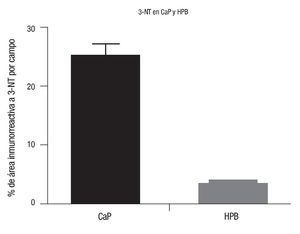
El porcentaje de área inmunorreactiva a 3-NT fue de 25.78 ± 15.37% y 4.43 ± 2.2%, en CaP y HPB (p <0.001), respectivamente (Imágenes 1y 2).
Imagen 1. Determinación de 3-NT en CaP y HPB. En el eje de las ordenadas se representan los valores del porcentaje del área inmunorreactiva a 3-NT por campo en tejidos de CaP y HPB; en el eje de las abscisas aparecen los grupos de estudio (CaP y HPB). En la gráfica se muestra que el área marcada (inmunorreactiva) para 3-NT (3-nitrotirosina) es mucho mayor en tejidos con CaP comparados con los tejidos con HPB. CaP, n=40; HPB, n=30; p <0.001. Los valores se representan como la media ± desviación estándar.
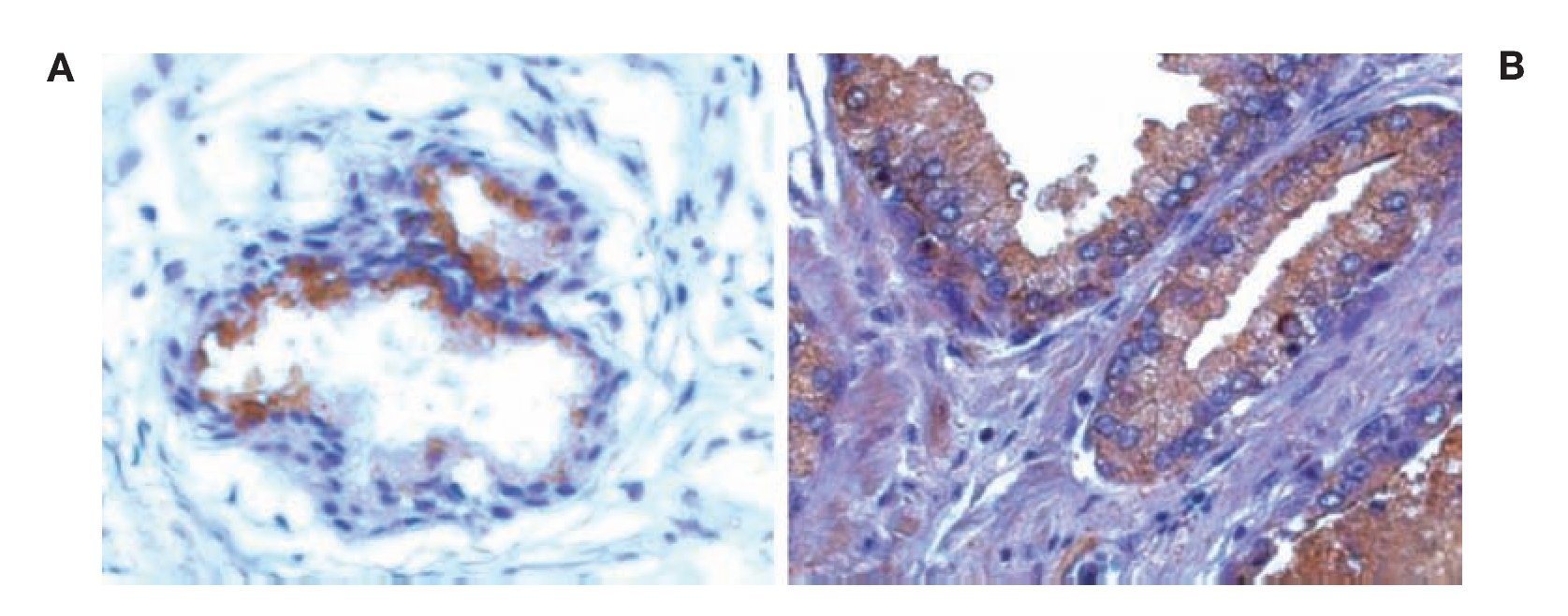
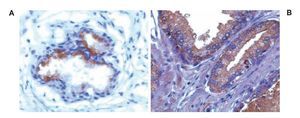
Imagen 2.Localización de 3-NT por inmunohistoquímica. Imágenes representativas de la expresión de 3-NT en cortes de tejido humano con diagnóstico histopatológico de HPB y CaP. A. HPB con expresión de 3-NT. B. CaP con expresión de 3-NT. El tejido glandular de próstata con HPB y CaP muestra inmunotinción positiva para 3-NT (color café o marrón). Las microfotografías son representativas y el campo representa 40x.
DISCUSIÓN
En este estudio se determinó y analizó el daño a proteínas (nitración de proteínas) en tejidos de pacientes con cáncer de próstata e hiperplasia prostática benigna. Para que la metodología fuera adecuada, se determinó primero en los tejidos el foco tumoral, así como las áreas características de HPB, con utilización de un anticuerpo monoclonal contra 3-NT para cuantificar la concentración de 3-NT (inmunohistoquímica) en los tejidos mencionados.
En estudios que condujeron Masri y colaboradores se determinaron las alteraciones para NO y sus metabolitos en cáncer de pulmón; estos investigadores demostraron que el NO, nitritos y nitrotirosina están incrementados en pacientes con cáncer de pulmón. Este dato es consistente con lo encontrado en el presente estudio, en el cual se observó que existe mayor nitración de proteínas en tejidos con CaP en comparación con tejidos con HPB. El área histológica estudiada (foco tumoral en CaP) y analizada fue el tejido glandular, en el cual se advirtió que es evidente el aumento de la inmunorreactividad, como se observa en la Imagen 2. Los autores describieron que el aumento de la 3-NT está limitado al tumor y por tanto al proceso tumoral. Asimismo, señalan que la acidosis y el ambiente altamente reducido del tumor pueden propiciar la generación local de NO y, como se ha comentado aquí y en otros protocolos, que la nitración de proteínas está incrementada en algunas tumoraciones en comparación con las áreas libres de tumor.14
La evidencia indica que las alteraciones en las ERO y ERN promueven el crecimiento neoplásico, ya que estas especies reactivas intervienen en la transducción de señales y tienen importantes implicaciones en la regulación de las funciones biológicas; en consecuencia, se ha sugerido que el NO y la nitración de proteínas pueden tener efectos notorios en el desarrollo y progresión tumoral.
Por otra parte, en diversas entidades patológicas, como el cáncer, se ha encontrado que la expresión de las tres isoformas de las sintasas de NO (inducible: iNOS; endotelial: eNOS; y neuronal: nNOS) está aumentada, como lo señalaron Blochw y cols. en 1998, ya que sugirieron que aumenta el NO a expensas de la iNOS, con una función importante en el desarrollo de tumores y la angiogénesis. Estas sintasas no se han estudiado lo suficiente en el CaP; la evidencia indica que las concentraciones de estas enzimas son bajas en el tejido benigno de este órgano y los especialistas han concluido que la expresión de iNOS epitelial puede emplearse como un marcador específico de CaP, ya que el NO tiene en parte una función importante en el desarrollo de la enfermedad. Gradini y colaboradores apoyan en cierta medida este conclusión, ya que este grupo de estudio encontró que hay un aumento de la expresión de iNOS en tejidos de HPB, lo que no se observa en tejidos normales de próstata.16
En otro estudio, Marangoni y colaboradores encontraron que la expresión de la eNOS podría tener una función importante en el proceso carcinogénico del tejido prostático. La producción de NO a expensas de esta enzima puede promover la progresión al cáncer, al regular la proliferación selectiva de las células tumorales mediante el estímulo angiogénico en el órgano.17 Estos resultados apoyan lo encontrado en el presente estudio, en el que se observan niveles de concentración diferencial, ya que hay mayor nitración en las células endoteliales (glándula) que en otras áreas del tejido canceroso y la diferencia es mayor entre tejidos con HPB comparados con los tejidos con CaP; la concentración de 3-NT es seis a ocho veces mayor en el CaP.
Díaz Arce apoya estas conclusiones, toda vez que encontró una relación entre el número de mutaciones y las concentraciones de ERN.18 Las ERN pueden modificar el ADN de forma directa mediante procesos de oxidación, desaminación o metilación de bases e indirectamente al suprimir la actividad de las enzimas que reparan el ADN. La oxidación y desaminación de las bases nitrogenadas del ADN pueden ocasionar transversiones o transiciones, de tal forma que estos mecanismos pueden causar mutaciones en el ADN, secuencias que pueden participar en la activación de oncogenes o la inhibición de genes supresores de tumores, o ambas cosas, lo cual favorece el desarrollo o la progresión tumoral.18
Cronauer y colaboradores demostraron que la inflamación crónica incrementa el riesgo de desarrollar diversos tipos de cáncer, entre ellos el de próstata; en su estudio se encontró que la iNOS interviene en el desarrollo y aumento del proceso inflamatorio, ya que la producción de NO se incrementa en detrimento de esta enzima, lo que condiciona la presencia de inflamación aguda o crónica, incluida la presencia de enfermedades autoinmunitarias, o la génesis tumoral. Eso mismo se reconoció en este estudio, en el cual se observó y demostró que la nitración de proteínas está aumentada, lo que podría precipitar un aumento de los procesos inflamatorios agudos y crónicos. Tales procesos, como ya se ha indicado, pueden participar en la etiopatogenia de las neoplasias, aunque en las publicaciones internacionales la función de la actividad de la iNOS en la mayoría de las enfermedades se entiende mal y no hay todavía consistencia en los datos encontrados en diversos estudios. En este mismo estudio, en biopsias de CaP y por inmunohistoquímica, se identificó que la expresión de la proteína iNOS en las células tumorales tiene un sólido nexo con la concentración de 3-NT, lo cual indica que tiene una función muy importante en el proceso, desarrollo y progresión tumoral.19 En este protocolo se advirtió que es evidente el aumento de la nitración de las proteínas en los tejidos tumorales estudiados y, aún más evidente, que dicho incremento se observa en el tejido glandular, es decir, los hallazgos de este trabajo son consistentes con los encontrados en la bibliografía. Los autores, en el estudio mencionado, sugirieron que la actividad intratumoral del iNOS favorece el desarrollo de células y que éstas son capaces de proliferar de manera independiente hasta promover el desarrollo de células neoplásicas.
Por ultimo, Baltaci y colaboradores notificaron que el aumento del NO producido a expensas de la iNOS puede ser factor en el crecimiento tumoral del cáncer de próstata, al menos por dos mecanismos: la estimulación de la angiogénesis y las mutaciones incrementadas en el ADN a través de la acción directa de radicales libres.20
CONCLUSIONES
La nitración de proteínas, y por lo tanto su alteración, es mucho más evidente en los tejidos de pacientes con cáncer de próstata respecto de los tejidos de individuos con hiperplasia prostática benigna.
Correspondencia: Dr. Esaú Floriano Sánchez.
Escuela Médico Militar. Cerrada de palomas S/N. Col. Lomas de San Isidro. México, D. F.
Teléfono: 5540-7728 Ext. 175, Fax: 52 5520-2121.
Correo electrónico:floriano_esa@yahoo.com