¿ INTRODUCCIÓN
El cáncer de próstata (CaP) es la segunda neoplasia más común después del cáncer de piel en los varones y la segunda causa de muerte en hombres por cáncer después del cáncer de pulmón.1 El aumento en la incidencia de CaP se atribuye numerosos factores. Más de 200 000 hombres en los Estados Unidos son diagnosticados anualmente con CaP y 30 000 hombres mueren cada año por esta enfermedad. Después de los 50 años de vida, la incidencia de CaP aumenta tres o cuatro veces cada 10 años.1 Los afroamericanos muestran la tasa de incidencia más elevada de CaP; la incidencia global de CaP en este grupo aumentó de 124 por 100 mil a 250 por 100 miel; es decir, un incremento de 102%. Los hispanoamericanos presentaron una incidencia intermedia de 104 por 100 mil. Los países asiáticos, sobre todo Japón y China, presentan una de las tasas más bajas de incidencia y mortalidad por CaP en el mundo. En Japón, de 1992 a 1995, fue de 4 por 100 mil.2 En México, en 1998 el CaP ocupó el segundo lugar respecto de la incidencia entre las neoplasias del varón, después del cáncer de piel. En cuanto a la mortalidad, ocupó también el segundo lugar de la totalidad de las neoplasias después del carcinoma cervicouterino.3
La etiología del CaP no es del todo clara. Hasta el momento, los aspectos que se han considerado como factores de riesgo son: la edad del individuo, la producción y metabolismo de los andrógenos, el área geográfica/etnia, el hábito dietético y la historia familiar.
La hiperplasia prostática benigna (HPB) se define histológicamente como una enfermedad caracterizada por aumento de las células epiteliales y estromales en el área periuretral de la próstata.4,5 Es un proceso patológico que contribuye con el desarrollo de síntomas del tracto urinario inferior en hombres de edad avanzada.
La principal complicación de los pacientes con HPB son las usuales molestias del tracto urinario bajo, tipificados por nicturia, tenesmo, disminución en la fuerza y el calibre del chorro, sensación de vaciamiento vesical incompleto.6
La HPB es el tumor benigno más común en varones y su incidencia está relacionada con la edad. La prevalencia de la HPB es dependiente de la edad, con inicio en su desarrollo después de los 40 años de edad. Para los 60 años de edad, su prevalencia es 50% y para los 85 años de edad es de 90%. Aunque la evidencia clínica de la enfermedad ocurre con menos frecuencia, los síntomas del tracto urinario bajo, también se relacionan con la edad. Aproximadamente la mitad de todos los hombres con diagnóstico histológico de HPB tienen síntomas del tracto urinario bajo de moderados a severos.7
Al igual que el CaP, está relacionada con la edad del individuo y requiere andrógenos para desarrollarse y crecer. A diferencia del CaP, la HPB es una lesión benigna que rara vez progresa hacia una neoplasia maligna. Otra disimilitud respecto al CaP es que no existe ninguna evidencia de que HPB sea clonal sólo se ha encontrado algunos cambios genéticos que implican estabilidad genómica. En HPB no se detectan grados morfológicos en el núcleo que son característicos en las neoplasias maligna. La patología hiperplásica con frecuencia presenta crecimientos variables del estroma y se ha sugerido que la secreción de factores de crecimiento por parte del mesénquima podría actuar sobre las células epiteliales adyacentes y contribuir al desarrollo de la hiperplasia de estas últimas.8
Se estima que la dieta puede contribuir con 35% de todos los cánceres humanos.9 La evidencia epidemiológica revela consistentemente que una ingestión baja de antioxidantes o un nivel sanguíneo bajo de antioxidantes puede incrementar el riesgo de padecer cáncer. Tanto el tabaquismo, como la inflamación crónica - dos de las principales causas de cáncer - tienen como un fuerte componente a los radicales libres en su mecanismo de acción. Recientemente se ha relacionado que el daño oxidativo juega un papel crítico en varias condiciones clínicas como lo son las enfermedades malignas; EROs pueden causar oxidación del DNA y daño a proteínas, daño a genes supresores tumorales y un aumento en la expresión de proto-oncogenes. El cáncer muestra un cambio pro-oxidativo en el estado oxidoreducción.
Las principales especies reactivas del oxígeno son: el radical superóxido (O2), el peróxido de Hidrógeno (H2O2) y el radical oxidrilo (HO). La formación de radical superóxido (O2―) también puede ocurrir a nivel de la NADPH-oxidasa. Por otro lado, la actividad de las enzimas antioxidantes como la superóxido dismutasa (SOD), glutatión peroxidasa (GPx) y catalasa (CAT) contribuyen al mantenimiento del equilibrio óxido-reductor, compensando el incremento del estrés oxidativo generado por las EROs (42,43). Las EROs también participan en el control del tono vascular, en particular, el radical anión superóxido (O2―) que interacciona con el NO formando peroxinitrito (ONOO―), con esto se disminuye la biodisponibilidad del NO, produciendo vasoconstricción.10
La óxido nítrico sintasa (NOS) es una enzima que contiene un grupo con secuencia similar al citocromo P-450 reductasa. En el humano existen a tres isoformas de NOS localizadas en el cromosoma 17: las isoformas constitutiva (cNOS) óxido nítrico sintasa neuronal (nNOS) y óxido nítrico sintasa endotelial (eNOS) que son reguladas por concentraciones de calcio entre 70-100 Nm y la iNOS solamente requiere concentraciones de cálcio entre 30-70 nm porque está unida constitutivamente a calmodulina, a diferencia de las otras isoformas. La iNOS se puede encontrar en la inflamación y en la estructura normal de las células. La enzima iNOS tal vez sea regulada por citocinas y tiene un incremento en su actividad y expresión en estadios inflamatorios. La resultante generación de NO puede ser benéfica o lo contrario en la patogénesis de enfermedad, dependiendo este proceso en parte en la cantidad generada de NO y la prevalencia de condiciones oxidantes en el tejido. La actividad de iNOS puede ser calculada indirectamente por medio de la medición de los productos finales generados por estas enzimas o directamente por inmunohistoquímica, (Northern o Western blots). Los niveles de NO y la expresión de la iNOS se correlacionan con actividad patógena y tal vez juegue una vital parte, tanto en estados fisiológicos como patológicos.11
De igual manera, la sobreproducción de NO que es catalizado por iNOS, una enzima soluble y activa en su forma dimérica, es citotóxica. La inmunoestimulación de citocinas o la actividad patógena bacteriana activa la iNOS y genera altas concentraciones de NO a través de la activación de factores nucleares inducibles incluyendo NFkB. La activación de iNOS es regulada principalmente por el nivel transcripcional, pero también por niveles postranscripcionales, de traducción y pos traducción a través de efectos en la estabilidad de las proteínas, dimerización, fosforilación, ligando a un cofactor y la disponibilidad de oxígeno y L-arginina y sus substratos. La prevención de la sobreproducción de NO en los organismos vivos puede llevársela través de líneas de regulación, siendo una manera de tratamiento de desordenes de altos niveles de NO sin afectar los niveles fisiológicos del mismo.11
¿ MÉTODOS
Sujetos de estudio: La recolección de muestras se llevó a cabo del mes de septiembre de 2008 a abril de 2009, seleccionando las muestras de los pacientes registrados en la libreta de cirugía del servicio de urología del Hospital Central Militar y que cumplieron con los criterios de inclusión, exclusión y eliminación.
Criterios de inclusión: a) Pacientes con diagnóstico de CaP con síndrome obstructivo urinario bajo de la vía urinaria; b) Pacientes con diagnóstico de HPB con indicación de resección transuretral prostática (RTUP) y prostatectomía radical.
Criterios de exclusión: a) Pacientes que no autorizan participar en el procedimiento. b) Pacientes que no sean candidatos a RTUP.
Criterios de eliminación: a) Cantidad de tejido insuficiente; b) Tejido que en el traslado sufra desnaturalización del material genético.
La cantidad de tejido necesaria para la Investigación fue de uno hasta cinco gramos; la obtención de las muestras se hizo inmediatamente después de la realización de la intervención quirúrgica, el tiempo de traslado que se tomó como máximo fue de una hora; desde la obtención de la muestra hasta su traslado al laboratorio de Biología Molecular de la Escuela Médico Militar, donde se mantuvieron a una temperatura de -70°C en el ultracongelador Revco® (Legaci ULT2186 3-35 Dupont SVVA Refrigerants).
Inmunohistoquímica: Por microscopía de luz, las muestras de tejidos de CaP y HPB fueron fijadas por inmersión en formalina (pH=7.4) y se embebieron en parafina. Para el análisis histológico, secciones de tejido (3 μm) fueron teñidas con hematoxilina y eosina (H&E). Las secciones de tejido fueron teñidas con ácido periódico de Shiff`s (PAS) para mostrar los polisacáridos, mucopolisacáridos y glicoproteínas de la membrana celular.
Los cortes fueron incubados con ácido peryódico durante cinco minutos y lavados con agua destilada. Los cortes fueron incubados con el reactivo de Schiff`s durante cinco minutos y contrateñidos con hematoxilina por 30 s. El perfil histológico de 5 campos seleccionados aleatoriamente fueron registrados utilizando el software KS-300 (Carl Zeiss, Jena, Germany). El porcentaje de área dañada con alteraciones histopatológicas fue obtenido (magnificación 400x). Para la inmunohistoquímica las secciones de tejido (3 μm) se desparafinaron y se calentaron para desenmascarar los sitios antigénicos; la actividad endógena de la peroxidasa fue bloqueada con 0.03% de H2O2 en metanol absoluto. Las secciones de tejido fueron incubadas toda la noche a 4ºC a una dilución 1:200 de anticuerpo monoclonal contra iNOS en solución TRIS Se removió el anticuerpo primario y se realizaron dos lavados repetitivos con TRIS, los cortes fueron incubados con una dilución 1:500 de anticuerpo policlonal de conejo como anticuerpo secundario y se realizaron dos lavados repetitivos con TRIS. Los anticuerpos unidos se detectaron con el complejo avidina-biotina (ABC-kit Vectatastain) y la diaminobenzidina como sustrato. Después de lavar repetidamente con TRIS los cortes fueron contrateñidos con hematoxilina. Todos los cortes fueron incubados bajo las mismas condiciones con la misma concentración de anticuerpo y en la misma corrida, por lo tanto, la inmunotinción fue comparable. Todos los especimenes fueron examinados por el microscopio de luz Axiovert 200M (Carl Zeiss, Jena, Germany). Para el análisis morfométrico automatizado, el porcentaje de células positivas (color marrón) se determinaron con un analizador de imágenes computarizado KS-300 3.0 (Carl Zeiss, Jena, Germany). Este equipo detecta automáticamente las células positivas determinando su porcentaje por campo. Cinco campos aleatorios fueron estudiados a una magnificación de 100 (área total 1,584,000 μ2). Los resultados fueron expresados como porcentaje.
Análisis de datos: Los datos de la inmunoreactividad de iNOS fueron analizados con la prueba t de Student y los datos se expresaron como media ± desviación estándar, se compararon ambos grupos (CaP y HPB) y se considero una p <0.05, como diferencia estadísticamente significativa. Para la aplicación de las pruebas estadísticas se utilizó el programa Graph Prisma versión 3.32.
¿ RESULTADOS
Del total de los 81 pacientes se obtuvieron las muestras biológicas, 42 pacientes (51.85 %) tenían diagnóstico establecido de CaP, mientras que 39 pacientes (48.14%) tuvieron diagnóstico establecido de HPB.
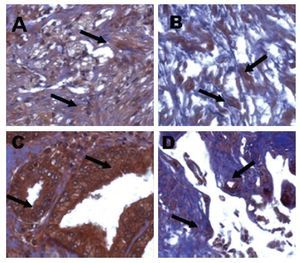
Expresión cuantitativa de iNOS en hiperplasia prostática benigna y cáncer de próstata en tejido glandular: Mediante la prueba de t para variables independientes encontramos diferencias estadísticamente significativas, como podemos observar en las Imágenes 1 y 2 (paneles A y B en estroma de cáncer de próstata y paneles C y D en estroma hiperplasia prostática benigna), donde es evidente que la inmunoreactividad está mucho más aumentada en tejidos con HPB (24.58% ± 6.3%) (p = 0.0016) esto evidencia que existe disminución en cuanto a la inmunorreactividad de iNOS en tejido glandular de CaP (16.3% ± 4.6%).
Imagen 1. Determinación por inmunohistoquímica de iNOS en la glándula de CaP y HPB
Imagen 2. Localización inmunohistoquímica de iNOS en estroma de cáncer de próstata e hiperplasia prostática. Las imágenes son cortes histológicos donde se observa la marca de iNOS, en (A) y (B) estroma de HPB, en (C) y (D) estroma de CaP.
Expresión cuantitativa de iNOS en hiperplasia prostática benigna y cáncer de próstata en tejido estromal: Mediante la prueba de t para variables independientes encontramos diferencias estadísticamente significativas, como podemos observar en las Imágenes 3 y 4 (paneles A y B en glándula de cáncer de próstata y paneles C y D en glándula de hiperplasia prostática benigna), donde es evidente que la inmunoreactividad está mucho más aumentada en tejidos con HPB (23.27% ± 8.8%; p = 0.0072), esto puede indicar que existe disminución en cuanto a la inmunorreactividad de iNOS en tejido estromal de CaP (15.89% ± 7.1%).
Imagen 3. Determinación por inmunohistoquímica de iNOS en la glándula de CaP y HPB .
Imagen 4.Localización inmunohistoquímica de iNOS en glándula de cáncer de próstata e hiperplasia prostática. Las imágenes son cortes histológicos donde se observa la marca de iNOS, en (A) y (B) glándula de HPB, en (C) y (D) glándula CaP.
En la Imagen 5, se muestra el porcentaje de área inmunoreativa para iNOS en CaP donde se puede observar una mayor expresión de esta enzima en la HPB (paneles C y D).
Imagen 5.Determinación del (%) de área inmunoreactiva a iNOS en CaP (A,B) y HPB (C,D).
¿ DISCUSIÓN
Se ha observado que los niveles de expresión de iNOS son muy bajos en muchos tipos de cultivos de células tumorales humanas11 lo que parece indicar que el tipo celular y la concentración de NO son importantes determinantes de las consecuencias biológicas.12,13
Se ha observado que el NO activa el gen de p53, asociado con la apoptosis en células tumorales.11,13 Además se ha observado que la transducción de células tumorales con el gen de iNOS incrementa significativamente la expresión del factor de crecimiento endotelial vascular (VEGF) y de la interleucina 8 (IL8) que son conocidos como los principales factores protumorales en cáncer de páncreas.12
La activación de linfocitos tumor-específicos recluta efectores celulares tal como los macrófagos que pueden ejercer una actividad antitumoral adicional por la síntesis de metabolitos reactivos.12 De acuerdo con lo anterior, la sobrerregulación de la expresión de iNOS también sugiere que los macrófagos, cómo células del sistema inmunitario, pueden contribuir a la reducción de la masa tumoral. Sin embargo, también existe evidencia de un efecto promotor tumoral del NO por lo que el potencial tumoricida de los macrófagos es controversialmente discutido.14,15 Cabe mencionar que el IFN-c representa un importante factor para la actividad citotóxica de los macrófagos por la inducción de la síntesis del NO.16,17 La expresión de iNOS también es esencial para la supresión del crecimiento tumoral por IFN-b.16,17
También se ha demostrado que la sobreexpresión de iNOS en células tumorales permite la muerte celular apoptótica18 y que inhibidores específicos de la NOS: L-NAME y L-NMMA ocasionan una reducción en el flujo sanguíneo tumoral dado que el NO regula la dilatación vascular y promueve la estimulación de la angiogénesis.
Se ha observado que las células tumorales generan NO constantemente y que esta especie reactiva posee diferentes acciones locales dependiendo de la concentración de la molécula. A bajas concentraciones de NO se promueve el crecimiento del tumor y la angiogénesis y a altas concentraciones posee una actividad antitumoral. Por lo tanto, nuestros estudios sugieren la hipótesis que la excesiva producción de NO puede estimular la producción de VEGF necesario para la vascularización de las células cancerosas.19,20
¿ CONCLUSIONES
Los resultados obtenidos en este estudio muestran un incremento en la expresión de iNOS en HPB en comparación con el CaP. Lo anterior parecer sugerir que el NO generado por la iNOS tienen un papel importante en el desarrollo del CaP lo que parece sugerir que estas enzimas participan en la dilatación vascular y permiten un incremento en las mutaciones celulares de los radicales libres en el ADN como un efecto secundario de la producción del NO.
Abreviaturas:
CaP: Cáncer de próstata,
EROs: Especies Reactivas de Oxígeno,
ERNs: Especies Reactivas de Nitrógeno,
HPB: Hiperplasia Prostática Benigna,
iNOS: sintasa de óxido nítrico inducible
Correspondencia: Dr. Esaú Floriano Sánchez.
Cerrada de palomas S/N. Col. Lomas de San Isidro. México, D. F.
Teléfono: 55407728-extensión175.
Correo electrónico:floriano_esa@yahoo.com