¿ INTRODUCCIÓN
La mayor parte de los pacientes portadores de cáncer prostático (CaP), cursan con una enfermedad localizada al momento del diagnóstico. Sin embargo, 30% a 40% de estos pacientes desarrollarán una recaída bioquímica después de la terapia quirúrgica radical.
La detección de células prostáticas en la circulación sanguínea (CPCs) al momento del diagnóstico de CaP o durante su seguimiento, podría señalar pacientes con mayor riesgo de desarrollo de micrometástasis, los cuales probablemente necesitarán de terapia adicional a la quirúrgica.
Existe una correlación entre la presencia de CPCs con los factores de pronóstico establecidos, la etapa clínica y el índice de Gleason, pero no con el nivel de APE sérico.1 Se han obtenido resultados semejantes al estudiar células cancerosas aisladas (CCAs), encontradas en la médula ósea.2-4
El tumor original es una mezcla de diferentes poblaciones de células con diferentes características, algunas con la habilidad de diseminar o proliferar. En la última década, el descubrimiento de genes llamados supresores tumorales, ha aportado nuevas evidencias acerca el proceso de metástasis. Cuando estos genes se expresan, inhiben el desarrollo de las macro y micrometástasis sin alterar el crecimiento del tumor primario.5-7 Los productos de estos genes pueden disminuir la actividad en uno o más pasos en el proceso metastasíco,8 causando la inhibición de la diseminación, implantación o la habilidad de formar colonias en tejidos distantes.
El gen supresor tumoral KAi1 está ubicado en la región p11.2 del cromosoma 11,9 y se codifica para una glucoproteína de la familia de las tetraspaninas, la CD82. En los tejidos prostáticos benignos, como en la hiperplasia que expresan el CD82;9 esta expresión está aumentada en la hiperplasia benigna asociada con cáncer de bajo grado, así como en cáncer prostático con un índice de Gleason de 3 y 4,10 pero la expresión está disminuida o ausente en los casos de cáncer de alto grado así como en las macrometástasis.11 Se ha postulado que el CD82 actúa por la proteíncinasa C, la cual posee un papel crucial en el ciclo celular, la migración y la invasión.
Presentamos un estudio transversal, utilizando doble-inmunomarcación para detectar la co-expresión del CD82 en CPCs primarias y secundarias, la relación con los parámetros clínicos y la presencia o ausencia de micrometástasis en la médula ósea en pacientes con cáncer prostático.
¿ OBJETIVO
Determinar la expresión de CD82, un inhibidor de metástasis, en las células prostáticas en la circulación sanguínea antes y después del tratamiento definitivo, la asociación con los parámetros clínicos y la presencia de micrometástasis ósea.
¿ MATERIAL Y MÉTODOS
Se estudiaron prospectivamente todos los pacientes con diagnóstico de CaP atendidos entre enero de 2006 y agosto de 2008 en un Centro Oncológico de la Ciudad de Santiago de Chile. Para cada paciente se registraron los siguientes datos; edad, APE sérico total al momento de la toma de muestra, etapa clínica, índice de Gleason y fecha del diagnóstico.
Luego de obtener un consentimiento informado por escrito, se extrajo una muestra de 4 mL de sangre venosa de la vena cubital, utilizando una aguja de 21G y un tubo con EDTA como anticoagulante (Beckinson-Vacutainer®).
Fue tomada una biopsia de médula ósea de la cresta ilíaca posterior superior y se prepararon tres improntas.
Separación de las células mononucleares: estas células se separaron mediante centrifugación diferencial con Histopaque 1,077® (Sigma-Aldrich), según las instrucciones del fabricante. Del sobrenadante obtenido se utilizaron 25 µL para preparar cada frotis (porta-objetos sialinzado-DAKO, EEUU). Los frotis fueron secados con aire por 24 horas y luego fijados con solución a 70% de etanol, a 5% de formol y a 25% de solución salina, tamponado con fosfato (PBS), pH 7.4 por cinco minutos y lavados en tres ocasiones con PBS.
Inmunocitoquímica: Se utilizaron anticuerpos monoclonales contra APE, clon 28A4 (Novocastro Laboratory, Reino Unido) en una concentración de 2,5 µg/mL para detectar células prostáticas. La reacción se desarrolló con un sistema de basado en fosfatasa alcalina-antifosfatasa alcalina (LSAB2, DAKO, EEUU) con neofuscina asicomo cromogen y levamisole (DAKO-EEUU), como inhibidor de fosfatasa alcalina endogéno, según las instrucciones del fabricante.
Las muestras positivas para APE tuvieron una segunda etapa de procesamiento para la detección de CD82 clon 5B5 (Novocastro Laboratory, Reino Unido), con una dilución de 1:50. Luego de una incubación con inhibidor de peroxidasa (DAKO, EEUU), se desarrolló la reacción con un sistema basado en peroxidasa (LSAB2, DAKO, EEUU) con Vector VIP (Laboratory Vector, EEUU) como cromogen, según las instrucciones del fabricante.
Los criterios de ISHAGE de 1999 fueron utilizados para definir una CPC.12 La expresión del CD82 fue clasificada según una escala semicuantificativa:
0 = sin expresión
1+ = parte de la membrana expresa CD82
2+ = toda la membrana expresa CD82 en forma débil
3+ = toda la membrana expresa CD82 fuertemente
Los pacientes se clasificaron según el porcentaje de células APE positivas que expresaron CD82: con >10% células con CD82, 2+; más, 3+ como positiva. Una micrometástasis fue definida como fragmentos de la médula ósea positiva para células expresando APE.
Análisis estadístico: Se utilizaron técnicas estadísticas descriptivas para las variables demográficas, la prueba t de Student para las diferencias entre edad y APE y la prueba de X2 para las diferencias en la frecuencia de células positivas entre los diferentes subgrupos. Se consideró un error alfa de 0.05, un error beta de 0.20 y p <0.05 como significativo. El análisis se realizó con el programa Epi Info® para Windows 98®.
Consideraciones éticas: El estudio fue desarrollado en conformidad de los principios de la declaración de Helsinsky y contó con la aprobación del Comité de Ética local.
¿ RESULTADOS
Se incluyeron en el estudio a 105 varones portadores de cáncer prostático: con diagnóstico reciente 30 y en etapa de seguimiento a 75. Su edad promedio fue de 71.3 años ± 8.4 años, con rango 47 a 94. El nivel promedio del APE sérico en los 30 pacientes previo al tratamiento, fue 6.81 ng/mL ± 4.45ng/mL y en los 75 casos en seguimiento pos-prostatectomía radical, fue de 0.41 ng/ ml ± 0.39 ng/mL. En 64 pacientes (60.4%), se detectaron CPCs en sangre venosa, con un promedio de 3.86 células/mL ± 3.27 células/mL; rango de 1 a 15 células/mL.
1. Detección de CPCs:
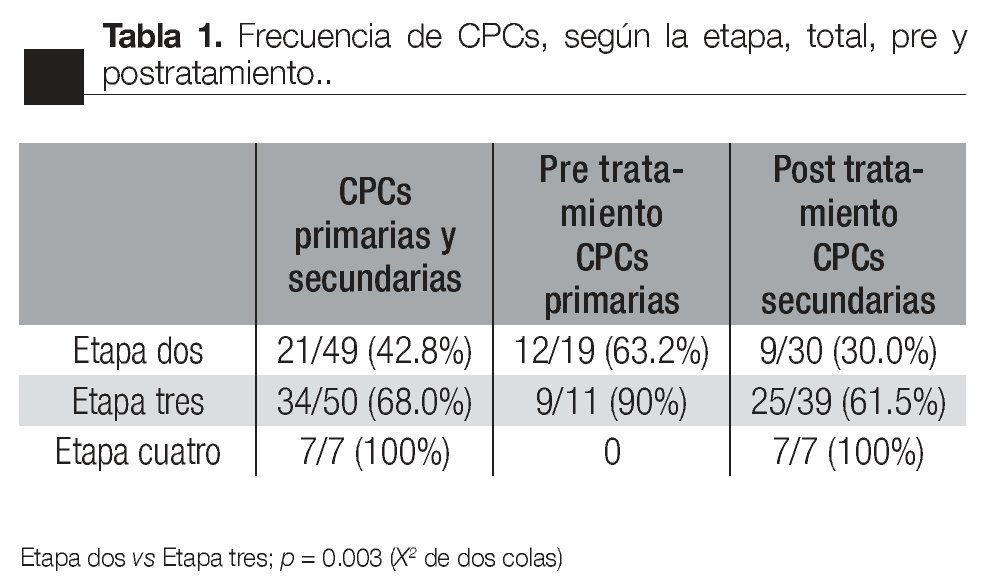
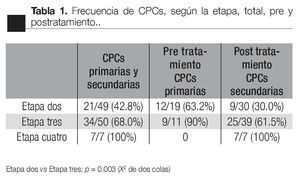
Según la etapa: Existió una correlación entre la presencia de CPCs y la etapa clínica de la enfermedad; 46.9% (23/49) de los pacientes en etapa dos, presentaron CPCs; de los etapa tres 64% (34/50) y de los pacientes en etapa cuatro, 100% (7/7) .
Existió una diferencia significativa en la frecuencia de detección de CPCs entre los pacientes de las etapas dos y tres (p <0.03, X2 de dos colas), y entre los pacientes en etapas dos y cuatro (p <0.01; Fisher de dos colas).
No existió una diferencia significativa entre los pacientes en etapa tres y lo que correspondieron a etapa cuatro (p = 0.17, Fisher de dos colas), (Tabla 1).
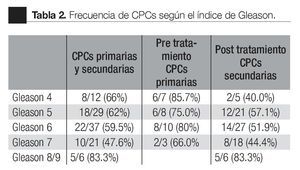
Al comparar la frecuencia de detección de CPCs pre y postratamiento, existieron diferencias significativas. En los pacientes en etapa dos, la frecuencia pretratamiento disminuyó de 13/18 (72.2%) a 10/30 (33%); postratamiento (p <0.01, X2 de dos colas). No existió una diferencia semejante en los pacientes en etapa dos y tres: 9/10 (90%) y 24/39 (61.5%); (p =0.13, Fisher de dos colas). Al comparar la frecuencia pre-tratamiento, no se evidenció diferencia significativa entre los pacientes en etapa dos y en etapa tres (13/18 vs 9/10, respectivamente; p = 0.38, Fisher de dos colas). En contraste con lo anterior, en la frecuencia postratamiento sí tubo diferencias significativas entre las etapas dos y tres: 10/30 (33%) vs 24/39 (61.5%), respectivamente (p <0.038, X2, dos colas). No se evidenció una asociación estadísticamente significativa entre la frecuencia de detección de CPCs y el índice de Gleason total o entre pre y postratamiento (Tabla 2).
2. Inmunomarcación con CD82:
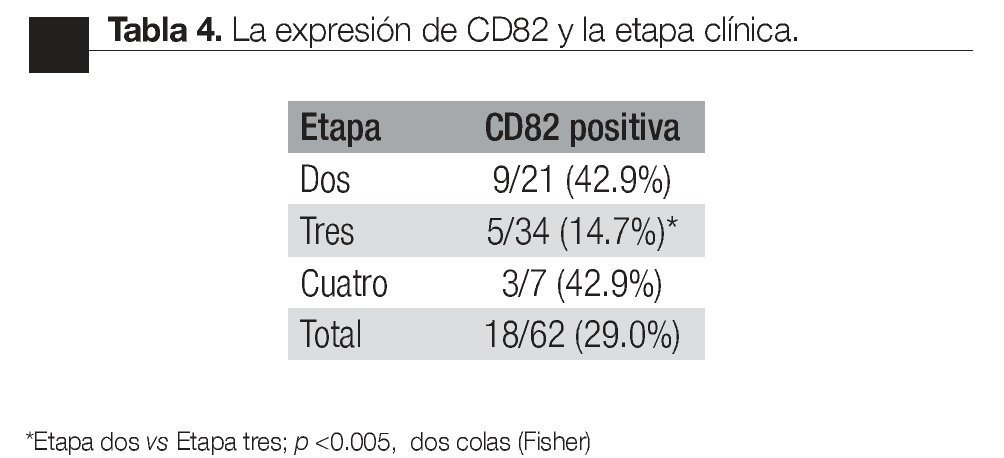
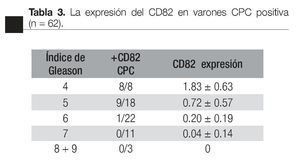
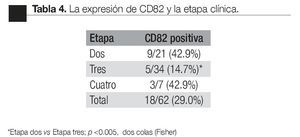
Según etapa: la detección de CPCs positivas para el CD82, fue más frecuente en pacientes en etapa dos que en la etapa tres (p <0.005, Fisher de dos colas); no hubo diferencia significativa en comparación con la etapa cuatro (Tabla 3).
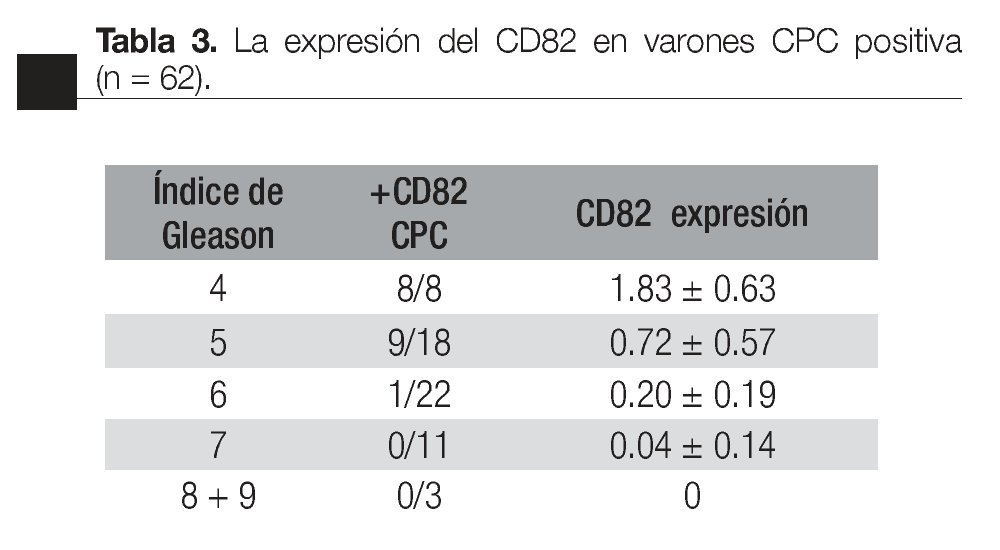
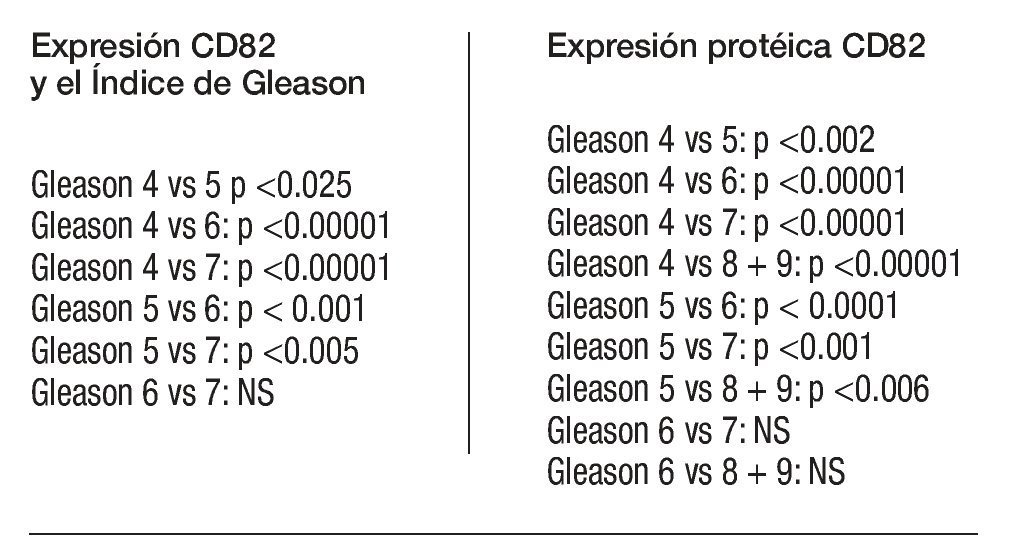
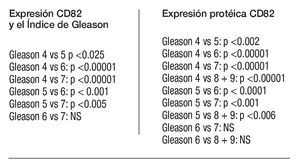
Según el índice de Gleason: la expresión del CD82 en las CPCs, tuvo una relación inversa con el índice de Gleason; CPCs detectadas en pacientes con índice de Gleason de * 7 fueron negativas para el CD82. El valor promedio de la expresión de CD82 disminuye significativamente con el aumento en el índice de Gleason (Tabla 4).
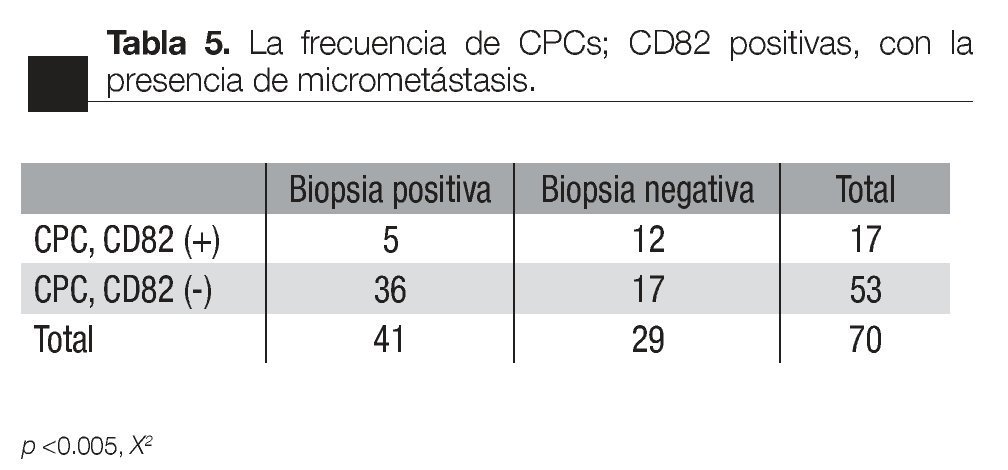
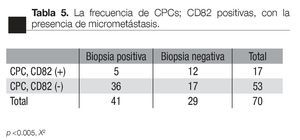
Asociación con la presencia de micrometástasis óseas: de los pacientes con CPC positivas, la presencia de CPCs CD82 fue asociada con un menor frecuencia de micrometastasis (p <0.005 X2, de dos colas), 5/17 vs 36/53, respectivamente (Tabla 5).
¿ DISCUSIÓN
El presente estudio es el primero que logra demostrar que las CPCs expresan CD82 y la relación entre su expresión, el índice de Gleason así como con la etapa clínica; semejante a lo informado por otros estudios que detectaron este marcador en células de tejido prostático obtenido de prostatectomías radicales.10,11
Nuestros resultados sugieren que la expresión del CD82 no es suficiente por sí misma para inhibir la diseminación de las CPCs del tumor primario o desde los microfocos en tejidos distantes. La asociación negativa con la presencia de las micrometástasis óseas, sugiere que el CD82 funciona para inhibir la implantación ósea. Como consecuencia, postulamos que las CPCs CD82 positivas, detectadas después de la terapia radical, manifiestan una recidiva local y podrían ser tratados con terapia complementaría local, a diferencia las CPCs CD82 negativas que puede originarse de una recidiva local o sistémica y que necesitará una terapia sistémica.
Proponemos que la presencia de CPCs implica un riesgo mayor de desarrollar micrometástasis. La co-expresión del CD82 se asocia con tumores de bajo grado, un riesgo disminuido del desarrollo de micrometástasis óseas y en pacientes con una recidiva bioquímica asociada con una recidiva local. La detección de las CPCs y la subclasificación con el CD82, podrían llegar a ser una herramienta útil en el seguimiento de pacientes con cáncer de próstata para determinar la necesidad de terapia complementaria y de qué tipo.
¿ AGRADECIMIENTO
El estudio fue apoyado por el Fondo de Investigación del Hospital de Carabineros de Chile. Agradecemos a la señora Ana María Palazuelos de Murray su apoyo en la redacción del manuscrito.
Fuente de financiamiento: Consejo de Docencia, Hospital de Carabineros de Chile.
Correspondencia:
Dr. Nigel P Murray.
Hospital de Carabineros de Chile, Simón Bolívar 2200, Ñuñoa. Santiago de Chile.
Teléfono: 225 6168.
Correo electrónico: nigelpetermurray@gmail.com