Introducción: El cáncer testicular representa el 5% de los tumores urológicos. El tratamiento de estas neoplasias comprende un abordaje multidisciplinario, lo cual repercute en la función testicular. Debido a que el tratamiento adyuvante no es selectivo para las células neoplásicas, lo cual impacta en la función reproductiva y hormonal.
Objetivo: Conocer la función testicular en pacientes con cáncer testicular, que recibieron tratamiento adyuvante con quimioterapia, manejados en el Hospital General "Dr. Manuel Gea González".
Material y métodos: Se realizó la revisión ambispectiva de 130 expedientes de la base de datos del Servicio de Urología, agrupando a los pacientes de acuerdo al número de ciclos de quimioterapia recibidos. Se registraron los resultados de las espermatobioscopias pre y postratamiento adyuvante, así como del perfil hormonal.
Resultados: El deterioro en la espermatogénesis al momento del diagnóstico de cáncer testicular se encontró en el 50% de los casos. Posterior a la administración de quimioterapia, el 67.5% de los pacientes presentaron alteración en a función reproductiva. La función hormonal resultó alterada con menor frecuencia, que la función reproductiva.
Conclusiones: La función reproductiva en los pacientes con cáncer testicular posquimioterapia está en relación con el estado previo a la adyuvancia y al número de ciclos recibidos.
Introduction: Testicular cancer represents 5% of all urologic tumors and its treatment involves a multidisciplinary approach with repercussions on testicular function because adjuvant treatment is not selective for neoplastic cells and therefore has a profound impact on reproductive and hormonal function.
Objective: To study the testicular function of patients with testicular cancer that received adjuvant chemotherapy management at the Hospital General Dr. Manuel Gea González.
Material and methods: An ambispective review was carried out using 130 case records from the hospital urology service database. Patients were grouped according to the number of chemotherapy cycles received and sperm evaluation results were recorded before and after adjuvant treatment and a hormonal profile was also carried out.
Results: Spermatogenesis deterioration at the time of testicular cancer diagnosis was found in 50% of the cases. After chemotherapy, 67.5% of the patients presented with reproductive function alteration. Changes in hormonal function were less frequent than in reproductive function.
Conclusions: Reproductive function in post-chemotherapy testicular cancer patients is related to reproductive function status prior to adjuvant treatment and to the number of cycles received.
¿ INTRODUCCIÓN
El cáncer testicular representa entre el 1% y el 5% de las neoplasias malignas en el hombre, reportándose tres a seis casos por cada 100 000 habitantes en países desarrollados, con menos del 5% de los casos con afección bilateral, siendo la neoplasia más común en los hombres entre los 15 y los 45 años de edad. Esto representa el pico de la edad reproductiva, afectando en un gran número de casos a los pacientes que aún no han iniciado su paternidad. Con el abordaje multidisciplinario actual, que incluye cirugía, quimioterapia y radioterapia, la tasa de curación es hasta de un 95%, representando un ejemplo de que de los tumores sólidos son potencialmente curables. Sin embargo, el tratamiento adyuvante produce un trastorno en la función reproductiva, afectando la fertilidad en el 30% de los pacientes que recibieron adyuvancia ya sea quimioterapia o radioterapia, teniendo este último un efecto mucho más deletéreo en la fertilidad.1-3
Existen múltiples estudios acerca del deterioro en la cuenta de espermatozoides, en pacientes con cáncer testicular previo al inicio de la quimioterapia, lo cual se reporta como un estado subfértil, atribuido a alteraciones en la espermatogénesis comunes en pacientes con tumores germinales de testículo.4,5 El efecto citotóxico de los agentes utilizados durante el tratamiento adyuvante, condiciona una disminución en la capacidad de concebir, con tasas de paternidad reportadas de un 95% en el caso de los pacientes que fueron sometidos únicamente a orquiectomía, comparado con tasas del 43% a 65% al término del tratamiento adyuvante con quimioterapia. Asimismo, durante el tratamiento con quimioterapia los estudios de espermatobioscopia reportan en su gran mayoría conteos espermáticos cercanos a cero.6,7 Sin embargo está documentada la reversibilidad de estos efectos, lo cual está en relación con el tipo, dosis y duración de la quimioterapia, además del estado de la espermatogénesis previo al tratamiento. A pesar del deterioro de la función reproductiva, entre un 30% a 40% de los pacientes muestran una recuperación de la fertilidad en uno a dos años después del término de la quimioterapia, lo que en seguimientos a 15 años han reportado una tasa de paternidad hasta del 85% en los pacientes que han intentado concebir.8,9 Por lo anterior, es importante asesorar al paciente previo al inicio de la quimioterapia, respecto a su futura capacidad para concebir.10,11
Actualmente los agentes de la quimioterapia son a base de platino, siendo el de elección y más utilizado en el mundo el cisplatino en combinación con bleomicina y etopósido.
Las guías internacionales recomiendan tratamiento con quimioterapia tanto profiláctico en los pacientes con alto riesgo de enfermedad metastásica oculta, así como en los pacientes con enfermedad metastásica evidente. Por lo cual, los ciclos de quimioterapia pueden variar de uno a cuatro o más, en relación al estadio clínico y a la respuesta al tratamiento, proyectando un grupo muy heterogéneo de pacientes en los cuales la función testicular posterior a la quimioterapia, puede variar de acuerdo al estado previo de la espermatogénesis y a la cantidad de ciclos recibidos durante el tratamiento. Los estudios publicados hasta el momento, reportan una relación directa entre el número de ciclos recibidos y el retorno de la fertilidad en pacientes sometidos a quimioterapia, teniendo como factor común que los pacientes quienes recibieron menos de cuatro ciclos, tienen una mayor probabilidad de recuperar la fertilidad.12-15
En forma paralela, se encuentra documentado el deterioro en la función hormonal en pacientes con antecedente de quimioterapia por cáncer testicular. Los reportes de pacientes con hipogonadismo posterior a la quimioterapia durante el seguimiento varían entre 11% y 25%, elevándose hasta un 38% en los pacientes que además recibieron radioterapia. Se ha demostrado que en estos pacientes, el deterioro en la espermatogénesis es más prolongado que el deterioro de la función hormonal, debido a que la célula de Leydig resulta más resistente al efecto citotóxico de la quimioterapia. Por lo cual, sólo 6% de los pacientes sometidos a quimioólo 6% de los pacientes sometidos a quimiolo 6% de los pacientes sometidos a quimioterapia continúan con niveles elevados de hormona luteinizante (LH), en comparación con 64% que elevan hormona folículo estimulante (FSH) a ocho años posquimioterapia.16-18
Existen reportes de que tras 18 meses del fin de la quimioterapia, los niveles de FSH retornan a la normalidad, lo que coincide con el retorno de la fertilidad hasta en 40% de los casos. Encontrando que los niveles persistentemente elevados de FSH se relacionan con la falta de células germinales en los túbulos seminíferos, resultando en un indicador pronóstico de que no se recuperará la fertilidad.16,19-21
Por lo comentado anteriormente, este estudio se dirige a conocer la fertilidad y la función hormonal en una cohorte de pacientes con diagnóstico de cáncer testicular, previo al tratamiento y por lo menos con dos años de seguimiento oncológico, ya que aún no existen reportes en población mexicana acerca del estado de la espermatogénesis pre y posquimioterapia, así como si el tratamiento condiciona o no, el deterioro en la función hormonal.
El objetivo del presente trabajo es conocer la función reproductiva y hormonal en los pacientes con diagnóstico de cáncer testicular, sometidos a quimioterapia adyuvante.
¿ MATERIAL Y MÉTODOS
Se realizó estudio ambispectivo de los 130 expedienó estudio ambispectivo de los 130 expedienambispectivo de los 130 expedientes de pacientes, con diagnóstico de cáncer testicular entre el año 2000 al 2009, que recibieron tratamiento adyuvante con quimioterapia, para conocer la función testicular (hormonal y reproductiva).
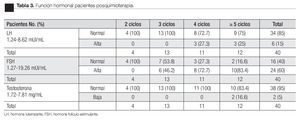
Se dividieron los pacientes en grupos, de acuerdo al tipo y número de ciclos de quimioterapia recibidos. En todos los pacientes se obtuvo una muestra de semen posorquiectomía antes de iniciar la quimioterapia, en todos los casos se les realizó una espermatobioscopia directa por lo menos a los dos años, después del término de la quimioterapia. Se le interrogó al paciente durante el seguimiento en la consulta, si había logrado concebir previo al diagnóstico de cáncer de testículo y después del tratamiento, registrándose el tiempo posquimioterapia en el cual fue posible. De igual manera, se tomaron determinaciones de testosterona total, LH y FSH a todos los pacientes, por lo menos a los dos años de seguimiento del término de la quimioterapia.
Para la determinación del estado hormonal, se tomaron como referencia los rangos de laboratorio clínico del Hospital General "Dr. Manuel Gea González" y para los reportes de la espermatobioscopia directa, los criterios de la OMS publicados en 2010.22
Los criterios de inclusión se definieron de la siguiente forma: pacientes con diagnóstico de cáncer de testícuóstico de cáncer de testícustico de cáncer de testículo de células germinales, que recibieron quimioterapia adyuvante y que hayan cumplido por lo menos dos años de seguimiento en nuestra Institución, con expediente clínico completo.
Los criterios de exclusión fueron determinados por: pacientes con tumores testiculares no germinales, pacientes que no hayan cumplido el seguimiento mínimo de dos años, casos donde el paciente fue sometido a linfadenectomía retroperitoneal y o radioterapia y paía retroperitoneal y o radioterapia y pacientes con diagnóstico de cáncer de testículo bilateral, así como pacientes con expediente clínico incompleto.
¿ RESULTADOS
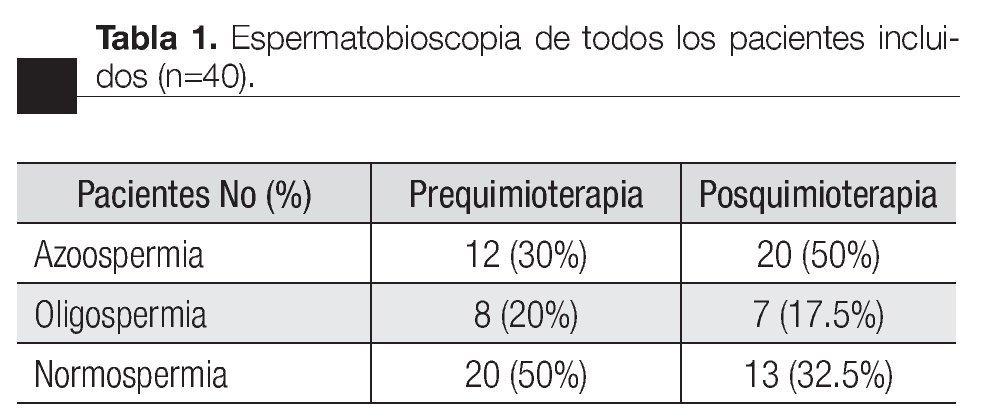
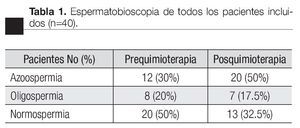
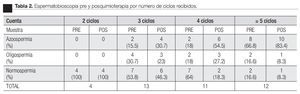
De todos los expedientes revisados de manera ambispectiva, se encontraron 56 pacientes que cumplieron los criterios de inclusión. De estos, en el protocolo se analizaron a 40 pacientes con todos los datos pre y posquimioterapia, registrados en el expediente clínico (Tabla 1) y 16 pacientes que sólo recibieron vigilancia, debido al estadio de la enfermedad en el cual fueron diagnosticados. El seguimiento promedio fue de 60 meses posquimioterapia, con rango de 24 a 96 meses. En los pacientes solamente vigilados, se reportó sólo un caso con azoospermia en el momento del diagnóstico, el cual contaba con el antecedente de criptorquidia contralateral corregida hasta los cuatro años de edad. El promedio de edad al momento del diagnóstico fue de 26.6 años. De los pacientes que recibieron quimioterapia, el 32.5% habían logrado la paternidad previa al tratamiento. De todas las muestras de semen obtenidas previo al inicio de la quimioterapia, el 50% resultaron con la cuenta de espermatozoides normal, el 20% de los casos se encontró con oligospermia y el 30% con azoospermia (Tabla 2).
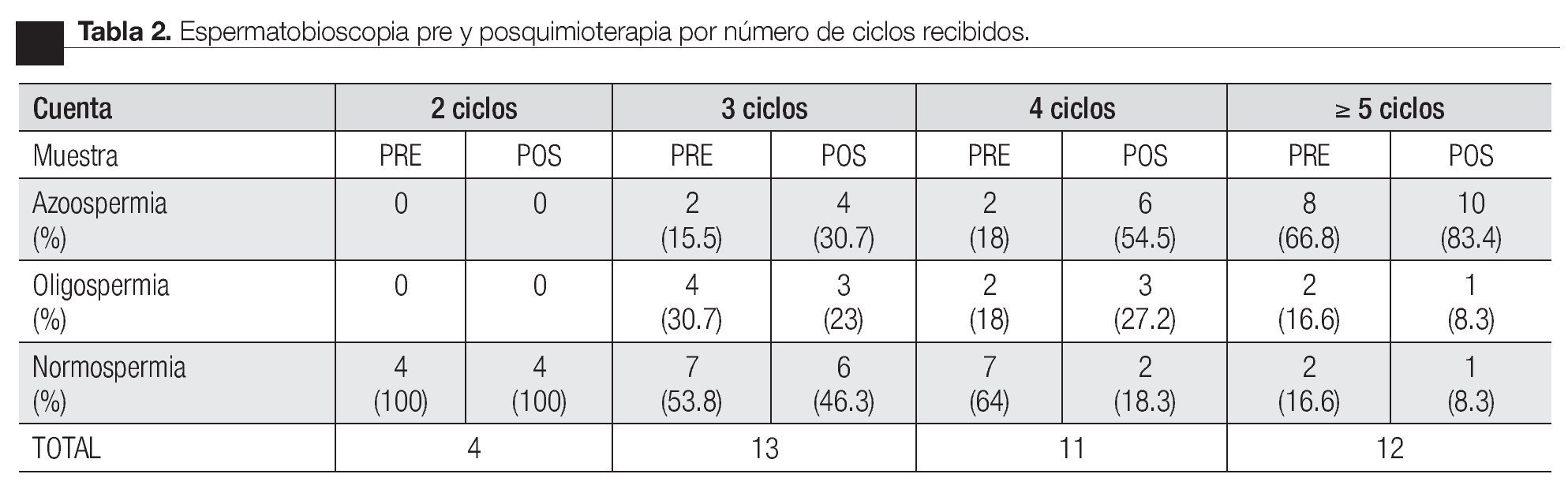
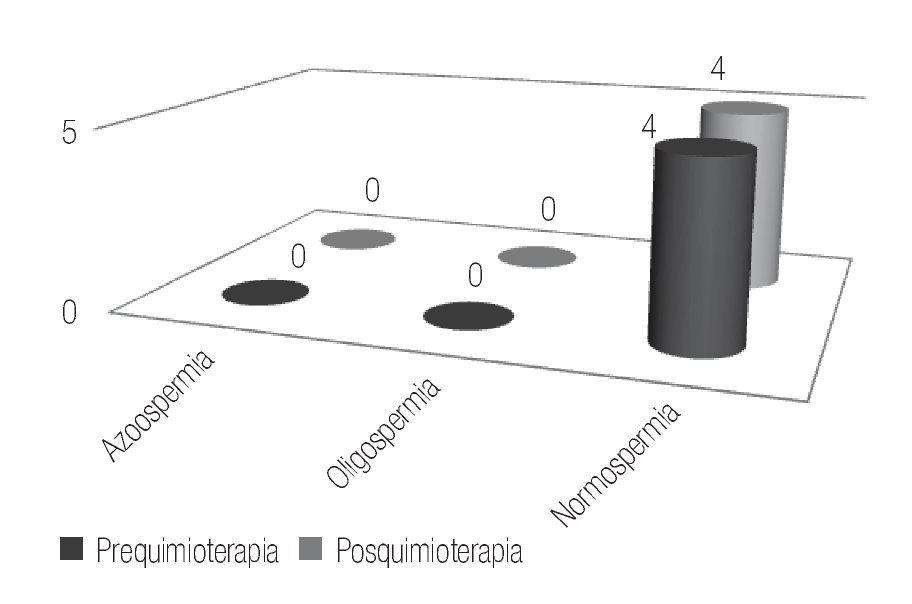
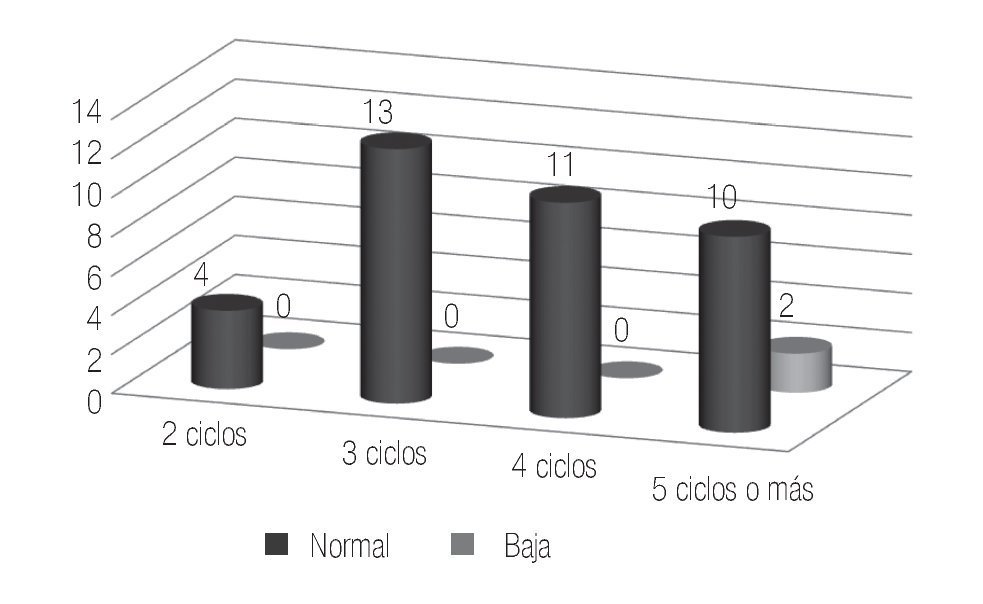
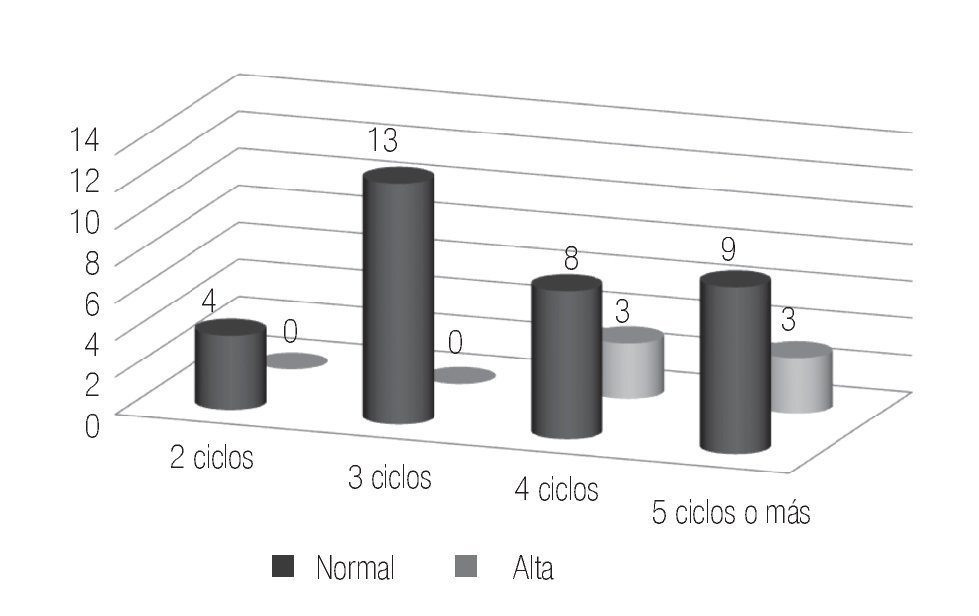
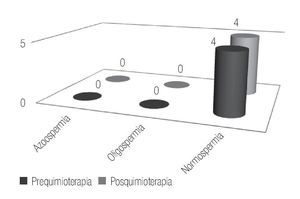
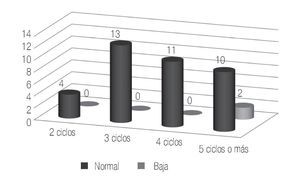
En el estudio de espermatobioscopia posquimioterapia se encontraron 32.5% de pacientes con normospermia, 17.5% de pacientes con oligospermia y 50% de pacientes con azoospermia. Respecto al resultado del estudio en los pacientes según el número de ciclos de quimioterapia recibidos, en los cuatro pacientes con dos ciclos se encontró normospermia pre y postratamiento, documentando la paternidad posquimioterapia en un caso (Figura 1).
Figura 1. Pacientes con dos ciclos de quimioterapia.
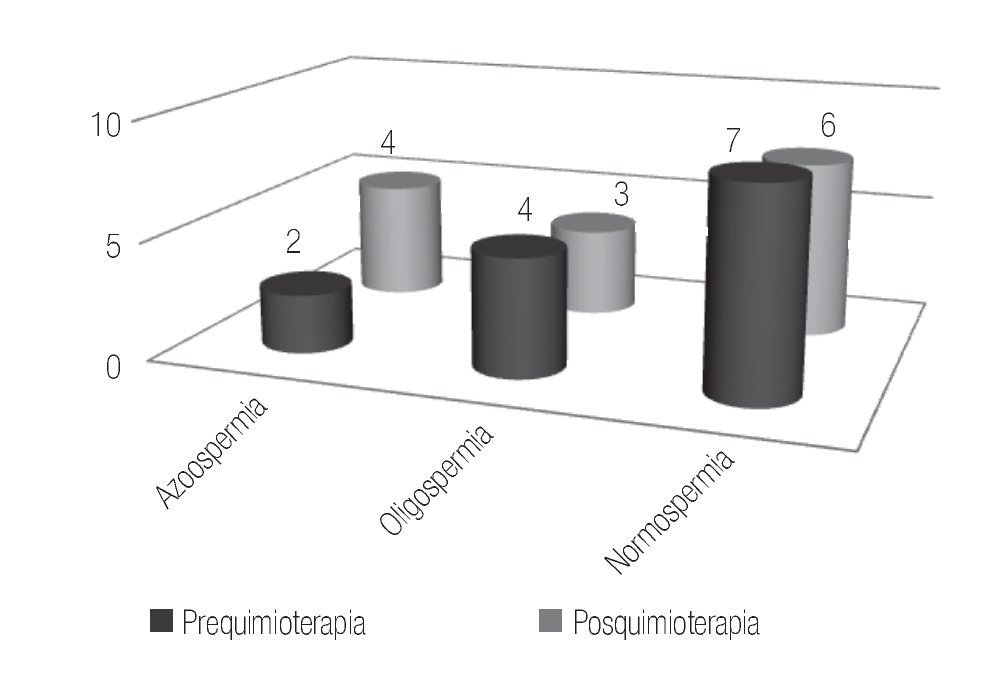
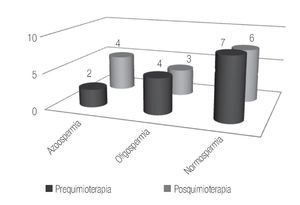
Para los pacientes con tres ciclos, la espermatobioscopia previa reportó un 58.3% de pacientes con normospermia, 30.7% con oligospermia y 15.5% de pacientes con azoospermia y para la muestra posquimioterapia, los casos con normospermia fueron 46.3%, oligospermia 23% y con azoospermia 30.7% (Figura 2). Cuatro de estos pacientes reportaron haber logrado la paternidad previa al diagnóstico y en dos casos más, la alcanzaron a los 28 y 41 meses del término posquimioterapia.
Figura 2.Pacientes con tres ciclos de quimioterapial.
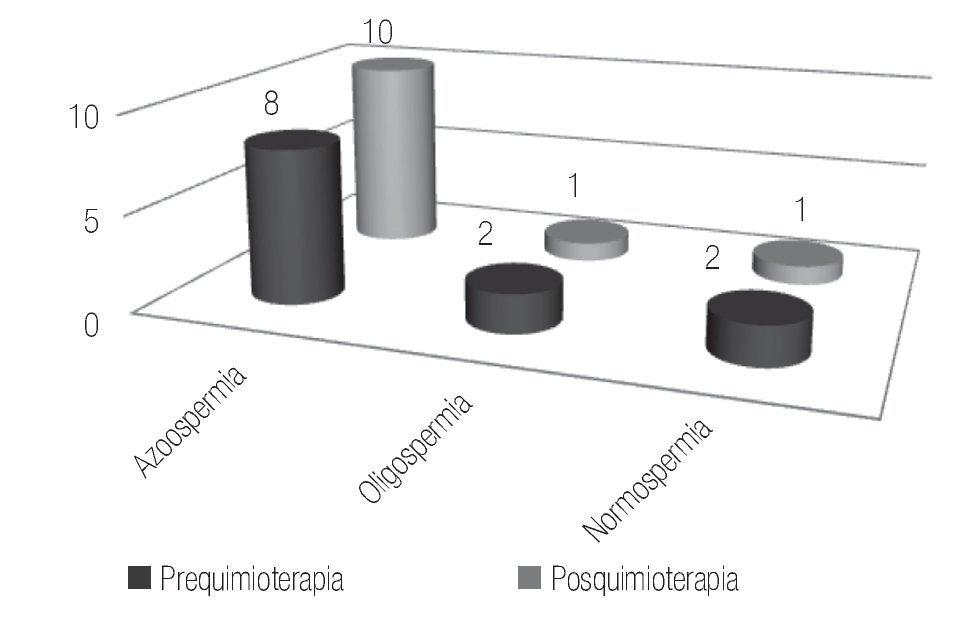
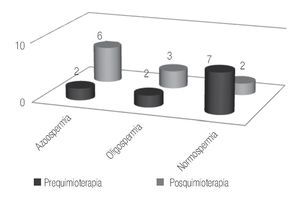
En los casos en los que se administraron cuatro ciclos de quimioterapia, el estudio previo al tratamiento reportó un 64% de pacientes con normospermia, 18% con oligospermia y otro 18% de casos con azoospermia. Para el estudio realizado posquimioterapia se encontró al 18.3% con normospermia, 27.2% con oligospermia y 54.5% de pacientes con azoospermia (Figura 3). En seis de estos casos, se registró paternidad previa a la quimioterapia y ninguna posterior al tratamiento.
Figura 3. Pacientes con cuatro ciclos de quimioterapia.
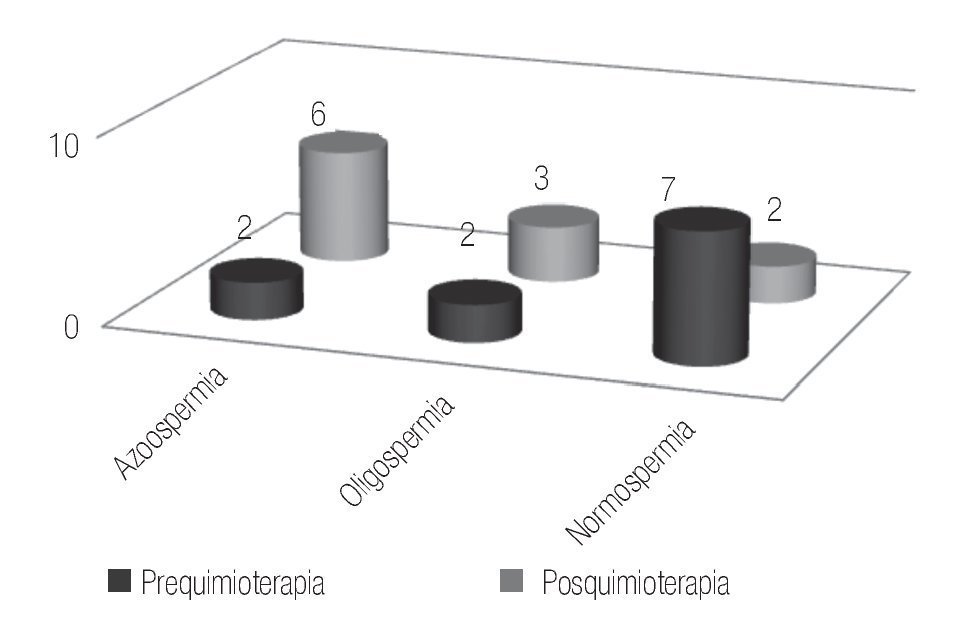
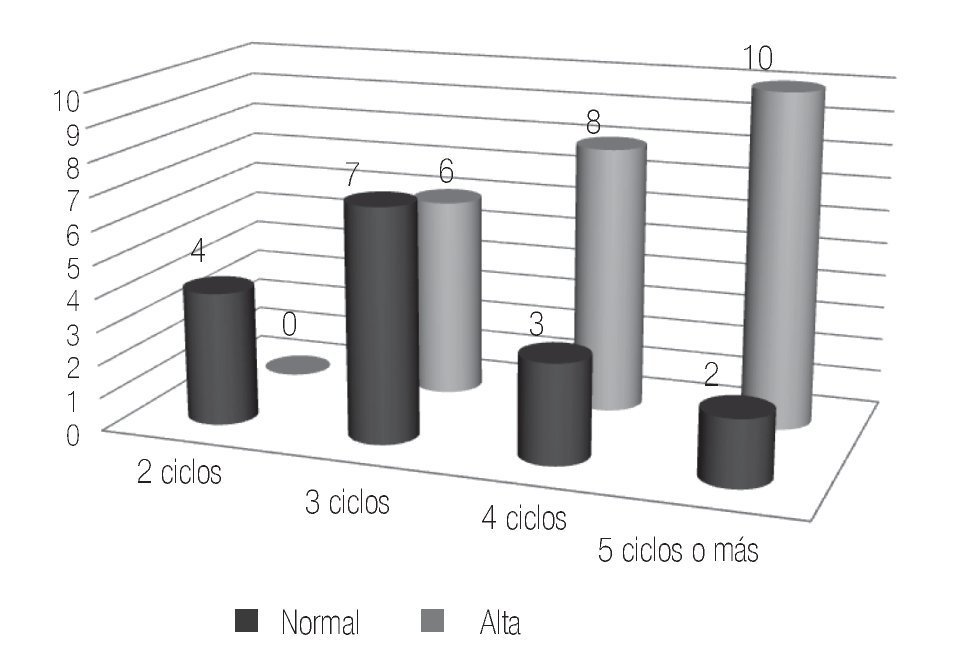
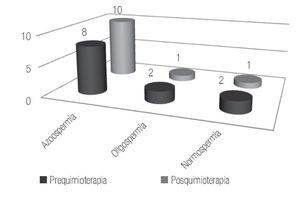
Para los pacientes que recibieron 5 ciclos o más de quimioterapia los estudios demostraron que el 16.6% de los casos eran normospérmicos, otro 16.6% de los casos oligospérmico y el 66.8% de los pacientes eran azoospérmicos previo al inicio de la quimioterapia, posterior al tratamiento los resultados reportaron a un 8.3% de pacientes con normospermia, 8.3% de pacientes con oligospermia y el 83.4% de los pacientes resultaron azoospérmicos (Figura 4). En ninguno de los casos, se registró paternidad pre o posquimioterapia.
Figura 4. Pacientes con cinco o más ciclos de quimioterapia.
En cuanto al patrón de la espermatobioscopia, en todos los casos la presentación más frecuente fue la alteración en la morfología, pero sin llegar al rango de formas anormales que menciona la OMS para considerarlo como teratospermia.
Para la determinación de la paternidad exitosa, se interrogó al paciente acerca de si ésta había sido lograésta había sido lograsta había sido lograda previo al diagnóstico, lo cual sucedió en 13 pacientes (32.5%) y sólo en tres casos posquimioterapia (7.5%). Dos de los cuales se registraron a los 32 y 61 meses de concluido el tratamiento, en el grupo de pacientes que recibieron tres ciclos de quimioterapia y el otro, a los 53 meses en el grupo de pacientes que recibieron solamente dos ciclos.
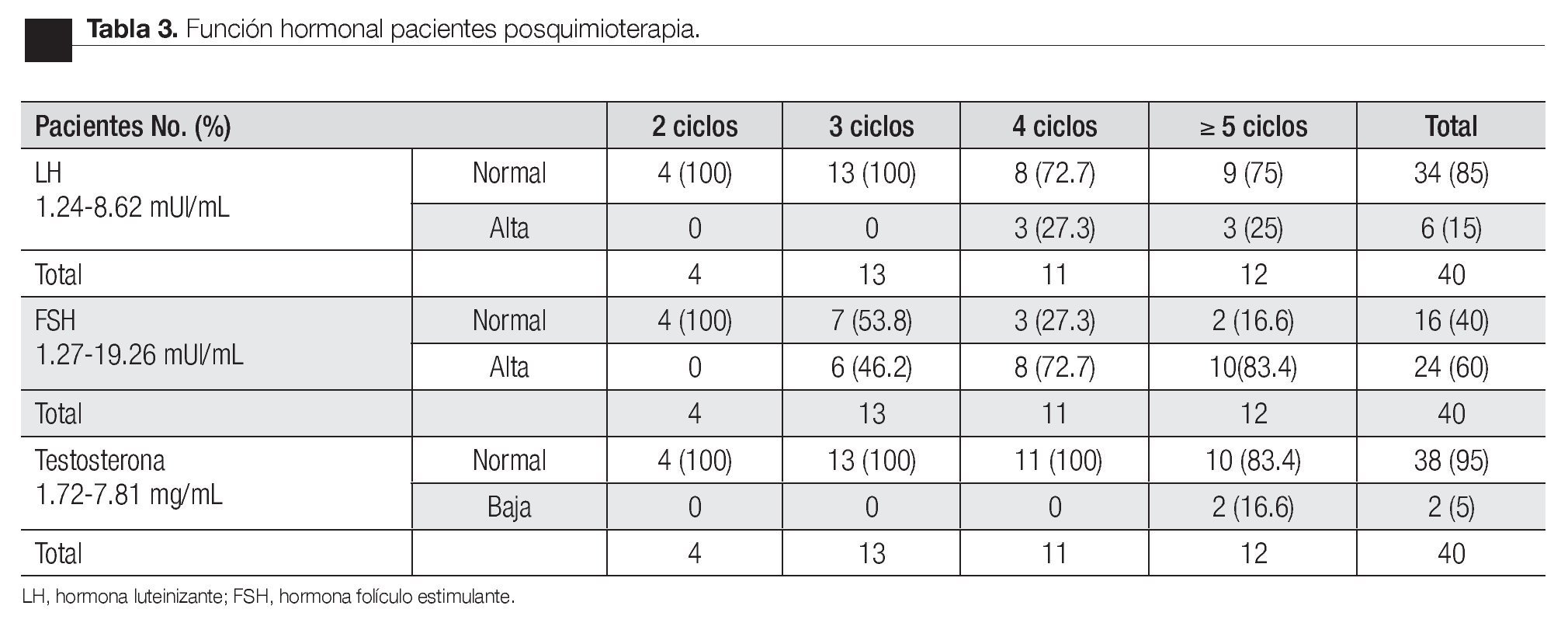
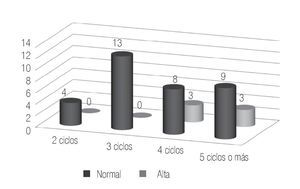
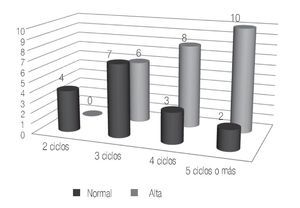
Respecto a la función hormonal posterior a quimioterapia, sólo el 5% de los pacientes presentaron niveles de testosterona por debajo del rango normal del laboratorio (Figura 5), asociándose con elevación de la LH en el 100% de los casos (Tabla 3). Todos los pacientes con hipogonadismo hipergonadotrópico, se encontraron en el grupo de cinco o más ciclos de quimioterapia. Sin embargo, se encontraron tres pacientes con elevación de la LH pero con niveles de testosterona total normales, entre los pacientes con cuatro ciclos y en un paciente con cinco ciclos de quimioterapia (Figura 6). La medición de la FSH demostró una elevación de los niveles de esta hormona en el 60% de los pacientes sometidos a quimioterapia, los cuales incluyen al 100% de los pacientes con azoospermia y al 57% de los pacientes con cuenta de espermatozoides menor a 15 000 000 mL (Figura 7).
Figura 5. Testosterona.
Figura 6.Hormona luteinizante.
Figura 7. Hormona folículo estimulante.
¿ DISCUSIÓN
Los resultados de nuestro estudio demuestran inicialmente que un 20% de los pacientes diagnosticados con cáncer de testículo presentan un grado de subfertilidad, reículo presentan un grado de subfertilidad, resubfertilidad, revelando espermatobioscopias con cuentas por debajo de los 15 000 000 de espermatozoides por mL y en 30% de los casos con azoospermia. Estos datos coinciden con los reportes publicados mundialmente, en aproximadamente 50% de los pacientes con cáncer de testículo con alteraciones en la espermatogénesis y un 10% a 35% de estos, presentan algún grado de infertilidad.20 Por lo anterior, se ha documentado que el riesgo de desarrollar cáncer de testículo se incrementa hasta 20 veces en pacientes con infertilidad, en comparación con controles sanos en el mismo rango de edad.21
En la espermatobioscopia posquimioterapia se documentó que sólo el 32.5% de los pacientes, se consideólo el 32.5% de los pacientes, se considelo el 32.5% de los pacientes, se consideran aún fértiles a diferencia del 50% previo al inicio de la adyuvancia, con lo que se obtiene un 17.5% de deterioro global en la capacidad reproductiva, resultando menor a lo reportado en la literatura, donde se menciona un deterioro de hasta el 30%.5-7
Asimismo se ha reportado la reversibilidad de estos efectos, lo cual en seguimientos a largo plazo han demostrado una recuperación a cifras normales con un pronóstico favorable para la fertilidad, incluso sin necesidad de reproducción asistida. A pesar de que el seguimiento promedio fue de 60 meses en nuestra casuística, sólo en algunos pacientes se documentó la recuperación progresiva de las cifras de espermatozoides, sobre todo en pacientes que recibieron menos de tres ciclos de quimioterapia, quienes fueron los menos afectados.
En los pacientes sometidos sólo a dos ciclos, la recuperación a dos años del tratamiento fue satisfactoria con una cifra de espermatozoides por arriba de 15 000000 mL en todos los casos, con un pronóstico favorable para la fertilidad, la cual se documentó en un paciente. Sin embargo, en algunos casos los pacientes no refirieron deseos o intentos de concebir.
Resulta interesante que entre los pacientes detectados con azoospermia al momento del diagnóstico, están los casos que se presentaron en estadios clínicos más avanzados. De los doce pacientes con esta característica, ocho se encontraron en estadio III, dos en estadio II y sólo uno en estadio clínico Is.
Por lo anterior, al analizar los casos de acuerdo al número de ciclos de quimioterapia recibidos, la gran mayoría de los casos que ameritaron cuatro ciclos o más eran pacientes previamente diagnosticados con azoospermia, por lo tanto el resultado no se le puede atribuir al tratamiento.
En cuanto a la función hormonal, sólo en dos caólo en dos calo en dos casos (5%) se determinó la presencia de hipogonadismo hipergonadotrópico, lo cual corresponde con lo mencionado en la literatura, apoyando la teoría de que la célula de Leydig es mucho más resistente al efecto de la quimioterapia, con series que reportan entre un 8% a 18% de los casos, sin relación al número de ciclos de quimioterapia recibidos.20-22 Los pacientes que elevaron FSH postratamiento corresponden a todos los pacientes azoospérmicos y a algunos oligospérmicos, que por su tiempo de seguimiento podemos pensar que se encuentran en periodo de recuperación posquimioterapia, para lo cual serán necesario determinaciones subsecuentes durante seguimientos más prolongados. Aunque de acuerdo a lo publicado, la persistencia de niveles elevados de FSH denota un pronóstico adverso para la fertilidad.
¿ CONCLUSIONES
Con los resultados obtenidos en nuestra casuística, podemos mencionar que la función reproductiva posquimioterapia para cáncer testicular está sujeta al estado de la misma al momento del diagnóstico, y conforme se incrementa el número de ciclos administrados, su recuperación a cifras normales es menos probable. Por lo que el uso de un banco de espermatozoides, debe ser una opción a considerar para el paciente con diagnóstico reciente de cáncer testicular.
Correspondencia: Dr. Gerardo Fernández Noyola.
Calzada de Tlalpan 4800. Col. Sección XVI. Delegación Tlalpan. C.P. 14080. México D.F., México.
Teléfono: 3624 5676, 4000 3044.