El objetivo de este estudio fue determinar la relación del antígeno prostático específico con indicadores histopatológicos y bioquímicos, en pacientes con diagnóstico clínico de cáncer de próstata.
Materiales y métodosEstudio transversal que incluyó pacientes de 50 años y mayores con diagnóstico clínico de cáncer de próstata, de marzo de 2012 a agosto de 2014. Se analizaron los niveles de antígeno prostático específico y datos bioquímicos e histopatológicos, mediante estadística descriptiva, correlación de Spearman, curvas ROC y tablas de contingencia.
ResultadosLa mediana de edad fue 71 años. La mediana del valor del antígeno prostático específico fue de 8.1ng/ml (2ng/ml a 3,685ng/ml). En 50 pacientes se confirmó el diagnóstico de cáncer de próstata por patología. Se encontró una asociación entre los niveles de antígeno prostático específico y el resultado de Gleason (p<0.05), así como entre antígeno prostático específico y gama-glutamil transferasa (p<0.05).
ConclusionesSe sugiere la determinación de gama-glutamil transferasa para aumentar sensibilidad y especificidad del antígeno prostático específico. La limitación de nuestro estudio es el número de pacientes.
The aim of this study was to determine the relation of prostate-specific antigen to histopathologic and biochemical indicators in patients with a clinical prostate cancer diagnosis.
Material and methodsA cross-sectional study was conducted on patients 50 years and older that had a clinical diagnosis of prostate cancer within the time frame of March 2012 and August 2014. Prostate-specific antigen levels and histopathologic and biochemical data were analyzed through descriptive statistics, the Spearman correlation, ROC curves, and contingency tables.
ResultsThe median age of the patients was 71 years and the median prostate-specific antigen value was 8.1ng/ml (2ng/ml to 3,685ng/ml). Pathologic study confirmed prostate cancer diagnosis in 50 patients. There was an association between prostate-specific antigen levels and Gleason score (p<0.05), as well as between prostate-specific antigen and gamma-glutamyl transferase (p<0.05).
ConclusionsGamma-glutamyl transferase determination is suggested for increasing prostate-specific antigen sensitivity and specificity. The number of patients was a limitation of our study.
Ha resultado evidente que la incorporación del antígeno prostático específico (APE) a la clínica revolucionó el diagnóstico del cáncer de próstata (CaP). Aunque no cumple las características del marcador tumoral ideal, es muy usado para diagnóstico y seguimiento del CaP. El APE es secretado por las células epiteliales en los conductos y acinos prostáticos tanto normales como hiperplásicos o malignos. Su función es de proteasa y su sustrato es una proteína del coágulo seminal resultando en la licuefacción del semen. Su vida media en plasma es de 2.2 a 3.2 días y sus niveles guardan relación con el volumen de la glándula o con la presencia de CaP. La gran difusión del empleo del APE ha producido un cambio en la epidemiología del CaP ya que la mayoría de los tumores se diagnostican en estadios tempranos. Ha producido efectos positivos, como una migración en el estadio1, una reducción drástica en el número de pacientes que se detectan con enfermedad avanzada2 y una posible reducción de la mortalidad3,4, si bien su empleo como tamizaje es aún controversial5.
La elevación de APE es 10 veces mayor en pacientes con CaP en relación al mismo volumen prostático que en pacientes con hiperplasia. Si se utiliza el punto de corte convencional de 4.0ng/dL, se detecta la gran mayoría de pacientes con cáncer; un nivel de APE menor a 4 indica que el cáncer no es probable; en cambio, niveles mayores a 10 implican que el CaP es probable6. Tiene una sensibilidad del 79% y especificidad del 59%, valor predictivo positivo (VPP) del 40% y valor predictivo negativo (VPN) del 89%7. Los niveles de APE pueden también verse afectados por otras situaciones; tiende a ser más elevado en edad avanzada y en infección o inflamación de la próstata. En hiperplasia prostática benigna (HPB), a menudo se presentan niveles elevados y puede permanecer elevado durante uno o dos días tras la eyaculación. La mayor limitación del APE para diagnóstico del CaP entonces es su falta de especificidad. Aunque la alteración de la arquitectura celular del CaP favorece la difusión del APE al torrente sanguíneo, las células neoplásicas producen individualmente menor cantidad de APE que las células de la HPB. Existe una menor expresión del APE por tumores con índice de Gleason más elevado8,9 que limita su valor pronóstico o la estimación del estadio clínico10,11.
Se ha sugerido que el APE total (tAPE) se relaciona más con el volumen prostático y con síntomas secundarios a HPB que con el riesgo de CaP6,7,12,13. Este solapamiento, asociado al hecho de que hay un número de pacientes con valores de APE menores de 4ng/ml que presentan un CaP clínicamente significativo, cuestiona el empleo del punto de corte «convencional»14,15. Un posible sobrediagnóstico y sobretratamiento de tumores indolentes plantean también dudas acerca de su empleo16–18. Por ello, en este estudio buscamos conocer la utilidad del APE en población mexicana y la relación que este presenta con indicadores bioquímicos e histopatológicos en CaP.
El principal objetivo de nuestro estudio fue identificar una asociación entre el nivel sérico del APE y los niveles séricos de los diferentes indicadores bioquímicos. Un objetivo secundario fue confirmar una relación entre elevación del APE y el diagnóstico histopatológico y si los niveles de 3.5ng/dl y de 4.5ng/ml son los niveles de corte adecuados para indicar una biopsia en varones mexicanos en la sexta y séptima década de la vida, respectivamente.
Materiales y métodosSe localizaron los expedientes de los pacientes varones con edades comprendidas entre los 50 y 85 años, con diagnóstico clínico de CaP, con estudio histopatológico de la próstata, y determinación del APE en suero, que se atendieron en el Hospital de Alta Especialidad de Veracruz. Se registraron los datos sociodemográficos, estado civil, nivel de escolaridad, ocupación actual, y los datos bioquímicos e histopatológicos de cada paciente. Se excluyeron aquellos pacientes con un episodio reciente (menos de una semana) de prostatitis o retención aguda de orina, así como los pacientes con instrumentación uretral y prostática previa en un período menor a una semana.
En el análisis estadístico se utilizó estadística descriptiva: frecuencias relativas, absolutas y porcentuales, así como medidas de tendencia central y medidas de dispersión; además se realizaron curva operativa del receptor (COR), correlación de Spearman y tablas de contingencia, mediante el programa SPSS 21.0.
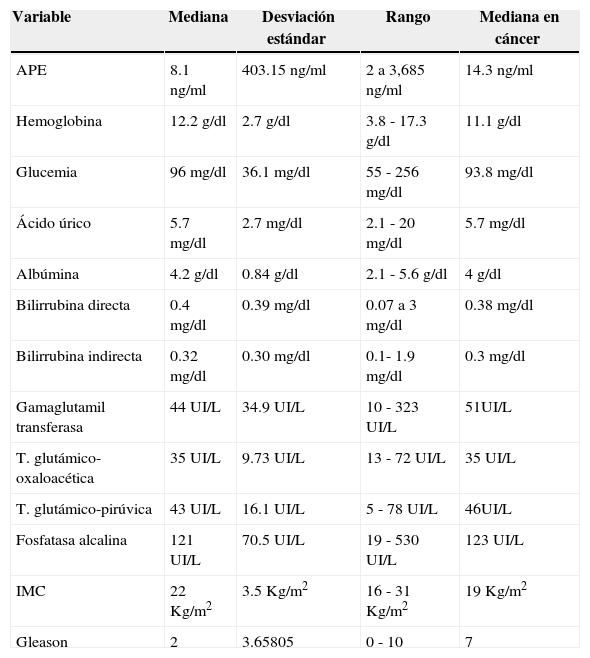
ResultadosEn este estudio se localizaron 120 expedientes de pacientes consecutivos con el diagnóstico clínico de CaP; de estos, se seleccionaron 100 expedientes que cumplían con los criterios de inclusión y que constituyen la base de este informe. La edad mediana de los pacientes fue de 71 años (desviación estándar 8.9 años, rango 50 - 85 años). El 39% estaban casados, 28% en unión libre, 18% eran solteros y 15% viudos. La mayoría estaban desempleados (39%) o eran campesinos (34%), el resto eran comerciantes (17%) y obreros (10%). El 59% de los pacientes tenían educación primaria, el 30% eran analfabetos, 9% con educación secundaria y solo el 2% con estudios de licenciatura. Los valores del APE variaron de 2ng/ml a 3,685ng/ml (mediana 8.1ng/ml, desviación estándar 403.15). Las medianas (± desviación estándar) de los indicadores bioquímicos (hemoglobina, glucemia, ácido úrico, albúmina, bilirrubina directa, bilirrubina indirecta, GGT, TGO, TGP, fosfatasa alcalina, e índice de masa corporal [IMC]) se muestran en la tabla 1.
Distribución de las medianas de los resultados en los parámetros clínicos, bioquímicos y patológicos de los pacientes
| Variable | Mediana | Desviación estándar | Rango | Mediana en cáncer |
|---|---|---|---|---|
| APE | 8.1ng/ml | 403.15ng/ml | 2 a 3,685ng/ml | 14.3ng/ml |
| Hemoglobina | 12.2g/dl | 2.7g/dl | 3.8 - 17.3g/dl | 11.1g/dl |
| Glucemia | 96mg/dl | 36.1mg/dl | 55 - 256mg/dl | 93.8mg/dl |
| Ácido úrico | 5.7mg/dl | 2.7mg/dl | 2.1 - 20mg/dl | 5.7mg/dl |
| Albúmina | 4.2g/dl | 0.84 g/dl | 2.1 - 5.6 g/dl | 4g/dl |
| Bilirrubina directa | 0.4mg/dl | 0.39mg/dl | 0.07 a 3mg/dl | 0.38mg/dl |
| Bilirrubina indirecta | 0.32mg/dl | 0.30mg/dl | 0.1- 1.9mg/dl | 0.3mg/dl |
| Gamaglutamil transferasa | 44 UI/L | 34.9 UI/L | 10 - 323 UI/L | 51UI/L |
| T. glutámico-oxaloacética | 35 UI/L | 9.73 UI/L | 13 - 72 UI/L | 35 UI/L |
| T. glutámico-pirúvica | 43 UI/L | 16.1 UI/L | 5 - 78 UI/L | 46UI/L |
| Fosfatasa alcalina | 121 UI/L | 70.5 UI/L | 19 - 530 UI/L | 123 UI/L |
| IMC | 22 Kg/m2 | 3.5 Kg/m2 | 16 - 31 Kg/m2 | 19 Kg/m2 |
| Gleason | 2 | 3.65805 | 0 - 10 | 7 |
En el 50% de estos pacientes el reporte de patología confirmó el diagnóstico de CaP (grupo cáncer). En los pacientes restantes (grupo benigno) el reporte de patología fue de HPB o prostatitis. El APE del grupo cáncer fue: mediana 16ng/ml, desviación estándar 563.3, rango 3.5 a 3,685ng/ml; mientras que en el grupo benigno el APE fue: mediana 6ng/ml, desviación estándar 4.19, rango 2 a 9ng/ml, siendo la diferencia estadísticamente significativa (prueba t de Student, p=0.02).
En los pacientes con CaP confirmado, la escala de Gleason se reportó entre 2 y 10 (mediana 7, desviación estándar 3.65). En 20 (40%) pacientes se reportó un Gleason de 6 o menor (bajo), en 12 (24%) reportaron un Gleason intermedio (de 7) y 18 (36%) pacientes presentaron un Gleason de 8 o mayor (alto).
Las variables de interés no seguían una distribución normal (test de Kolmogorov-Smirnov), por lo que se analizó el coeficiente de correlación entre variables mediante el test Rho de Spearman. Tratamos de encontrar una correlación entre los indicadores bioquímicos y los resultados histopatológicos. Como era de esperarse, la correlación lineal entre esos datos arrojó una asociación altamente significativa entre los niveles de APE y el resultado de Gleason (prueba Rho de Spearman; p<0.001, tabla 2).
Distribución de los pacientes según el coeficiente de correlación (Rho de Spearman) del APE con las variables de patología
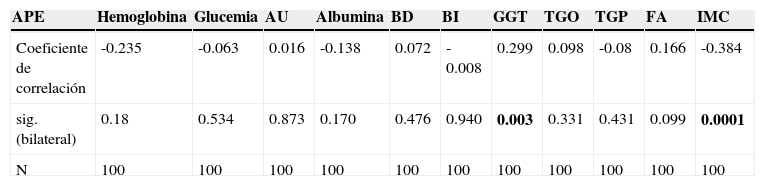
Se observó que 5 pacientes con CaP tenían ligera elevación de las pruebas de funcionamiento hepático, y se decidió excluirlos de análisis adicional. Cuando se contrastaron los niveles de APE y las cifras de GGT en los 45 pacientes con CaP y pruebas de funcionamiento hepático normales se encontró una asociación significativa (p=0.03) entre APE elevado y GGT elevado; una asociación similar se observó al contrastar el APE con el IMC de los pacientes (p=0.001), aunque fue a la inversa, a mayores niveles de APE, cifras más bajas de IMC. No se observó una correlación significativa del APE con alguna otra variable bioquímica (tabla 3).
Distribución de los pacientes según el coeficiente de correlación (Rho de Spearman) del APE con cada variable
| APE | Hemoglobina | Glucemia | AU | Albumina | BD | BI | GGT | TGO | TGP | FA | IMC |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Coeficiente de correlación | -0.235 | -0.063 | 0.016 | -0.138 | 0.072 | -0.008 | 0.299 | 0.098 | -0.08 | 0.166 | -0.384 |
| sig. (bilateral) | 0.18 | 0.534 | 0.873 | 0.170 | 0.476 | 0.940 | 0.003 | 0.331 | 0.431 | 0.099 | 0.0001 |
| N | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 100 |
AU: ácido úrico; BD, bilirrubina directa; BI: bilirrubina indirecta FA: fosfatasa alcalina;; GGT: gammaglutamil transferasa; IMC: índice de masa corporal; TGO: transaminasa glutámicooxaloacética; TGP: transaminasa glutámicopirúvica.
Es de llamar la atención la asociación que se observó entre los niveles crecientes de hemoglobina y los niveles de GGT, ya que se encontró una correlación débilmente negativa entre ellos (prueba Rho de Spearman, datos no mostrados). Así mismo se observó una correlación débilmente positiva entre la hemoglobina y el IMC (prueba Rho de Spearman, datos no mostrados).
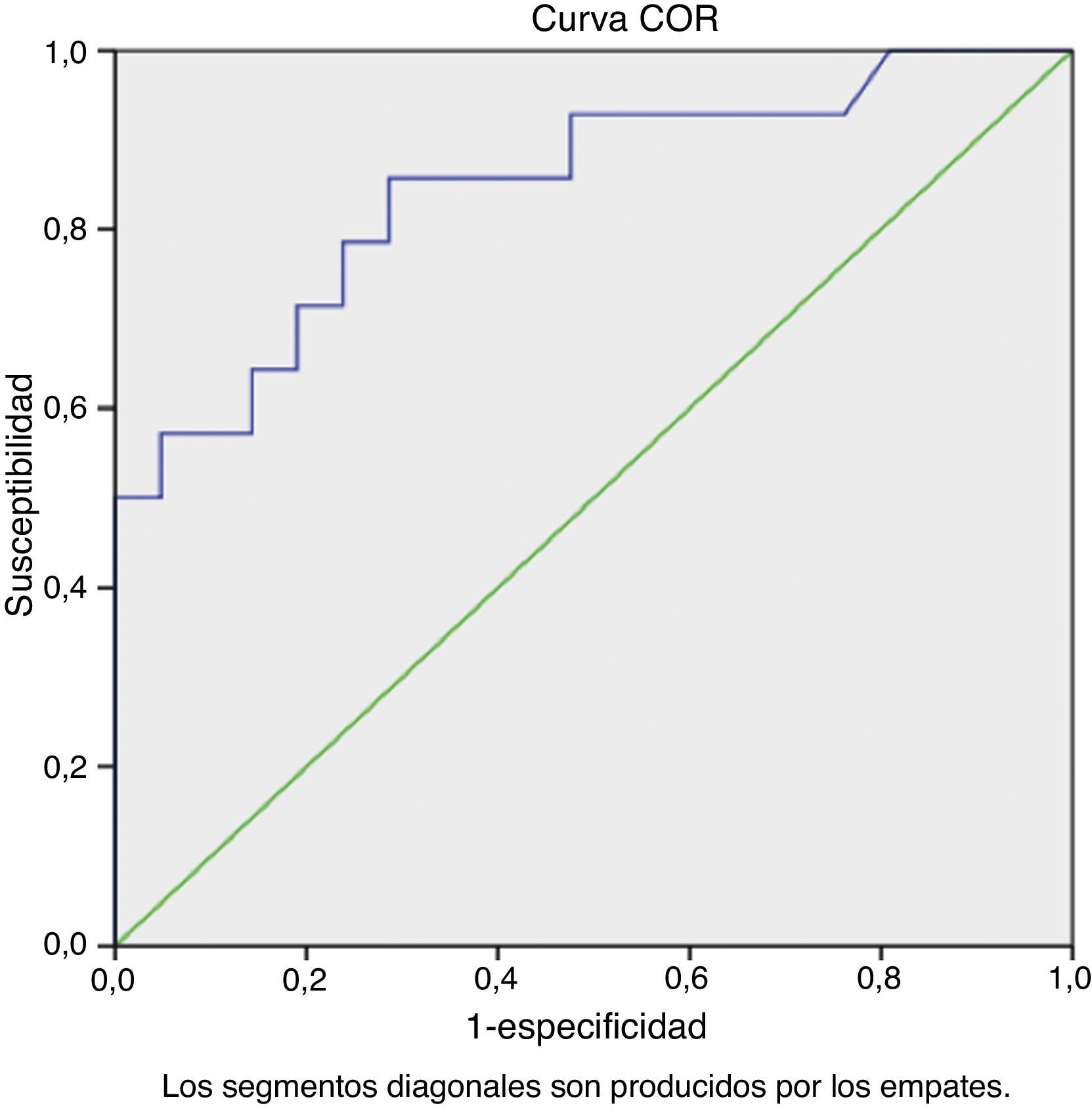
Se realizaron posteriormente las representaciones gráficas para especificidad-sensibilidad por medio de la COR. Encontramos que para los pacientes de la sexta década de la vida el área bajo la curva es de 0.667 (IC 95%: 0.311 - 1.0). En el análisis de contingencia de los puntos de corte para pacientes de la sexta década, el APE de 3.5ng/dl mostró una sensibilidad del 100%, con una especificidad del 25%, con un VPN de 100% y un VPP de 66.6%. Si aumentábamos el punto de corte de APE a 7.25ng/dl, la especificidad aumentó al 75%, con una sensibilidad del 66.7%, VPN de 60% y VPP del 80% (fig. 1).
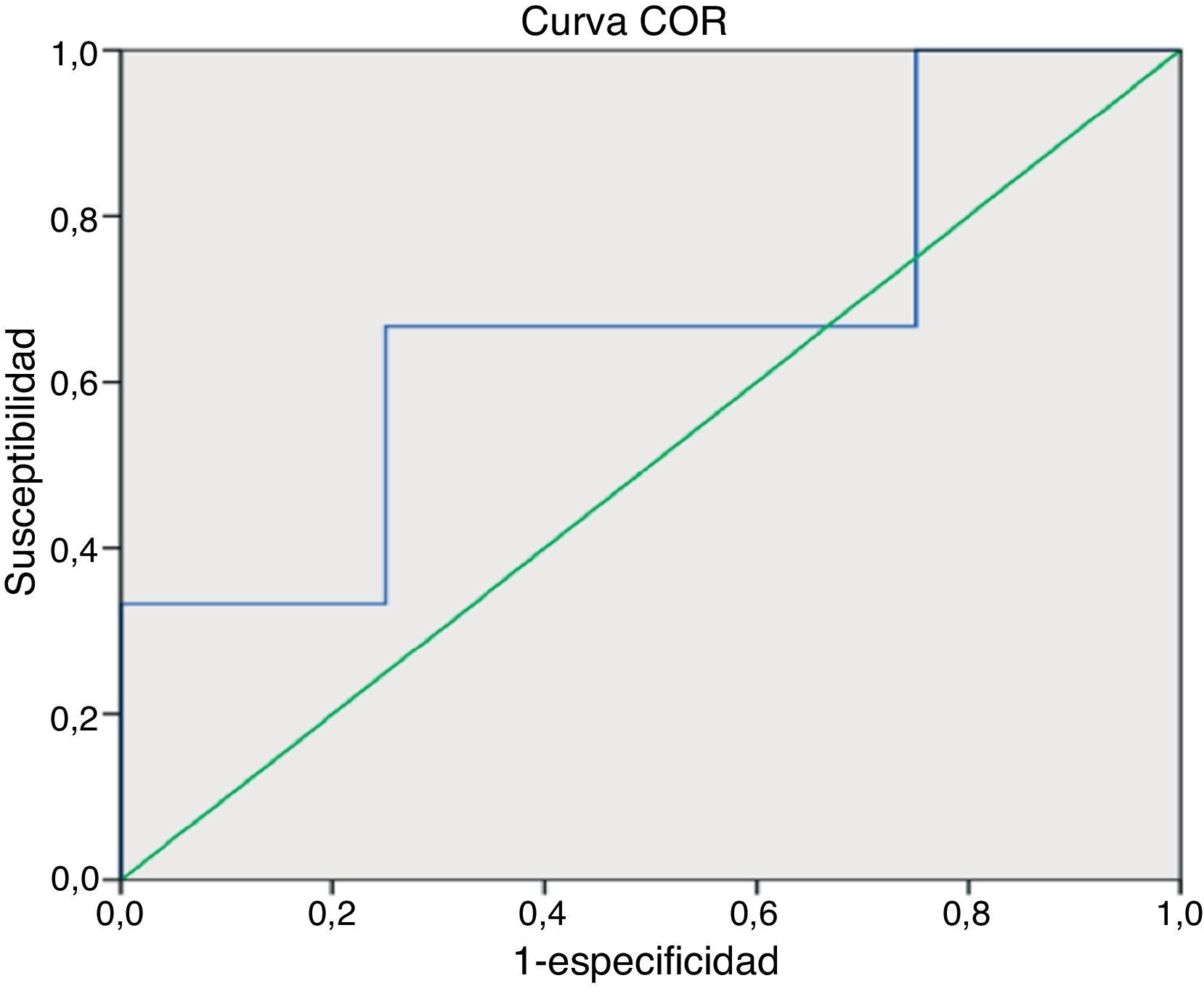
En la COR para los pacientes de la séptima década de la vida el área bajo la curva fue de 0.845 (IC 95%: 0.708 - 0.982) (fig. 2). Si tomamos, en pacientes de la séptima década, un punto de corte para el APE de 4.5ng/dl, encontramos una especificidad del 33.3% con una sensibilidad del 92.8%, VPN de 87.5% y VPP de 48.1%; cuando se eleva el punto de corte de APE a 7.5ng/dl la especificidad aumenta al 71.4% con una sensibilidad correspondiente al 85.7%, VPN de 88.23% y VPP del 66.6%.
DiscusiónSon factores de riesgo conocidos para el desarrollo del CaP la edad, la genética, la dieta y el estilo de vida, la nacionalidad, infecciones e inflamación del órgano, entre otros19. El riesgo de desarrollar alteraciones prostáticas se incrementa con la edad20. Más de la mitad de los mayores de 60 años y 80% de los mayores de 80 años presentarán hiperplasia prostática benigna21. El CaP también resulta más frecuente conforme avanza la edad. El promedio de edad al diagnóstico es de 70 años19, si bien se ha encontrado cáncer de próstata en autopsias de individuos chinos, alemanes, israelitas, jamaicanos, suecos y ugandeses que murieron de causa diferente al cáncer, en el 30% de los hombres de 50 y en el 80% de los hombres de 70 años22. En el 2005 en los Estados Unidos hubo un estimado de 230,000 casos nuevos y 30,000 muertes debidas al CaP23.
El APE es una serinproteasa que sirve de biomarcador para el diagnóstico y para manejo del CaP22, que se creía solo era sintetizado por las células epiteliales de la próstata24, pero es también secretado en mínima proporción por diferentes tipos celulares, normales y tumorales23. El APE es un marcador útil pero tiene grandes limitaciones25, por ejemplo, los CaP de alto grado no son raros con niveles de APE de 4.0ng/ml o menor26. La disminución del umbral por arriba del cual las biopsias están indicadas al valor de APE de 3ng/ml resultó en un incremento de las tasas de biopsias negativas hasta el 70 a 80%27, es decir, pacientes que podrían nunca desarrollar CaP son sometidos a un manejo agresivo.
El principal objetivo de nuestro estudio fue identificar si la relación entre elevación del APE y el diagnóstico histopatológico y si los niveles de 3.5ng/dl y de 4.5ng/ml son los niveles de corte adecuados para indicar una biopsia en varones mexicanos en la sexta y séptima década de la vida, respectivamente. Se observó para los niveles de corte de 3.5ng/dl (sexta década de la vida) una sensibilidad del 100% y una especificidad de 25%; elevando el punto de corte a 7.25ng/ml aumenta la especificidad al 75%, con una sensibilidad del 66.7%. Con respecto a los pacientes de la séptima década sucedió algo similar; con un nivel de 4.5ng/dl se demostró una sensibilidad de 92.8% con una especificidad del 33%; elevando el punto de corte a 7.5ng/dl la sensibilidad es de 85.7% y la especificidad del 71.4%; aun con esto, significa que aproximadamente el 25% de los pacientes tendrán resultados falsos positivos y por lo tanto, incluso con estos niveles, se estaría errando el diagnóstico en un subgrupo de pacientes con riesgo de sobretratamiento.
Con relación al IMC y cáncer de próstata, existe solo una débil evidencia de asociación del IMC aumentado y el riesgo de CaP28,29. Tres sistemas hormonales –el eje insulina y factor de crecimiento semejante a insulina (IGF), los esteroides sexuales, y las adipocinas– son los mecanismos candidatos mejor estudiados que asocian el exceso de peso y el riesgo de cáncer. Los tres sistemas están interrelacionados a través de la insulina; sin embargo, sus roles podrían variar entre los diferentes tipos de cáncer. Una hiperinsulinemia crónica disminuye las concentraciones de IGF binding protein (IGFBP)-1 e IGFBP-2, lo cual incrementa la IGF-1 biodisponible (libre) con mitogénesis y antiapoptosis, las que favorecen el desarrollo tumoral18. La IGF-1 circulante total, determinante mayor de la IGF-1 biodisponible, también se asocia a un mayor riesgo de CaP6. Las concentraciones de IGF-1 circulante total son más altas en los hombres, lo cual explica parcialmente las diferencias en cánceres entre ambos sexos30.
La adiposidad está inversamente relacionada con las concentraciones de testosterona en los hombres31. La adiponectina, la más abundante adipocina, es secretada principalmente por la grasa visceral y está inversamente relacionada con el IMC. La concentración circulante media está más elevada en mujeres. Este agente de sensibilización a la insulina es antiangiogénico, antiinflamatorio, e inhibe el crecimiento tumoral en animales; se ha reportado también una asociación inversa entre las concentraciones de adiponectina y el riesgo de cáncer en humanos32. Otros sistemas incluyen las citocinas inflamatorias relacionadas con obesidad, una respuesta inmune alterada, estrés oxidativo, el sistema del factor nuclear kB33, hipertensión y peroxidación lipídica, etc.34. Al disminuir el consumo de cigarrillos, principal causa de cáncer, el exceso de peso podría resultar el factor dominante en el estilo de vida que contribuya aumentar la incidencia de esta enfermedad.
En este estudio observamos una correlación significativa entre APE e IMC pero en todos nuestros pacientes con patología prostática, ya que al realizar el análisis exclusivamente de los pacientes con CaP en relación al IMC encontramos una correlación débilmente negativa, similar a estudios previos, lo que demuestra que el aumento de peso no está relacionado con el riesgo de CaP en nuestra población.
Los niveles de GGT son comúnmente usados como un biomarcador del consumo excesivo de alcohol y como un índice de daño hepático, aunque se ha sugerido su uso como un marcador de estrés oxidativo35. Además, altos niveles de GGT están presentes en la próstata y puede contar para el hecho de que la actividad de GGT en suero de hombres es más elevada que en mujeres30. Por ello, el CaP puede ser fuente de la elevada actividad de GGT en el suero. Contrario al hecho de que la GGT circulante más elevada en varones proviene de la próstata, no se ha observado un incremento significativo en la GGT sérica media entre pacientes con HPB y CaP en comparación con controles sanos35, por lo que, a pesar de los altos niveles de GGT en la próstata, no se observó una producción incrementada de GGT prostática en HPB y cáncer de próstata27, aunque existe evidencia de que la GGT es un sensible biomarcador para otras neoplasias urológicas como el cáncer renal metastático36. Nosotros encontramos una interesante correlación entre los niveles de GGT y el APE entre los pacientes con CaP; la relación directamente proporcional entre estos dos factores sugiere que, para aumentar la sensibilidad diagnóstica, podría ser conveniente incluir la determinación de GGT en sangre para contribuir a aumentar la especificidad del APE, incluso construir un algoritmo diagnóstico, lo que disminuiría la proporción de falsos positivos evitando biopsias prostáticas innecesarias.
ConclusionesLa elevación del punto de corte de APE a 7.25ng/dl para varones de la sexta década y de 7.50ng/dl entre aquellos en la séptima década son los niveles que demuestran una mayor especificidad de la prueba, hasta el 75 y el 71.4% respectivamente, para evidenciar el diagnóstico del CaP y así justificar la indicación de la realización de la biopsia en nuestra población.
De manera adicional, la relación entre el CaP y los indicadores bioquímicos analizados arroja una correlación significativa cuando niveles elevados de APE se asocian a niveles de GGT elevados lo que nos permite evidenciar que, para realizar un adecuado diagnóstico, sería conveniente asociar las determinaciones séricas del APE y la GGT como marcador para aumentar la especificidad de APE, lo que por consiguiente disminuirá la proporción de falsos positivos.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónNo se recibió patrocinio de ningún tipo para llevar a cabo este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.