¿ INTRODUCCIÓN
La infertilidad es la falta de embarazo en una pareja que tiene relaciones sexuales durante al menos 12 meses sin protección anticonceptiva1 y afecta aproximadamente de diez a quince de cada cien parejas en edad reproductiva.2 La falla en la fertilidad masculina puede ser el resultado de anormalidades urogenitales, infecciones del tracto genital, aumento de la temperatura escrotal, alteraciones endócrinas, anormalidades genéticas y factores inmunológicos.1 En un alto porcentaje de casos, la infertilidad es catalogada como inexplicable;3 estos casos pueden ser resultado de factores como estrés crónico, alteraciones causadas por contaminantes ambientales, exceso de radicales libres y anormalidades cromosómicas.3 Aunque tradicionalmente se ha señalado a la mujer como la responsable de la infertilidad, el problema afecta tanto a hombres como a mujeres y recientemente se ha atribuido al hombre 50% de las causas.4
En los varones hay una declinación de la función reproductiva con la edad y también se observa una disminución gradual de la testosterona sérica, aproximadamente 0.5% a 2% por año después de los 50 años.5 La disminución de la testosterona sérica se debe a una disminución en la función testicular, a una disminución de la función del eje hipotálamo-hipófisis con la consecuente disminución de las gonadotropinas circulantes4 o a un aumento en la producción de la globulina fijadora de hormonas sexuales que se une a una cantidad mayor de testosterona.
La disminución de gonadotropinas y de testosterona (hipogonadismo hipogonadotrópico) es una causa bien documentada de infertilidad, de manera que los padecimientos asociados con cambios hormonales potencialmente pueden conducir también a infertilidad.
El síndrome metabólico (SM), también conocido como síndrome de resistencia a la insulina, es una alteración metabólica que se describió por primera vez en 1920 como una combinación de hipertensión, hipertrigliceridemia y gota.6 Con el tiempo surgieron diversas definiciones del síndrome, cada una considerando distintos componentes; que varían en su requerimiento esencial desde obesidad central hasta resistencia a la insulina o intolerancia a la glucosa.7 De acuerdo con el Panel de Tratamiento del Adulto (ATP III) y el Consenso del grupo de la Federación Internacional de Diabetes, llevada a cabo en Berlín en 2005, para hacer el diagnóstico de SM en los hombres se requiere la presencia de al menos tres de las siguientes características: circunferencia abdominal de 90 centímetros o más, triglicéridos igual o mayor de 150 mg/dL, colesterol de lipoproteínas de alta densidad (HDL) menor de 40 mg/dL, tensión arterial de 130/85 mmHg o mayor, glucemia en ayuno de 100 mg/dL o mayor.8
Utilizando estos criterios, el síndrome metabólico tiene una prevalencia de 9.5% a 23%7 y se asocia a un riesgo incrementado de enfermedad cardiovascular y de disfunción eréctil, esta última consecuencia del compromiso vascular peniano y disfunción endotelial, representando un factor de infertilidad.
Se sabe que el síndrome metabólico en los hombres lleva a una alteración del perfil hormonal. Los hombres obesos tienen niveles elevados de estrona y estradiol y hay también una atenuación de la amplitud de pulso de la hormona luteinizante (LH), lo cual conduce a una disminución de la producción testicular de testosterona. La combinación de estos hallazgos, representa un estado aislado de hipogonadismo hipogonadotrópico que se cree es inducido por retroalimentación negativa de la hiperestrogenemia sobre la secreción hipofisiaria de LH.7 Sin embargo, aún no queda claro qué repercusión tienen estos cambios hormonales en el potencial reproductivo del hombre.
¿ OBJETIVO
Comparar los niveles hormonales y los parámetros seminales en hombres infértiles con y sin síndrome metabólico.
¿ MÉTODOS
Se hizo un estudio transversal analítico de 60 pacientes que acudieron a la consulta de Andrología por infertilidad. Se hizo una historia clínica que incluyó interrogatorio y exploración física en la que se consideró el registro de peso, medición del perímetro abdominal y toma de presión arterial. También se solicitaron exámenes de laboratorio que incluyeron glucosa sérica, lipoproteínas, colesterol y triglicéridos. Se hizo un análisis hormonal midiendo concentraciones séricas de hormona luteinizante (LH), hormona foliculoestimulante (FSH), testosterona (T), estradiol (E2) y prolactina (PRL). Todos los pacientes proporcionaron una muestra seminal obtenida por masturbación de acuerdo con los requisitos que marca la Organización Mundial de la Salud (OMS).1 También se aplicó el cuestionario International Index of Erectile Function (IIEF-5), instrumento validado internacionalmente para diagnosticar disfunción eréctil9 y se calculó su prevalencia.
Los pacientes fueron separados en dos grupos. En el primero se incluyeron a los pacientes que reunieron los requisitos de acuerdo a los criterios del ATPIII para ser considerados portadores de síndrome metabólico. En el segundo grupo se incluyeron a los pacientes que no tuvieron síndrome metabólico. Se hizo la comparación de las variables metabólicas, hormonales y seminales entre los grupos, con y sin síndrome metabólico. Una vez identificados a los pacientes con hipogonadismo, definido éste como una concentración menor de 9.9 nmol/L, se procedió a la comparación de las mismas variables entre pacientes con y sin hipogonadismo.
Se utilizó prueba t de student para comparación de muestras independientes para las variables cuantitativas y prueba Ji cuadrada para variables categóricas considerando un valor de p <0.05 estadísticamente significativo. Se utilizó la prueba de U de Mann-Whitney para comparar a los grupos con y sin síndrome metabólico, así como entre grupos con y sin hipogonadismo.
¿ RESULTADOS
Fueron incluidos 60 pacientes con infertilidad, de los cuales 37 reunieron los criterios del ATPIII para ser incluidos en el grupo con síndrome metabólico, lo que constituye una prevalencia de 61.6%. Se identificaron 38 pacientes con hipertrigliceridemia, 34 con hipercolesterolemia y 23 con hiperglucemia, lo que representa una prevalencia respectiva de 63%, 57% y 38%.
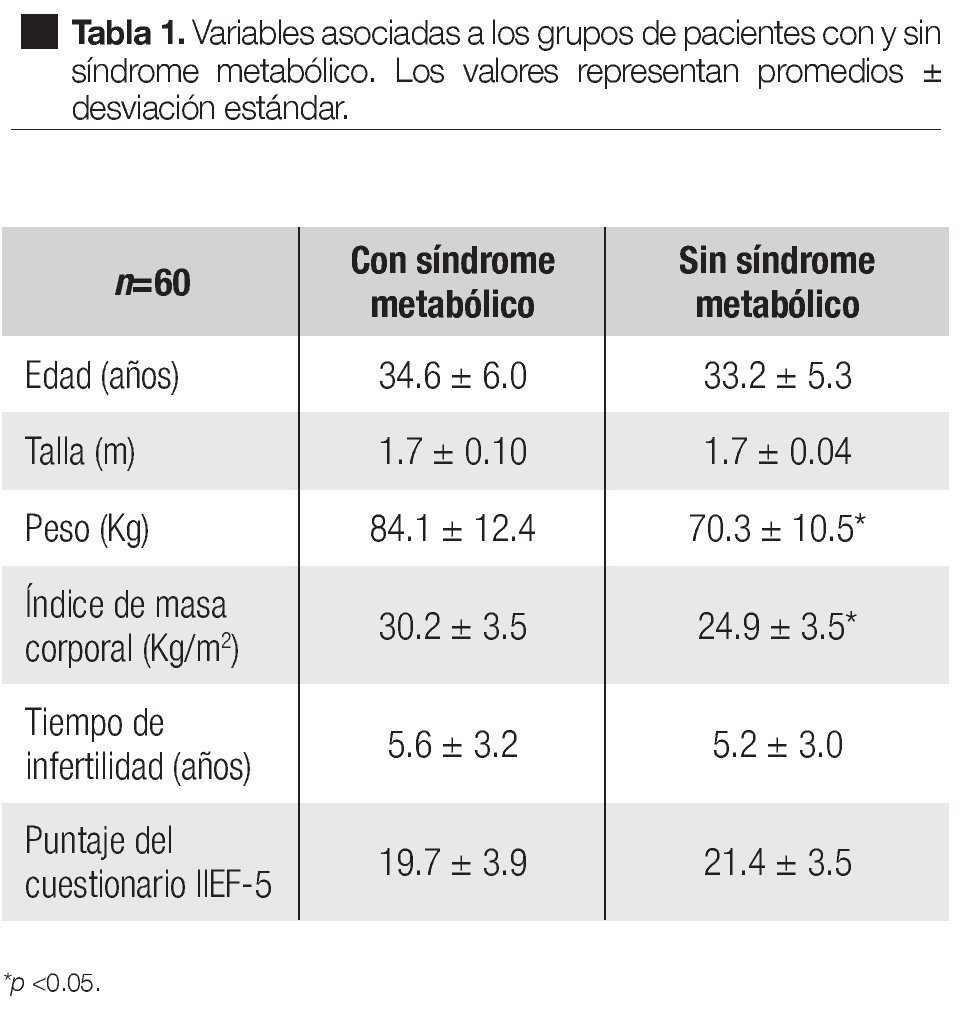
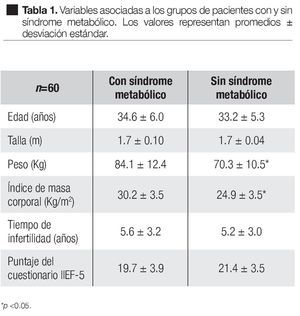
En el grupo de pacientes con síndrome metabólico, la edad fue de 34.6 años, la talla de 1.7 m, el peso de 84.1 Kg, el índice de masa corporal (IMC) de 30.2 Kg/ m2, el tiempo de infertilidad de 5.6 años y el cuestionario IIEF-5 de 19.7 puntos. Los valores respectivos en el grupo de pacientes sin síndrome metabólico fueron: 33.2 años, 1.7 m, 70.3 Kg, 24.9 Kg/m2, 5.2 años y 21.4 puntos. De estas variables, solamente el peso y el IMC mostraron una diferencia significativa (Tabla 1).
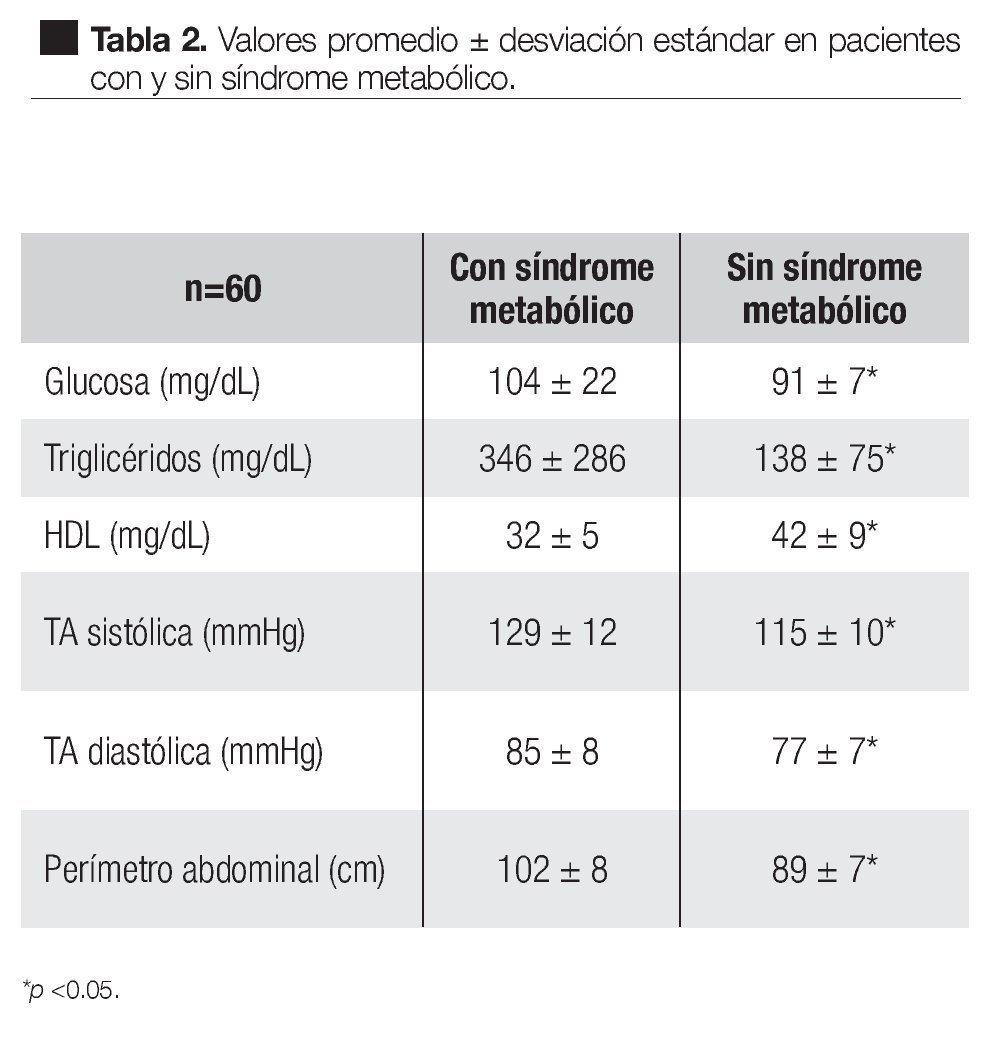
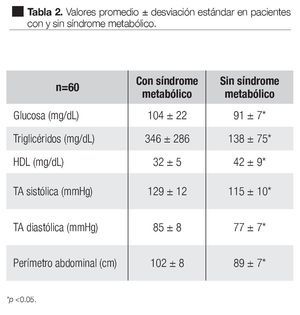
En el grupo de pacientes con SM, la glucosa fue de 104 ± 22 mg/dL, triglicéridos 346 ± 286 mg/dL, HDL 32 ± 5 mg/dL, TA sistólica 129 ± 12 mmHg, TA diastólica 85 ± 8 mmHg, perímetro abdominal 102 ± 8 cm. Los valores respectivos en el grupo sin SM fueron 91 ± 7 mg/dL, 138 ± 75 mg/dL, 42 ± 9 mg/dL, 115 ± 10 mmHg, 77 ± 7 mmHg, 89 ± 7 cm. Todos los valores fueron estadísticamente significativos, p <0.05 (Tabla 2).
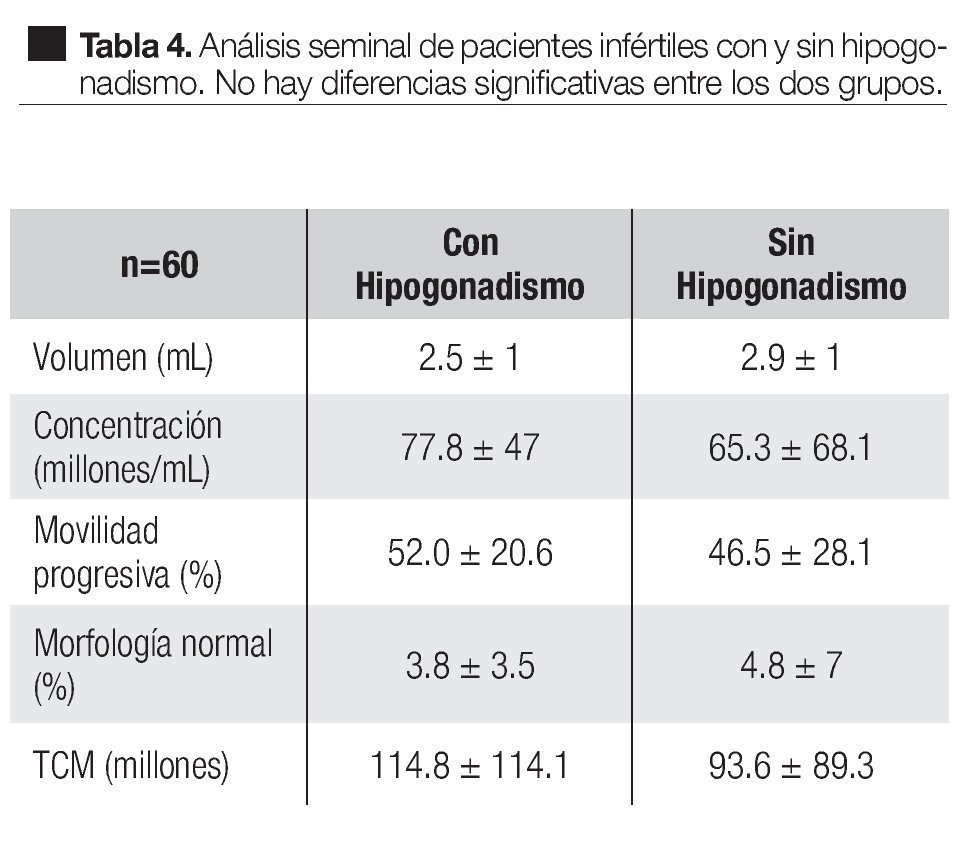
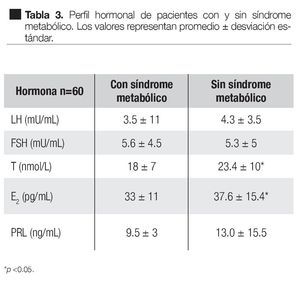
En relación al perfil hormonal, en los pacientes con SM, LH fue 3.5 ± 11 mU/mL, FSH 5.6 ± 4.5 mU/mL, T 18 ± 7 nmol/L, E2 33 ± 11 pg/mL, PRL 9.5 ± 3.0 ng/ mL. En los pacientes sin SM, los valores fueron LH 4.3 ± 3.5 mU/mL, FSH 5.3 ± 5 mU/mL, T 23.4 ± 10 nmol/L, E2 37.6 ± 15.4 pg/mL y PRL 13.0 ± 15.5 ng/mL. Tanto testosterona como estradiol mostraron una diferencia significativa entre los grupos (Tabla 3).
Cuatro de 37 pacientes (10.8%) con síndrome metabólico, presentaron hipogonadismo, definido como un nivel sérico de testosterona menor de 9.9 nmol/L.
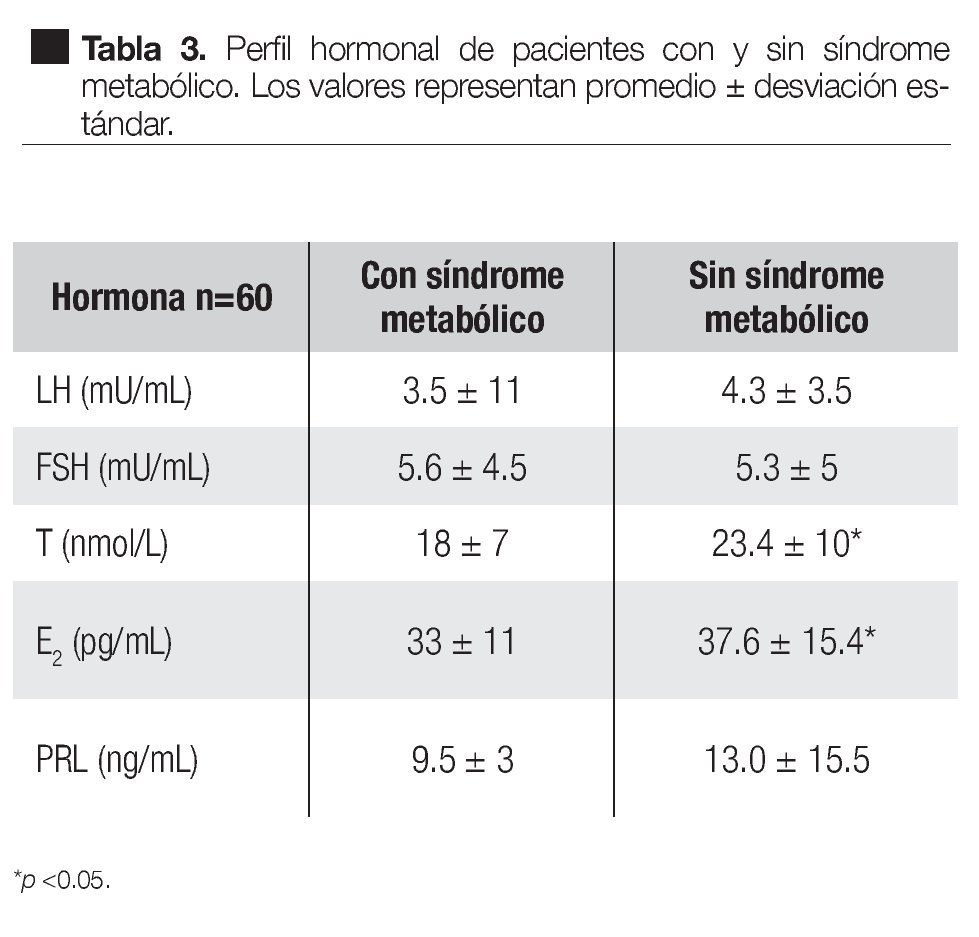
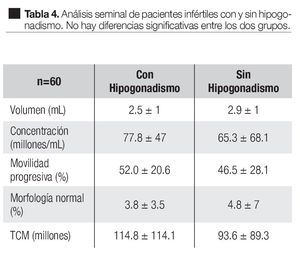
En los pacientes con hipogonadismo el análisis seminal mostró un volumen de 2.5 ± 1 mL, concentración de 77.8 ± 47 millones/mL, movilidad progresiva de 52.0% ± 20.6%, morfología normal de 3.8% ± 3.5% y total de células móviles (TCM) de 114.8 ± 114.1 millones. En los pacientes sin hipogonadismo los valores fueron 2.9 ± 1 mL, 65.3 ± 68.1 millones/mL, 46.5% ± 28.1%, 4.8% ± 7%, 93.6 ± 89.3 millones respectivamente. Ninguno de estos parámetros mostró diferencias significativas entre los grupos (Tabla 4).
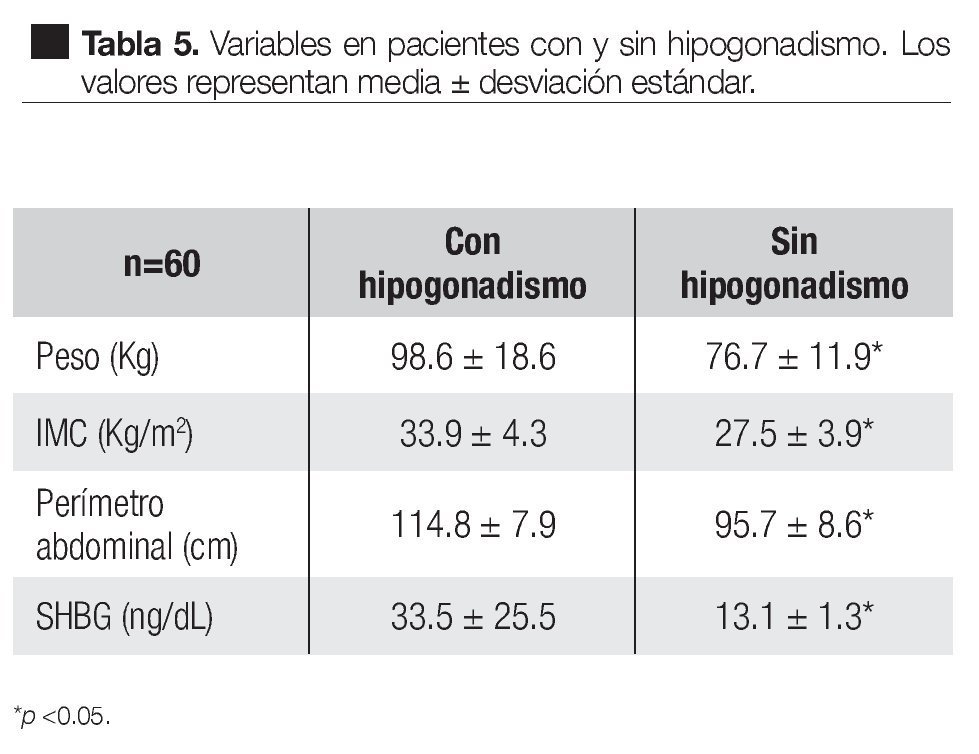
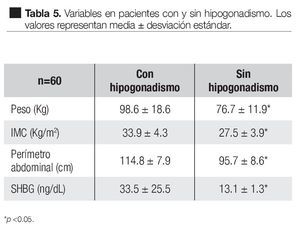
El peso, IMC, circunferencia abdominal y la hormona fijadora de hormonas sexuales (SHBG) en el grupo de pacientes con hipogonadismo fue de 98.6 ± 18.6 kg, 33.9 ± 4.3 kg/m2, 114.8 ± 7.9 cm y 33.5 ± 25.5 ng/dL respectivamente. En el grupo de pacientes sin hipogonadismo estos valores fueron de 76.7 ± 11.9 kg, 27.5 ± 3.9 kg/m2, 95.7 ± 8.6 cm y 13.1 ± 1.3 ng/dL respectivamente. Todos estos valores tuvieron una diferencia significativa (Tabla 5).
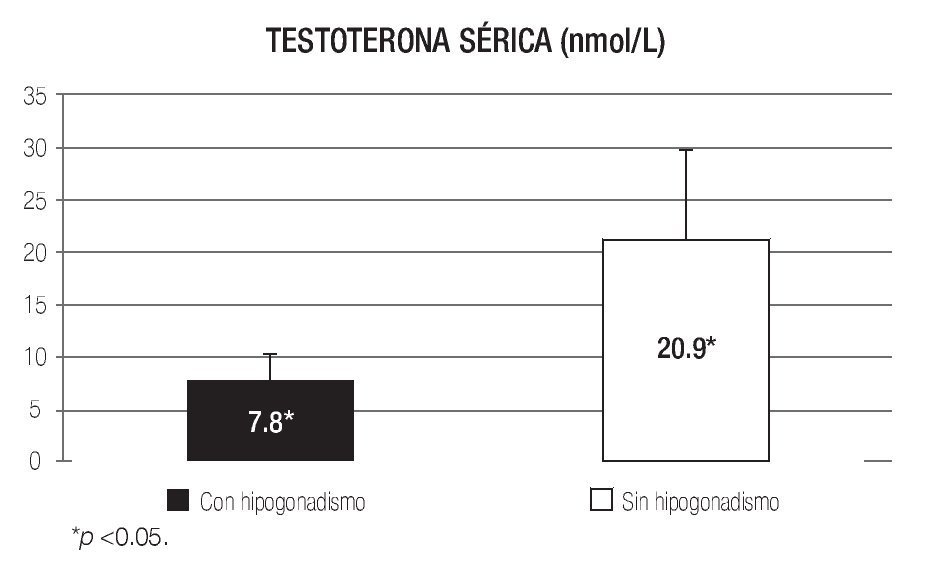
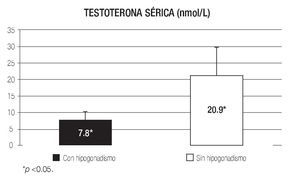
La concentración sérica de testosterona total en los pacientes con hipogonadismo fue de 7.8 ± 2.4 nmol/L, en tanto que en los pacientes sin hipogonadismo fue de 20.9 ± 8.9 nmol/L, siendo la diferencia significativa (Imagen 1).
Imagen 1.Concentración sérica de testosterona en pacientes con y sin hipogonadismo.
Dos de los cuatro pacientes con hipogonadismo presentaron disfunción eréctil (DE) leve (puntaje IIEF-5 20.5 ± 4.3), en tanto que esta condición se presentó también en 26 de 56 pacientes sin hipogonadismo (puntaje IIEF-5 20.4 ± 3.9). No hubo diferencia ni en la frecuencia de presentación de DE ni en el puntaje del cuestionario IIEF-5.
¿ DISCUSIÓN
El síndrome metabólico es una entidad que se ha venido incrementando de forma importante en los últimos años y ha alcanzado una prevalencia alta en la actualidad.7 Su influencia sobre el desarrollo de cardiopatía isquémica o de diabetes mellitus es incuestionable; sin embargo, considerando que se trata de un síndrome con repercusión sistémica, su influencia sobre la fertilidad aún está por establecerse. Destaca en este estudio la alta prevalencia (61.6%) del síndrome en la población estudiada, lo que sugiere una predisposición a la adquisición de la patología, o la infertilidad es un factor asociado al síndrome. Considerando que el hipogonadismo es una entidad que conduce a infertilidad y que en este estudio, el mismo se observó en el grupo de pacientes con síndrome metabólico, es posible que exista una asociación entre síndrome metabólico, hipogonadismo e infertilidad. Los estudios que reportan el síndrome metabólico se han hecho en poblaciones abiertas y por lo mismo no es posible comparar los resultados, pero es evidente que las prevalencias reportadas son evidentemente menores que la observada en este estudio, tal vez por el hecho de tratarse de una población con infertilidad.
Se observaron prevalencias elevadas de sobrepeso (50%), obesidad (30%), hipertrigliceridemia (63%), hipercolesterolemia (57%) y de hiperglucemia (38%).
En otro estudio se reportó en pacientes infértiles9,10 18% de obesidad, 65% de dislipidemia (hipercolesterolemia, hipertrigliceridemia o ambas) y 15% de intolerancia a la glucosa. Aunque elevadas, estas cifras son inferiores a las reportadas en este estudio. Esto puede deberse a que han cambiado los niveles de corte para definir las alteraciones metabólicas y también a que posiblemente se ha incrementado la frecuencia de las alteraciones metabólicas.
En lo que se refiere a las concentraciones hormonales, se observó una diferencia significativa en los niveles de testosterona (18 ± 7 nmol/L vs. 23.4 ± 10 nmol/L) y de estradiol (23.4 ± 10 pg/mL vs. 37.6 ± 15.4 pg/mL) entre los pacientes con y sin síndrome metabólico, siendo los valores más elevados en el segundo grupo, acorde con un informe previo, que asocia el síndrome metabólico con hipogonadismo.11 Si bien se piensa que la aromatización periférica de la testosterona conduce a un aumento de estradiol y éste es responsable de la disminución de gonadotropinas; también es cierto que a menor disponibilidad de testosterona hay menor posibilidad de aromatización, lo que puede explicar la menor concentración sérica de estradiol en el grupo con hipogonadismo.
La obesidad central como componente del síndrome metabólico se ha asociado principalmente a un estado de hipogonadismo hipogonadotrópico, en el cual los estrógenos, producto de la aromatización periférica de los andrógenos, produce un efecto de retroalimentación negativa a nivel central caracterizado por una disminución en la amplitud de la secreción de gonadotropinas afectando especialmente la amplitud de sus pulsos y con esto la producción de testosterona.12
En este estudio observamos la aparición de hipogonadismo solamente en el grupo de pacientes con síndrome metabólico. En contraparte, no se identificó algún caso de hipogonadismo entre los pacientes carentes de síndrome metabólico. Esto sugiere que la alteración hormonal que describe al hipogonadismo probablemente se encuentra asociada a las alteraciones propias del síndrome metabólico. Un estudio previo reportó que el hipogonadismo es más frecuente en pacientes con síndrome metabólico (11.9% vs. 3%, p <0.0001)13 valor muy parecido al que observamos en este estudio, ya que la aparición de hipogonadismo en pacientes con síndrome metabólico fue de 10.8%.
Otros estudios han señalado que el descenso de la concentración de testosterona sérica relacionado con la edad en los hombres se exacerba con la obesidad, el síndrome metabólico y la DM2, en tanto que la prevalencia de hipogonadismo entre los pacientes que cumplen los cinco criterios ATP III ha sido 10 veces mayor que en los sujetos sin anormalidades metabólicas.7
Acorde con lo anterior, en los pacientes con hipogonadismo se observaron diferencias significativas en el peso, índice de masa corporal, circunferencia abdominal y globulina transportadora de hormonas sexuales (SHBG, Tabla 5). Esto es congruente ya que los primeros tres parámetros están en relación directa con obesidad y ésta a su vez se relaciona con bajas concentraciones de testosterona y de SHBG,14 ésta última disminuida en los pacientes obesos, debido principalmente a un estado de hiperinsulinemia que caracteriza a estos casos y que causa una inhibición de la síntesis hepática de esta globulina.
¿ CONCLUSIONES
Se observó una prevalencia muy alta (61.6%) de síndrome metabólico en hombres infértiles, así como de disfunción eréctil (50%), por lo que su búsqueda intencionada debe constituir una práctica rutinaria en la evaluación de estos pacientes.
Los casos con hipogonadismo (10.8%), se presentaron solamente en los pacientes con síndrome metabólico, por lo que probablemente este último favorece su aparición. Es probable que el SM se asocie a la infertilidad, a través del surgimiento del hipogonadismo ya que éste es una causa de infertilidad, aun cuando no se encontró una asociación con alteraciones de los parámetros seminales.
Dada su alta prevalencia, es importante la búsqueda de SM y de hipogonadismo en pacientes infértiles, por las repercusiones que significan para la fertilidad, la calidad de vida y las peligrosas repercusiones en la salud general de los pacientes.
Correspondencia: Dr. Armando Juárez Bengoa.
Montes Urales 800, Col. Lomas de Virreyes. Delegación Miguel Hidalgo. México, D.F. 11000.
Teléfono: 55 20 99 00, Extensión: 337.
Correo electrónico: ajuarezbengoa@yahoo.com.mx.