Background: Detrusor sphincter dyssynergia (DSD) is characterized by the desynchronized activity of the detrusor muscle and the external urethral sphincter (EUS).
Aims: To evaluate the clinical response to the application of botulinum toxin type A for DSD in children with neurogenic bladder.
Material and methods: A descriptive, retrospective, cross-sectional study was conducted to evaluate the response to the application of botulinum toxin type A in DSD in children with neurogenic bladder.
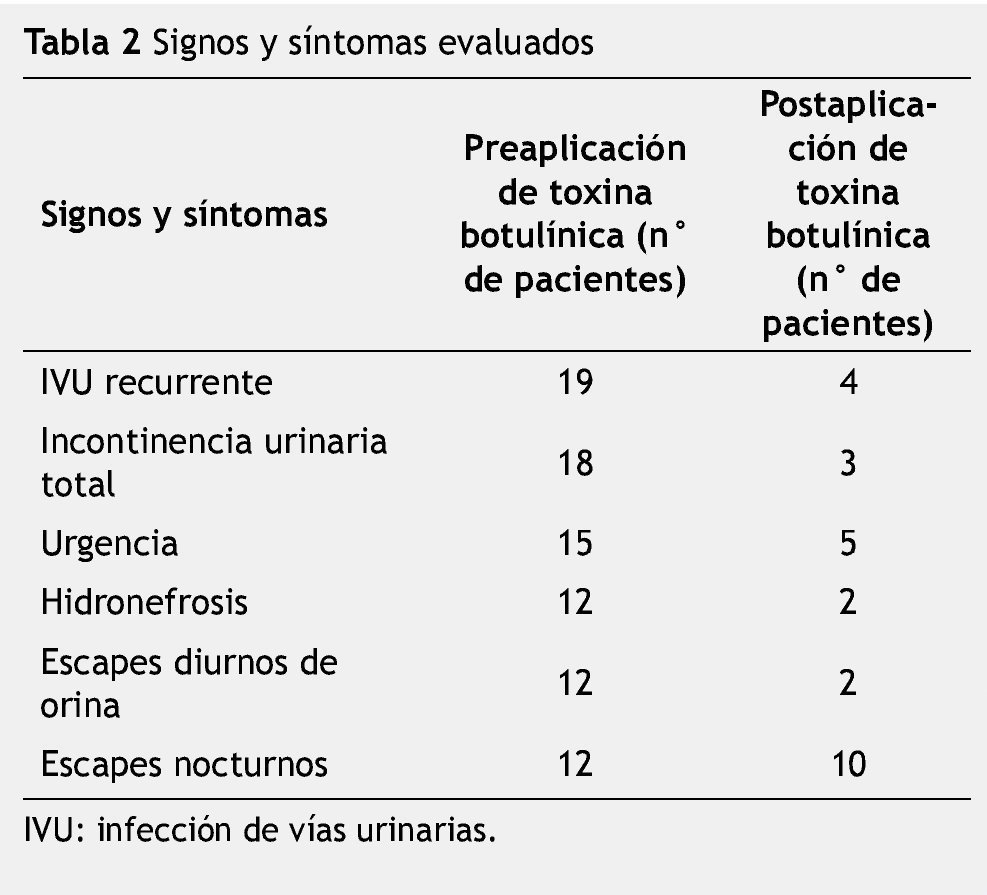
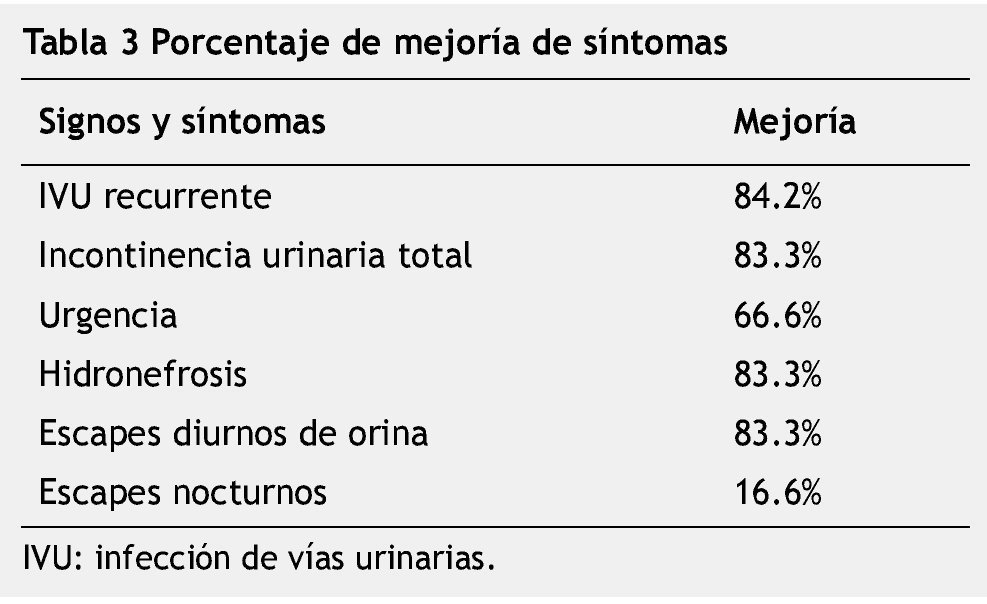
Results: A total of 155 case records of urologic outpatients with neurogenic bladder were reviewed. Thirty-eight of them showed DSD. All received 100u of botulinum toxin type A in the EUS. The most frequent of the evaluated signs and symptoms were: urinary tract infection, total urinary incontinence, urinary urgency, hydronephrosis, diurnal leaks, and nocturnal leaks. After the application of botulinum toxin type A, we observed the following responses: urinary tract infections were resolved in 84.2% of the cases, total incontinence in 83.3%, hydronephrosis in 83.3%, urinary urgency in 66.6%, nocturnal leaks 16.6%, and diurnal leaks in 83.3%.
Conclusions: Botulinum toxin application in the EUS for DSD is a safe, effective, and reproducible option with favorable results.
Introducción: la disinergia detrusor-esfínter (DDE) se caracteriza por la actividad desincronizada del músculo detrusor y el esfínter uretral externo (EUE).
Objetivos: Evaluar la respuesta clínica a la aplicación de toxina botulínica tipo A, para la DDE en niños con vejiga neurogénica.
Material y métodos: Estudio descriptivo, retrospectivo y transversal para evaluar la respuesta a la aplicación de toxina botulínica tipo A, en la DDE en niños con vejiga neurogénica.
Resultados: Se revisaron 155 expedientes de casos de la consulta externa de urología con vejiga neurogénica. Treinta y ocho mostraron DDE. Todos recibieron 100u de toxina botulínica tipo A en el EUE. De los signos y síntomas evaluados los más frecuentes fueron: infección de vías urinarias, incontinencia urinaria total, urgencia urinaria, hidronefrosis, escapes diurnos y escapes nocturnos. Después de la aplicación de toxina botulínica observamos las siguientes respuestas: las infecciones de vías urinarias se resolvieron en 84.2% de los casos, la incontinencia total en 83.3%, hidronefrosis en 83.3%, urgencia urinaria en 66.6%, escapes nocturnos en 16.6% y escapes diurnos en 83.3%.
Conclusiones: la aplicación de toxina botulínica en el EUE para la DDE es una opción reproducible, efectiva y segura, con resultados favorables.
Pagina nueva 1
Introducción
La vejiga es una víscera hueca compuesta mayormente por músculo liso, que tiene como funciones fundamentales el almacenamiento de orina durante periodos de tiempo, y el vaciamiento espontáneo con control voluntario. El almacenamiento de la orina requiere de un reservorio con baja presión a máxima capacidad, y con control voluntario sobre la continencia. La fase de vaciamiento amerita control voluntario sobre los esfínteres y la pared del reservorio vesical1. Cualquier alteración en estas fases funcionales de la vejiga de origen neurológico, se conoce en general como vejiga neurogénica. Existen distintos tipos de vejiga neurogénica, ya que implican una combinación de los distintos músculos en interacción. La vejiga neurogénica es una entidad caracterizada por alteraciones en las funciones normales de origen neurológico. Estas pueden manifestarse por dificultad en el almacenamiento de la orina o en el vaciamiento vesical2.
La disinergia detrusor-esfínter (DDE) es una condición caracterizada por la actividad simultánea del músculo detrusor y el esfínter uretral externo (EUE)1.
El síntoma más común que acompañan a la DDE es el chorro urinario descoordinado e interrumpido. Los signos urodinámicos muestran una asociación entre una alta presión miccional y la interrupción del flujo, sin alteración del vaciado total de la vejiga. Al evaluar a niños pequeños con disfunción miccional aparente, se debe tener precaución y no interpretar síntomas intermitentes y transitorios como patológicos, lo que conduciría a realizar estudios innecesarios. Si en cambio, la disfunción miccional persiste más allá del periodo de aprendizaje de control de esfínteres, en especial si se asocia con complicaciones urinarias como urosepsis recurrente, pueden existir causas anatómicas y neurológicas que deben ser estudiadas.
La localización de la lesión neurológica en la DDE que ocasiona los síntomas puede encontrarse a 3 niveles distintos: por encima del tallo cerebral, en la médula espinal o en el sistema nervioso periférico. Entre las múltiples patologías que afectan al sistema nervioso y que pueden manifestarse con síntomas a nivel del tracto urinario inferior se encuentran: accidente cerebrovascular, ataxia cerebelar, tumores cerebrales, hidrocefalia, parálisis cerebral, retraso mental, enfermedad de Parkinson, síndrome de Shy-Drager, esclerosis múltiple, mielodisplasia, agenesia sacra, lesión medular, diabetes, hernia de discal, enfermedades infecciosas -como SIDA, síndrome de Guillain Barré, herpes, virus linfotrófico T humano, enfermedad de Lyme, poliomielitis, sífilis, tuberculosis-, cirugía pélvica radical -resección de carcinoma rectal e histerectomía radical-, cirugía de la médula espinal, compresión medular y vejiga neurogénica no neurogénica como en el síndrome de Hinman2.
La DDE es un padecimiento que siempre amerita un manejo. Es preciso contar con una historia clínica completa que cuente con interrogatorio, examen físico, exploración neurológica, así como exámenes de laboratorio y gabinete.
Por último y como parte fundamental de la evaluación del paciente con DDE, se debe realizar un estudio urodinámico completo.
La toxina botulínica es producida por la bacteria anaeróbica gram positiva Clostridium botulinum. Fue aislada por primera vez en 1897 por van Ermengem, es una de las neurotoxinas más potentes conocidas por el ser humano. Estructuralmente está compuesta por una doble cadena de aminoácidos de 150 kDa, constituida por una cadena ligera de 50 kDa y una cadena pesada de 100 kDa, ambas unidas por un puente disulfuro. Su mecanismo de acción consiste en inhibir la liberación de acetilcolina en la unión colinérgica presináptica. Aunque existen 7 neurotoxinas inmunológicamente distintas con diferentes proteínas blanco intracelulares y características de acción distintas, sólo las toxinas botulínicas serotipo A y B tienen uso clínico. La neurotoxina botulínica puede inhibir la liberación de neurotransmisor de las neuronas sensoriales y resultar en desensibilización periférica.
La neurotoxina botulínica puede también bloquear la liberación central de glutamato y disminuir los receptores de aminoácidos excitadores, los cuales son importantes para la percepción del dolor3.
Desde la aplicación la toxina botulínica tipo A por primera vez, por Steinhardt en 1997 para el tratamiento de la DDE, se ha extendido su uso al tratamiento de niños con hiperactividad del detrusor o del esfínter, neurogénicos o no neurogénicos, resistentes a tratamientos convencionales. Desde entonces, su uso ha extendido al tratamiento de niños con hiperactividad del detrusor no neurogénica resistentes a tratamiento y disfunción miccional refractaria. La duración de la parálisis inducida varía dependiendo del tipo de músculo tratado. En casos de hiperactividad del detrusor neurogénica y no neurogénica, el efecto del tratamiento dura de 10 a 12 meses, y en el caso del músculo estriado unas 12 a 18 semanas3.
La patología de base más común en la población pediátrica afectada por hiperactividad del detrusor neurogénica es el mielomeningocele (93%), seguido por los tumores de la médula espinal y trauma. Los tratamientos de primera línea en la población pediátrica incluyen los fármacos antimuscarínicos y el cateterismo limpio intermitente, sin embargo 10% a 15% de estos pacientes presentan enfermedad refractaria y efectos colaterales adversos severos4.
La hipótesis para su uso es que el periodo de parálisis de la musculatura del piso pélvico y EUE después de la inyección de toxina botulínica, es suficiente para corregir el patrón incorrecto de micción y reaprender la relajación de la musculatura del piso pélvico, utilizando por lo tanto la uroterapia estándar5,6.
Debido a la gran prevalencia de enfermedad vesical, el uso de la toxina botulínica para vejiga hiperactiva e hiperactividad de detrusor se ha estudiado en forma más extensa. Sin embargo, en el campo de DDE neurogénica y no neurogénica, la inyección de toxina botulínica en el esfínter uretral o en el piso pélvico continúa siendo un tratamiento prometedor7,8.
El objetivo del presente trabajo es evaluar la mejoría en los síntomas y los parámetros de la uroflujometría con el uso de toxina botulínica, en el manejo de la DDE en pacientes pediátricos con vejiga neurogénica.
Material y métodos
Estudio descriptivo, retrospectivo y transversal para determinar el impacto clínico del uso de toxina botulínica tipo A, en el manejo de la DDE en pacientes pediátricos con vejiga neurogénica. El universo de estudio fueron los pacientes atendidos en el Servicio de urología del Instituto Nacional de Pediatría con diagnóstico de vejiga neurogénica y DDE, tratados con inyección endoscópica de toxina botulínica tipo A.
Se evaluaron en etapa pre y postaplicación de toxina botulínica, los siguientes signos y síntomas: urgencia urinaria, escapes parciales diurnos de orina, incontinencia urinaria total, episodios de retención aguda de orina, tenesmo urinario, escapes nocturnos de orina e infecciones urinarias de repetición. En todos se realizó ultrasonido renal, cistouretrografía miccional, examen general de orina, urocultivo, así como uroflujometría con electromiografía del EUE, antes y después de la aplicación de toxina botulínica tipo A.
Resultados
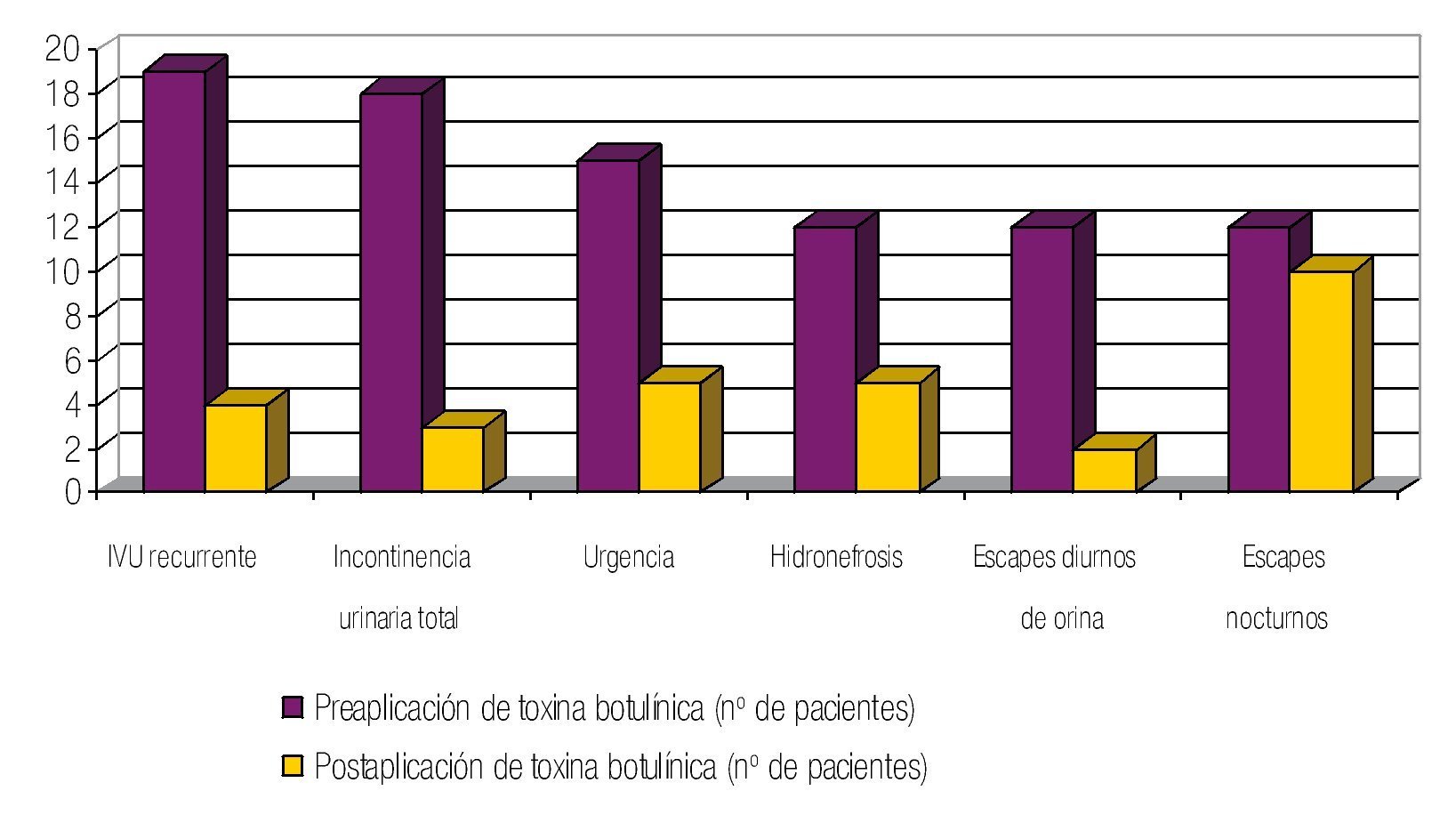
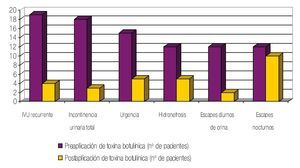
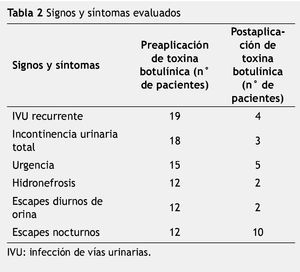
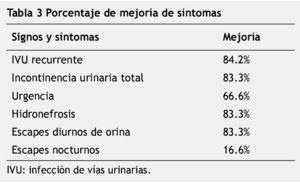
Se revisaron los expedientes de 155 casos vistos en la Consulta Externa de urología, catalogados como vejiga neurogénica. Treinta y ocho pacientes mostraron DDE. Dieciséis fueron hombres y 22 mujeres; edad promedio de 9.3 años (rango de 1 a 19 años) (tabla 1). A todos los pacientes estudiados se les aplicó 100u de toxina botulínica tipo A en el EUE. De los signos y síntomas evaluados el más frecuente fue la infección de vías urinarias de repetición con un total de 19 casos, seguido por incontinencia urinaria total en 18, urgencia urinaria en 15, hidronefrosis en 12, pérdidas urinarias diurnas en 12 y pérdidas urinarias nocturnas en 12 pacientes (fig. 1) (tabla 2). Posterior a la aplicación de toxina botulínica, se observó la siguiente respuesta: la infección de vías urinarias se resolvió en 15 pacientes (84.2%), incontinencia total en 15 (83.3%), hidronefrosis en 10 (83.3%), urgencia urinaria en 10 (66.6%), escapes nocturnos en 2 (16.6%) y escapes diurnos en 10 (83.3%) (tabla 3). De los síntomas menos frecuentes, la retención aguda de orina y el tenesmo se resolvieron en 100% de los casos, y la polaquiuria en 50%.
Figura 1 Signos y síntomas evaluados.
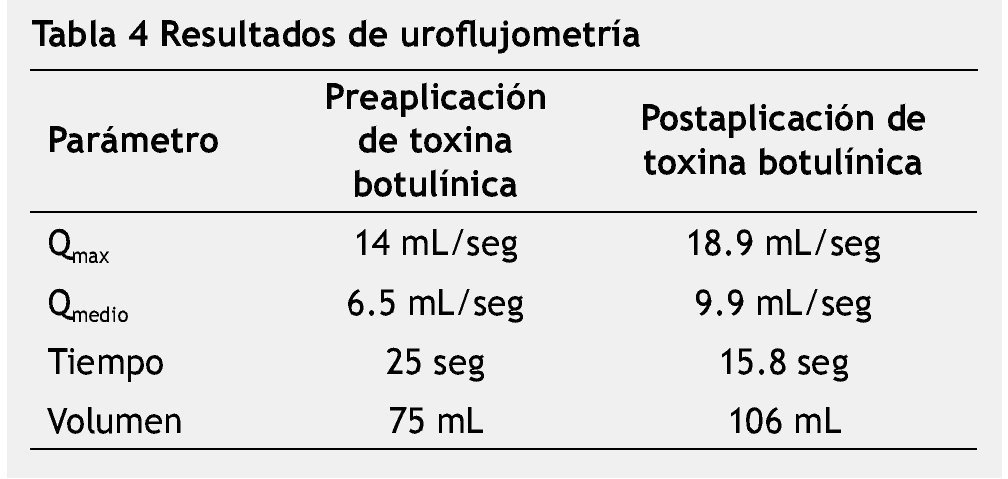
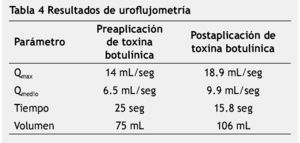
Los parámetros evaluados durante la uroflujometría fueron el Qmax, Qmedio, tiempo y volumen miccionado. En la etapa preaplicación de toxina botulínica, el resultado promedio en Qmax fue de 14 ml/seg (1.9-35 ml/seg), el Qmedio de 6.5 ml/seg (1.1-13.4 ml/seg), el tiempo de micción de 25 segundos (15-46 segundos) y el volumen miccionado de 75 ml (11-208 ml). Posterior a la aplicación de toxina botulínica, los resultados fueron los siguientes: Qmax de 18.9 ml/seg (7.4-35.3 ml/seg), Qmedio de 9.9 ml/seg (2.5-18 ml/seg), tiempo de 15.8 segundos (5-31 segundos) y volumen de 106 ml (50-196 ml) (tabla 4).
No hubo efectos colaterales debido al fármaco en ningún caso.
Discusión
La DDE es un patrón miccional en lesionados medulares con niveles por encima del sacro. Trae consecuencias gra ves para el tracto urinario inferior y superior derivadas de las altas presiones intravesicales y residuos posmiccionales, así como síntomas molestos para los pacientes como la incontinencia urinaria y la dependencia, y otros potencialmente mortales como los episodios de disreflexia. Un tratamiento inadecuado puede llevar a perpetuar esta situación con sus consecuencias devastadoras para todo el tracto urinario9. La primera línea de tratamiento para pacientes con DDE con siste en disminuir los residuos y las presiones intravesicales con cateterismos intermitentes, así como las contracciones involuntarias del detrusor con el uso de anticolinérgicos. Desafortunadamente, no todos los pacientes se adhieren adecuadamente a este tratamiento por diferentes razones, que van desde dificultades en el paso de las sondas por trauma uretral o inhabilidad manual, hasta intolerancia a los medicamentos. Algunos siguen estricta y ade cuadamente las pautas de tratamiento, pero a pesar de esto las complicaciones aparecen y en muchas ocasiones persisten en el tiempo. Hasta 50% tienen infecciones sintomáticas cuya inci dencia aumenta con el tiempo, la tercera parte de los hombres y 5% de las mujeres tienen sangrado a largo plazo. La estrechez uretral aumenta con el seguimiento y la mayoría de los casos se presentan después de los primeros 5 años, cerca de un 15% de pacientes con alteraciones uretrales que dificultan el catete rismo, 2% a 4% requieren manejo quirúrgico9-11.
Desde hace más de 20 años contamos con la toxina botulínica tipo A en el tratamiento de la DDE. Si bien, no es el método de primera línea en estos pacientes, se convierte en una muy buena opción en aquellos que no son candidatos o en los que han fallado otros planteamientos terapéuticos. Esta potente toxina, producto del Clostridium botulinum, fue aprobada inicialmente para usos faciales y estéticos11. Hoy en día, los urólogos la hemos adoptado no sólo para la micción no coordinada sino también para el tratamiento de la hiperactividad del detrusor, cistitis intersticial, retención urinaria y patologías prostáticas; con buenos resultados a pesar de no estar aprobada su aplicación en tracto urinario inferior por la FDA12.
A pesar de tratarse de un procedimiento mínimamente invasivo con un perfil de seguridad excelente, se han reportado síntomas ir ritativos miccionales o hematuria y raramente debilidad generalizada, disfagia, diplopía, visión borrosa, boca seca y malestar general13. En nuestra serie no tuvimos ninguna complicación mayor.
En general, observamos una notable mejoría de la sintomatología y las infecciones de repetición, similar a los reportes de la literatura médica, así como una mejoría en el patrón de la uroflujometría posterior a la aplicación de toxina botulínica en el EUE.
Encontramos como una limitación de nuestro estudio, el constituir una serie de casos analizados en forma retrospectiva, sin embargo y como principal aportación hallamos que es la serie más grande de casos reportados en la literatura médica en México.
Conclusiones
La aplicación de toxina botulínica en el EUE como tratamiento para la DDE es una opción técnicamente reproducible, efectiva y segura, con resultados favorables para el control de los síntomas y el restablecimiento del desequilibrio funcional, que repercuten en el funcionamiento de tracto urinario superior.
Financiamiento
No se recibió ningún patrocinio para llevar a cabo este artículo.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses.
* Autor para correspondencia:
Calzada de Tlalpan N° 4800, Colonia Sección XVI,
Delegación Tlalpan, C.P. 14080, México D.F., México.
Teléfono: 4000 3044, ext. 3298.
Correo electrónico: doctorangel25@hotmail.com (J.A. Martínez).