Introduction: Prostate cancer is the second cause of death from cancer in men worldwide. Various cytochromes in this disease are being studied, but there are few reports in the literature on cytochromes CYP4F11 and CYP8A1. In the present study, the presence of CYP4F11 and CYP8A1 was investigated in prostate cancer and in benign prostatic hyperplasia.
Material and method: Thirty-two hyperplasia and thirty-two cancer samples were obtained and conditions were standardized to detect the presence of CYP4F11 and CYP8A1 in the tissues by means of immunohistochemistry.
Results: CYP4F11 and CYP8A1 were expressed in prostate cancer but not in benign prostatic hyperplasia.
Conclusions: These results suggest that CYP4F11 and CYP8A1 could be used as prognostic and/or early detection factors, by carrying out biopsies in patients suspected of having prostate cancer.
Introducción: El cáncer de próstata (CaP) es la segunda causa de muerte en hombres, por cáncer a nivel mundial. Se están estudiando varios citocromos en CaP. Para el caso del CYP4F11 Y 8A1, existen pocos estudios en la literatura. En este estudio, se determinó la presencia del CYP4F11 y 8A1 en CaP e hiperplasia prostática benigna (HPB).
Material y método: Se obtuvieron 32 muestras de HPB y 32 de CaP. Se estandarizaron las condiciones, para detectar por inmunohistoquímica la presencia de CYP4F11 y CYP8A1 en los tejidos.
Resultados: El CYP4F11 y 8A1 no se expresaron en HPB.
Conclusiones: Los resultados anteriores sugieren que CYP4F11 y 8A1 podrían ser utilizados como factores pronósticos y/o detección temprana, realizando estudios en biopsias de pacientes sospechosos de CaP.
¿ INTRODUCCIÓN
El cáncer de próstata (CaP) es la segunda causa de muerte en hombres, por neoplasias a nivel mundial, siendo la primera el cáncer de pulmón.1 En México, las tres principales causas de muerte por tumores malignos en el año del 2009, correspondieron a próstata (17.1%), tráquea, bronquios y pulmón (16.6%) y estómago (10.4%).2 La hiperplasia prostática benigna (HPB) es una enfermedad caracterizada por aumento de las células epiteliales y estromales, en el área periuretral de la próstata, que se desarrolla en la zona transicional.3 Se desconocen las causas específicas que determinan el inicio y la progresión del CaP, sin embargo, se atribuyen factores genéticos y ambientales en la evolución de esta enfermedad.4 El comienzo y la progresión de CaP están influidos por los andrógenos.5
El sistema citocromo p450 (CYP450) es una enorme y diversa superfamilia de proteínas, que en el hombre están asociadas a la membrana mitocondrial y del retículo endoplásmico, donde actúan metabolizando cientos de sustancias endógenas y exógenas.6 Mediante una combinación de investigación de cDNA y amplificación rápida del mismo, se determinó el análisis y secuenciación de una nueva isoforma del citocromo p450 human, de la subfamilia 4F. La isoforma 4F se designa CYP4F11 y se expresa principalmente en el hígado humano, seguido por el riñón, corazón y músculo esquelético.7
Los CYP450 tienen un papel central en el metabolismo oxidante de xenobióticos, incluidos los medicamentos contra el cáncer, los agentes cancerígenos y compuestos endógenos.8 Varias estrategias terapéuticas están siendo desarrolladas para aprovechar la presencia, la sobreexpresión y la actividad del sistema p450 en tumores.9
Por ser el CYP4F11 un citocromo de reciente descubrimiento, los estudios en los que se han empleado son de número reducido, más aún aquellos en los que buscan su presencia en algún tipo de cáncer. Existen a la fecha un par de estudios en los que han buscado la expresión de CYP4F11, en cáncer de colon y ovario.
En el cáncer colorrectal en comparación con el colon normal, la mayor inmunoreactividad fue para CYP2S1 de la tinción inmunohistoquímica. Mientras que CYP1A1, CYP2F1, CYP2R1, CYP4F11, CYP4V2, y CYP4Z1 en más del 80% de los núcleos fueron negativos para estos citocromos.10
En el cáncer de ovario no se encontró la expresión proteica de CYP1A1, CYP4F11, CYP24 y CYP39, en comparación con ovario normal.11
En cuanto al CYP8A1, la primera ocasión en la que fue reportada la existencia de este citocromo fue en el año de 1994, por Yokoyama y colaboradores mediante un estudio descriptivo del gen humano para la codificación de la prostaciclina sintasa (PGIS). La función de este gen consiste en la síntesis de prostaglandina I2, a partir de prostaglandina H2, jugando un papel en el proceso inflamatorio.12
Después en el año 2001, Chevalier y colaboradores reportaron sobre variantes alélicas que afectan la región que codifica para CYP8A1, las cuales causan cambios en los aminoácidos, sin que aún existan análisis sobre estas variantes en el riesgo al cáncer.13
De acuerdo con lo anterior, el objetivo del presente estudio fue detectar, por primera vez, la expresión de CYP4F11 y 8A1 en CaP e HPB.
¿ MATERIAL Y MÉTODO
Sujetos de estudio: Se sometieron a estudio 64 tejidos de pacientes registrados en la libreta de intervención quirúrgica, de la Sala de Urología del Hospital Central Militar, dentro del periodo comprendido entre el año 2008 al 2011, de acuerdo con los criterios de inclusión y no inclusión.
Criterios de inclusión: 1) Tejido de pacientes con diagnóstico histopatológico de CaP. 2) Tejidos de pacientes con diagnóstico de HPB, analizados en el Departamento de Patología, dentro del periodo comprendido entre el año 2008 al 2011.
Criterios de no inclusión: 1) Tejidos de pacientes con diagnóstico de CaP, que hayan sido obtenidos por cualquier otro procedimiento, que no sea prostatectomía radical. 2) Tejidos de pacientes con diagnóstico de HPB obtenidos por biopsia.
TIPO DE ESTUDIO:
Inmunohistoquímica: Por microscopía de luz, las muestras de tejidos de CaP y HPB fueron fijadas por inmersión en formalina (pH=7.4) y se embebieron en parafina. Para el análisis histológico, secciones de tejido (3 mm) fueron teñidas con hematoxilina y eosina (H&E). Las secciones de tejido fueron teñidas con ácido periódico de Shiff`s (PAS) para mostrar los polisacáridos, mucopolisacáridos y glicoproteínas de la membrana celular.
Los cortes fueron incubados con ácido peryódico, durante cinco minutos y lavados con agua destilada. Los cortes fueron incubados con el reactivo de Schiff`s durante cinco minutos y contrateñidos, con H&E por 30 segundos. El perfil histológico de cinco campos seleccionados aleatoriamente fueron registrados utilizando el software KS-300 (Carl Zeiss®, Jena, Germany). El porcentaje de área dañada con alteraciones histopatológicas fue obtenido (magnificación 400x). Para la inmunohistoquímica, las secciones de tejido (3 mm) se desparafinaron y se calentaron para desenmascarar los sitios antigénicos. La actividad endógena de la peroxidasa fue bloqueada con 0.03% de H2O2, en metanol absoluto. Las secciones de tejido fueron incubadas toda la noche a 4ºC, a una dilución 1:100 de anti-CYP4F11 y a una dilución 1:50, para anti-CYP8A1 en solución TRIS. Se removió el anticuerpo primario y se realizaron dos lavados repetitivos con TRIS, los cortes fueron incubados con una dilución 1:500 de anticuerpo policlonal de conejo, como anticuerpo secundario y se realizaron dos lavados repetitivos con TRIS. Los anticuerpos unidos se detectaron con el complejo avidina-biotina (ABC-kit Vectatastain) y la diaminobenzidina, como sustrato. Después de lavar repetidamente con TRIS, los cortes fueron contrateñidos con H&E.
Todos los cortes fueron incubados bajo las mismas condiciones, con igual concentración de anticuerpo y en la misma corrida, por lo tanto, la inmunotinción fue comparable. Todos los especímenes fueron examinados por el microscopio de luz Axiovert 200M (Carl Zeiss®, Jena, Germany). Para el análisis morfométrico automatizado, el porcentaje de células positivas (color marrón) se determinaron con un analizador de imágenes computarizado KS-300 3.0 (Carl Zeiss®, Jena, Germany). Este equipo detecta automáticamente las células positivas, determinando su porcentaje por campo. Cinco campos aleatorios fueron estudiados a una magnificación de 100 (área total 1 584 000 m2). Los resultados fueron expresados como porcentaje.
¿ RESULTADOS
Los pacientes con CaP tuvieron un antígeno prostático específico (APE) de 9.62, y una edad promedio de 65.8 años. Los pacientes con HPB tuvieron una APE de 7.91, y una edad promedio de 68.5 años.
De los pacientes con CaP, 6% presentaron un Gleason de puntuación tres, 3% un Gleason de puntuación cuatro, 40% un Gleason con puntuación seis, 36% un Gleason de puntuación siete y 15% un Gleason de ocho.
Respecto a la categoría de las edades, que presentó con mayor frecuencia CaP en este estudio fue de 66-75 años con un 38%, seguido del rango de 56-65 años con 34%.
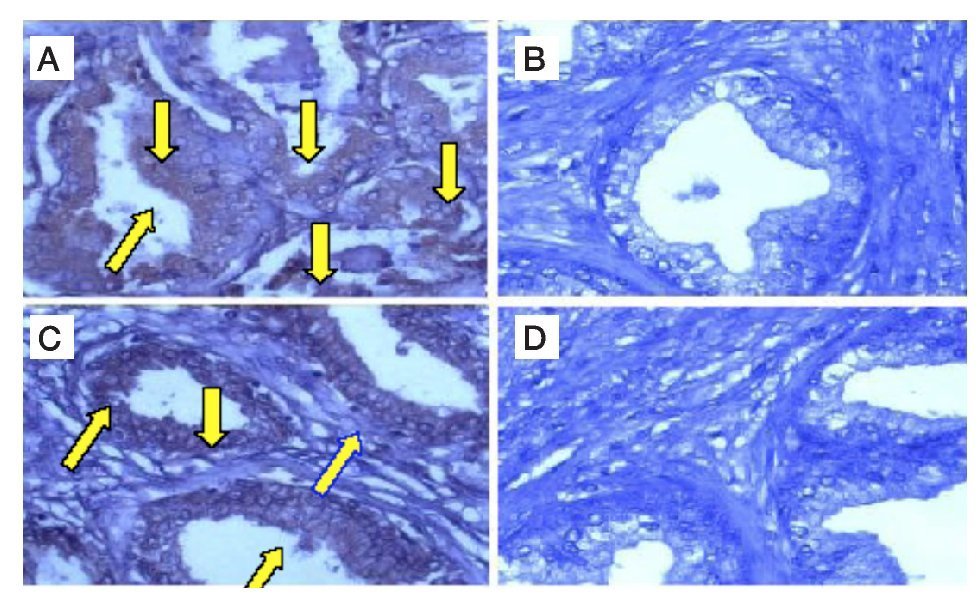
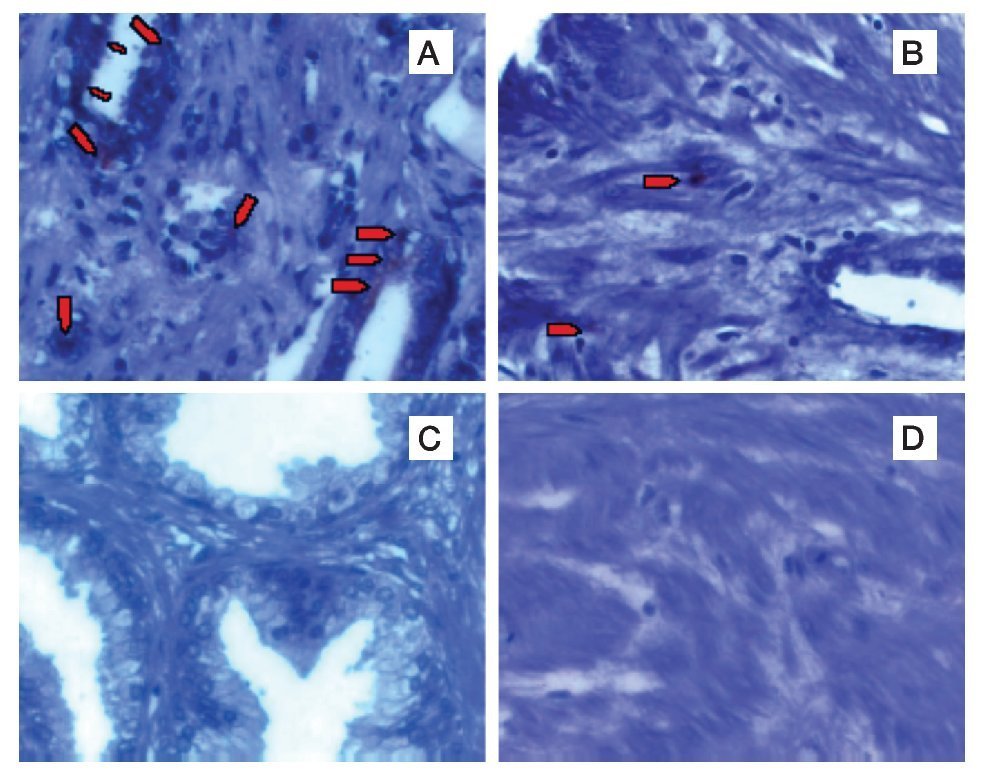
Se detectó la presencia de CYP4F11 y de CYP8A1, por primera vez en CaP en comparación con tejido hiperplásico, en donde no se observó su presencia (Figuras 1 y 2).
Figura 1. Determinación por inmunohistoquímica de la presencia de CYP4F11 en la glándula y estroma, en CaP y HPB. Glándula de CaP A). Glándula de HPB B). Estroma de CaP C) y Estroma de HPB D).
Figura 2. Determinación por inmunohistoquímica de la presencia de CYP8A1 en la glándula y estroma, en CaP y HPB. Glándula de CaP A). Estroma de CaP B). Glándula de HPB C) y estroma de HPB D).
¿ DISCUSIÓN
Con base en estudios previos es posible observar, que sólo se ha detectado la expresión de los CYP4F11 y 8A1 en algunos tejidos del organismo humano.11-14 No obstante, en esta investigación se demostró por primera vez la expresión de estos citocromos (CYP4F11, CYP8A1) en CaP. Sobre esto último, podemos sugerir que probablemente tenga un rol en la regulación de los procesos inflamatorios, dado que ya se demostró el papel de TNF-α y la interleucina 1α y el papel de la enzima en el metabolismo de leucotrienos. Por otro lado, dado su papel en la detoxificación de ácidos hidroxiperoxi eicosatetraenóicos (HETES), subproductos de la lipoperoxidación, y que también el factor de transcripción AP-1 está involucrado en la expresión de su gen.11
El CYP8A1 (conocido como prostaciclina I2 sintasa) está conformado por 1 500 nucleótidos, que codifican para una proteína de 500 aminoácidos localizada en el cromosoma 20q13.13. Este CYP no posee la típica actividad de monooxigenasa de los otros, ya que cataliza el rearreglo de prostaglandina H2 (PGH2) a prostaglandina I2 (PGI2). El CYP8A1 posee un residuo de Tyr 430, que es nitrado por peroxinitrito, el cual resulta en la inhibición de la actividad catalítica de este CYP.15,16
Este CYP se expresa constitutivamente y puede ser sobreregulado por citocinas, hormonas reproductivas y factores de crecimiento. Además, CYP8A1 puede acoplarse funcionalmente con ciclooxigenasas (COX) y fosfolipasas.17
Con respecto al papel del CYP8A1 en la carcinogénesis, Frigola y colaboradores en 2005 encontraron una hipermetilación en el promotor de CYP8A1, en cáncer colorrectal.18 Poole y colaboradores en 2006, encontraron que seis repeticiones polimórficas en los alelos de CYP8A1 (<6R/<6R) se asociaron con un riesgo en el incremento de pólipos colorrectales, en comparación con el genotipo silvestre (6R/6R).19
Stearman y colaboradores en 2007, y Nemenorff y colaboradores en 2008, mencionan la importancia de la vía del ácido araquidónico en cáncer de colon y pulmón, así como en otras enfermedades inflamatorias. En el caso de las neoplasias de pulmón, se observa que este CYP (8A1) se encuentra regulado en forma específica. En ratones transgénicos con sobreexpresión de CYP8A1 se ha visto una protección contra carcinógenos del humo de tabaco, que inducen la formación tumoral en pulmón, por lo que tendría un papel en la quimioprevención.20,21
Por otro lado, Kajita y colaboradores en 2005 analizaron la expresión del ARNm de COX-2, tromboxano A2 (TXA2) y CYP8A1 por reacción en cadena de la polimerasa en tiempo real, en carcinoma papilar tiroideo y en tejidos normales. En este estudio se incrementó de manera significativa TXA2, no hubo diferencias en COX-2 y de manera importante se incrementó CYP8A1.22
En nuestro estudio, al analizar la presencia por inmunohistoquímica de CYP8A1 y 4F11 en tejidos con CaP, encontramos la presencia de estas proteínas, así como su ausencia en tejidos con HPB. Los resultados sugieren que los porcentajes de área marcada para este CYP fueron más elevados y frecuentes, conforme aumenta la edad, Gleason y APE.
De acuerdo con las evidencias anteriores, probablemente CYP4F11 y CYP8A1 tengan un papel regulatorio en el estrés oxidante durante la transformación de las células normales a cancerosas en la próstata, sobre todo porque este último está involucrado en la vía inflamatoria.
¿ CONCLUSIONES
En este estudio demostramos que el CYP4F11 y 8A1, se expresan en tejidos con CaP y no en tejidos con HPB. Este hallazgo nos podría indicar que las células tumorales en el CaP, se encuentran reguladas en cierta parte por el metabolismo endógeno y de xenobióticos, así como por el estrés oxidante, dado la participación del sistema CYP450 en estos fenómenos.
Lo anterior puede generar cambios genéticos continuos, que se manifiestan como un aumento en las anormalidades cromosómicas y en las mutaciones, lo que a su vez puede propiciar la génesis y propagación tumoral. Con los resultados obtenidos se podría sugerir, que el CYP4F11 y 8A1 pueden ser empleados como marcadores de detección temprana y/o seguimiento o como factores pronósticos en pacientes con CaP. Sin embargo están justificados estudios posteriores que aclaren el papel de la quimioprevención de estos citocromos, para alargar la aparición clínica del CaP a lo largo de la vida del paciente, o bien para que sean utilizados como verdaderos factores pronósticos.
¿ AGRADECIMIENTOS
Este trabajo fue realizado con fondos de CONACYT (proyecto: SALUD- 2010-01-140535, del Fondo Sectorial de Investigación en Salud y Seguridad Social) y por el IPN (SAPPI, Proyecto SIP: 20113894). LAOA beca No.241493 y CRB beca No.265693 por el CONACYT. PIFI (IPN) No. 3387, 3391 y 3357; CAVJ, SAPM y JJMH. Se le Agradece a la Fundación Gonzalo Río Arronte IAP, México, por la donación del Microscopio Confocal Axiovert 200 M.
Correspondencia: Dr. Esaú Floriano Sánchez.
Sección de Posgrado e Investigación, Escuela Superior de Medicina, IPN. Plan de San Luis y Díaz Mirón. Col. Casco de Santo Tomas, Miguel Hidalgo. C.P. 11340. México D.F., México.
Celular: 553855 2702.
Correo electrónico:floriano_esa@yahoo.com