¿ INTRODUCCIÓN
El cáncer de próstata es el cáncer no cutáneo más frecuente y la segunda causa de muerte por cáncer en los hombres de Estados Unidos; se estima que en 2006 se diagnosticaron más de 234 000 pacientes con cáncer de próstata y en más de 27 000, fue la causa de muerte.1,2 Dada su prevalencia en muchos países y su amplio espectro de malignidad, se han establecido distintos métodos de tratamiento, lo cual ha favorecido la controversia acerca del método de detección y tratamiento preferido. La prevalencia del cáncer de próstata aumenta notablemente con la edad. En estudios de autopsia se documentó la presencia de focos microscópicos en cerca de un cuarto o un tercio de los hombres entre la cuarta y la quinta década de la vida; y en más de tres cuartas partes en la novena década. En México, con base en el Registro Histopatológico de Neoplasias de 1997, ocupó el tercer lugar entre éstas en general, con una distribución de 6%, por detrás del carcinoma cervicouterino y de mama; sin embargo, al separar por sexo los casos de neoplasias, esta enfermedad se sitúa en el primer lugar de los carcinomas que afectan a los hombres, con 17%.3 El carcinoma de próstata se origina en la zona periférica de la glándula prostática hasta en 80% de los casos; por lo tanto, en las etapas iníciales de la enfermedad, éste no da sintomatología obstructiva urinaria, lo que establece que hasta 60% de los casos diagnosticados por primera vez, estén en etapas clínicas avanzadas.4
La evolución natural del cáncer de próstata varía desde la enfermedad indolente asintomática durante toda la vida del paciente, hasta el cáncer de alto grado de agresividad que da metástasis rápidamente y lleva a la muerte con gran sufrimiento. El desafío para el médico es saber aconsejar el tratamiento efectivo en aquellos pacientes que lo requieren. En la elección del tratamiento adecuado se debe evaluar el potencial de malignidad del tumor y el estado general de salud, la expectativa de vida y las preferencias de calidad de vida del paciente.
El tratamiento del carcinoma prostático que se encuentra en etapa clínica confinada al órgano tiene como objetivo primordial quitar el tumor y mantener al paciente libre de enfermedad; para esto, se utilizan diferentes opciones de manejo: a) Prostatectomía radical, que consiste en la excéresis total de la glándula prostática junto con ambas vesículas seminales, así como de la porción ampular de los conductos deferentes;5-7 b) radioterapia externa o teleterapia;8,9 c) implante de semillas radiactivas en el órgano, o braquiterapia.10 y d) manejo conservador, que implica la vigilancia del paciente y su tratamiento cuando la sintomatología lo amerita.11,12
La prostatectomía radical es uno de los tratamientos curativos más practicado en los centros urooncológicos de los países desarrollados ya que ha demostrado buenos resultados en manos expertas;13,14 sin embargo, también se le ha criticado y señalado como un tratamiento agresivo, por lo que se ofrecen otras opciones de manejo, como las ya mencionadas. Los intentos por comparar la eficacia de la cirugía y la radioterapia son motivo de controversia debido a diferencias en la selección de los pacientes, la estadificación clínica y patológica y el estudio de las fallas del tratamiento.8,9
En nuestro país, esta alternativa de tratamiento se utiliza en forma rutinaria desde hace pocos años, sólo en algunas instituciones,15-17 debido en parte al mejoramiento de los métodos de diagnóstico, lo que permite identificar el padecimiento en etapas tempranas, pero también al interés del personal médico urológico por dominar esta técnica.18
En este trabajo, ejercimos un análisis sobre los resultados de la serie inicial de pacientes sometidos a esta modalidad terapéutica en el Servicio de Urología del Centro Médico del Instituto de Seguridad Social del Estado de México y Municipios (ISSEMyM).
¿ MÉTODOS
Universo de trabajo: Se revisaron los expedientes de enfermos con diagnóstico histopatológico corroborado de adenocarcinoma de próstata y con estadio clínico confinado al órgano, tratados en forma primaria con prostatectomía radical durante el periodo comprendido de noviembre de 2004 a julio de 2009 en nuestro servicio.
Estadificación de la neoplasia. Se determinó en cada paciente mediante exploración clínica completa, incluyendo un examen rectal digital. Antes de la cirugía, a todos se les efectuaron exámenes básicos de laboratorio y gabinete: biometría hemática, química sanguínea, pruebas de coagulación, determinación sérica de antígeno prostático específico (APE), ultrasonido transrectal de la próstata con biopsia de la misma.
La enfermedad sistémica fue excluida en algunos pacientes con valores de APE superiores a 20 ng/dL, con base en un gamagrama óseo con Tc99 negativo. A algunos enfermos se les efectuó tomografía axial computarizada. El sistema de estadificación clínica utilizado fue el de la Unión Internacional Contra el Cáncer (UICC) TNM de 199720 de la siguiente manera:
Tx: No se puede evaluar el tumor primario, T0: sin pruebas de tumor primario, T1: Tumor no palpable ni visible mediante técnicas de imagen, T1a: Tumor detectado como hallazgo fortuito en resección transuretral menor o igual a 5% del tejido resecado, T1b: Tumor detectado como hallazgo fortuito en resección transuretral mayor de 5% del tejido resecado, T1c: Tumor identificado mediante punción por biopsia (por ejemplo a consecuencia de un PSA elevado), T2: Tumor palpable limitado a la próstata, T2a: El tumor que afecta a menos de la mitad de un lóbulo, T2b: El tumor abarca más de la mitad de un lóbulo pero no ambos lóbulos, T2c: El tumor que afecta a más de un lóbulo, T3: Tumor es palpable mas allá de la próstata, T3a: Extensión extracapsular unilateral, T3b: extensión extracapsular bilateral, T3c: Tumor que invade la/s vesícula/s seminal/ es, T4: Tumor fijo o que invade estructuras adyacentes distintas de las vesículas seminales, T4a: El tumor invade cuello vesical, el músculo del esfínter externo, recto,T4b: el tumor invade el musculo elevador del ano o esta fijo a pared pélvica.
Los sujetos que clínicamente presentaron una estadificación entre T1a y T2c fueron clasificados como pacientes con enfermedad confinada al órgano; mientras que los que tuvieron estadio T3a o mayor fueron catalogados como pacientes con enfermedad localmente avanzada.
Gradación. El resultado histopatológico de la biopsia se expresó con base en el sistema de gradación de Gleason,19 el cual utiliza una escala de acuerdo a la diferenciación glandular del tumor, con un mínimo de 1 y un máximo de 5. La suma de Gleason expresa la suma de la zona más diferenciada del tumor, más la zona menos diferenciada del mismo.
El resultado indica el grado de diferenciación glandular del tumor: una suma de 2-4 representa un tumor bien diferenciado, de 5-7 moderadamente diferenciado y de 8-10 poco diferenciado.
Estadio patológico. Fue establecido con base en el Sistema de la Unión Internacional Contra el Cáncer (UICC) TNM de 1997,20 de acuerdo con el análisis histopatológico de la pieza quirúrgica.
Seguimiento. Se efectuó mediante visitas trimestrales el primer año del periodo postoperatorio, durante las cuales se efectuaron: exploración física y determinación del antígeno prostático específico.
Enfermedad residual y progresión de la enfermedad. Se determinó como enfermedad residual cuando los pacientes presentaron: 1) márgenes quirúrgicos positivos, 2) cifras séricas del antígeno prostático específico postoperatorio por arriba del estándar (0.2 ng/mL) después de la prostatectomía.
Se consideró como progresión de la enfermedad cuando los pacientes presentaron: 1) exploración física rectal con masa palpable postoperatoria, 2) elevación del valor del APE después de un control normal.
Complicaciones. Fueron catalogadas en inmediatas y tardías. Las inmediatas incluyeron: sangrado transoperatorio, lesiones de órganos adyacentes, infección de la herida quirúrgica, fuga de la cistotomía; las tardías: impotencia, incontinencia o estenosis de la unión uretrovesical.
¿ RESULTADOS
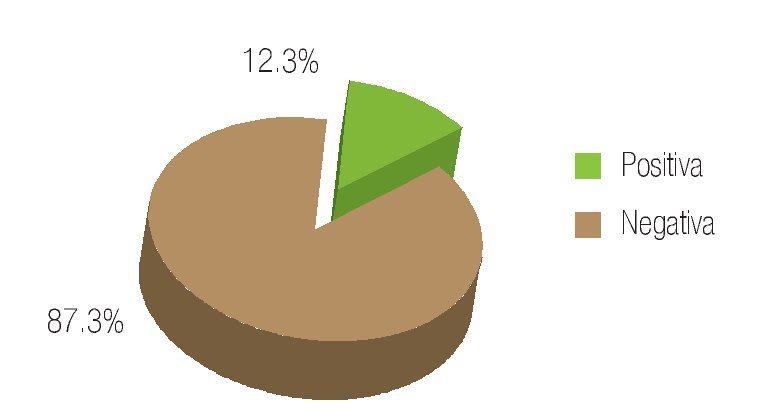
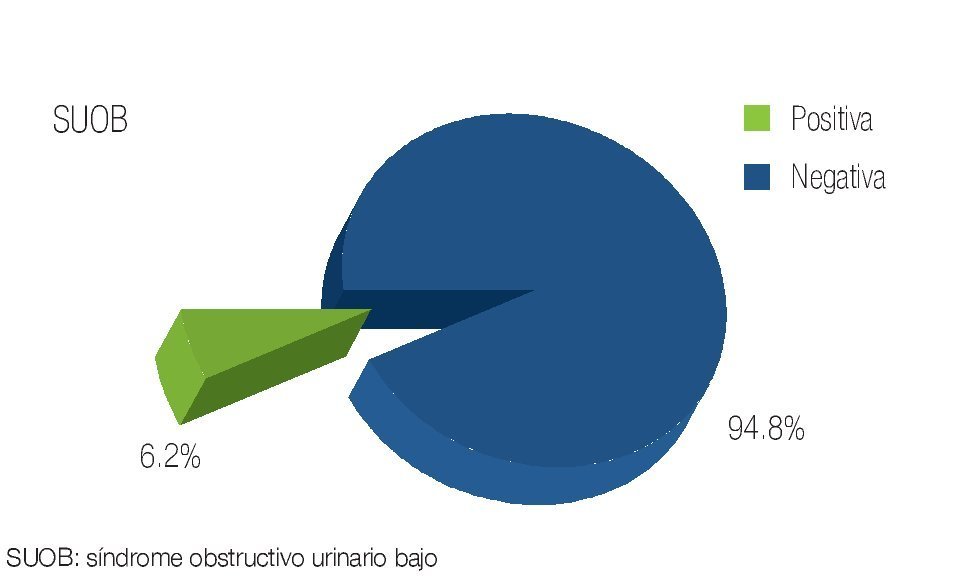
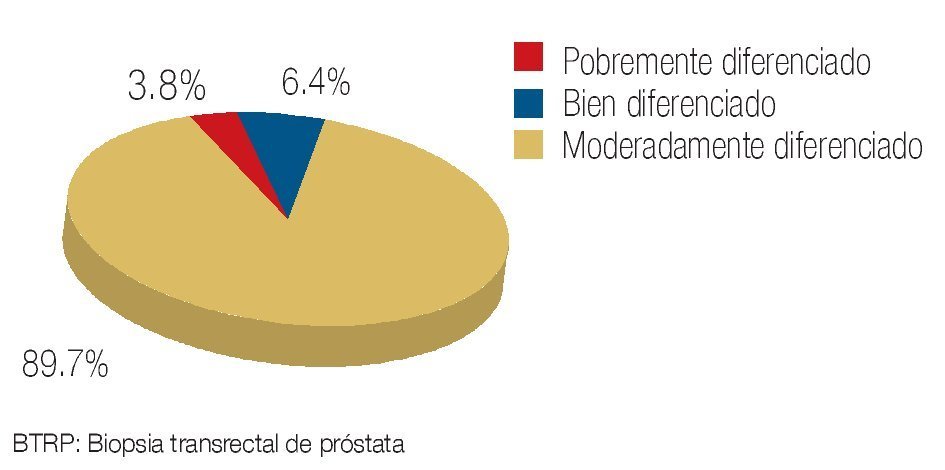
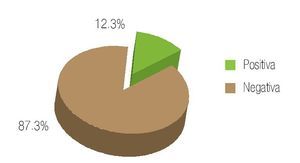
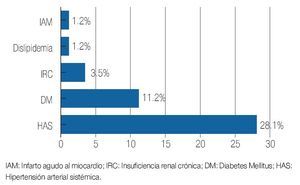
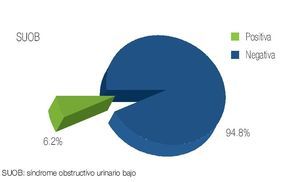
Se revisaron un total de 81 expedientes, de los cuales sólo se incluyeron 78 que se encontraban completos y contaban con un seguimiento adecuado en sus consultas postquirúrgicas. La edad promedio de los pacientes fue de 63.7 años con un rango de 49 a 78 años de edad. De los pacientes incluidos, 12.7% contaba con carga genética positiva para adenocarcinoma prostático, mientras que 87.3% negó este antecedente (Imagen 1). De los antecedentes de importancia, 29.5% tenía historia de tabaquismo positivo. En función de la comorbilidad asociada, se evidenció: hipertensión arterial en 28.1% de los pacientes, diabetes mellitus en 11.2%, insuficiencia renal crónica en 3.5%, antecedente de infarto agudo en 1.2%, y dislipidemia en 1.2% (Imagen 2). De los pacientes incluidos en el estudio, 74 (94.8%) refirieron sintomatología obstructiva baja en la entrevista clínica (Imagen 3). El valor promedio del antígeno prostático específico pre quirúrgico, fue de 9.2 ng/mL, con un rango de 4.3 a 21.2 ng/mL; postquirúrgico de 0.2, con un rango de 0.003 a 1.2 ng/mL (Imagen 4). El APE de 1.2 se registró en un paciente al mes de posoperado, habiéndose considerado como recidiva bioquímica, por lo que requirió manejo adyuvante.Se analizaron los valores prequirúrgicos de Gleason en las biopsias transrectales de próstata; encontrando tumor bien diferenciado (Gleason 2-4) en cinco pacientes (6.4%), moderadamente diferenciado (Gleason 5-7) en 70 (89.7%) y pobremente diferenciado (Gleason 8-10) en tres pacientes (3.84%).
Imagen 1. Carga genética para cáncer de próstata.
Imagen 2. Comorbilidad asociada.
Imagen 3. Pacientes con sintomatología urinaria baja.
Imagen 4. Grado de diferenciación celular histopatológica.
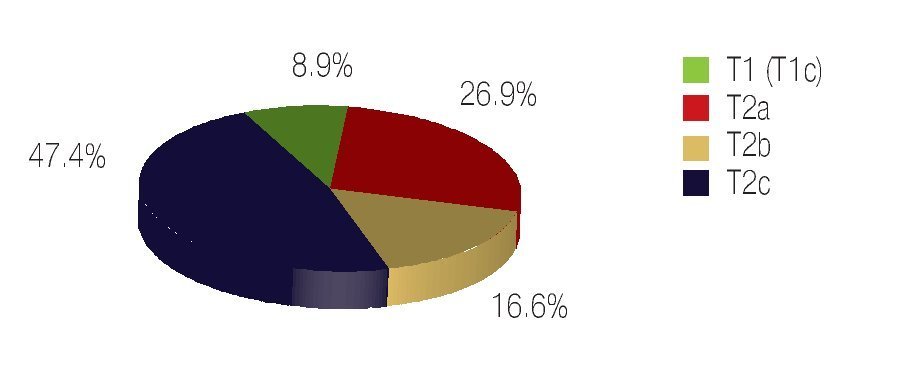
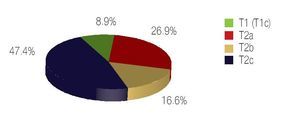
De los 78 pacientes operados incluidos en el presente estudio, 100% fueron catalogados en etapa clínica localizada o confinada al órgano en la etapa prequirúrgica, de éstos, siete pacientes (8.9%), estaban en estadio clínico T1, todos ellos en estadio T1c, el resto (91.02%) se encontró en estadio T2, 21 (26.9%) en T2a, 13 (16.6%) en T2b y 37 (47.4) en T2c, ninguno de los pacientes operados fue clasificado como T3 o T4 (Imagen 5).
Imagen 5. Estadio clínico TNM.
Posterior al análisis histopatológico postquirúrgico se encontró que 67 (85.8%) de los pacientes presentaron tumor confinado al órgano, siete (8.9%) con datos de infiltración periprostática (cuatro con infiltración capsular y tres con invasión a vesículas seminales). De cuatro (5.12%) de los pacientes, el reporte histopatológico final se encontró negativo a enfermedad neoplásica, aunque previamente se contó con biopsia positiva a adenocarcinoma (Imagen 6).
Imagen 6.Reporte histopatológico final, en el que se indica la extensión o localización del tumor.
Se requirió uso de terapia adyuvante en los cuatro casos informados con enfermedad localmente avanzada; dos en estadio T3a y dos en estadio T3b con recidiva bioquímica y se empleó terapia adyuvante en tres pacientes con enfermedad confinada a órgano que durante el seguimiento presentaron recidiva bioquímica.
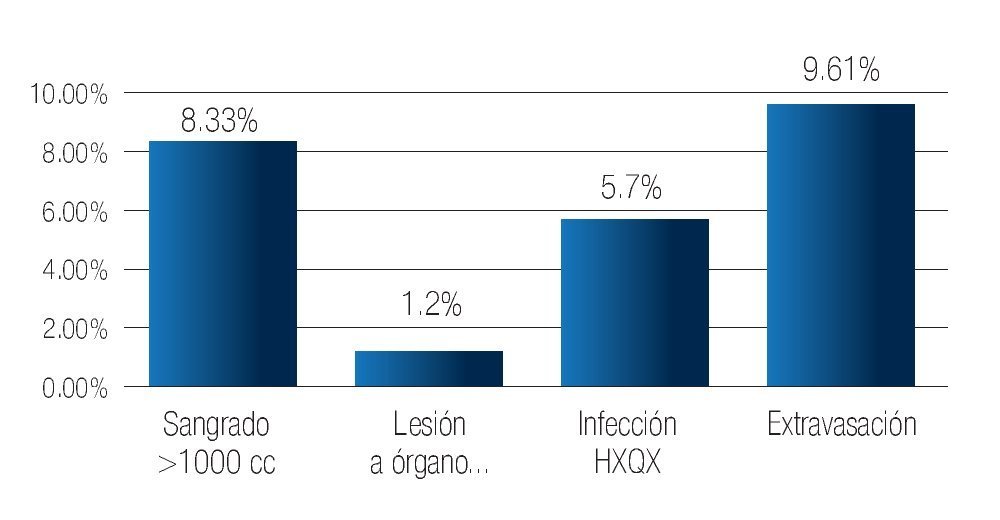
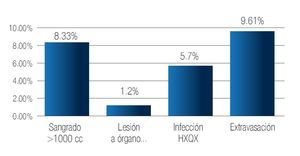
Como complicaciones inmediatas, se cuantificó al sangrado transquirúrgico mayor a 1000 mL en 8.33% de los casos, quienes recibieron transfusión de concentrados globulares. Se documentó lesión de órgano adyacente en un paciente, lo que corresponde a 1.2%, debido a una perforación en la cara anterior del recto, resuelta mediante cierre primario en dos planos, resolviéndose sin más complicaciones. La infección de la herida quirúrgica se presentó en 5.7% de los pacientes, la extravasación de orina a través de la anastomosis se presentó en 9.61% de los pacientes cediendo antes del quinto día de postoperatorio solo con manejo conservador (Imagen 7).
Imagen 7. Complicaciones inmediatas.
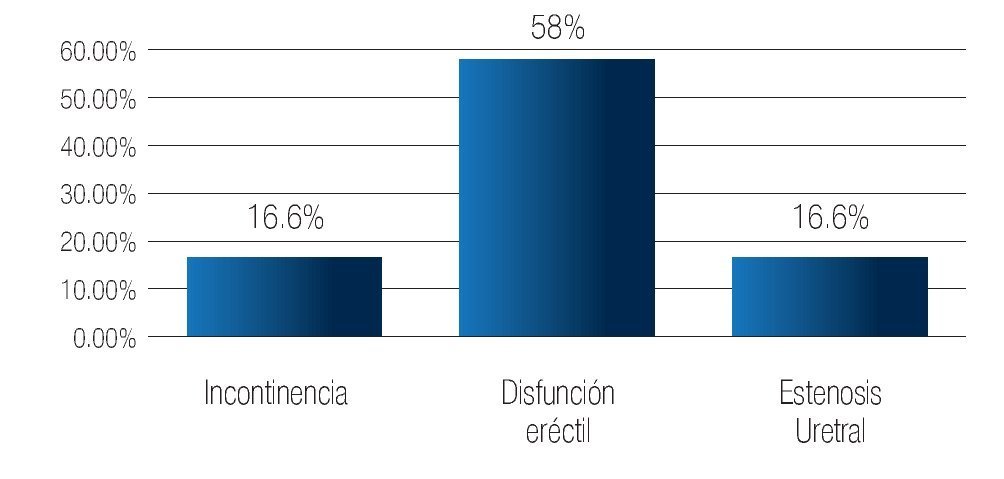
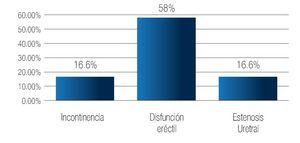
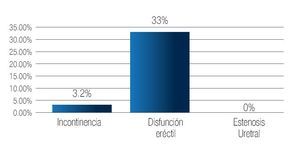
Complicaciones a los 3 meses: La estenosis de uretra se presentó en 13 pacientes (16.6%) y disfunción eréctil en 45 (58%) sujetos. Se registró incontinencia urinaria en 13 (16.6%) de los pacientes (Imagen 8). Las complicaciones al año, fueron: disfunción eréctil en 16 pacientes (33%), e incontinencia urinaria persistente en dos (3.2%) casos (Imagen 9). De los 78 pacientes incluidos en este estudio, no se han registrado defunciones. El seguimiento máximo es de 55 meses.
Imagen 8. Complicaciones a los tres meses.
Imagen 9. Complicaciones al año del posoperatorio.
¿ DISCUSIÓN
La prostatectomía radical es una de las principales opciones terapéuticas para los estadios localizados del carcinoma de próstata. Existen grandes series en las que se analizan los resultados de éste procedimiento a largo plazo, las cuales evidencian las ventajas del procedimiento sobre otras opciones, como la radioterapia, la braquiterapia y la vigilancia sin tratamiento.8-12,14,27
La morbilidad observada en nuestro estudio, es comparable a la registrada en otros trabajos. 21-25
La complicación más frecuente en nuestros pacientes fue la disfunción eréctil posoperatoria; similar a lo observado por autores como Walsh y Catalona.6,25
La continencia urinaria fue evaluada en todos los enfermos durante el estudio. Encontramos un porcentaje de incontinencia urinaria en 3% (dos casos) al año de posoperatorio, cifra comparable a la reportada por otros autores.21 En una extensa revisión de la literatura, Steiner y colaboradores demostraron que la continencia urinaria posterior a la prostatectomía varía de 63% a 96%; mientras que de 0 a 35% presentan incontinencia por urgencia, y de 0 a 17% presentan incontinencia total; esto también fue superado en la medida que se dominó totalmente la técnica. La cantidad de sangrado fue reduciéndose marcadamente conforme se fue teniendo mayor experiencia en el procedimiento.21
En diversos trabajos 22-24 se informa un porcentaje de casos con lesión de recto, que va de 1% a 7%; en nuestra serie, este accidente se presentó sólo en uno de los casos y constituyó 1.2% de las complicaciones.
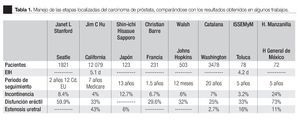
En el Centro Médico del Instituto de Seguridad Social del Estado de México y Municipios, se practica este procedimiento desde finales de 2004 y se ha logrado implementar como una opción terapéutica rutinaria en el manejo de las etapas localizadas del carcinoma de próstata comparándose con los resultados obtenidos en la bibliografía mundial (Tabla 1).
¿ CONCLUSIONES
La prostatectomía radical retropúbica resulta ser un procedimiento efectivo para el tratamiento del cáncer de próstata confinado a la glándula. Asimismo podemos considerar que, a pesar de ser una excelente opción terapéutica, no deja de ser un procedimiento en el que pueden presentarse complicaciones trans y posquirúrgicas; con mayor relevancia tardías como lo son la incontinencia urinaria y la disfunción eréctil, que en ocasiones pueden encaminar tanto al paciente como al médico tratante a optar por otra alternativa de manejo; sin embargo los resultados obtenidos en nuestro servicio se encuentran dentro del los rangos comunicados en la bibliografía, por lo que nos permite ofrecer mayor seguridad a nuestros pacientes.
Los métodos de detección temprana empleados por nuestro servicio (APE, examen dígito-rectal y finalmente biopsia transrectal prostática guiada por ultrasonido), nos han permitido detectar pacientes de los cuales la gran mayoría presentan enfermedad confinada a órgano, en los que el manejo quirúrgico radical ha mostrado resultados curativos libres de recidiva hasta el momento.
Correspondencia: Dr. Axel Costilla Montero.
Av. Baja Velocidad 284. Colonia San Jerónimo Chicahualco, C.P. 52140, Metepec, México.
Teléfono y Fax: 72 2275 6300 Ext. 2198.
Correo electrónico: axelcm2000@yahoo.com