Determinar la relación entre el antígeno prostático específico (PSA) y la hipertrofia prostática benigna (HPB) utilizando como marcador de la hiperplasia el volumen prostático en pacientes con síntomas del tracto urinario inferior.
Materiales y métodosEl estudio REPSA es un registro epidemiológico multicéntrico que recabó datos de adultos mexicanos mayores de 50 años de edad con HPB y síntomas del tracto urinario inferior moderados a severos definidos por medio de la Escala Internacional de Síntomas Prostáticos. Fueron excluidos los pacientes con infección urinaria activa, prostatitis o aquellos con diagnóstico de cáncer prostático. Se determinó el volumen prostático por ultrasonido y se midió el PSA sérico en cada paciente.
ResultadosSe estudiaron 855 pacientes (edad media 64±8.9años), el tiempo medio de evolución de HPB fue 3.3±3.1años. El valor medio de PSA fue de 2.1±3.2ng/ml. La prevalencia de disfunción eréctil observada fue del 81.9%. El volumen prostático medio fue 44.5±26.7mm3. Se encontró una correlación positiva entre el PSA y el volumen prostático (coeficiente de correlación de Pearson=0.88, p<0.01).
ConclusionesExiste una correlación positiva entre los niveles de PSA y el volumen prostático en pacientes mexicanos con HPB y síntomas del tracto urinario inferior.
To determine the relation between prostate-specific antigen (PSA) and benign prostatic hyperplasia (BPH) using the prostate volume in patients with lower urinary tract symptoms as a hyperplasia marker.
Material and methodsThe REPSA study is a multicenter epidemiologic data register on Mexican adult men over 50 years of age that presented with BPH and moderate-to-severe lower urinary tract symptoms defined by the International Prostate Symptom Scale (IPSS). Patients that had active urinary infections, prostatitis, or those diagnosed with prostate cancer were excluded from the study. Prostate volume was determined through ultrasound and serum PSA was measured in each of the patients.
ResultsA total of 855 patients were studied (mean age 64.0±8.9 years) and the mean BPH progression time was 3.3±3.1 years. The mean PSA value was 2.1±3.2ng/ml. Erectile dysfunction prevalence was 81.9%. The mean prostate volume was 44.5±26.7mm3. There was a positive correlation between PSA and prostate volume (Pearson correlation coefficient=0.88, P<.01).
ConclusionsThere was a positive correlation between PSA levels and prostate volume in Mexican patients presenting with BPH and lower urinary tract symptoms.
La hiperplasia prostática benigna (HPB) es una condición común entre los hombres mayores. La incidencia de HPB es considerada hasta del 50% en hombres de 60 años, elevándose al 88% en hombres de 80 años1. Se estima que casi la mitad de estos sujetos desarrollarán síntomas del tracto urinario inferior (STUI) de moderados a severos2.
El antígeno prostático específico (PSA) es una glucoproteína producida por el epitelio prostático en forma exclusiva, lo que lo ha distinguido como marcador no invasivo, sensible y específico de enfermedad de la glándula prostática, incluyendo el cáncer prostático, sin embargo la HPB así como la prostatitis también elevan el nivel de PSA3. Su medición está indicada en pacientes mayores de 40 años con antecedentes familiares directos de cáncer de próstata y en todos aquellos mayores de 45 años con HPB para el diagnóstico diferencial del cáncer prostático4.
En México, la incidencia y la prevalencia de afecciones de la próstata se han incrementado, lo que se explica por el aumento de la expectativa de vida, que da la oportunidad a los hombres a desarrollar STUI. Uno de los métodos utilizados para ayudar a diagnosticar esta dolencia es el PSA. Actualmente no existen datos provenientes de pacientes mexicanos sobre la relación que existe entre los niveles de PSA y la HPB, pero datos obtenidos de otras poblaciones5 demuestran que existe una fuerte relación entre los niveles de PSA y el volumen prostático, siendo este último un marcador objetivo del grado de HPB6.
Debido a lo anterior, el objetivo del presente estudio fue determinar la relación entre el PSA y la HPB utilizando como marcador de la hiperplasia el volumen prostático.
Materiales y métodosEl presente trabajo forma parte del estudio REPSA, un registro epidemiológico multicéntrico, llevado a cabo en el periodo comprendido entre noviembre de 2009 y julio de 2010. De forma breve, el estudio incluyó datos de adultos mexicanos mayores de 50 años de edad con HPB y STUI moderados a severos sin tratamiento en los 6meses previos. Todos los pacientes firmaron el consentimiento informado.
Fueron excluidos los pacientes con infección urinaria activa, prostatitis o aquellos con diagnóstico de cáncer prostático. En adición a los datos demográficos y antropométricos de la historia clínica estándar, se determinó el volumen prostático por ultrasonido en cada paciente y se recolectaron datos acerca de los STUI por medio de la Escala Internacional de Síntomas Prostáticos (IPSS). Se consideraron STUI moderados a los puntajes en el IPSS entre 8 y 19, y STUI severos a los puntajes≥20.
El cuestionario de salud sexual y disfunción eyaculatoria del hombre (MSHQ-DE) en su versión abreviada y el cuestionario para la salud sexual masculina (IIEF-5) fueron utilizados para evaluar datos de disfunción sexual en los pacientes incluidos.
La medición del PSA se realizó mediante el equipo PSAwatch, Mediwatch Plc, Rugby, (Reino Unido), entregado a cada investigador participante por el patrocinador.
Los datos fueron registrados por el médico a cargo de cada paciente en una forma de reporte de caso (FRC) diseñada exprofeso, y al término del periodo del estudio los datos de cada FRC fueron concentrados en una base de datos electrónica. Como control de calidad de la información, al término del periodo de inclusión de pacientes, un monitor de estudio calificado provisto por el patrocinador controló la calidad de la información registrada en el FRC, verificando la identidad y diagnóstico de cada paciente así como la información del FRC comparándola contra los documentos fuentes (notas de pacientes, expedientes médicos, etc.) para los primeros 5 pacientes incluidos en el 10% de los centros del registro, seleccionados al azar.
Se realizó estadística descriptiva basada en medidas de tendencia central; las variables categóricas se reportan como n y porcentaje. El grado de correlación entre los niveles de PSA y el volumen prostático medido en mm se calculó mediante el uso del coeficiente de correlación de Pearson de 2 vías con un nivel de significación del 5%. Los análisis fueron realizados con el paquete estadístico SPSS Statistics para Windows, Versión 17.0., Chicago (EE. UU.).
ResultadosSe incluyeron 901 pacientes reclutados de 36 centros mexicanos, 46 pacientes fueron eliminados por no cumplir con los criterios de inclusión (23 pacientes no cumplieron con la edad, 18 pacientes tenían un IPSS<8, y por último, en 5 pacientes no se midió el PSA. Para los análisis finales se incluyeron datos de 855 pacientes (94.9%).
La edad media fue de 64±8.9años. En cuanto a las variables antropométricas, la estatura y peso medios fueron 170.2±7.4cm y 79.8±11.9kg, respectivamente. Como las morbilidades más frecuentes, encontramos la hemorragia transuretral en el 67.7%, la hipertensión arterial en el 34.7% y el tabaquismo en el 24.6% de los pacientes.
Los medicamentos más frecuentemente utilizados fueron los antihipertensivos (33.9%), hipoglucemiantes orales y/o insulina (15.4%) y los fármacos antiulcerosos (3.2%). La frecuencia cardiaca media durante la entrevista fue de 76±10lpm, presión arterial sistólica 133.1±17.5mmHg y presión arterial diastólica 82.7±9.9mmHg.
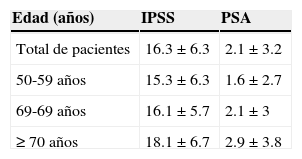
Evaluación de la hiperplasia prostática benignaEl tiempo medio de evolución de HPB fue de 3.3±3.1 años. El valor medio de PSA fue de 2.1±3.2ng/ml. La sintomatología según el IPSS fue moderada en 616 pacientes (72.1%), y severa en 239 casos (28.0%). Se observaron puntuaciones más altas en el IPSS conforme aumentaban los valores medios de PSA; los pacientes con sintomatología moderada tuvieron un valor medio de PSA de 1.9±2.7ng/mL, mientras que en aquellos con sintomatología severa fue de 2.8±4.1 ng/mL (tabla 1).
Relación entre la edad, la Escala Internacional de Síntomas Prostáticos y valores del antígeno prostático
| Edad (años) | IPSS | PSA |
|---|---|---|
| Total de pacientes | 16.3±6.3 | 2.1±3.2 |
| 50-59 años | 15.3±6.3 | 1.6±2.7 |
| 69-69 años | 16.1±5.7 | 2.1±3 |
| ≥70 años | 18.1±6.7 | 2.9±3.8 |
IPSS: Escala Internacional de Síntomas Prostáticos; PSA: valores del antígeno prostático específico.
Todos los valores están reflejados como media±desviación estándar.
La media del IIEF-5 fue 13.7±7.9. Se observaron puntajes progresivamente menores en el IIEF-5 conforme aumentaba el grupo de edad: el grupo de 50-59 años tuvo una media IIEF-5 de 17.2±6.5; mientras que el grupo de 60-69 años obtuvo 13.9±7.4, y el grupo de 70 años o más 8.6±7.7. La prevalencia de disfunción eréctil observada fue de 81.9% (668 casos). En cuanto a la evaluación de la disfunción eyaculatoria, se observó una media MSHQ-DE de 11.0±3.6. También se vio una tendencia a niveles más altos de PSA en los pacientes con los puntajes más altos en el IIEF-5: 1.9±2.7ng/mL en los pacientes con función eréctil normal y 2.2±3.3ng/mL en aquellos con disfunción eréctil. Los pacientes con función eréctil normal tuvieron mayor valor de MSHQ-DE y que los pacientes con disfunción eréctil, (13.7±1.6 vs. 10.3±3.6). Adicionalmente, los pacientes con sintomatología moderada de la HPB tuvieron valores más altos en el MSHQ-DE, 11.5±3.4, frente a 9.6±3.7 en los pacientes con sintomatología severa.
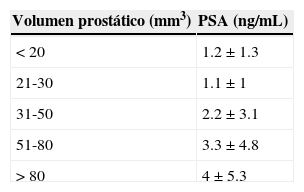
Desenlace primarioEl volumen prostático medio fue de 44.5±26.7mm3. Hubo una relación positiva entre el PSA y el volumen prostático evidenciado por un coeficiente de correlación de Pearson de 0.88 (p<0.01), la tabla 2 muestra los valores de PSA y volumen prostático encontrados en este estudio.
Relación entre el volumen prostático y el valor del antígeno prostático específico
| Volumen prostático (mm3) | PSA (ng/mL) |
|---|---|
| <20 | 1.2±1.3 |
| 21-30 | 1.1±1 |
| 31-50 | 2.2±3.1 |
| 51-80 | 3.3±4.8 |
| >80 | 4±5.3 |
PSA: valores del antígeno prostático específico.
Todos los valores están reflejados como media±desviación estándar.
La asociación entre el volumen prostático y los niveles de PSA resulta del incremento en la cantidad de tejido secretor disponible conforme aumenta la HPB6. La relevancia del hallazgo de incremento en el volumen prostático se relaciona con el tratamiento de los STUI ya que estudios previos han demostrado que, en el caso del tratamiento médico para estos síntomas, el volumen prostático constituye un factor pronóstico de respuesta7.
En concordancia con lo reportado en la literatura mundial5, nuestro estudio encontró una correlación positiva entre los valores de PSA y el volumen prostático. De especial relevancia, la población que estudiamos es sintomática, habiéndose utilizado una medida objetiva de la presencia de STUI como lo es el IPSS. En 2007 Shim et al.8 estudiando una población análoga a la nuestra de pacientes con STUI ya habían reportado una relación lineal dependiente de la edad entre los niveles de PSA y el volumen prostático que es consistente con nuestros propios datos.
Como hallazgos adicionales, encontramos tendencias consistentes entre las puntuaciones en IPSS e IIEF-5 y los niveles de PSA los cuales parecen tener también un comportamiento dependiente de la edad.
Por otro lado, en nuestro estudio la prevalencia de disfunción eréctil fue del 81,9%, con incrementos de acuerdo a la gravedad de la sintomatología de la HPB. A este respecto podemos citar el estudio de Corona et al.9 quienes describen un incremento en el riesgo de disfunción eréctil en pacientes con niveles altos de PSA consistentes con aumento del tamaño prostático, lo cual apoya los hallazgos del presente trabajo.
Consideramos que la información obtenida en este estudio es útil y aplicable a la población mexicana, ya que la medición del PSA es una prueba ampliamente disponible aun en poblaciones de pacientes que no tienen acceso a determinaciones más objetivas del volumen prostático como el ultrasonido. Este hecho constituye una de las fortalezas principales de nuestro estudio y da pie a la posibilidad de emitir recomendaciones sobre el uso de este marcador sérico como una medida subrogada del volumen prostático y por ende de la presencia de HPB. También, proporciona un punto de partida para futuros estudios que evalúen la eficacia de los distintos tratamientos médicos disponibles en la actualidad para la HPB con o sin STUI.
ConclusionesExiste una correlación positiva entre los niveles de PSA y el volumen prostático en pacientes mexicanos con HPB y STUI. Además, se encontró una alta prevalencia de disfunción eréctil en la población estudiada la cual se incrementó consistentemente conforme a la edad y a los niveles de PSA.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesSanofi Aventis de México S.A. de C.V. proporcionó financiamiento económico para el desarrollo de la presente investigación y la preparación del escrito, sin embargo no tuvo ningún papel en el diseño del estudio, en la recolección de datos, en el análisis e interpretación de la información, decisión para envío a publicación ni elección de la revista.
Agradecemos al Dr. Alfonso Vallejos su contribución en la edición de este manuscrito.
Aguilar Otero, Carlos Jorge; Barroso Serrano, Alejandro; Ceballos Duarte, Gerardo José; Colin Garcia, Eliseo Uriel; Contreras Gutiérrez, José Alfredo; del Villar Orrostieta, Aarón; Galindo, Miguel Angel; Gonzalez Ramírez, Rubén; Guarneros Cruz, Jesús; Hernández Bustillo, Manuel; López Verdugo, José Francisco; Marquina Sánchez, Manuel; Morales Covarrubias, Alejandro; Nishimura Torres, Salvador Kazuo; Oceguera Manzur, Alfredo; Paredes Mendoza, Jorge; Pérez Ramos, Héctor Javier; Ramírez González, Javier Salomón; Reyes Gutiérrez, Miguel Angel; Treviño Sosa, Gerardo; Wingartz Plata, Hugo.