Objetivo: Reportar la evolución oncológica de los pacientes con tumores germinales no seminomatosos (TGNS) tratados en nuestra Institución.
Material y métodos: De 1984-2011 se diagnosticaron 72 casos de TGNS. Analizamos retrospectivamente el estadio, los factores de riesgo y los marcadores tumorales (MT). Los desenlaces evaluados fueron la supervivencia global (SG) y libre de recurrencia (SLR).
Resultados: La estirpe histológica más común como forma única fue el carcinoma embrionario. El 51% de los casos fue de riesgo bajo, intermedio en 38% y alto en 9%. El tiempo de seguimiento fue de 50.48 ± 53.81 meses (rango 2-275). El tratamiento inicial consistió de orquiectomía (ORQ) y vigilancia activa (VA) en 23 casos, ORQ más quimioterapia (QT) en 40 y QT seguido de ORQ en nueve. La SLR a 10 años fue de 81% y 45% en el grupo de riesgo bajo e intermedio; en alto riesgo no se alcanzó la media de SLR (p=0.0006). La SG a 10 años en el grupo de riesgo bajo, intermedio y alto fue de 100%, 79% y 66%, respectivamente (p<0.0001).
Conclusiones: El manejo de los tumores testiculares no seminomatosos debe ser multidisciplinario tomando como base la clasificación internacional de grupos de riesgo.
Aims: To report the oncologic progression of patients presenting with nonseminomatous germ cell tumors (NSGTs) treated at our institution.
Methods: From 1984-2011, 72 NSGTs were diagnosed. We retrospectively analyzed stage, risk factors, and tumor markers. The evaluated outcomes were overall survival (OS) and recurrence-free survival (RFS).
Results: The most common single histologic strain was embryonal carcinoma. A total of 51% of the cases were low risk, 38% were intermediate risk, and 9% were high risk. The mean follow-up time was 50.48 ± 53.81 months (2-275 month range). Initial treatment was orchiectomy (ORC) and active surveillance (AS) in 23 cases, ORC plus chemotherapy (CT) in 40 cases, and CT followed by ORC in 9 cases. RFS at 10 years was 81% for the low risk patients and 45% for the intermediate risk group; the mean RFS was not reached by the high risk group (p = 0.0006). OS at 10 years was 100% for the low risk group, 79% for the intermediate risk group, and 66% for the high risk group (p < 0.0001).
Conclusions: Nonseminomatous testicular tumor management should be multidisciplinary and based on the international risk group classification.
¿ INTRODUCCIÓN
El cáncer de testículo (CT) es la neoplasia sólida más común en hombres entre 15 y 35 años de edad, y la segunda más común entre 35 y 40 años, con un riesgo de desarrollarlo durante la vida de 0.2%.1 En Estados Unidos el CT ocupa del 1% a 3% de todas las neoplasias,2-4 se registran 6 000 casos nuevos con 350 muertes al año.5,6 En los últimos años se ha incrementado su incidencia en Norte América y Europa desde 2.3% hasta 5%.7 Adami y colaboradores reportaron que la incidencia estandarizada de acuerdo a la edad se duplica o triplica cada 15 a 25 años, en diferentes países europeos del norte.8
El Registro Histopatológico de Neoplasias en México de 2001, reportó que el CT fue la neoplasia más común en hombres en edad reproductiva (15 a 44 años), con una incidencia de 950 casos por cada 100 000 habitantes.9 En el 2008 la Organización Mundial de la Salud (OMS) a través de su sitio en internet GLOBOCAN, reportó que la incidencia en nuestro país fue de 2 528 casos por cada 100 000 habitantes, ocupando el 10° lugar (5.3%) de los tumores más frecuentes en población masculina mexicana.10
Los tumores germinales no seminomatosos (TGNS) ocupan cerca de la mitad de los casos de CT, siendo el pico de presentación a partir de los 25 años de edad. La estirpe más común es el carcinoma embrionario (CE).11
En los últimos 25 años la expectativa de vida en los pacientes con CT ha incrementado considerablemente, tanto en los pacientes de bajo (hasta del 100%) como en los de alto riesgo (80%).12 Actualmente, el tratamiento es multimodal, combinando cirugía (orquiectomía ORQ por vía inguinal y linfadenectomía retroperitoneal), quimioterapia (QT) y radioterapia (RT).
El objetivo del presente estudio es reportar la evolución oncológica de los pacientes con TGNS tratados en nuestra Institución, con base en la clasificación de grupos de riesgo del International Germ Cell Cancer Collaborative Group (IGCCCG).
¿ MATERIAL Y MÉTODOS
De enero 1984 a enero 2011, 132 casos de CT fueron tratados en nuestro Instituto. De éstos, 72 tuvieron TGNS y son el grupo a analizar en este estudio. Se incluyeron aquellos con información clínica y seguimiento completos.
Las variables analizadas retrospectivamente fueron edad, marcadores tumorales (MT) prequirúrgicos, modalidad de tratamiento, estadio patológico, presencia de invasión linfovascular (ILV) y porcentaje de CE en la pieza de ORQ. Para el seguimiento se llevó a cabo la medición seriada de MT (alfa-fetoproteína AFP, fracción b de gonadotropina coriónica humana b-GCH y deshidrogenasa láctica DHL), además de estudios de imagen.
En los pacientes con CE se midió la proporción que esta estirpe ocupaba dentro del tumor y se clasificó en mayor o menor a 50%.
Para la estadificación se utilizó el sistema TNM 2010 que incluye los MT,13 y de manera adicional la clasificación del IGCCCG.14
Se definió como "recurrencia" a la presencia de enfermedad después de un periodo libre de enfermedad, y como "progresión" al incremento de la actividad neoplásica a pesar de tratamiento. Los desenlaces evaluados fueron la supervivencia global (SG) y libre de recurrencia (SLR).
Para el análisis estadístico de supervivencia se llevó a cabo con el método Kaplan-Meier y la prueba de Mantel-Cox para comparar dichos resultados. Se realizaron con el programa StatView 5.0 para Windows (SAS Institute, Cary, NC).
¿ RESULTADOS
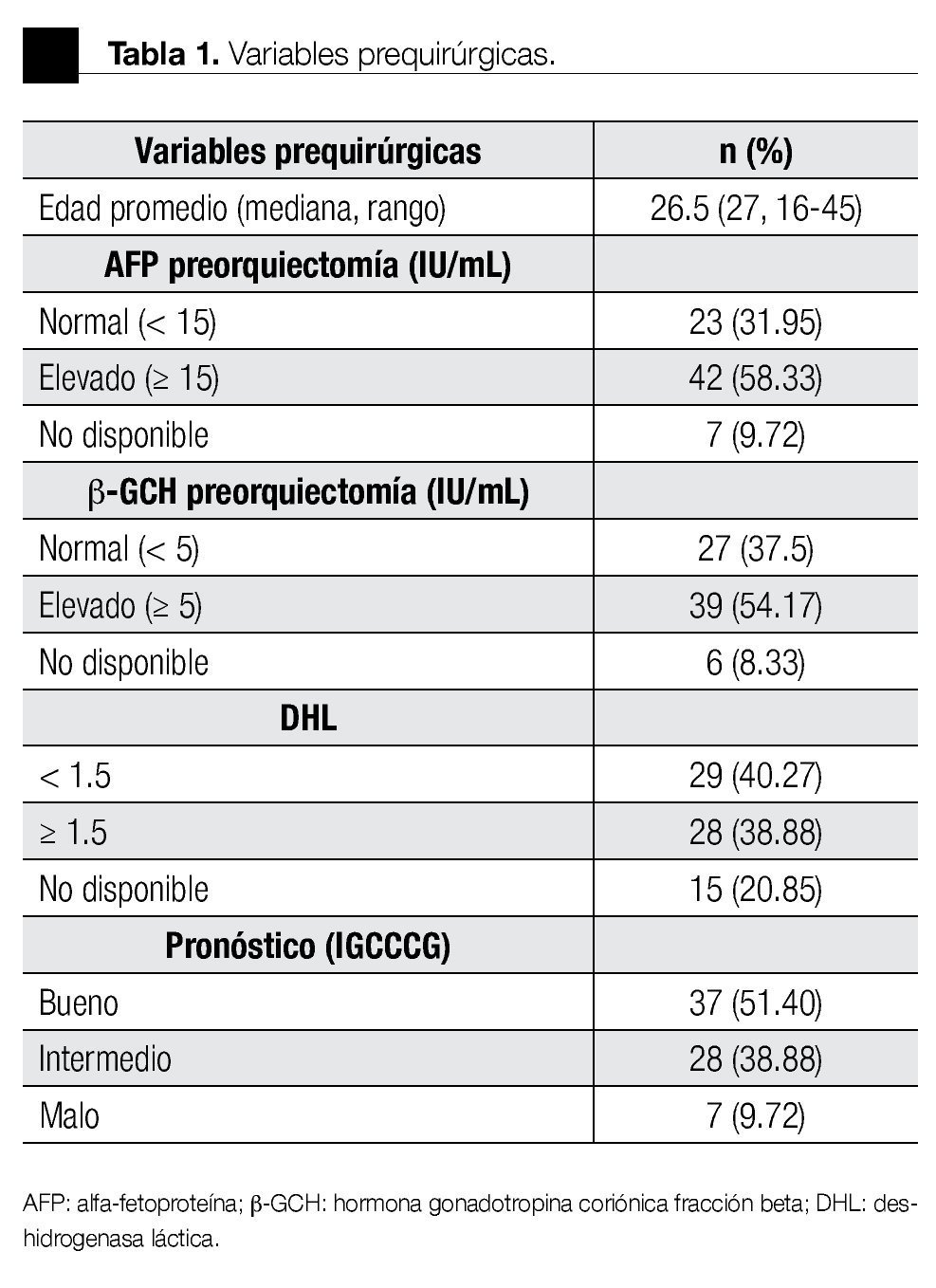
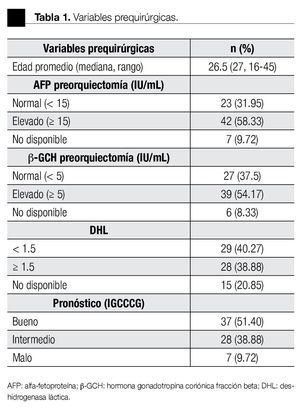
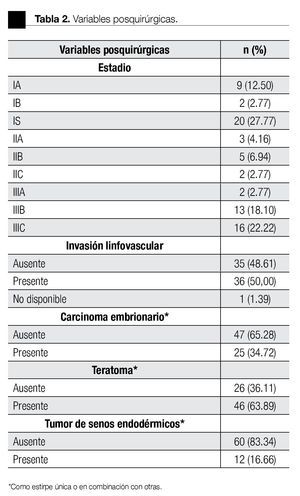
De los 72 pacientes, 51 tuvieron tumores mixtos (con un componente adicional de seminoma). El testículo derecho estuvo afectado en 40 y el izquierdo en 32 pacientes. La AFP, b-GCH y DHL se encontraron elevadas en 56%, 54% y 75% al momento del diagnóstico. El tiempo transcurrido desde el inicio de los síntomas hasta el tratamiento tuvo una media de tres meses. El tiempo de seguimiento fue de 50.48 ± 53.81 meses (rango 2-275). En la Tablas 1 y 2 se resumen las variables pre y posquirúrgicas.
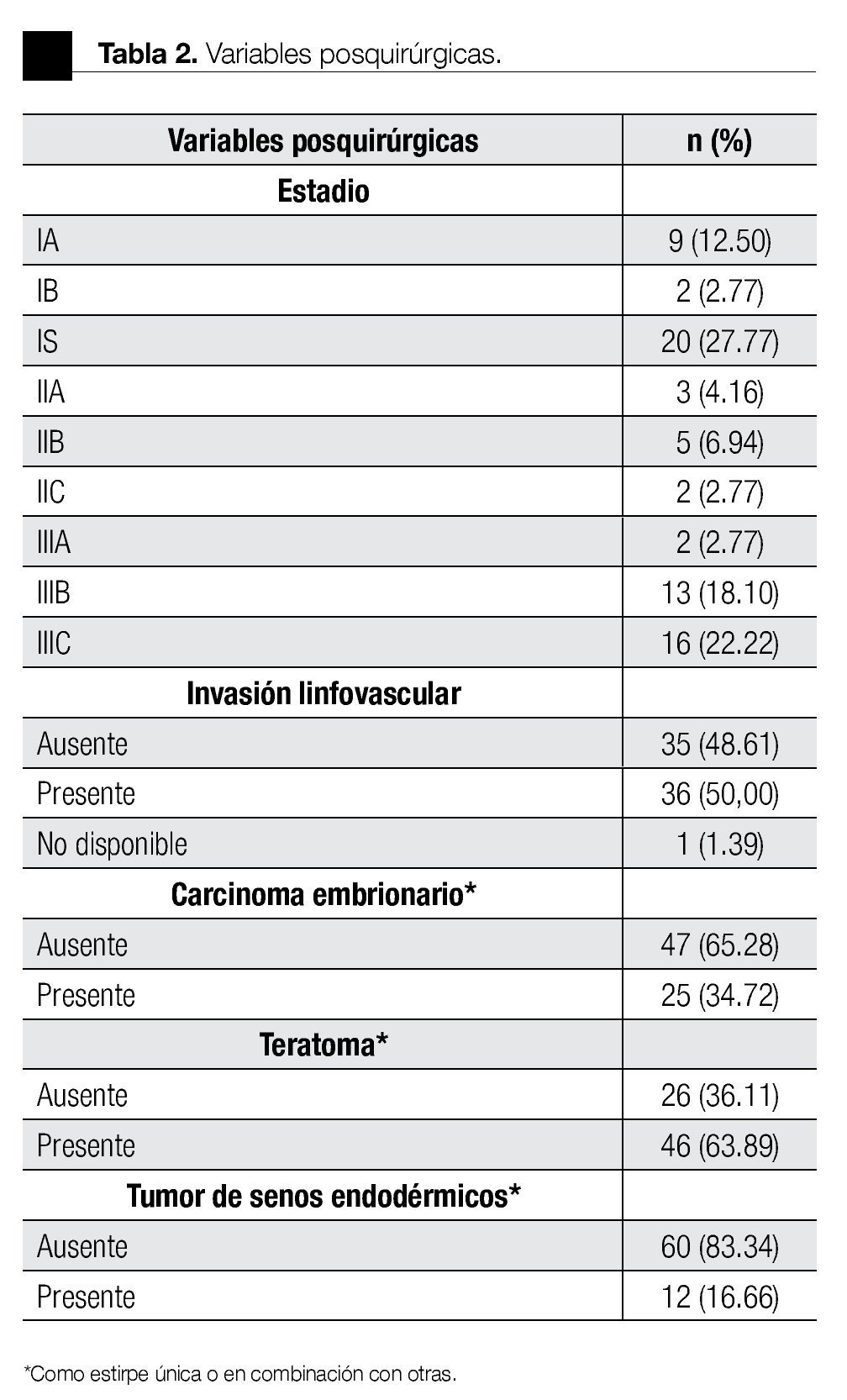
El estadio más común al diagnóstico fue IS con 20 casos (27.77%), seguido del IIIC con 16 (22.22%). El grupo de riesgo (IGCCCG) fue bajo en 51%, intermedio en 38% y alto en 9%. La estirpe más común como forma única fue el CE (17.64%), mientras que en los mixtos fue el teratocarcinoma (27.94%). El 50% tuvo ILV. De los 21 que contenían CE, 13 tuvieron más del 50% en la pieza.
El tratamiento inicial consistió en ORQ por vía inguinal y vigilancia activa (VA) en 23 casos, ORQ más QT en 40 y QT seguido de ORQ en nueve.
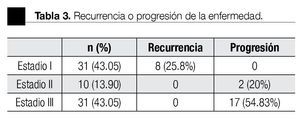
En la Tabla 3 se describe la distribución por estadios. De los 31 pacientes en estadio I, 23 fueron a VA y ocho recibieron QT profiláctica; se demostró recurrencia de la enfermedad en siete y uno, respectivamente. Se detectó ILV en 10 casos, de los cuales cuatro tuvieron recurrencia. En cuatro pacientes se encontró más del 50% de CE en la pieza, sin ninguna recurrencia. Los 10 pacientes en estadio II recibieron QT adyuvante. De éstos, ocho fueron llevados a linfadenectomía retroperitoneal laparoscópica (LRP) y dos de ellos presentaron progresión de la enfermedad con una media de seguimiento de siete meses. Se detectó ILV en siete casos y más del 50% de CE en dos pacientes, no se presentó recurrencia con estos factores de riesgo.
En estadio III, 22 pacientes recibieron QT adyuvante y en 13 de ellos fue necesario realizar resección de masa retroperitoneal residual. En otros nueve casos se administró QT antes de la ORQ, debido a la extensión de la enfermedad. La ILV fue positiva en 19 casos, de los cuales nueve presentaron progresión de la enfermedad. En siete casos se encontró más de 50% de CE, y tres de ellos presentaron progresión.
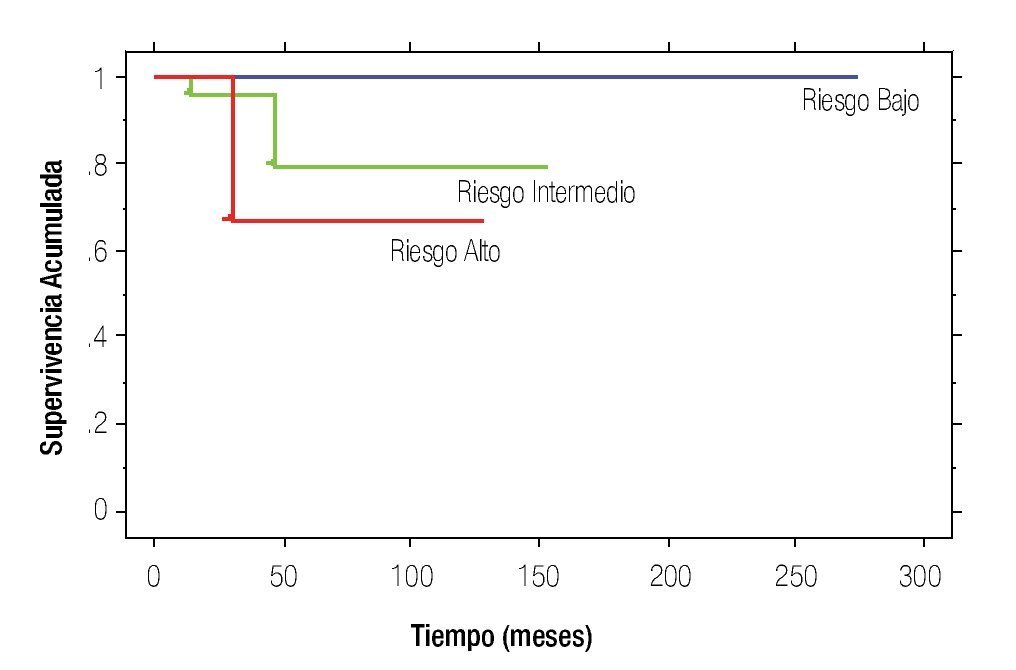
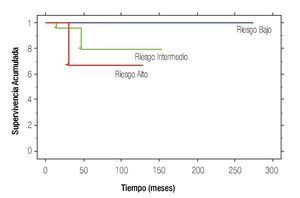
La SLR a 10 años en el grupo de riesgo bajo fue de 81% y en intermedio de 45%, mientras que en el de alto riesgo no se alcanzó la media de SLR (p=0.0006). La SG a 10 años en el grupo de riesgo bajo fue de 100%, en intermedio de 79% y en alto de 66%, p<0.0001 (Figura 1).
Figura 1. Supervivencia global.
Durante el seguimiento de los pacientes se presentaron tres defunciones. Dos de ellas relacionadas a CT metastásico a los 14 y 30 meses de seguimiento, ambos se diagnosticaron en estadio IIIC. El paciente restante falleció de choque séptico adjudicado a perforación intestinal.
¿ DISCUSIÓN
Durante el siglo 20 se observó un incremento en la incidencia de CT, pero actualmente se ha convertido en una meseta según lo reportado por Purdue y colaboradores. Este incremento se dio con mayor rapidez en regiones propensas (descendencia europea), y se comenta que pueda deberse a una mejor vigilancia estrecha y diagnóstico oportuno o al aumento de los factores de riesgo que se presentan en la actualidad, los cuales se encuentran relacionados a cambios en el estilo de vida.15
Los datos encontrados en nuestra Institución son comparables con aquellos reportados internacionalmente y en nuestro país. Gerson y colaboradores presentaron en México una incidencia mayor de tumores no seminomatosos (84%) en una población de 26 casos y una edad de 27 años al diagnóstico, en nuestra Institución los TGNS fueron más comunes y la edad media fue la misma. Al igual que el presente estudio, los estadios más comunes al diagnóstico fueron el estadio I y III.5
Con respecto a datos internacionales se ha encontrado una relación mayor de no seminoma contra seminoma, una mayor incidencia de CT derecho y los valores de AFP y b-GCH se encontraron elevados en más del 50% de los pacientes.7 Martin y colaboradores encontraron en España predominio no seminomatoso de formas puras en comparación con formas mixtas, lo contrario sucede en nuestra Institución, en donde se reportó 49.5% de formas mixtas y 25% formas puras. La forma pura más común en ambos estudios fue el CE, con un 17.6% en nuestra serie. El diagnóstico en estadio I fue más frecuente al igual que nuestra serie.4
En una población de 957 pacientes, Germá-Llunch y colaboradores reportaron una proporción basada en grupos de riesgo (IGCCCG) de 63% con riesgo bajo, 19% intermedio y 18% alto,7 lo cual varía en nuestro estudio con 51.4%, 38.8% y 9.7%, respectivamente.
El manejo de los TGNS en estadio I permanece en controversia y posterior a la ORQ se consideran válidos: VA, QT profiláctica y LRP.16,17 El grupo SWENOTECA recomiendan como buena opción la VA a pacientes en estadio I con ILV negativa y para aquellos con ILV positiva, uno o dos ciclos de BEP. Este grupo establece que un ciclo de BEP (bleomicina, etopósido y cisplatino) reduce hasta en un 90% las recurrencias en pacientes de bajo y alto riesgo.18 Chevreau y colaboradores reportaron que hasta un 10% de los pacientes desarrollarán metástasis afuera del campo de la LRP, por lo que consideran a la QT profiláctica con dos ciclos BEP como buena opción en pacientes con factores de riesgo ILV y CE, su serie no tuvo evidencia de recurrencia durante su seguimiento (promedio 113.2 meses).17 Nicolai y colaboradores establecieron que estos pacientes tienen un 30% de riesgo de presentar micrometástasis,18 y que la LRP es una opción viable para su manejo. En su serie, se realizó a 322 pacientes LRP y se observó una recurrencia a 10 años del 15.2% con un seguimiento de 17.3 años, con esto justifican que la mitad de los pacientes que son elegibles para QT profiláctica, también son elegibles a LRP y con esto evitar la progresión de la enfermedad con resultados similares.19 En nuestra serie solamente se realizó manejo mediante VA o QT adyuvante en este tipo de pacientes.
Germá-Llunch y colaboradores reportaron una supervivencia a tres años de 94% para no seminoma con una media de seguimiento de 33 meses, la tasa de recurrencia para pacientes en estadio I fue 58 de 262 pacientes en VA (22%) y una recurrencia de 168 (0.5%) con QT adyuvante.7 En nuestra serie, los pacientes en estadio I presentaron una recurrencia de siete de 23 pacientes en VA (30.43%) y una recurrencia de ocho (12.5%) con QT adyuvante. En el estudio realizado por el grupo SWENOTECA, aquellos pacientes con ILV negativa y VA, se observó una recurrencia de 13.5% con una media de 0.7 años, para este mismo tipo de pacientes en que se dio QT profiláctica (un ciclo de BEP), se dio una recurrencia de 1.3% con una media de seguimiento de 4.1 años. Aquellos pacientes con factores de riesgo, ILV positiva, se reportó una recurrencia de 3.2% para paciente que recibieron un ciclo de BEP y los que recibieron dos ciclos de BEP, no se reportaron recurrencias con una media de seguimiento de cinco años.18
En el estudio basado en grupos de riesgo, Germá-Llunch y colaboradores se encontró una SLR a tres años en el grupo de riesgo bajo de 87.9%, intermedio 75.5% y alto con 62.2%. La SG fue 96.8%, 88.6% y 72%, respectivamente.7 En el presente estudio se encontraron datos semejantes pero a 10 años, se diferenció la SLR para el riesgo intermedio con 45% y en alto riesgo no se alcanzó la media (p=0.0006); la SG no presentó cambios importantes.
¿ CONCLUSIONES
El manejo de los tumores testiculares no seminomatosos debe ser multidisciplinario. Nuestros resultados sugieren que la QT profiláctica disminuye la posibilidad de recurrencia en estadio I. La clasificación en grupos de riesgo del IGCCCG es una buena herramienta para detectar aquellos pacientes que tiene mayor probabilidad a desarrollar recurrencia, quienes podrían beneficiarse de un tratamiento más agresivo desde el inicio.
¿ CONFLICTO DE INTERESES
Los autores declaran no tener ningún conflicto de intereses.
¿ FINANCIAMIENTO
Los autores no recibieron ningún patrocinio para llevar a cabo este estudio.
Correspondencia:
Dr. Francisco Rodríguez Covarrubias.
Departamento de Urología, Instituto Nacional de Ciencias Médicas y Nutrición "Salvador Zubirán".
Vasco de Quiroga 15, Colonia Sección XVI,
Delegación Tlalpan, C.P. 14000. México D.F., México.
Teléfono: 5487 0900, ext. 2145. Fax: 5485 4380.
Correo electrónico:frodriguez.covarrubias@gmail.com