Objetivo: Evaluar el papel pronóstico de variables clínico-patológicas en pacientes con cáncer de células renales (CCR) tratados quirúrgicamente.
Material y métodos: Analizamos retrospectivamente la base de datos de 440 pacientes con tumores renales. Se analizaron variables tanto clínicas como histopatológicas. El desenlace principal fue la supervivencia cáncer específica (SCE), evaluada con el método de Kaplan-Meier. Se realizó análisis univariado y multivariado para determinar los factores pronósticos.
Resultados: Se identificaron 370 pacientes con CCR entre marzo de 1980 y julio de 2011, el seguimiento promedio fue de 55.4 meses. Fallecieron 23.2% a causa del cáncer, se encontraron tumores más grandes (p<0.0001), de mayor grado (p<0.0001) y con mayor frecuencia de invasión linfovascular (p<0.0001). La SCE a cinco y 10 años fue de 97.2% y 97.2% en estadio I, 77.8% y 68.1% en estadio II, 62.7% y 49.4% en estadio III, 18.4% y 6.0% en estadio IV (p<0.0001). Todas las variables se asociaron con la SCE en el análisis univariado, y en el multivariado, el grado nuclear, la invasión ganglionar, el diámetro tumoral y la presencia de metástasis mantuvieron una asociación independiente con la supervivencia.
Conclusiones: Corroboramos el potencial pronóstico del grado nuclear, diámetro tumoral, ECOG (por sus siglas en inglés, Eastern Cooperative Oncology Group), invasión linfática y la presencia de metástasis.
Aims: To evaluate the prognostic role of clinicopathologic variables in patients with renal cell cancer (RCC) that were surgically treated.
Material and methods: We retrospectively analyzed the hospital database of 440 patients with renal tumors, evaluating clinical as well as histopathologic variables. The main outcome was cancer-specific survival (CSS) that was determined using the Kaplan-Meier method. Univariate and multivariate analyses were carried out to establish the prognostic factors.
Results: A total of 370 patients with RCC were identified covering the period of time from March 1980 to July 2011. The mean follow-up time was 55.4 months. There was a 23.2% mortality due to cancer and, compared with the surviving patients, those that died presented with larger tumors (p<0.0001), of higher grade (p<0.0001), and with a greater frequency of lymphovascular invasion (p<0.0001). The CSS at five and 10 years was 97.2% and
97.2% in stage I, 77.8% and 68.1% in stage II, 62.7% and 49.4% in stage III, and 18.4% and 6.0% in stage IV (p<0.0001), respectively. All variables were associated with CSS in the univariate analysis and in the multivariate analysis nuclear grade, lymph node invasion, tumor diameter, and the presence of metastasis maintained an independent association with survival.
Conclusions: We corroborated the prognostic potential of nuclear grade, tumor diameter, Eastern Cooperative Oncology Group (ECOG) score, lymph node invasion, and the presence of metastasis.
¿ INTRODUCCIÓN
El carcinoma de células renales (CCR) es la séptima neoplasia más común y la tercera urológica más frecuente, representa cerca del 2% a 3% de las neoplasias.1-3 Tiene una predilección por el género masculino, con una relación de 2:1. La edad al diagnóstico es entre la sexta y séptima décadas de la vida. 3-5
El CCR de células claras es el subtipo histológico más frecuente, engloba cerca del 70% a 80%, seguido por el papilar (10% a 15%), el cromófobo (3% a 5%) y el CCR de túbulos colectores (< 1%).6-8
La incidencia del CCR ha incrementado debido a diversas razones, incluyendo el diagnóstico de masas renales de manera incidental (hasta en el 70% de los casos).9,10 No obstante, hasta un 25% de los pacientes al momento de su presentación son diagnosticados con enfermedad metastásica.11
La supervivencia a largo plazo alcanza el 90% en enfermedad localizada, pero es menor al 5% en estadios avanzados.12 El tratamiento para el CCR localizado es la cirugía y en la actualidad, tanto la nefrectomía radical como la cirugía preservadora de nefronas (nefrectomía parcial) son equivalentes en términos funcionales y oncológicos.3,7,10,13-15 Los factores pronósticos identificados en enfermedad localizada incluyen el estadio y el grado nuclear;16 en la enfermedad localmente avanzada, son la invasión ganglionar y la diferenciación sarcomatoide;17 y en la enfermedad avanzada se asocian el estado de desempeño, la sintomatología y algunos marcadores de inflamación e hipercalcemia, por mencionar algunos.18
El propósito de este estudio es evaluar de manera retrospectiva, el papel pronóstico de las variables clínicas y patológicas en una cohorte de pacientes con CCR tratados quirúrgicamente.
¿ MATERIAL Y MÉTODOS
Analizamos retrospectivamente la base de datos de 440 pacientes consecutivos con neoplasias renales tratados mediante nefrectomía radical o parcial, en el Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán, en el periodo comprendido entre marzo de 1980 a julio de 2011. Fueron excluidos aquellos pacientes con tumores benignos, enfermedades hereditarias como síndrome de Von Hippel-Lindau, o que tuviesen una estirpe histológica diferente a CCR en el reporte histopatológico.
Las variables evaluadas fueron pérdida de peso, estado de desempeño del grupo ECOG (por sus siglas en inglés, Eastern Cooperative Oncology Group), diámetro tumoral (£ 7 cm, > 7 cm), grado nuclear (disponible en el 83% de los casos), invasión a ganglios linfáticos y presencia de metástasis. El estadio se determinó mediante la clasificación TNM 2002. El punto de corte utilizado para el diámetro tumoral fue de 7 cm, porque en base a éste se ha demostrado diferencia estadística en la supervivencia para todos los estadios.
El análisis estadístico se realizó mediante las pruebas de ji cuadrada y t de student para comparar promedios y proporciones, respectivamente. Se evaluó la ubicación y número de recurrencias, así como la posibilidad de resección quirúrgica (metastasectomía) en caso de que éstas se presentasen. Los intervalos de supervivencia fueron calculados del momento de la nefrectomía (radical o parcial), a la recurrencia de la enfermedad o la muerte por cáncer, respectivamente. Los desenlaces evaluados fueron la supervivencia libre de enfermedad (SLE) y supervivencia cáncer específico (SCE), las cuales se calcularon mediante el método de Kaplan-Meier y la comparación de estos resultados con la prueba de Mantel-Cox. Se realizó análisis univariado y multivariado con el modelo de riesgos proporcionales de Cox, para evaluar el valor pronóstico de las variables previamente mencionadas. Se consideró estadísticamente significativo un valor de p<0.05. Todos los análisis se realizaron con StatView® para Windows (SAS Institute, Cary, NC).
¿ RESULTADOS
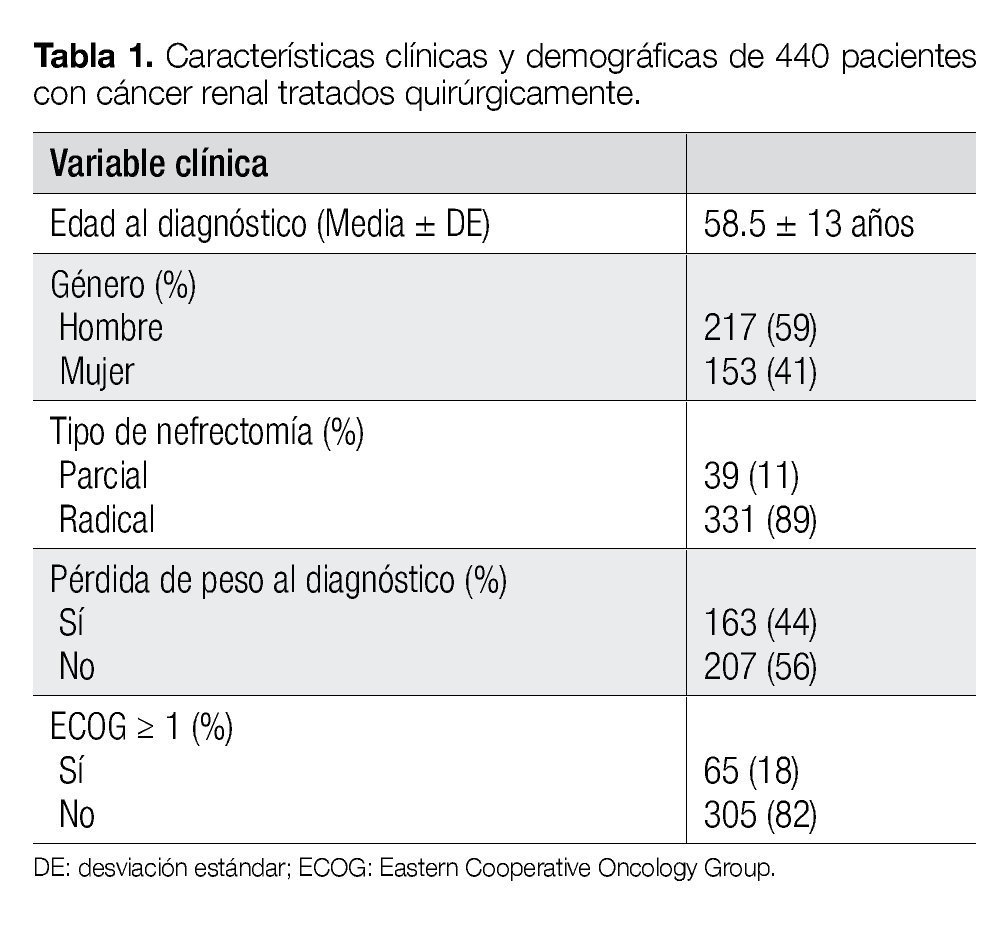
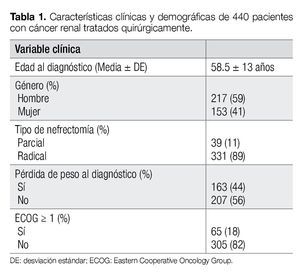
Se identificaron 370 pacientes con CCR tratados quirúrgicamente, de marzo de 1980 a julio de 2011. En 89% de los casos, el manejo fue con nefrectomía radical. El rango de edad se encontró entre 24 y 92 años. El seguimiento promedio fue de 55.4 ± 53.1 meses (mediana 38 meses, rango 1-271). El resto de las características clínicas y demográficas se resumen en la Tabla 1.
CARACTERÍSTICAS HISTOPATOLÓGICAS
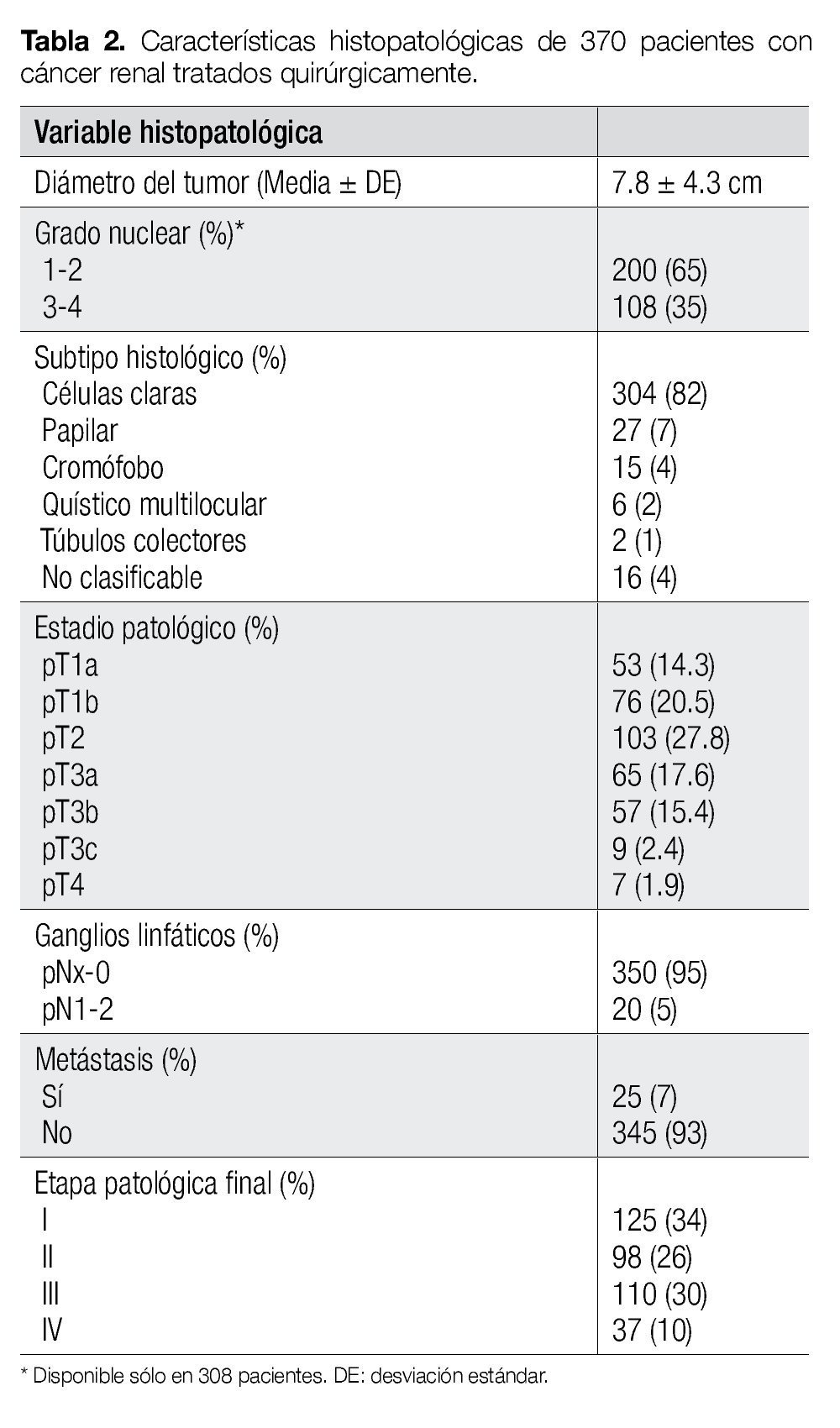
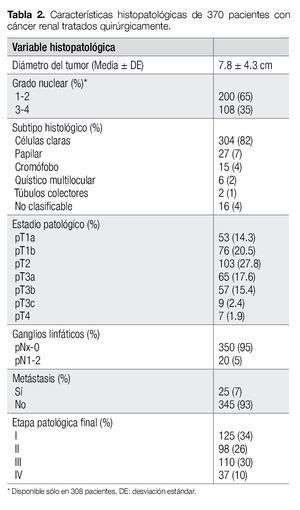
El diámetro del tumor fue > 7 cm en 53% de los casos. El subtipo histológico más común fue el de CCR de células claras (82%). El grado nuclear fue descrito en 308 pacientes y de ellos, el 65% fue Fuhrman 1-2. Sólo 5% presentaron invasión ganglionar y 7% con metástasis. Las variables patológicas se resumen con detalle en la Tabla 2.
RECURRENCIA
Del total, 106 pacientes (29%) tuvieron recidiva, con un tiempo promedio de recurrencia de 27.4 ± 29.8 meses (mediana 16, rango 1-129). Los sitios afectados más frecuentemente fueron pulmón (35%) y hueso (21%). Desde el punto de vista técnico, fue posible realizar metastasectomía con intento curativo en 26 casos (24.5%), ya que en el resto fue considerado irresecable.
SUPERRVIVENCIA CÁNCER ESPECÍFICA
Ochenta y seis pacientes (23.2%) murieron a causa del cáncer, después de un tiempo promedio de 49.2 ± 44.1 meses (mediana de 35, rango 2-220). En comparación con los sobrevivientes, los que murieron por cáncer tuvieron tumores más grandes (media 10.5 ± 5.8 cm vs 7.1 ± 3.4 cm, p<0.0001), mayor frecuencia de tumores de alto grado (64% vs 27%, p<0.0001) y con mayor frecuencia de invasión linfovascular (46% vs 18%, p<0.0001).
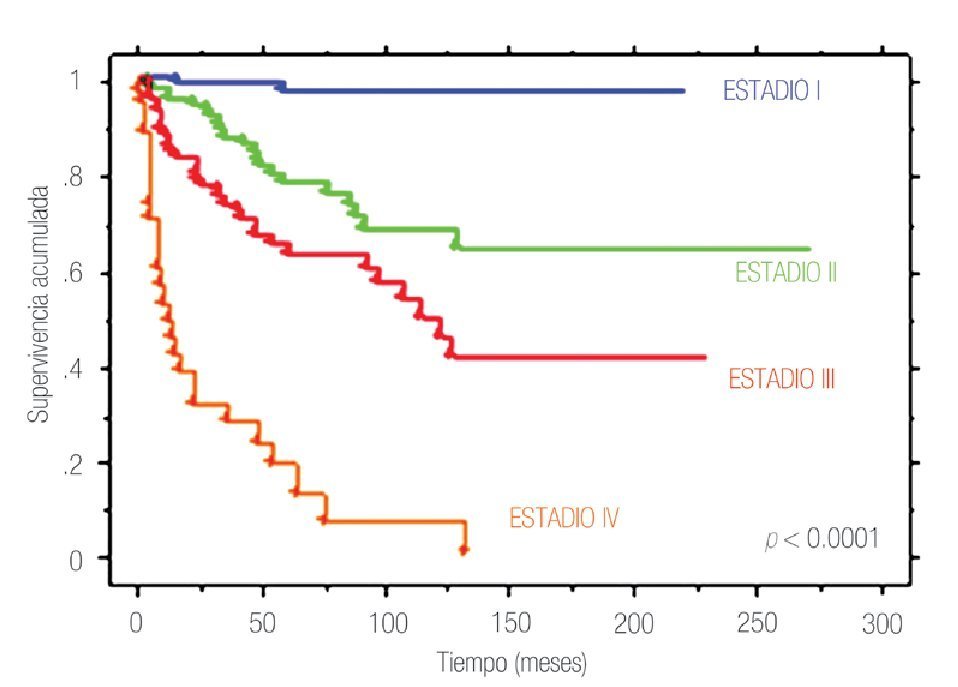
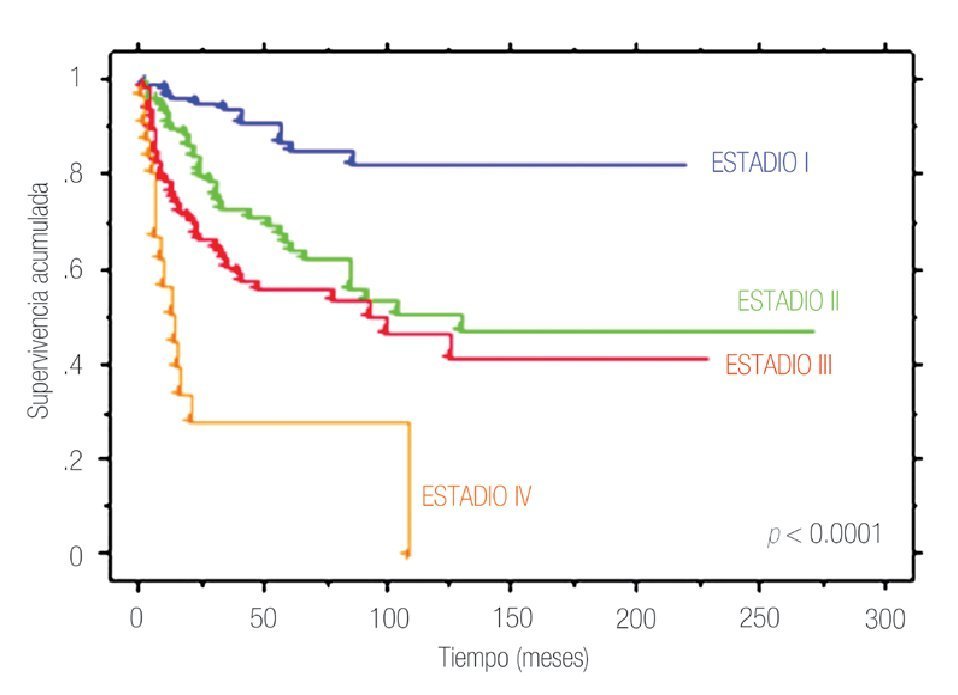
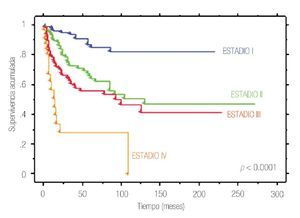
La SCE a cinco y 10 años en toda la cohorte fue de 73.8% y 65.3%, respectivamente. Al estratificar de acuerdo a la etapa patológica final, la SCE a cinco y 10 años fue de 97.2% y 97.2% en etapa I, 77.8% y 68.1% en etapa II, 62.7% y 49.4% en etapa III y 18.4% y 6.0% en etapa IV (p<0.0001) (Figura 1).
Figura 1. Supervivencia cáncer específica por estadio patológico final en 370 pacientes con cáncer renal tratados quirúrgicamente.
SUPERVIVENCIA LIBRE DE ENFERMEDAD
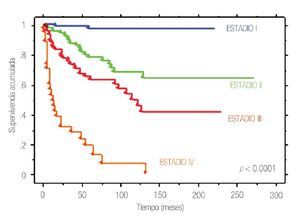
A cinco y 10 años, la SLE en toda la cohorte fue de 67.1% y 56.9%, respectivamente. Al estratificar de acuerdo con la etapa patológica final, la SLE a cinco y 10 años fue de 85.4% y 82.6% en etapa I, 64.7% y 47.4% en etapa II, 56.6% y 46.8% en etapa III, 28.5% y 0% en etapa IV (p<0.0001) (Figura 2).
Figura 2. Supervivencia libre de enfermedad por estadio patológico final en 370 pacientes con cáncer renal tratados quirúrgicamente.
FACTORES PRONÓSTICOS
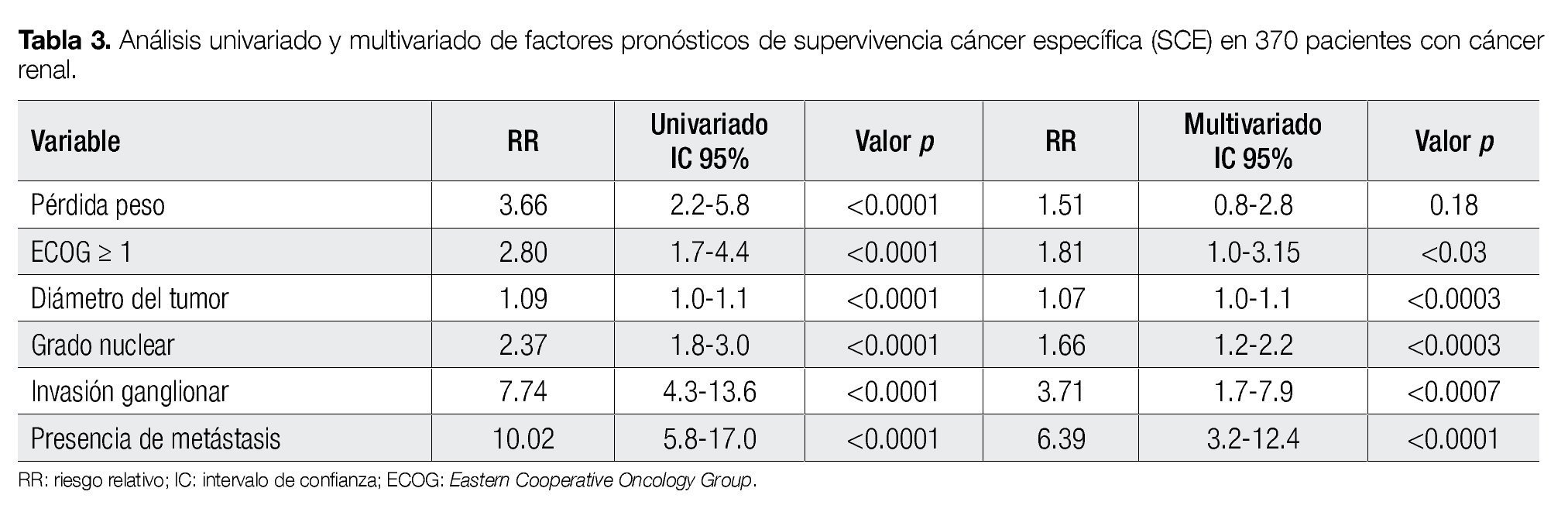
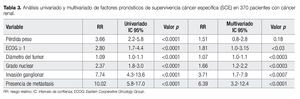
En el análisis univariado todas las variables incluidas se asociaron de manera estadísticamente significativa con la SCE. En el análisis multivariado con el modelo de Cox, el estado de desempeño (p<0.03), el tamaño del tumor (p<0.0003), el grado nuclear (p<0.0003), la invasión ganglionar (p<0.0007) y la presencia de metástasis (p<0.0001), mantuvieron una asociación independiente con el riesgo de mortalidad secundaria a cáncer (Tabla 3).
¿ DISCUSIÓN
En esta era de desarrollo de nuevos tratamientos y de un análisis profundo sobre los factores pronósticos y nomogramas en torno al CCR, es importante definir y conocer el papel que juegan éstos sobre la evaluación de los pacientes, no sólo con el fin de conocer el tratamiento ideal que se le ofrecerá, sino también para predecir la evolución oncológica de la enfermedad a largo plazo.19,20
Se define a un factor pronóstico como un marcador que puede ser usado para determinar la progresión o evolución de una enfermedad.19 Estas variables deben poder ser aplicadas a la práctica, y para ello deben cumplir con criterios que incluyen demostrar su viabilidad, significancia estadística en análisis univariados y su independencia subsecuente en relación a otros factores (análisis multivariado), que puedan ser reproducibles y validados por series grandes.19,21
Los factores pronósticos se pueden categorizar principalmente en tres: los relacionados al paciente, los que incluyen parámetros histopatológicos, y en base a sus características moleculares.22
Respecto a los factores histopatológicos, el estadio TNM es reconocido como el más importante en el CCR por su mayor impacto sobre el comportamiento clínico.23
La invasión a ganglios linfáticos es un factor predictivo independiente a pesar del estadio T, y su presencia conlleva a mal pronóstico para el paciente,17,19,24 con evidencia de que la invasión ganglionar (presente o ausente) aporta información pronóstica, sin demostrar diferencias entre pN1 y pN2.25 La SCE en estos pacientes es de 5% a 30% a cinco años y 0% a 5% a los 10 años.6,12 En nuestra serie, este parámetro tanto en su análisis univariado (p<0.0001) y multivariado (p<0.0007) resulta significativo para la SCE, compatible con otras grandes series revisadas.19, 24-28
Encontramos también que la presencia de metástasis disminuye de manera significativa la supervivencia en los pacientes con CCR, y coincide con lo encontrado en reportes previos, en los cuales es de alrededor de 50%, 30% a 50% y de 0% a 5% a uno, cinco y 10 años, respectivamente.19, 23,29-32
Desde 1932, Hand y Broders reportaron la relación entre el grado histológico y la SCE, y desde entonces han surgido otros modelos basados en características histopatológicas como los propuestos por Arner y colaboradores en 1965, Skinner en 1971, Syrjanen y Hjelt en 1978. Sin embargo, fue hasta 1982 que surgió el sistema más usado actualmente, propuesto por Fuhrman. Desde entonces, diversas series con un número importante de pacientes se han dado la tarea de demostrar el significado pronóstico de este sistema, y en la mayoría se ha corroborado que el CCR de bajo grado tiene una mejor supervivencia.29,33-35 En nuestra serie, el grado nuclear fue asignado en base al Fuhrman y clasificado en bajo grado (1-2) vs alto grado (3-4). Este parámetro demostró significancia estadística, tanto en el análisis univariado como multivariado.
El tamaño del tumor es una característica importante en el terreno clínico y patológico de los pacientes con CCR, ya que ha mostrado ser un factor predictivo independiente de la SLE y SCE.36 No obstante, existen en la literatura médica reportes contradictorios en los que no se ha podido validar como un factor pronóstico independiente.37,38 Estudios como el de Klatte y colaboradores39 concluyen que el tamaño tumoral no es un factor que muestre impacto en el pronóstico de la enfermedad, pero por otro lado, muchas otras series demuestran que el tamaño del tumor se asocia de forma significativa con la presencia de invasión ganglionar, metástasis e influye de forma negativa en el pronóstico oncológico y sobrevida del paciente.28,40-43 En esta serie, el diámetro del tumor fue determinante sobre el resultado final de los pacientes estudiados.
El estado de desempeño del paciente medido, ya sea por Karnofsky o por ECOG, es una forma fácil de ver el impacto tanto subjetivo como objetivo de los signos y síntomas secundarios a la enfermedad.23 En pacientes con CCR metastásico se acepta de forma general, que el estado de desempeño y los síntomas constitucionales conllevan un mal pronóstico, mientras que los signos y síntomas en pacientes con CCR localizado son probablemente un reflejo de efectos paraneoplásicos, y no tanto de la extensión del tumor.44 Los pacientes asintomáticos con tumores encontrados de manera incidental tienen mejor supervivencia, menor riesgo de metástasis y presentación en estadios más tempranos, comparado con pacientes sintomáticos.19,32,35 En el estudio del SSIGN, a pesar de que el ECOG se asoció con supervivencia global, no fue un factor pronóstico para la SCE.36
La escala del ECOG inicialmente se valoró en estadios metastásicos, sin embargo, su importancia se ha extendido más allá, usándose en todos los estadios.23 En un estudio realizado por el grupo de Pantuck y colaboradores23 sobre 661 pacientes en UCLA, la supervivencia a cinco años fue de 51% cuando el ECOG fue 3 1 vs 81% cuando el ECOG fue de 0. Un estudio realizado por Dall'Oglio y colaboradores45 destaca la diferencia en la SLE (82.9% vs 57.3%) y SCE (85.2% vs 64.1%), entre pacientes asintomáticos vs sintomáticos, respectivamente. Este parámetro mostró consistencia en nuestro grupo de estudio, principalmente en pacientes con enfermedad localmente avanzada o metastásica, y alcanzó significancia estadística en el análisis univariado. Al considerar que la mayoría de los casos de CCR en nuestra serie se encontraron en estadio temprano, se explicaría el hecho de que la presentación clínica (por ejemplo, pérdida de peso) no tuviera el impacto pronóstico esperado. A pesar de ello, nuestro estudio corrobora el potencial pronóstico del ECOG en el análisis multivariado.
Las series nacionales publicadas previamente son pequeñas,46-48 y no en todas se analizan los factores pronósticos mediante análisis multivariado. En el estudio realizado por Rodríguez-Jasso y colaboradores46 se analizaron 96 pacientes con CCR, y sólo 52 de ellos cumplieron los criterios de inclusión. Los factores de mayor importancia pronóstica fueron el estadio clínico, el grado nuclear y el subtipo histológico. Por otra parte, Mota-Romero y colaboradores47 analizaron de manera retrospectiva 106 casos de CCR, y demostraron una mayor supervivencia en estadios tempranos en comparación con estadios tardíos.
Nuestro estudio tiene como principal limitante el carácter retrospectivo del análisis. No obstante, hasta el momento, de las series nacionales publicadas, ésta es la que cuenta con el mayor número de pacientes, lo que proporciona mayor confiabilidad respecto a los resultados obtenidos.
¿ CONCLUSIÓN
Nuestros hallazgos confirman la relevancia de las características clínicas y patológicas sobre la evolución oncológica del CCR. El grado nuclear, el diámetro tumoral, la invasión a ganglios linfáticos, la presencia de metástasis y el ECOG son los factores pronósticos más importantes para determinar la SCE.
La evaluación intencionada de estas variables y la búsqueda de nuevos factores pronósticos, nos permitirán integrar información detallada del impacto de la enfermedad, terapéutica y seguimiento que se ofrecerá a cada paciente.
Correspondencia:
Dr. Francisco Rodríguez Covarrubias.
Vasco de Quiroga No. 15,
Colonia Sección XVI,
Delegación Tlalpan, C.P. 14000. México D.F., México.
Teléfono: 5487 0900, extensiones 2145, 2260. Fax: 5485 4380.
Correo electrónico:frodriguez.covarrubias@gmail.com