Objetivo: Evaluar el papel pronóstico de variables clínico-patológicas en pacientes con carcinoma de células transicionales de tracto urinario superior (CCT-TUS) tratado quirúrgicamente.
Material y métodos: Se analizó retrospectivamente la base de datos de 59 pacientes diagnosticados de CCT-TUS, operados de 1980 a 2012 en nuestro Instituto. Se analizaron las variables clínicas e histopatológicas, y se midió el tiempo de supervivencia libre de enfermedad (SLE), supervivencia cáncer-específica (SCE) y supervivencia global (SG).
Resultados: El seguimiento promedio fue de 56.4 meses. El 50.8% tuvo recidiva, con una SLE promedio de 42.9 meses, 70% recurrió en el primer año, y el 96.7% a los 5 años mostró mayor recurrencia en estadio III y IV (p=0.020). El 20.3% murieron a causa del cáncer, con una SCE al primer y 5° año de 94.9% y 81.4%, respectivamente, éstos tuvieron mayor recurrencia (p=0.000), pérdida de peso al diagnóstico (p=0.030), mayor invasión linfovascular (p=0.006) y la SCE fue menor en estadios más avanzados (p=0.012) y en pacientes con índice de masa corporal (IMC) ≥30 (p=0.003). Se encontró asociación de SG con pT (p=0.001), invasión linfovascular (p=0.000), estadio (p=0.000), clasificación de la Organización Mundial de la Salud (OMS) (p=0.000) y edad mayor de 75 años (p=0.020).
Conclusión: El CCT-TUS es una enfermedad con alto riesgo de recurrencia y mortalidad. Corroboramos el potencial pronóstico de la clasificación AJCC, de la OMS, TNM, invasión linfovascular, edad, pérdida de peso e IMC.
Aims: To evaluate the prognostic role of clinicopathologic variables in patients with transitional cell carcinoma of the upper urinary tract (TCC-UUT) that were treated surgically.
Methods: A retrospective analysis was carried out using the database of 59 patients diagnosed with TCC-UUT that were operated on within the time frame of 1980 to 2012 in our institute. The clinical and histopathologic variables were analyzed and the length of time of disease-free survival (DFS), cancer-specific survival (CSS), and overall survival (OS) were measured.
Results: The mean follow-up period was 56.4 months. A total of 50.8% patients had disease recurrence. The mean DFS was 42.9 months, 70% had disease recurrence in the first year, and 96.7% at 5 years. Patients with stage III and IV disease had greater recurrence (p=0.020). A total of 20.3% patients died from the cancer and the CSS rate was 94.9% the first year and 81.4% the fifth year. These patients had greater disease recurrence (p=0.000), weight loss at the time of diagnosis (p=0.030), greater lymphovascular invasion (p=0.006), and CSS was lower in the more advanced stages (p=0.012) and in patients with a body mass index (BMI) ≥ 30 (p=0.003). OS was associated with pT (p=0.001), lymphovascular invasion (p=0.000), stage (p=0.000), the World Health Organization (WHO) classification (p=0.000), and age above 75 years (p=0.020).
Conclusions: TCC-UUT is a disease that has a high risk for recurrence and mortality. We corroborated the outcome potential of the American Joint Committee on Cancer (AJCC), the WHO, and the TNM classifications, as well as the factors of lymphovascular invasion, age, weight loss, and BMI.
Introducción
La incidencia del carcinoma de células transicionales de tracto urinario superior (CCT-TUS) es de 2 casos por cada 100,000 habitantes-año1, representa el 7% de los tumores renales y el 5% de los uroteliales2, es 2 veces más común en mujeres que en hombres3, tiene una recurrencia de 30% a 50%4, casi 2 veces mayor en varones, con una supervivencia cáncer-específica equiparable en ambos sexos.
La incidencia del CCT-TUS se ha incrementado en las últimas décadas5, esto probablemente se relacione con el incremento en la esperanza de vida de la población. Consistente con esto último, esta neoplasia pocas veces aparece antes de los 40 años y la edad de presentación promedio es a los 65 años2. El pronóstico global depende del estadio en el que se encuentra al momento del diagnóstico, con una supervivencia del 100% a los 5 años con estadio Ta y Tis, menos del 50% con estadio T2 y T3, y 10% con estadio T46-8. El tratamiento de elección es la nefroureterectomía radical abierta, aunque hoy en día se pueden considerar alternativas menos invasivas obteniendo los mismos resultados en supervivencia9.
Aunque se desconoce la causa de la enfermedad se han descrito factores relacionados con su etiología, como lo son el tabaco y la exposición laboral10. Los factores pronóstico los podemos clasificar en prequirúrgicos o clínicos, que comprenden: edad, raza, ECOG-PS (por sus siglas en inglés, Eastern Cooperative Oncology Group Performance Status), obesidad, hábito tabáquico, localización del tumor, hidronefrosis, síntomas, y antecedente de cáncer vesical; y posquirúrgicos o patológicos, destacando el estadio del tumor, el grado patológico, carcinoma in situ concomitante, invasión linfovascular, tumor multifocal, arquitectura del tumor, tamaño del tumor, afección de ganglios linfáticos y necrosis tumoral11.
El propósito de este estudio es evaluar de manera retrospectiva el papel pronóstico de las variables clínicas y patológicas de una cohorte de pacientes con CCT-TUS, tratado quirúrgicamente.
Material y métodos
Analizamos de forma retrospectiva la base de datos de 82 pacientes con CCT-TUS tratados con nefroureterectomía entre los años 1980 a 2012, en el Instituto Nacional de Ciencias Médicas y Nutrición "Salvador Zubirán". Fueron excluidos los pacientes con diagnóstico histológico diferente a CCT-TUS.
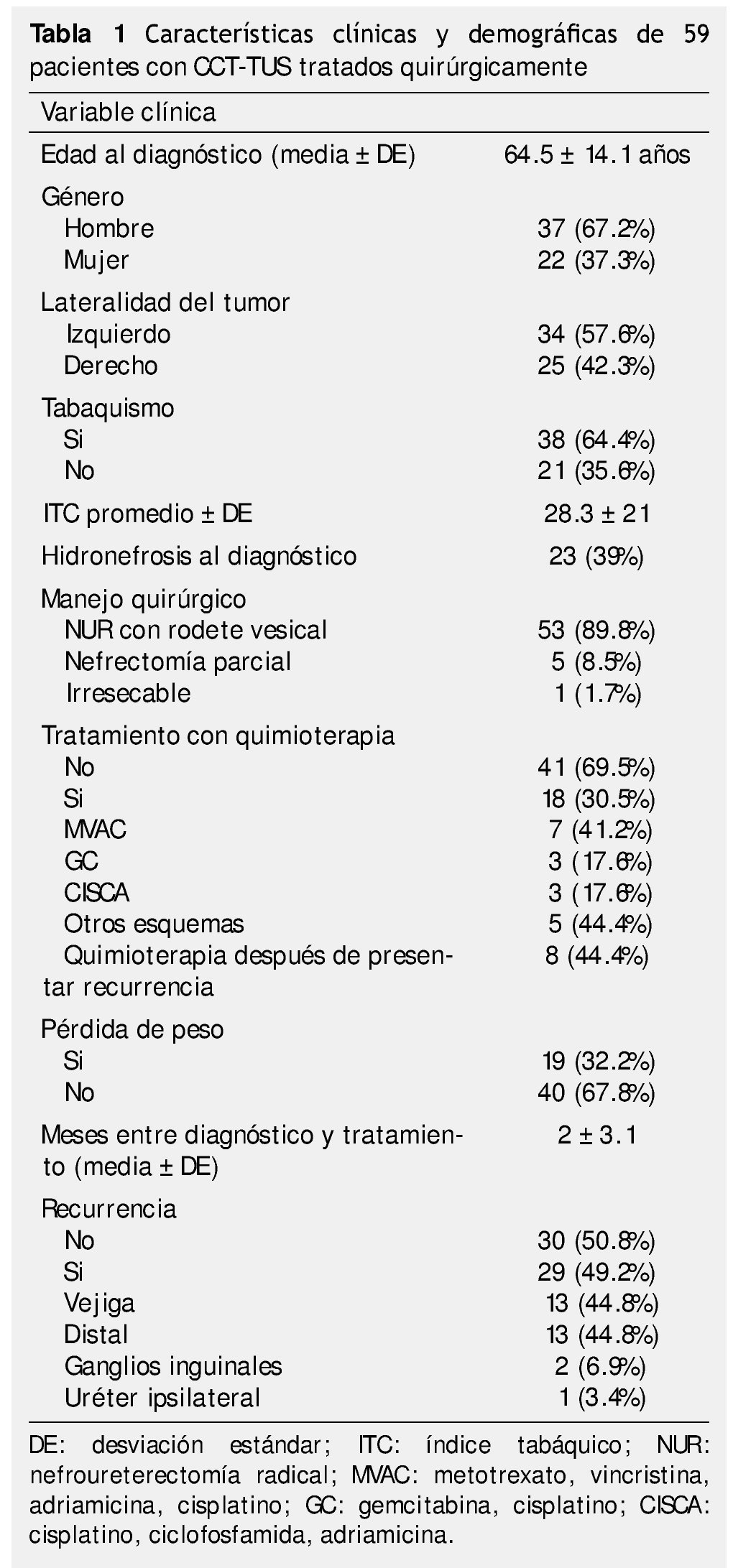
Las variables evaluadas fueron: género, edad, lateralidad del tumor, tabaquismo, hidronefrosis, pérdida de peso, índice de masa corporal (IMC), meses transcurridos entre diagnóstico y tratamiento quirúrgico, tipo de quimioterapia recibida, estadio patológico según la AJCC (por sus siglas en inglés, American Joint Committee on Cancer), grado histológico, bordes, clasificación histopatológica de la Organización Mundial de la Salud (OMS), multifocalidad y recurrencia. El estadio se determinó mediante la clasificación TNM 2002.
El análisis estadístico se realizó mediante las pruebas de ji cuadrada y t de Student para comparar promedios y proporciones. Se evaluó la ubicación y número de recurrencias. Los desenlaces evaluados fueron la supervivencia libre de enfermedad (SLE), supervivencia cáncer-específica (SCE) y supervivencia global (SG), las cuales fueron calculadas mediante el método de Kaplan-Meier y la compensación de estos resultados con la prueba de Mantel-Cox. Los intervalos de supervivencia fueron calculados a partir de la cirugía a la recurrencia de la enfermedad o la muerte, por cáncer o por otra causa. Se realizó análisis univariado y multivariado con el modelo de riesgos de proporciones de Cox, para evaluar el valor pronóstico de las variables previamente mencionadas. Se consideró estadísticamente significativo un valor de p<0.05. Todos los análisis se realizaron con el paquete estadístico para ciencias sociales SPSS® versión 17 (SPSS Inc, Chicago, Il, EEUU).
Resultados
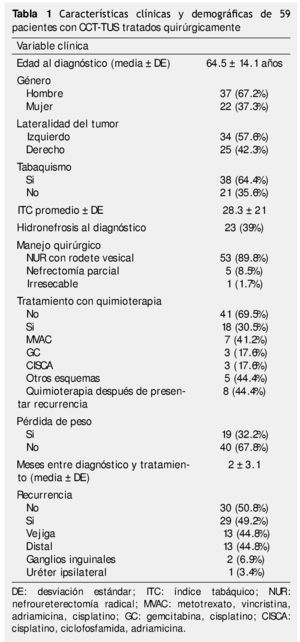
Se identificaron 82 pacientes diagnosticados con CCT-TUS tratados quirúrgicamente en el periodo comprendido entre 1980 a 2012, de los cuales, 59 tuvieron información y seguimiento completo. La muestra estuvo integrada por 37 hombres (62.7%) y 22 mujeres (37.3%); el rango de edad se encontró entre 24 y 87 años. El seguimiento promedio fue de 56.4 meses (mediana de 28 meses, rango de uno a 345 meses). El resumen de características clínicas y demográficas se encuentra en la tabla 1.
Características histopatológicas
El 16.9% (n=10) de los casos se diagnosticaron en un estadio IV, con un predominio de alto grado según la clasificación de la OMS, la mayoría de los casos tenía estadios tempranos pTa/pTis/pT1 39%, pN0 32.2% y M0 con 94.9%; se obtuvieron bordes positivos en un 30.5% de las muestras obtenidas (tabla 2).
Recurrencia
Durante el seguimiento, 50.8% (n=30) tuvieron recurrencia, con un tiempo promedio de recidiva de 42.9 ± 75.3 meses, 44.8% (n=13) recurrió en vejiga, 44.8% (n=13) tuvo recurrencia a distancia, 3.4% (n=1) recurrió en el uréter ipsilateral y el 6.9% (n=3) tuvo recurrencia en ganglios inguinales.
El 44.4% de los pacientes de los que recurrieron, recibieron quimioterapia adyuvante. De todos los pacientes que presentaron recurrencia, 70% (n=21) la presentaron en el primer año, y el 96.7% (n=29) a los 5 años. Cuando se estratificó con la clasificación de la AJCC, el estadio I recurrió 30.4% (n=7) en el primer año y 34.8% (n=8) al 5° año después de la cirugía, en el estadio II 25% (n=2) y 50% (n=4), el estadio III recurrió 38.9% (n=7) y 61.1% (n=11), respectivamente, y el estadio IV recurrió 60% (n=6), todos en el primer año de seguimiento (p=0.020).
Supervivencia cáncer-específica
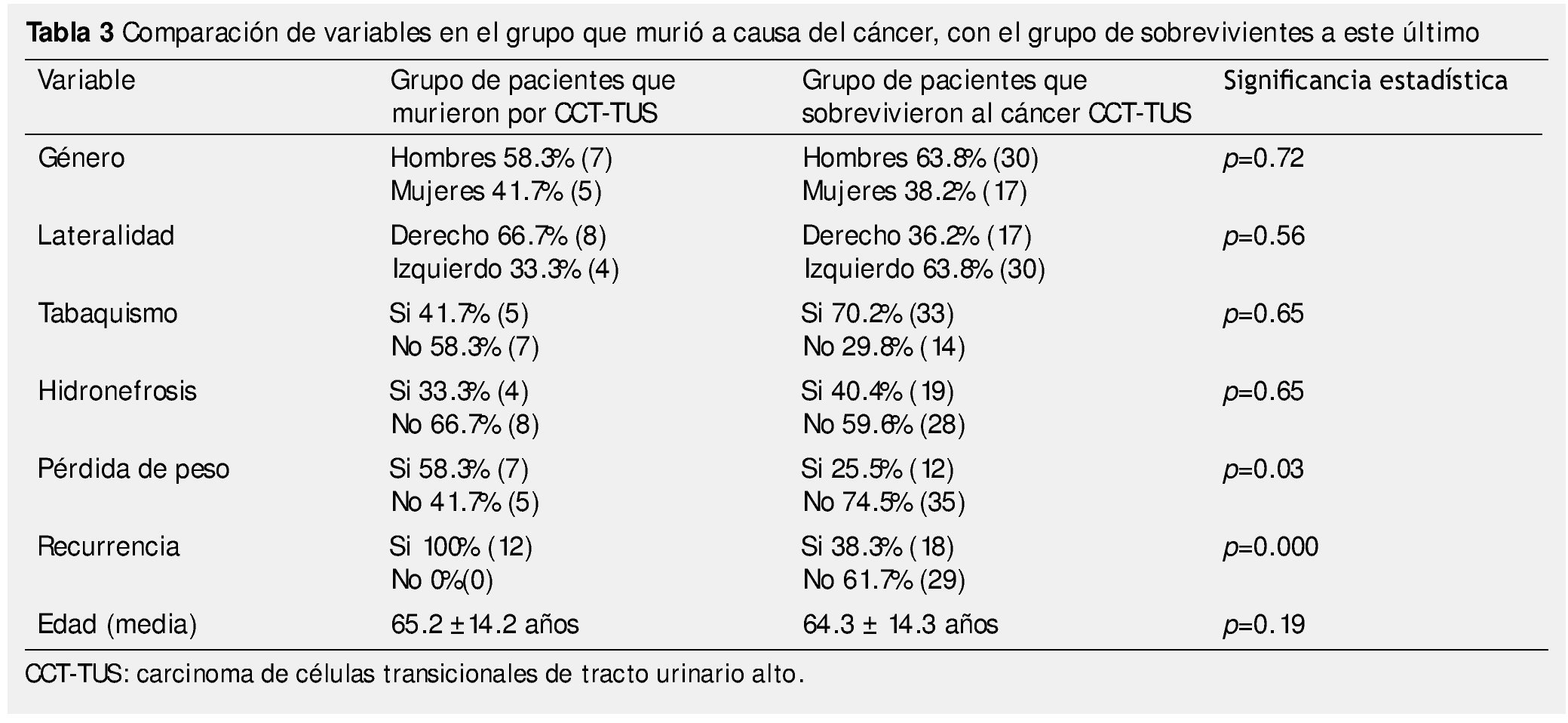
De los pacientes en seguimiento, 20.3% (n=12) murieron a causa del cáncer, con una SCE promedio de 24.6 ± 20.3 meses (mediana de 20, rango de 4 a 80 meses). Todos los pacientes presentaron recurrencia, en comparación con los que no murieron por CCT-TUS, que sólo recurrió el 38.3% (n=18) (p=0.000); el 58.3% de los que murieron por cáncer tuvieron pérdida de peso al diagnóstico, en los supervivientes lo tuvo el 25.5% (p=0.03) (tabla 3).
La SCE en el primer y 5° año fue de 94.9% (n=56) y 81.4% (n=48), respectivamente. Cuando lo estratificamos por estadio patológico según la AJCC encontramos 96.6% y 94.1% en el estadio I, 100% y 91.5% en estadio III, 96.6% y 93.2% en estadio IV, respectivamente (p=0.012); las causa de muerte en pacientes con estadio II fueron diferentes al cáncer. La SCE en pacientes con invasión linfovascular fue de 50% al año y 0% a los 5 años y los que no tuvieron dicha condición fue de 87.5% y 12.5%, respectivamente (p=0.006), de los pacientes con IMC ≥30 Kg/m2, la SCE al año fue de 33.3% en comparación con el 88.9% de los pacientes con IMC <30 Kg/m2 (p=0.003) (tabla 3).
Supervivencia libre de enfermedad
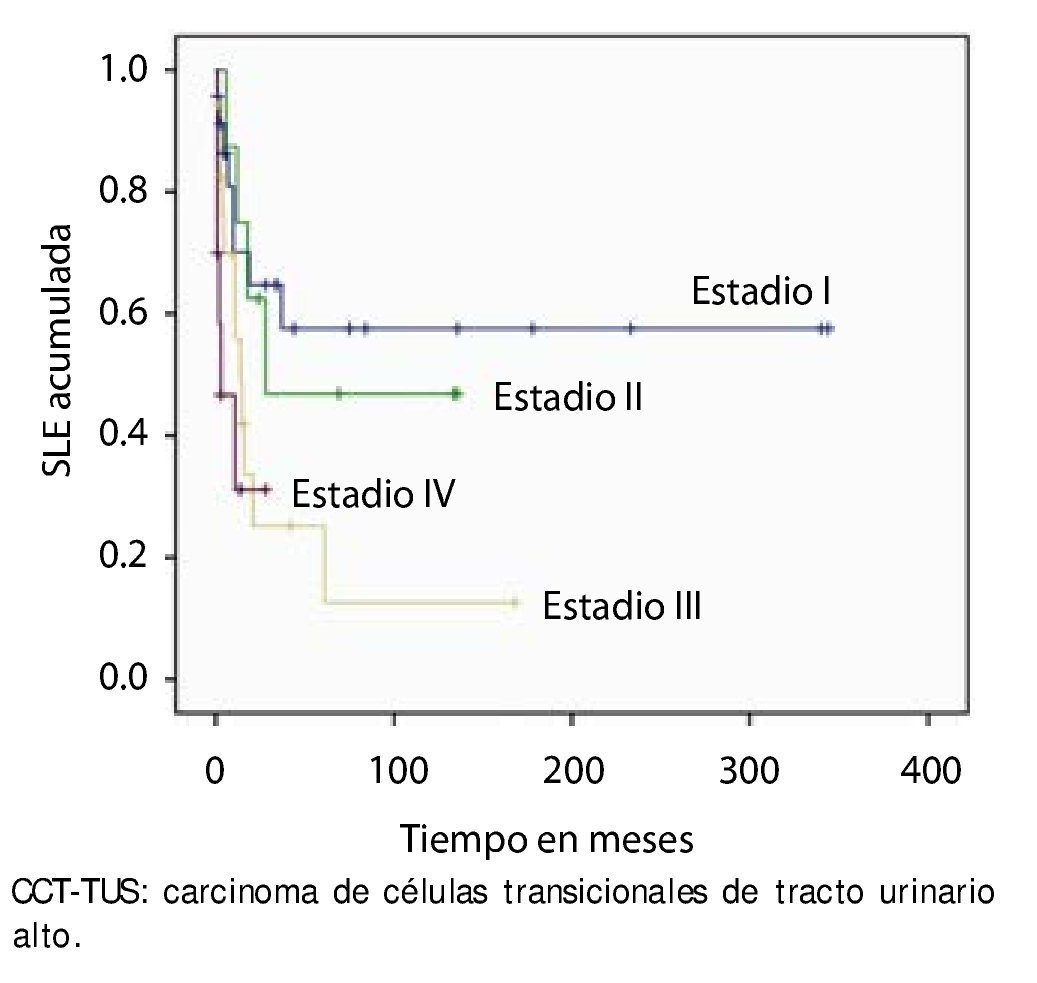
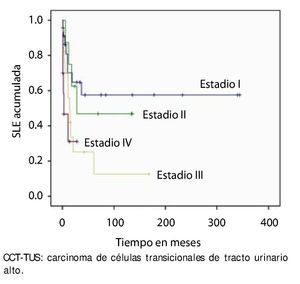
En la muestra estudiada, la SLE fue de 86.4% (n=51) al año y 49.2% (n=29) a los 5 años. Se estratificó con la clasificación de la AJCC y observamos que el estadio I tuvo una SLE al primer año del 70.1% y 57.5% al 5° año, en el estadio II fue de 75% y 50%, en estadio III 55.9% y 25%, y el estadio IV 31.1% al primer y 5° año, respectivamente (p=0.020) (fig. 1).
Figura 1. Supervivencia libre de enfermedad por estadio patológico final en 59 pacientes con CCT-TUS.
Factores pronósticos
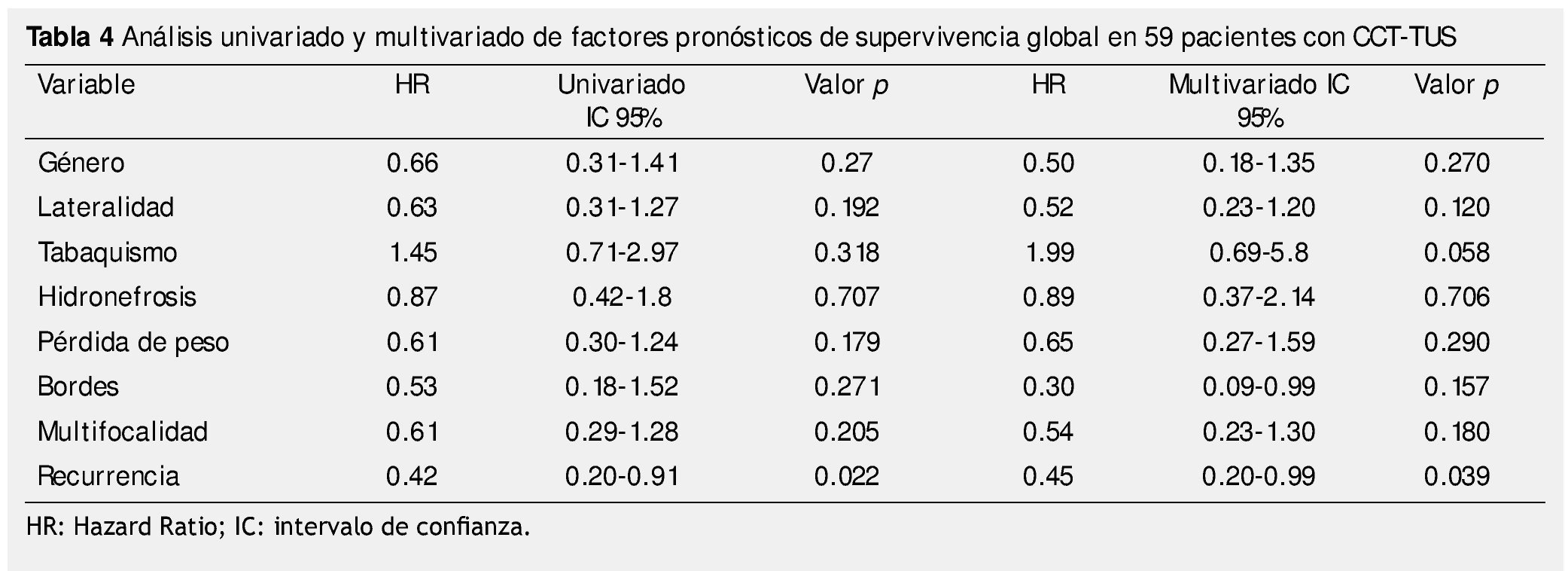
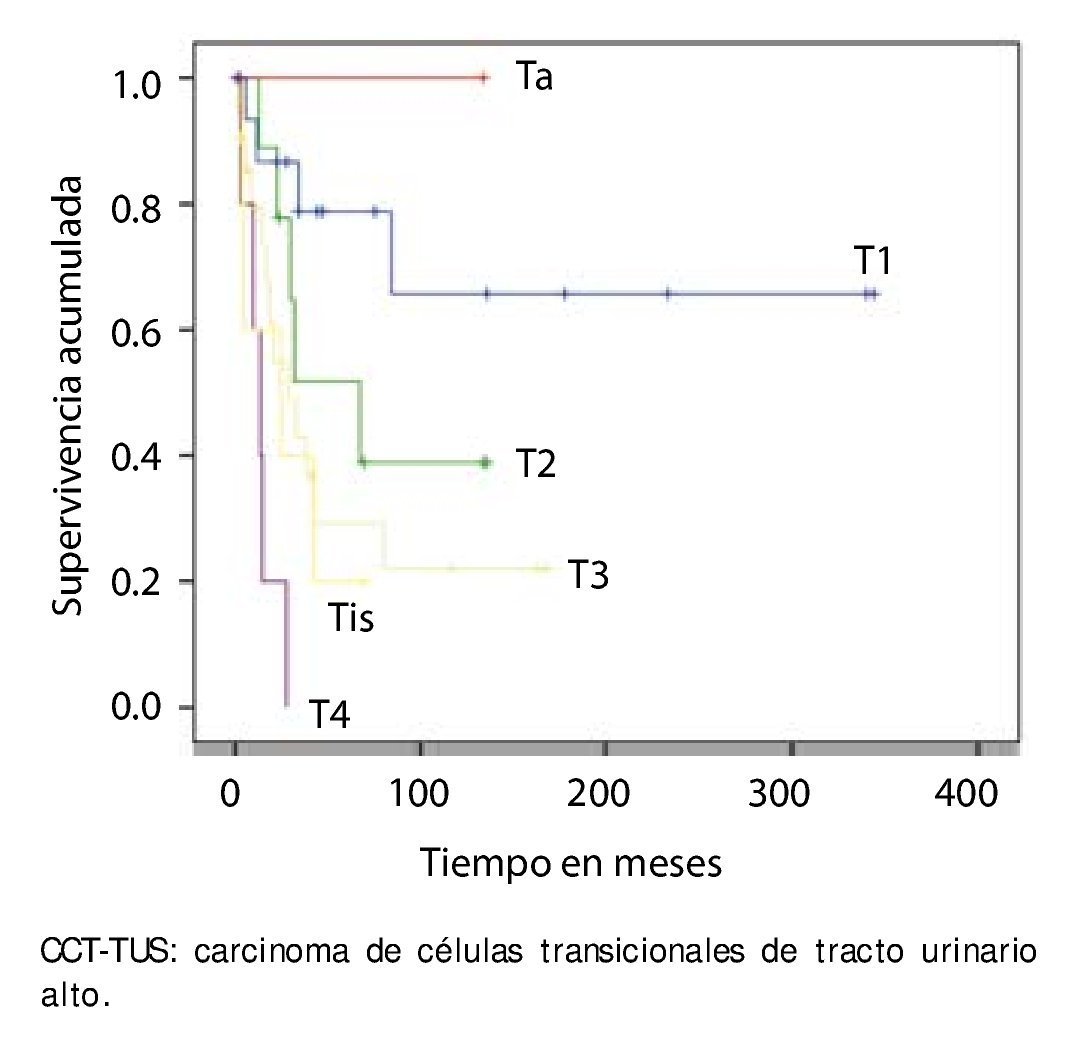
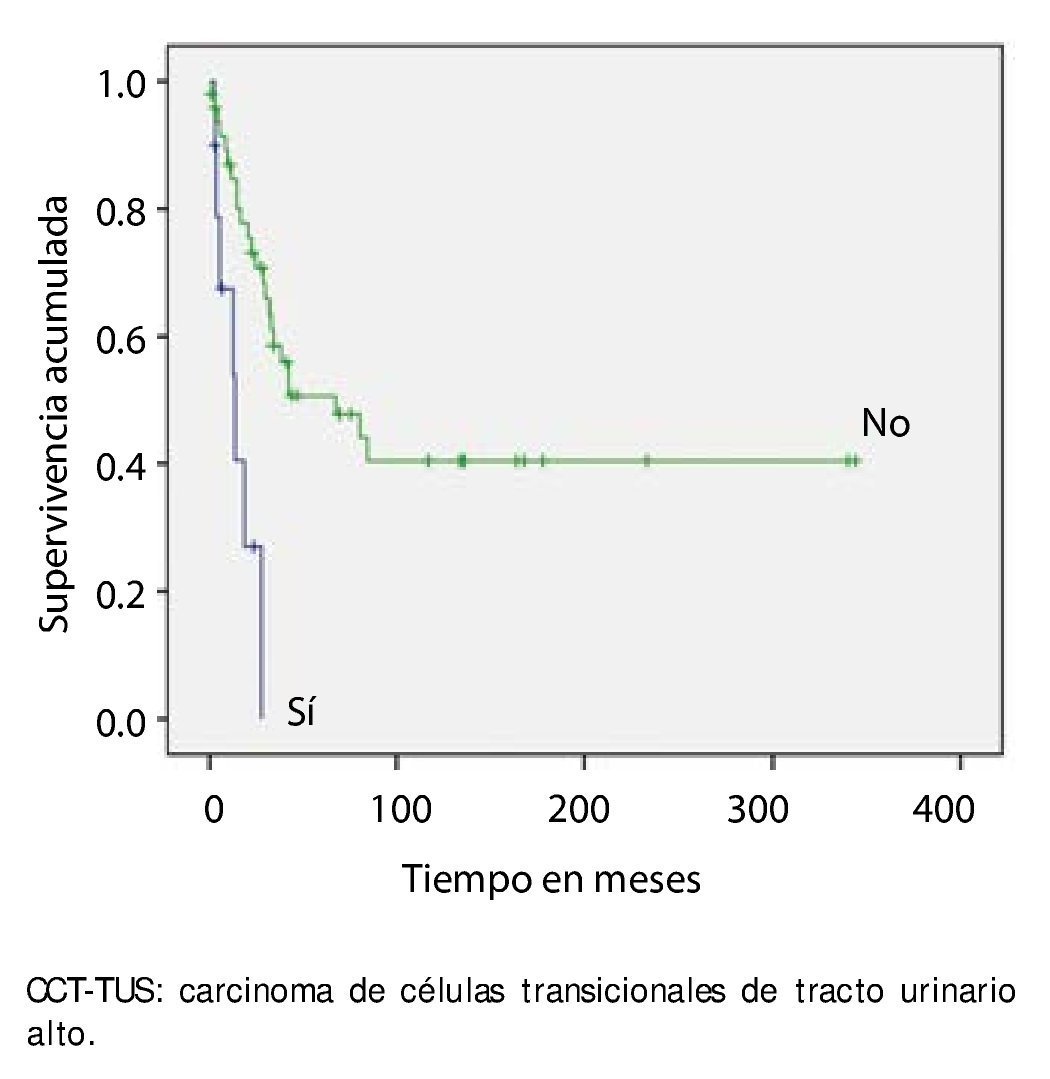
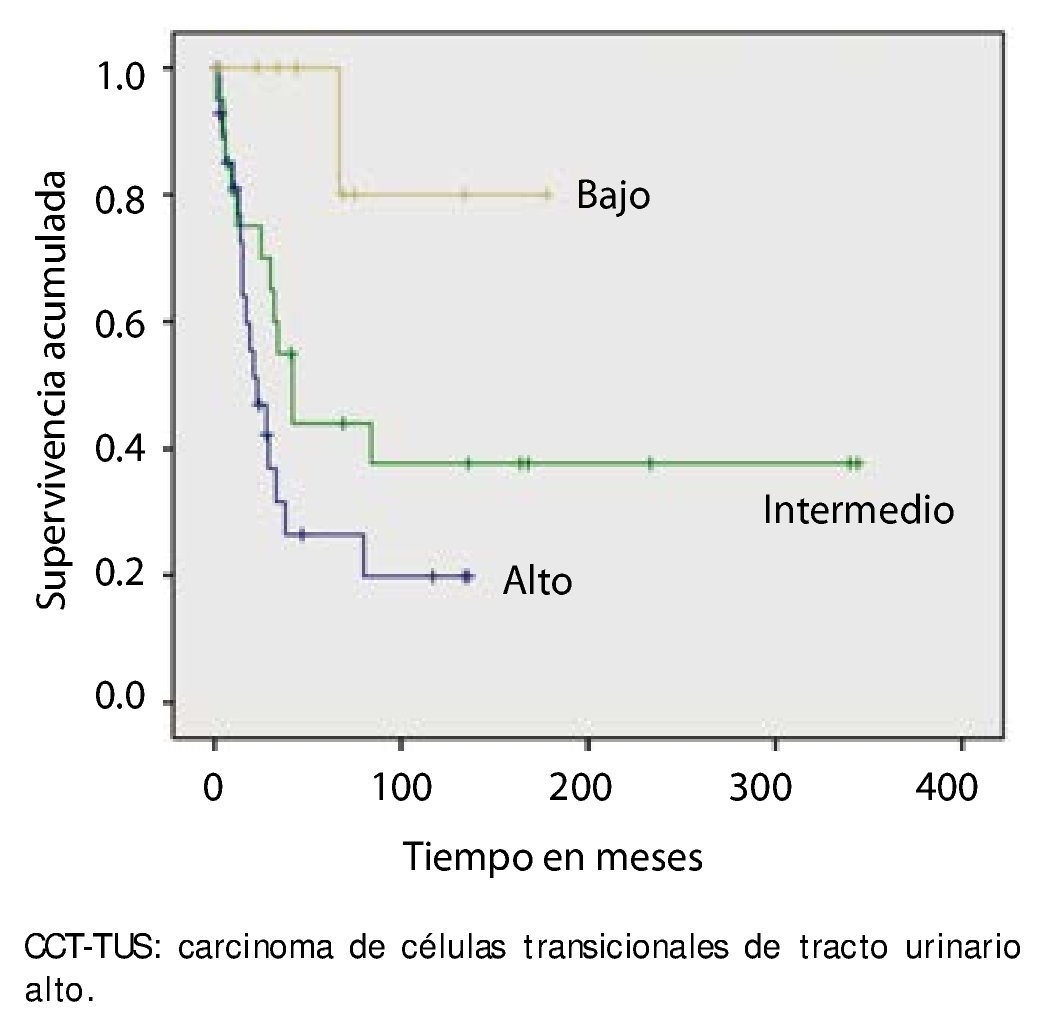
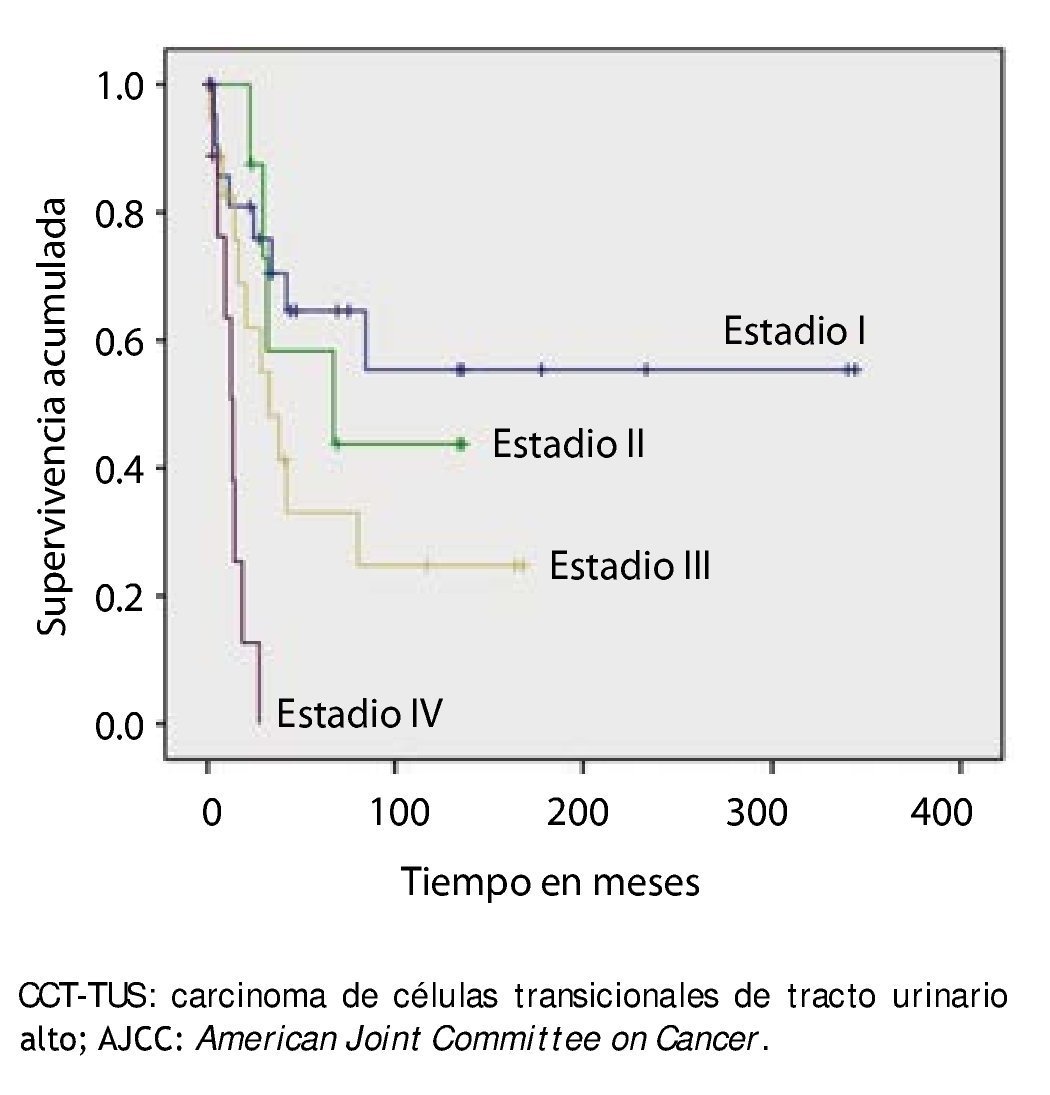
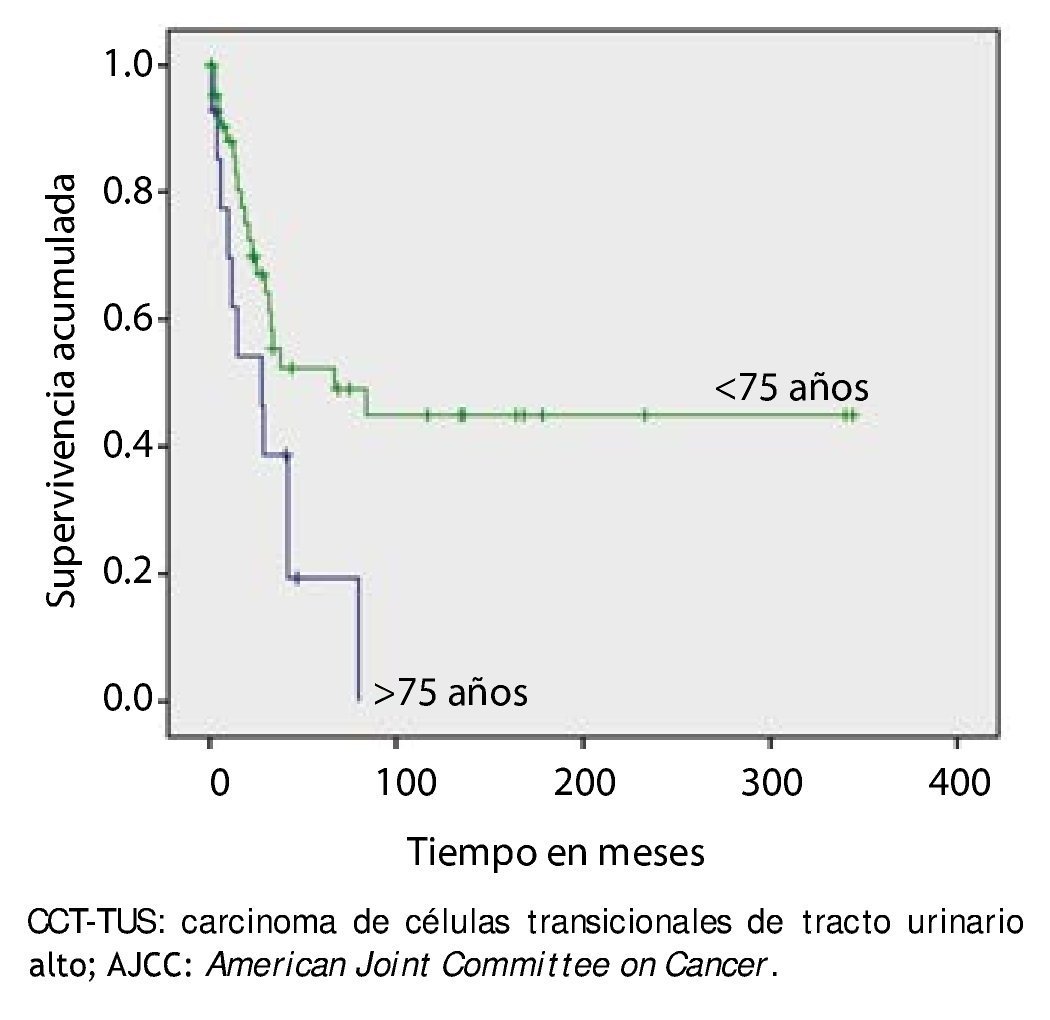
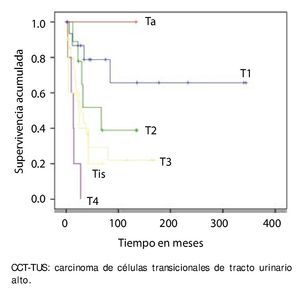
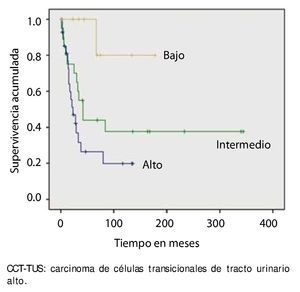
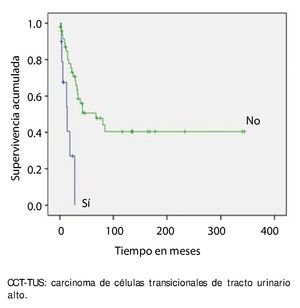
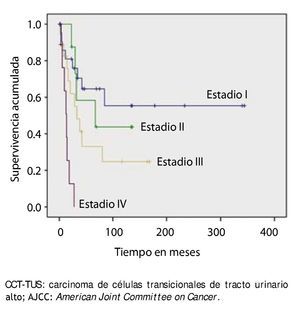
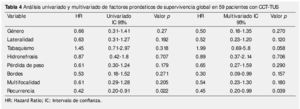
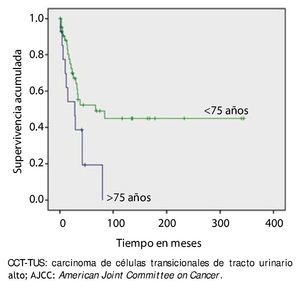
La supervivencia al año y a los 5 años según pT fue de 100% para Ta, 86.7% y 80% para T1, 100% y 55.6% para T2, 81.0% y 42.9 para T3, 60% y 0% para T4 y 60% y 20% para Tis, respectivamente (p=0.001) (fig. 2). Con la clasificación de la OMS observamos una supervivencia en los mismos lapsos de tiempo de 100% con bajo grado, 75% y 45% con grado intermedio, y 82.1% y 39.3% con alto grado (p=0.000) (fig. 3). En los pacientes que tuvieron invasión linfovascular observamos una supervivencia de 70% (n=7) y 30% (n=3), en comparación con el 85.7% y de 57.7% de los que no tuvieron (p<0.001) (fig. 4). La supervivencia al primer y 5° año fue de 81% y 64.6% para el estadio I, 100% y 58.3% en el estadio II, 82.5% y 33% en estadio III y, 63.5% y 0% en el estadio IV de la clasificación de la AJCC, respectivamente (p<0.001) (fig. 5) (tabla 4). La edad fue un factor determinante de supervivencia, en los pacientes mayores de 75 años tuvieron una sobrevida de 61.9% al año y 19.3% a los 5 años, en comparación con 87.9% y 52.3% en menores de esta edad (p=0.020) (fig. 6).
Figura 2. Supervivencia global por pT en 59 pacientes con CCTTUS.
Figura 3. Supervivencia global en 59 pacientes con CCT-TUS, estadificados con la clasificación de la OMS.
Figura 4. Supervivencia global en 59 pacientes con CCT-TUS con invasión linfovascular.
Figura 5. Supervivencia global en 59 pacientes con CCT-TUS, estadificados con la clasificación AJCC.
Figura 6. Supervivencia global en 59 pacientes con CCT-TUS mayores de 75 años.
Discusión
El cabal conocimiento de la historia natural de la enfermedad permite el desarrollo de una terapéutica efectiva, por tanto, vislumbrar los factores pronósticos es una tarea fundamental para dicho fin, el desenlace del CCT-TUS tratado quirúrgicamente tiene resultados heterogéneos, por lo que resulta difícil predecirlos. Hoy en día se encuentran disponibles estudios realizados con cooperativa multi-institucional, que han aportado factores pronósticos adicionales a la clasificación patológica tradicional12-15.
Nuestra muestra tuvo similitud con las características reportadas en otras series, la media de edad observada es de 64.5 años y la obtenida por Anderstrom con una serie de 49 pacientes fue de 65 años2,16, aunque en series más recientes se ha publicado una edad promedio de 70 años3,17. Encontramos una relación 2:1 en hombres respecto a las mujeres, como la realizada por Shariat en el 2011, donde se analizó de manera retrospectiva a 754 pacientes en diverso centros en Asia, Canadá y Europa, lo cual se confirmó en otras series18-20.
De los factores clínicos o prequirúrgicos, se han descrito características del paciente como la edad avanzada que predice una menor SCE, SLE y SG18,19; en nuestra serie encontramos que una edad mayor a 75 años tiene un impacto negativo en la SG, SLE y SCE, sin embargo en este estudio no fue significativo para las últimas 2 (p=0.020, p=0.222 y p=0.636, respectivamente); también el tabaquismo se ha descrito como un factor de recurrencia y de menor SCE21,22, en nuestra serie no obtuvimos significancia estadística (p=0.984 y p=0.228, respectivamente). De la misma forma, un IMC ≥30 Kg/m2 se ha asociado a una menor SG, SCE y SLE23, de las cuales obtuvimos significancia estadística en una menor SCE (p=0.003). El género es una característica clínica que no se ha asociado con la SG y SCE, se han realizado estudios multicéntricos en los que no se ha encontrado diferencia en la supervivencia y las características patológicas19,20, hecho corroborado con nuestros resultados.
Dentro de las características patológicas o postoperatorias que tienen un valor pronóstico en el CCT-TUS, las más importantes son el estadio, seguido del grado patológico24-26. En nuestra cohorte, estas 2 características fueron estadísticamente significativas (p=0.001 y p=0.000, respectivamente) con un importante impacto en la sobrevida (figs. 2 y 3). La invasión linfovascular es otro factor patológico de gran importancia27-30, en el 2007 en una serie de 135 pacientes, Kasutaka reportó una recurrencia de 33.3% en pacientes con invasión linfovascular, cifra comparable al 40% reportado en nuestra cohorte (p=0.053). De la misma manera reportaron que 31.2% de los pacientes finados por cáncer tuvieron invasión linfovascular; en nuestra cohorte la frecuencia fue del 33.3%, porcentaje significativamente superior al 10.9% de los que no murieron por cáncer, de los cuales Kasutaka reportó un 10.3%27. La invasión de ganglios linfáticos se ha reportado en detrimento de la SCE31,32, en nuestra cohorte encontramos que los pacientes con invasión a ganglios linfáticos tuvieron una SCE del 50% al año, en comparación con el 87.5% de los que no la presentaron (p=0.006), y de los que murieron por CCT-TUS, el 33.3% tuvo invasión a ganglios linfáticos. Bolenz en una serie de 432 pacientes reportó esta última cifra con un 58%32. Otro de los factores reportados con impacto negativo en la SCE es la multifocalidad del tumor33,34, y aunque nuestros resultado concuerdan con lo mencionado, no obtuvimos significancia estadística (p=0.121). Esto último muy probablemente se deba a que sólo 3 pacientes que tuvieron por causa de muerte el cáncer, presentaron además multifocalidad. Se han descrito otros factores postquirúrgicos importantes, como el tamaño del tumor, presencia de necrosis y carcinoma in situ concomitante35-38, sin embargo no los reportamos en este trabajo.
Las características de recurrencia también coinciden con lo descrito en estudios multicéntricos, donde la recurrencia en vejiga reportada en nuestra serie fue del 22% y en la literatura internacional se ha descrito una recurrencia del 18% al 37%39,40, aunque en otras series se ha llegado a reportar en un rango del 30% al 50%41,42.
La serie que reportamos es este artículo tuvo una SCE a 2 años de 88.1%, en la literatura internacional se ha reportado en un rango del 72%-95%43-45; en el 2008 en una serie de 60 pacientes en Tailandia se reportó una SCE de 86.3%46, es por esto y todo lo mencionado anteriormente que podemos considerar la información aquí reportada como confiable, sin embargo reconocemos las grandes limitaciones que tienen nuestros datos, empezando por la naturaleza propia del estudio, que con su carácter retrospectivo nos obliga a hacer interpretaciones con cautela, y por la naturaleza misma del CCT-TUS, ya que al ser una enfermedad con baja prevalencia, nos ofrece un número de pacientes reducido, razón por la que en el estudio, el análisis multivariado no proporcionó información adicional, y por último, lo que nunca se debe de olvidar al revisar cualquier tipo de estudio científico, la asociación estadística dista por mucho de una asociación causal.
Conclusión
Nuestros hallazgos confirman la relevancia de las características clínicas patológicas sobre la evolución oncológica del CCT-TUS, la clasificación AJCC, de la OMS, el TNM, invasión linfovascular, edad, pérdida de peso e IMC, son los factores pronósticos más importantes para el desenlace de la enfermedad.
La evaluación intencionada de estas variables y la búsqueda de nuevos factores pronósticos, nos permitirán integrar información detallada de la enfermedad, terapéutica y seguimiento que se ofrecerá a cada paciente.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Financiamiento
No se recibió patrocinio para llevar a cabo este artículo.
* Autor para correspondencia:
Instituto Nacional de Ciencias Médicas y Nutrición "Salvador Zubirán".
Vasco de Quiroga N° 15, Colonia Sección XVI, Delegación Tlalpan, C.P. 14000, México D.F., México.
Teléfono: 5487 0900, ext. 2145, 2260. Fax: 54854380.
Correo electrónico: francisco.rodriguezc@quetzal.innsz.mx (F. Rodríguez-Covarrubias).