La prostatectomía radical+linfadenectomía pélvica puede mejorar la supervivencia libre de progresión y supervivencia cáncer-específica en la enfermedad ganglionar.
ObjetivoAnalizar las características de los pacientes con enfermedad ganglionar en el análisis histopatológico de la prostatectomía radical.
Material y métodosEstudio retrospectivo de pacientes sometidos a prostatectomía radical con enfermedad ganglionar metastásica de 1988 a 2015.
ResultadosSe incluyeron 25 pacientes, de 66.5 años (DE±6.5); antígeno prostático específico medio de 20.17ng/dL (RIC: 18); con una mediana de seguimiento en 63 meses (RIC: 86). Clasificación de riesgo por D’Amico, 15 (60%) pacientes de alto, 8 (32%) intermedio y 2 (8%) de riesgo bajo. Se encontraron márgenes positivos en 15 casos (60%); estadio tumoral T2 en 4 (16%), T3A en 3 (12%), T3B en 17 (68%) y T4 en 1 (4%); cantidad de ganglios positivos, uno en 14 (56%), 2 en 3 (12%) y más de 2 en 8 (32%) casos. Recibieron radioterapia 3 pacientes (16%) y bloqueo hormonal 24 (96%). La supervivencia libre de progresión fue de 105 meses y la supervivencia cáncer-específica fue del 86 y 45% a 5 y 10 años respectivamente. El HR para progresión bioquímica fue significativo en márgenes positivos (HR: 9.5, IC95%: 0.99-91.5, p=0.50) y ≥2 ganglios positivos (HR: 8.5, IC95%: 1.1-61.9, p=0.34). La afectación≥2 ganglios predijo progresión con una OR de 7.2 (IC95% 1.06-48.6, p=0.043).
ConclusionesLa supervivencia media a 5 años es superior al 80%. El número de ganglios positivos podría ser un factor predictor de progresión bioquímica.
Radical prostatectomy+pelvic lymph node dissection can improve progression-free survival and cancer-specific survival in lymph node disease.
AimTo analyze the characteristics of patients with lymph node disease in the histopathologic findings of the radical prostatectomy and lymph node dissection.
Material and methodsA retrospective study was carried out on patients that underwent radical prostatectomy with metastatic lymph node disease within the time frame of 1988 to 2015.
ResultsThe study included 25 patients with a mean 66.5 years of age (SD±6.5), a mean prostate-specific antigen of 20.17ng/dl (IQR: 18), and a median follow-up period of 63 months (IQR: 86). According to the D’Amico classification, 15 (60%) patients were high-risk, 8 (32%) were intermediate-risk, and 2 (8%) were low-risk. Positive margins were found in 15 cases (60%); 4 (16%) patients had T2 tumor stage, 3 (12%) had T3A, 17 (68%) had T3B, and one patient (4%) had T4. Fourteen (56%) patients had one positive lymph node, 3 (12%) patients had 2 positive lymph nodes, and 8 (32%) patients had more than 2 positive lymph nodes. Three (16%) patients received radiotherapy and 24 (96%) underwent hormone blockade. Progression-free survival was 105 months and cancer-specific survival was 86% at 5 years and 45% at ten years. The HR for biochemical progression was significant in positive margins (HR: 9.5, 95% CI: 0.99-91.5, P=.50) and when there were≥2 positive lymph nodes (HR: 8.5, 95% CI: 1.1-61.9, P=0.34). Involvement of≥2 lymph nodes predicted progression with an odds ratio of 7.2 (95% CI: 1.06-48.6, P=.043).
ConclusionsThe average 5-year survival was above 80%. The number of positive lymph nodes could be a predictive factor for biochemical progression.
La presencia de enfermedad nodal es un hallazgo patológico adverso, pero no todos los pacientes están en el mismo riesgo de recurrencia bioquímica y supervivencia cáncer-específica1,2. La población con enfermedad ganglionar de bajo volumen tratada con cirugía radical y tratamiento adyuvante ha demostrado tener resultados a largo plazo tan favorables como los que no tienen involucramiento ganglionar1,3. Estos estudios están basados en que el cáncer de próstata con ganglios positivos no es siempre igual a enfermedad sistémica e incurable2,4,5. Actualmente la práctica de suspender la prostatectomía por hallazgo de ganglios positivos transoperatorios ya no está sustentada por la evidencia científica6,7.
Al encontrar involucramiento ganglionar en la prostatectomía radical, la recomendación actual es la terapia de privación androgénica con o sin radioterapia o el manejo expectante en casos seleccionados8.
Reportamos los resultados a largo plazo en pacientes mexicanos con enfermedad ganglionar hallada en la prostatectomía radical.
ObjetivoObjetivo primarioEvaluar las características y resultados oncológicos de los pacientes con cáncer de próstata y metástasis ganglionares detectadas en la prostatectomía radical con linfadenectomía pélvica.
Objetivos secundariosAnalizar los factores pronósticos asociados a progresión del cáncer o supervivencia cáncer-específica.
Material y métodosRevisión retrospectiva de los expedientes clínicos de 474 pacientes operados de prostatectomía radical entre los años 1988 a 2015 en nuestra institución. Los individuos con enfermedad ganglionar posterior a la cirugía fueron 28 (5.9%). Los procedimientos quirúrgicos fueron realizados por un solo grupo de urólogos. Fueron utilizados el sistema de clasificación TNM 2009 y el puntaje de Gleason. Se excluyeron aquellos casos con información incompleta o seguimiento posquirúrgico menor a un mes. Se obtuvo aprobación por el comité institucional.
La persistencia bioquímica se definió como un valor del antígeno prostático específico (APE)>0.2ng/ml después de la cirugía. La progresión del cáncer de próstata fue definida como resistencia a la castración bioquímica; recurrencia local o aparición de enfermedad metastásica ósea, visceral o ganglionar no relacionada a la linfadenectomía pélvica. Recurrencia bioquímica fue definida como, niveles de castración sérica con testosterona<50ng/dL o 1.7nmol/L más progresión bioquímica, es decir 3 mediciones consecutivas del APE con una semana de separación que resultó en 2 incrementos del 50% sobre el nadir, con un APE>2ng/mL; o progresión radiológica, que es la aparición de 2 o más nuevas lesiones óseas en el gammagrama óseo o crecimiento de lesiones en tejidos blandos usando los criterios Response Evaluation Criteria in Solid Tumours (RECIST).
El objetivo primario consistió en describir las características de la población pre y postoperatorias, la supervivencia global, cáncer-específica y supervivencia libre de progresión. El objetivo secundario fue evaluar la relación de estos resultados con factores clínico-patológicos como el nivel del APE al diagnóstico, el puntaje de Gleason patológico, estadio tumoral, márgenes quirúrgicos, número de ganglios afectados así como determinar el grado de concordancia del Gleason de la biopsia y el quirúrgico. El puntaje de Gleason se categorizó en<7 y≥7. El número de ganglios positivos se categorizo en uno, 2 o 3 o más.
El análisis descriptivo fue reportado como media y desviación estándar, mediana con rango intercuartílico o proporción basada en el tipo de dato y distribución. La comparación fue hecha usando Chi-cuadrada o prueba exacta de Fisher para las variables categóricas, y pruebas paramétricas y no-paramétricas para variables continuas según el caso. La supervivencia postoperatoria se estimó usando el método de Kaplan-Meier y la diferencia entre estas se determinó por Log Rank. El impacto de los factores clínico-patológicos fue analizado usando el modelo de los riesgos proporcionales de Cox. El grado de concordancia entre los puntajes de Gleason pre y poscirugía se calculó mediante el coeficiente de Kappa. Para evaluar si los factores clínico-patológicos previamente descritos predicen la progresión se utilizó un modelo de regresión logística binaria univariado y multivariado.
El análisis estadístico se realizó con el programa estadístico IBM SPSS versión 22. Todos los resultados fueron de 2 colas y los valores de p<0.05 se consideraron estadísticamente significativos.
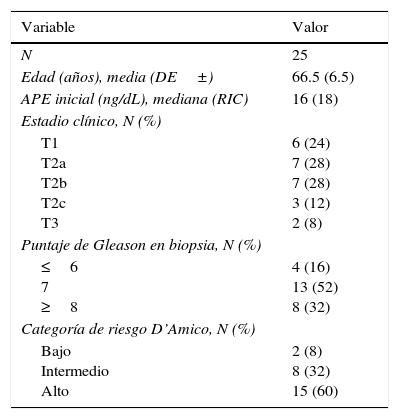
ResultadosSe analizaron 25 pacientes, fueron excluidos 3 casos, 2 por no contar con información completa y uno por tener menos de un mes de seguimiento. Las características de la población se encuentran enlistadas en la tabla 1. La mediana de seguimiento fue de 63 meses (rango intercuartílico 86 meses). En la tabla 2 se describen los hallazgos histopatológicos de la cirugía.
Características preoperatorias de los pacientes con enfermedad ganglionar positiva posprostatectomía
| Variable | Valor |
|---|---|
| N | 25 |
| Edad (años), media (DE±) | 66.5 (6.5) |
| APE inicial (ng/dL), mediana (RIC) | 16 (18) |
| Estadio clínico, N (%) | |
| T1 T2a T2b T2c T3 | 6 (24) 7 (28) 7 (28) 3 (12) 2 (8) |
| Puntaje de Gleason en biopsia, N (%) | |
| ≤6 7 ≥8 | 4 (16) 13 (52) 8 (32) |
| Categoría de riesgo D’Amico, N (%) | |
| Bajo Intermedio Alto | 2 (8) 8 (32) 15 (60) |
APE: antígeno prostático específico; DE: desviación estándar; RIC: rango intercuartílico.
Hallazgos histopatológicos de la prostatectomía radical más linfadenectomía pélvica de los pacientes con enfermedad ganglionar positiva
| Variable | Valor |
|---|---|
| Puntaje de Gleason quirúrgico, N (%) | |
| ≤6 7 ≥8 | 3 (12) 6 (24) 15 (64) |
| Estadio tumoral (T patológico), N (%) | |
| T2 T3a T3b T4 | 4 (16) 3 (12) 17 (68) 1 (4) |
| Márgenes quirúrgicos positivos, N (%) | 15 (60) |
| Invasión perineural, N (%) | 19 (76) |
| Invasión perivascular, N (%) | 13 (52) |
| Extensión extracapsular, N (%) | 16 (64) |
| Invasión de vesículas seminales, N (%) | 18 (72) |
| Número de ganglios afectados, N (%) | |
| 1 | 14 (56) |
| 2 | 3 (12) |
| >2 | 8 (32) |
Recibieron radioterapia 4 pacientes (16%), adyuvante en 3 casos y salvamento solamente en uno. La terapia de privación androgénica fue administrada en 24 individuos (96%), de manera adyuvante en 20 pacientes y de salvamento en 4.
El puntaje de Gleason cambió en 17 pacientes (68%), aumentó en 13 (52%) y disminuyó en 4 casos (16%). En el 32% de la población no ocurrieron cambios. El coeficiente de Kappa para el grado de concordancia fue de 0.111 (p=0.259).
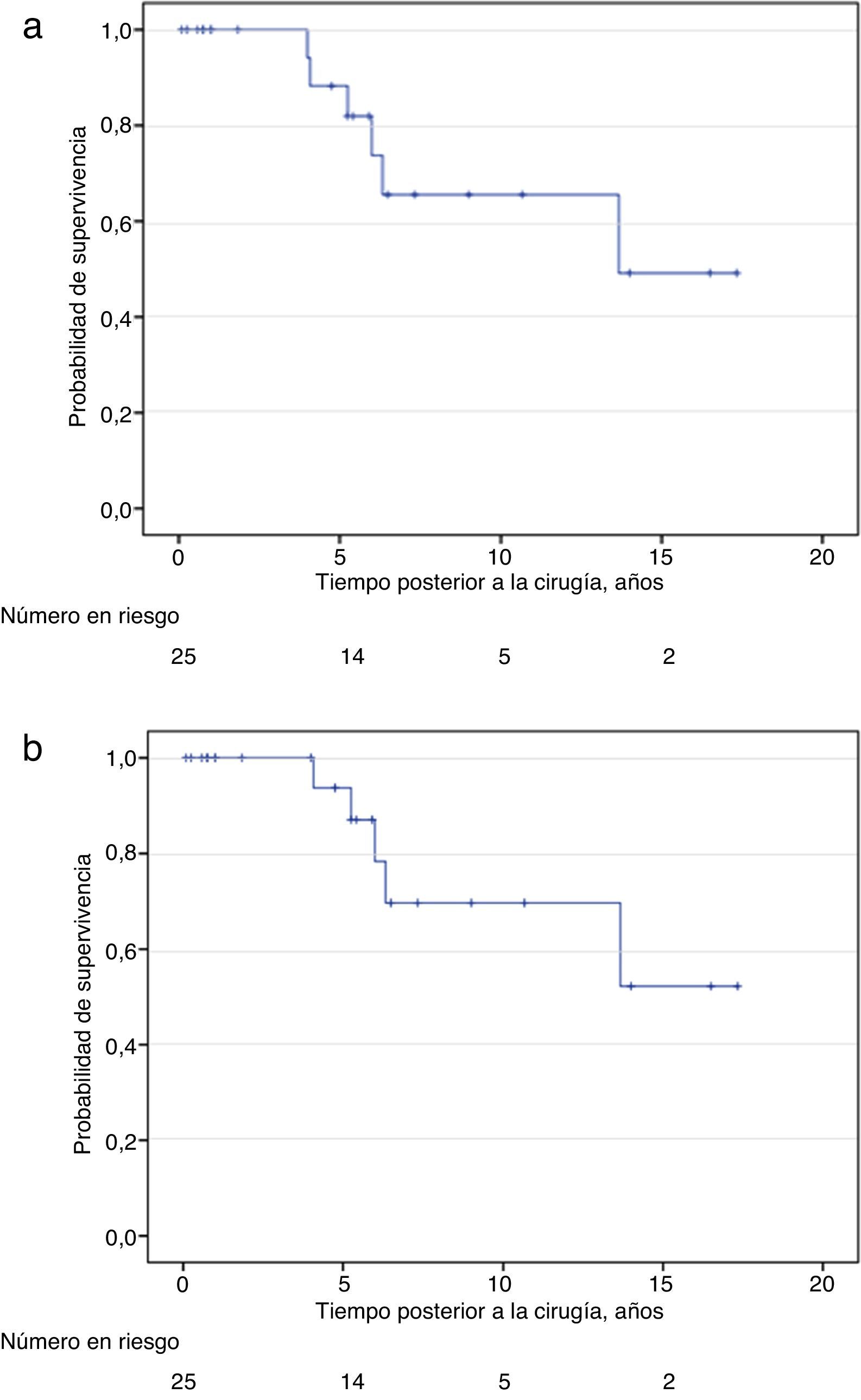
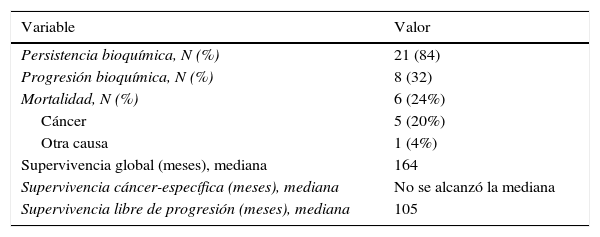
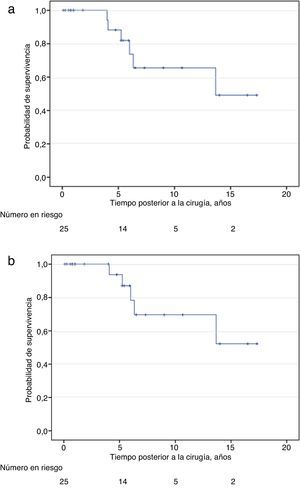
En la tabla 3 se resumen los principales resultados oncológicos. La supervivencia global a los 2, 5 y 10 años fue del 100%, 81% y 43% respectivamente (fig. 1a). Por otro lado, la supervivencia cáncer-específica a los 2, 5 y 10 años fue del 100%, 86% y 45% respectivamente (fig. 1b). En el análisis univariado no encontramos asociación entre los factores histopatológicos y supervivencia cáncer-específica (tabla 4). No hubo diferencias significativas en supervivencia cáncer-específica para el uso o no de radioterapia (Log Rank 0.99) o terapia de privación androgénica (Log Rank 0.53).
Resultados oncológicos posteriores a la prostatectomía en pacientes con enfermedad ganglionar positiva
| Variable | Valor |
|---|---|
| Persistencia bioquímica, N (%) | 21 (84) |
| Progresión bioquímica, N (%) | 8 (32) |
| Mortalidad, N (%) | 6 (24%) |
| Cáncer | 5 (20%) |
| Otra causa | 1 (4%) |
| Supervivencia global (meses), mediana | 164 |
| Supervivencia cáncer-específica (meses), mediana | No se alcanzó la mediana |
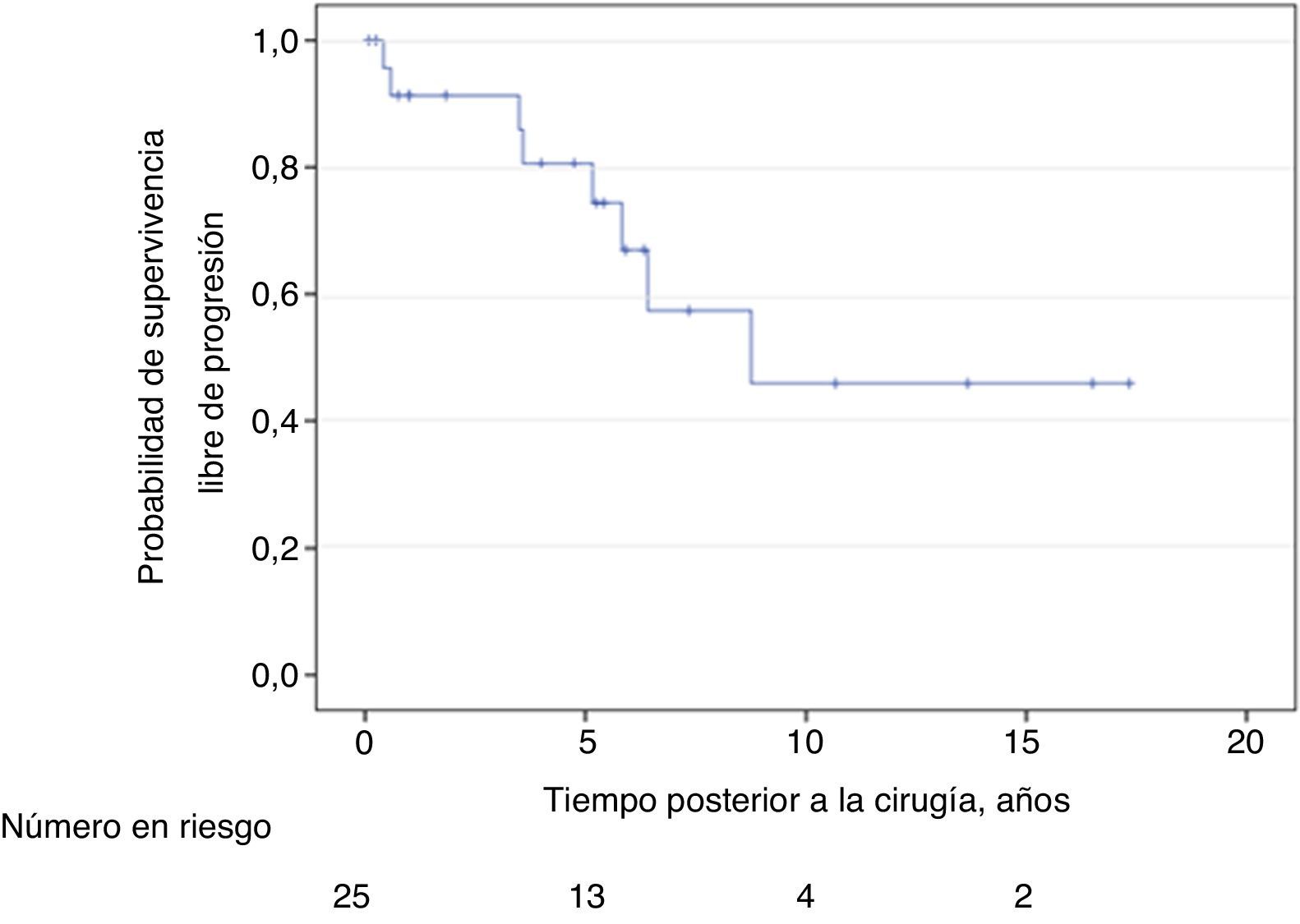
| Supervivencia libre de progresión (meses), mediana | 105 |
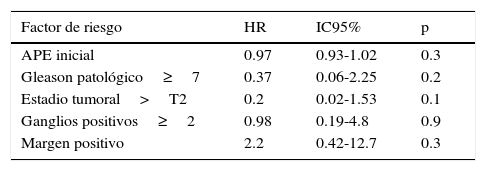
Análisis univariado de factores de riesgo asociados a mortalidad cáncer-específica posterior a la prostatectomía en pacientes con enfermedad ganglionar positiva
| Factor de riesgo | HR | IC95% | p |
|---|---|---|---|
| APE inicial | 0.97 | 0.93-1.02 | 0.3 |
| Gleason patológico≥7 | 0.37 | 0.06-2.25 | 0.2 |
| Estadio tumoral>T2 | 0.2 | 0.02-1.53 | 0.1 |
| Ganglios positivos≥2 | 0.98 | 0.19-4.8 | 0.9 |
| Margen positivo | 2.2 | 0.42-12.7 | 0.3 |
APE: antígeno prostático específico; HR: hazard ratio; IC: intervalo de confianza.
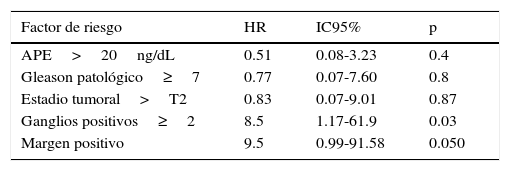
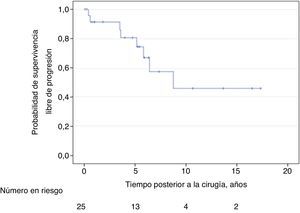
Ocho pacientes presentaron progresión del cáncer de próstata. Las probabilidades de permanecer libre de progresión bioquímica al primer, segundo, quinto y décimo año fueron del 91, 91, 67 y 46% respectivamente (fig. 2). La afectación de ≥2 ganglios y la positividad de los márgenes quirúrgicos se asociaron significativamente con incremento en el riesgo de progresión en un modelo de los riesgos proporcionales de Cox multivariado (tabla 5). No hubo diferencias significativas en supervivencia libre de progresión para el uso o no de radioterapia (Log Rank 0.69) o terapia de privación androgénica (Log Rank 0.44).
Análisis multivariado de factores de riesgo asociados a progresión posterior a la prostatectomía en pacientes con enfermedad ganglionar positiva
| Factor de riesgo | HR | IC95% | p |
|---|---|---|---|
| APE>20ng/dL | 0.51 | 0.08-3.23 | 0.4 |
| Gleason patológico≥7 | 0.77 | 0.07-7.60 | 0.8 |
| Estadio tumoral>T2 | 0.83 | 0.07-9.01 | 0.87 |
| Ganglios positivos≥2 | 8.5 | 1.17-61.9 | 0.03 |
| Margen positivo | 9.5 | 0.99-91.58 | 0.050 |
APE: antígeno prostático específico; HR: hazard ratio; IC: intervalo de confianza.
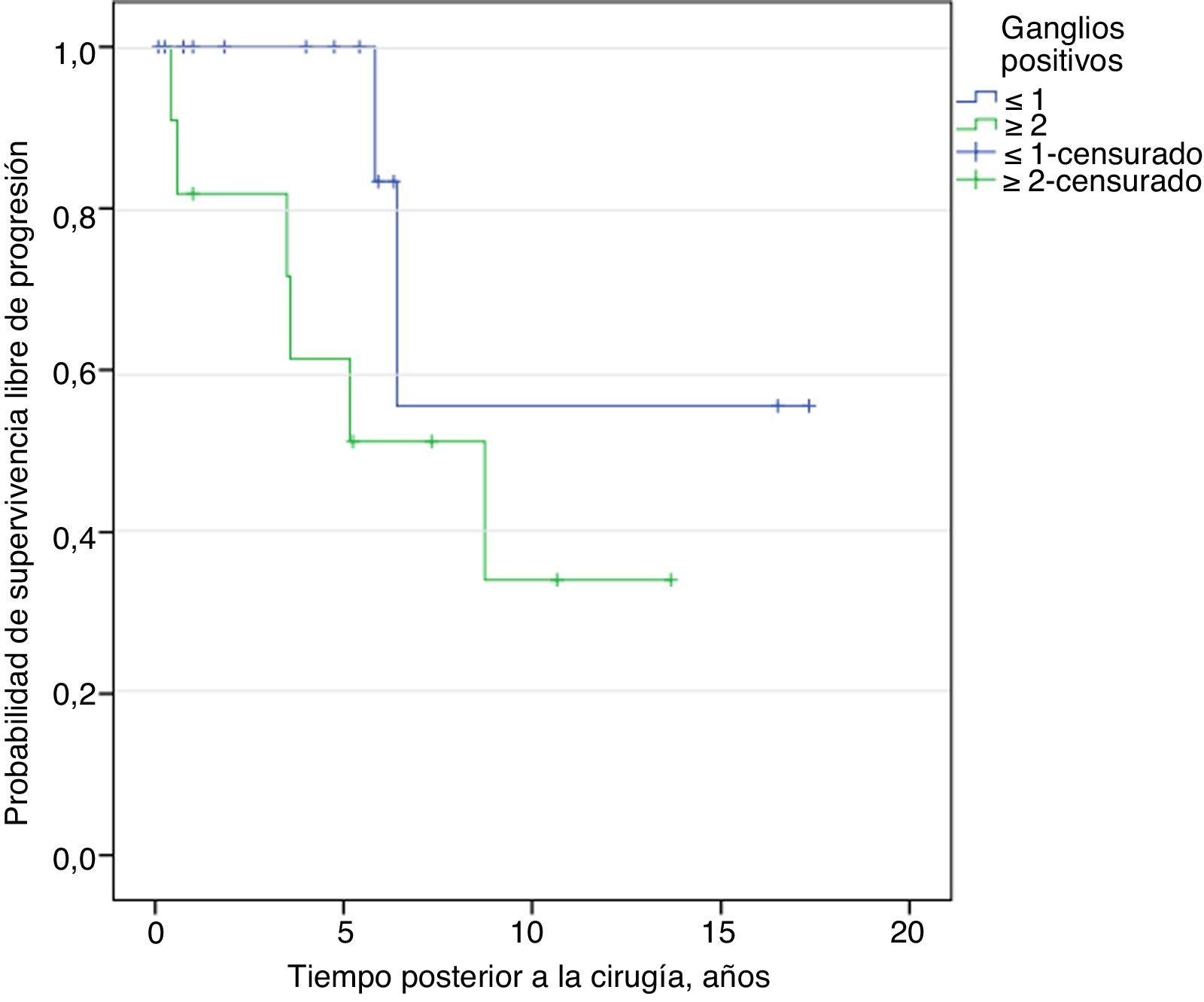
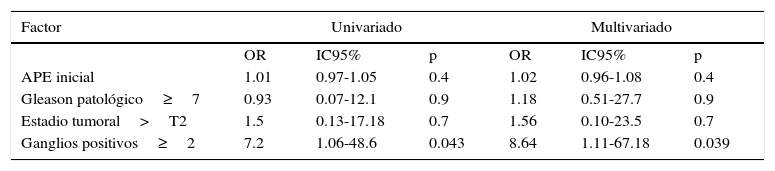
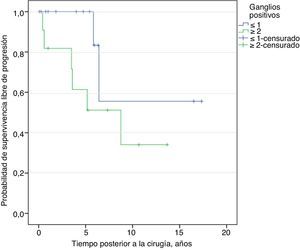
En el modelo de regresión logística binaria univariado y multivariado, se encontró que una afectación de≥2 ganglios predice la progresión del cáncer de próstata (tabla 6). No hubo diferencia en la supervivencia libre de progresión entre uno o más ganglios positivos (Log Rank 0.129) (fig. 3)
Modelo univariado y multivariado para predicción de progresión posterior a la prostatectomía en pacientes con enfermedad ganglionar positiva
| Factor | Univariado | Multivariado | ||||
|---|---|---|---|---|---|---|
| OR | IC95% | p | OR | IC95% | p | |
| APE inicial | 1.01 | 0.97-1.05 | 0.4 | 1.02 | 0.96-1.08 | 0.4 |
| Gleason patológico≥7 | 0.93 | 0.07-12.1 | 0.9 | 1.18 | 0.51-27.7 | 0.9 |
| Estadio tumoral>T2 | 1.5 | 0.13-17.18 | 0.7 | 1.56 | 0.10-23.5 | 0.7 |
| Ganglios positivos≥2 | 7.2 | 1.06-48.6 | 0.043 | 8.64 | 1.11-67.18 | 0.039 |
APE: antígeno prostático específico; OR: odds ratio; IC: intervalo de confianza.
El 5.9% de los individuos operados de prostatectomía radical tuvieron ganglios positivos, lo que corresponde a lo reportado en la literatura (5.8-10.6%)3,9. El 68% con enfermedad metastásica de bajo volumen (≤2)10. La menor incidencia de enfermedad ganglionar se atribuye a la implementación del APE en la práctica clínica11.
Los pacientes tuvieron características clínicas pre- y postoperatorias adversas, tales como riesgo alto por criterios de D’Amico (60%), puntaje de Gleason patológico≥8 (64%), estadio tumoral≥3 (84%), márgenes quirúrgicos positivos (60%), extensión extraprostática (64%) e invasión de las vesículas seminales (72%).
Por otro lado, el puntaje de Gleason preoperatorio, indispensable para la toma de decisiones terapéuticas, cambió en más de la mitad de los casos ya en el puntaje de Gleason quirúrgico. En nuestra población se encontró una concordancia baja (coeficiente de Kappa 0.111, p=0.259). Con relación a nuestros resultados, en un análisis de 7,643 pacientes se compararon los puntajes en la biopsia y prostatectomía radical donde encontraron que el 36% de los casos aumentó a un valor mayor y concluyen que en un cuarto de los tumores con Gleason 5-6 en la biopsia aumentarán a Gleason 7 o mayor en la prostatectomía radical12.
Los resultados oncológicos a largo plazo demostraron que existe persistencia bioquímica en el 84%; en un tercio de los casos (32%) progresó el cáncer, con una mediana de supervivencia libre de progresión de 8.7 años y tasas de supervivencia libre de progresión a 5 y 10 años del 67 y 46% respectivamente; la mortalidad fue del 24% y en su mayoría fue secundaria al cáncer de próstata (20%); la mediana de supervivencia global es de 13 años con tasas de supervivencia cáncer-específicas a 5 y a 10 años del 86 y 45% respectivamente. Recientemente, Touijer et al., en una cohorte de 369 pacientes con enfermedad ganglionar posprostatectomía encontraron que la mortalidad global fue del 17.3% de las cuales el 10% de estas fueron por cáncer; la supervivencia global y cáncer-específica a 10 años fue del 60 y 72% respectivamente; la probabilidad de supervivencia libre de metástasis y recurrencia bioquímica a 5 y 10 años fue del 65 y 28% respectivamente5. En otro estudio de 147 casos, el 33.3% progresaron, el 14.7% fallecieron por cáncer; las supervivencias globales y cáncer-específicas a 5 y 10 años fueron del 76.6 y 86.5% y 73.7 y 47.2% respectivamente, con supervivencia media global de 144 meses y 145 de supervivencia cáncer-específica media, la progresión a 5 y 10 años fue del 49.8 y 31.6% respectivamente13.
El 96% de los pacientes recibieron terapia de privación androgénica y solamente el 16% radioterapia. En nuestros resultados no hubo diferencias en supervivencia cáncer-específica o progresión al compararlos con el uso o no de cada modalidad de tratamiento, lo que podría estar relacionado con el bajo volumen de pacientes y las características de nuestro estudio. Por otro lado, en el 2011, Steuber et al., en 158 pacientes con cáncer de próstata clínicamente localizado y posterior hallazgo de enfermedad ganglionar, encontraron que la supervivencia global y cáncer-específica a 10 años fue del 77 y 61% para aquellos con terapia hormonal adyuvante y del 61 y 31% para aquellos sin terapia adyuvante respectivamente (p=0.001)14. Además, la terapia hormonal temprana en este contexto se ha asociado a mejoría de la supervivencia global, cáncer-específica o supervivencia libre de progresión15,16. Respecto a la radioterapia en la enfermedad N1, se ha demostrado que como tratamiento adyuvante es un predictor independiente de recurrencia bioquímica (p=0.002) y de supervivencia cáncer-específica (p=0.009)3.
En nuestro estudio, no encontramos asociación entre factores histopatológicos tales como el APE inicial, Gleason patológico, estadio tumoral, número de ganglios positivos y márgenes positivos con la supervivencia cáncer-específica. En cambio, en algunas poblaciones la presencia de más de un ganglio positivo, puntaje de Gleason, estadio tumoral y/o márgenes quirúrgicos impactan en la supervivencia cáncer-específica a largo plazo 1,4,16,17.
La afectación de más de un ganglio (HR: 8.5, IC95%: 1.17-61.9, p=0.03) y los márgenes positivos (HR: 9.5, IC95%: 0.99-91.5, p=0.050) se asociaron aun mayor riesgo de progresión bioquímica. Estos hallazgos concuerdan con lo encontrado en otros estudios donde el volumen ganglionar impacta en el riesgo de progresión2,17. Briganti et al. describieron en una cohorte de 703 pacientes N1 M0 que la afectación de<3 ganglios experimenta significativamente una mayor supervivencia cáncer-específica (84 vs. 62%, p<0.001)10.
En una revisión sistemática reciente se concluye que el tratamiento del cáncer de próstata con enfermedad ganglionar necesita un cambio conceptual de una opción paliativa a un primer paso como tratamiento multimodal para mejorar significativamente la supervivencia a largo plazo e incluso la cura en casos selectos6. Mientras, hay ciertos autores que apelan a cambiar la clasificación categórica entre N0 y N1 en esta enfermedad debido a la evidencia actual que invita a subestratificar a los pacientes con enfermedad N1.
Las limitaciones de nuestro estudio son el carácter retrospectivo, el bajo volumen de pacientes y la obtención de los datos de un solo centro hospitalario. Por el contrario, este es el primer estudio latinoamericano que analiza esta población.
ConclusionesLos resultados oncológicos a largo plazo en la enfermedad N1 intervenidos de prostatectomía radical más terapia adyuvante son considerablemente buenos con medianas de supervivencia a 8 años. Nuestros resultados confirman que el número de ganglios afectados es un factor pronóstico para supervivencia libre de progresión.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónNo hubo apoyo financiero en relación con este artículo
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.