Introducción: Se realizó un estudio prospectivo, comparativo, descriptivo, para observar la expresión de sintasa de óxido nítrico neuronal (nNOS), en tejido prostático con cáncer e hiperplasia.
Métodos: Se tomaron las muestras de tejidos correspondientes a los pacientes diagnosticados dentro del periodo comprendido entre 2005 y 2009, almacenados en el Departamento de Patología del Hospital Central Militar, de acuerdo con los criterios de inclusión, exclusión y eliminación del mismo.
Resultados y Conclusiones: Por medio de la técnica de inmunoistoquímica se obtuvo la densidad relativa, donde se observó una disminución de nNOS en tejidos con cáncer de próstata (CaP) en comparación con la expresión en los tejidos de hiperplasia benigna prostática (HBP).
Background: A descriptive, comparative, prospective study was carried out to observe neuronal nitric oxide synthase (nNOS) expression in prostate tissue presenting with cancer and hyperplasia.
Methods: Tissue samples were taken from patients diagnosed with benign prostatic hyperplasia and prostate cancer within the time frame of 2005 to 2009. The samples were stored in the Pathology Department of the Hospital Central Militar, according to department inclusion, exclusion and elimination criteria.
Results and Conclusions: Relative density was obtained through immunohistochemistry and a reduction of nNOS was observed in tissues with prostate cancer when compared with its expression in tissues with benign prostatic hyperplasia (BPH).
INTRODUCCIÓN
En México, el cáncer de próstata (CaP) es el segundo lugar respecto a la incidencia de patología oncológica después del cáncer de piel, y el segundo lugar en mortalidad después del cáncer cervicouterino.1 Después de los 50 años de edad, la incidencia de CaP aumenta tres o cuatro veces cada 10 años. Los mecanismos moleculares que se relacionan con el desarrollo y la progresión del CaP, no han sido estudiados en su totalidad. Como se menciona en la literatura médica, existe una estrecha relación entre la producción de estrés oxidante y el desarrollo de cáncer.1,2
La etiología de hiperplasia benigna prostática (HPB) es multifactorial. Actualmente, se reconocen dos factores: la edad y la presencia de andrógenos. No obstante, se sospecha que puede haber otros factores involucrados en este proceso.3 Las teorías más recientes abogan por un desbalance hormonal de estrógenos/andrógenos, o por la existencia de factores de crecimiento prostáticos con un papel permisivo del ambiente hormonal.4
El desarrollo de la HPB en el hombre es considerado una parte normal del proceso de envejecimiento en los hombres, y es hormonalmente dependiente de la producción de la testosterona y la dihidrotestosterona (DHT).5
Se ha podido demostrar un aumento de la 5-a-reductasa en la zona periuretral y en el estroma, dos áreas fundamentales en la génesis de la hiperplasia. También existe la evidencia de un catabolismo reducido de la DHT.6
Además, hay argumentos para considerar la participación de los estrógenos en la génesis y mantenimiento de este fenómeno. Dichos argumentos que favorecen la acción de los estrógenos en el prostatismo son: 1) Los receptores estrogénicos están más elevados en el estroma que en el epitelio. 2) La demostración experimental del efecto sinérgico de estrógenos y andrógenos en la producción de hiperplasia en el perro. 3) El estímulo con 17-estradiol incrementa el número de receptores androgénicos en el tejido hiperplásico.7
Existe una variedad de factores promotores del crecimiento que se han aislado del tejido prostático, éstos incluyen: factor de crecimiento epidérmico (EGF), factor de crecimiento de fibroblastos (FGF), factor de crecimiento derivado de las plaquetas (PDGF), factores de transformación del crecimiento (TGF-a, TGF-b) y factores de crecimiento de osteoblastos. Los factores más dependientes de la acción de los andrógenos son: EGF y TGF-a. Lepor y colaboradores demostraron que las concentraciones de estos factores son mayores en tejido hiperplásico.8-15
Actualmente, se desconocen las causas específicas que determinan la aparición del CaP, pero se han visto asociados factores genéticos y ambientales.15,16
El comienzo y la progresión de CaP están influidos por los andrógenos. La dieta rica en grasas promueve el crecimiento de células cancerígenas en la próstata. Las grasas son una fuente de radicales libres que favorecen la aparición del CaP.17-19
En un estudio de la American Journal of Epidemiology en el 2004, las asociaciones con el cáncer avanzado fueron más homogéneas, sugiriendo una relación con las grasas saturadas pero no con los ácidos linoleicos, poliinsaturados, a-linolénicos, eicosapentaenoicos y docosahexaenoicos.18
Existen polimorfismos genéticos asociados al riesgo de CaP, como en el gen de la 5α reductasa tipo 2 y la 3α-hidroxiesteroide-deshidrogenasa tipo 2. El gen del receptor de andrógenos presenta dos polimorfismos, que desempeñarían un papel en la iniciación y progresión del CaP.20-23
Existe un factor localizado en el brazo largo del cromosoma 1 (1q24-25), que incrementa el riesgo de desarrollar esta neoplasia a una edad más temprana.14,15 Entre los factores protectores están el isoflavonoide genisteína (que inhibe la 5-reductasa), las hortalizas crucíferas que contienen sulfurafano de isotiocianato, los retinoides, como los licopenos y los inhibidores de la biosíntesis de colesterol. También podría disminuir el riesgo el a-tocoferol, que es un antioxidante y protector de las membranas celulares (vitamina E), el selenio, la vitamina D que es una hormona esteroide que inhibe la proliferación de líneas celulares de CaP e induce su diferenciación.24-33
MÉTODOS
Se utilizaron los tejidos correspondientes a pacientes con diagnóstico de HPB y CaP, que fueron intervenidos en la Sala de Urología del Hospital Central Militar, durante el periodo comprendido entre septiembre de 2005 a abril 2009, posteriormente fueron solicitados a la jefatura del Departamento de Patología del mismo hospital. De acuerdo con los criterios de inclusión, exclusión y eliminación, se revisaron los expedientes clínicos para obtener los datos especificados en la hoja de recolección de datos.
Los criterios de inclusión fueron: los tejidos de pacientes con diagnóstico histopatológico de HBP y CaP, obtenidos del almacén de Patología, registrados entre los años 2005 a 2009.
Los criterios de eliminación fueron: los tejidos que durante el traslado o por este mismo, no se hayan conservado adecuadamente, y muestra insuficiente.
Se determinó la expresión de la sintasa de óxido nítrico neuronal (nNOS) por medio de inmunohistoquímica en tejidos con HBP y CaP, se comparó su expresión en ambos grupos.
Inmunohistoquímica: Por microscopía de luz, las muestras de tejidos de CaP y HPB fueron fijadas por inmersión en formalina (pH=7.4), y se embebieron en parafina. Para el análisis histológico, secciones de tejido (3 mm) fueron teñidas con hematoxilina y eosina (H&E). Las secciones de tejido fueron teñidas con ácido periódico de Shiff`s (PAS) para mostrar los polisacáridos, mucopolisacáridos y glicoproteínas de la membrana celular.
Los cortes fueron incubados con el reactivo de Schiff`s durante cinco minutos, y contrateñidos con H&E por 30 segundos. El perfil histológico de cinco campos seleccionados aleatoriamente fueron registrados utilizando el software KS-300 (Carl Zeiss®, Jena, Alemania). El porcentaje de área dañada con alteraciones histopatológicas fue obtenido (magnificación 400x). Para la inmunohistoquímica, las secciones de tejido (3 mm) se desparafinaron y se calentaron para desenmascarar los sitios antigénicos. La actividad endógena de la peroxidasa fue bloqueada con 0.03% de H2O2 en metanol absoluto. Las secciones de tejido fueron incubadas toda la noche a 4ºC a una dilución 1:100 de anti-CYP4F11, y a una dilución 1:50 para anti-CYP8A1 en solución TRIS. Se removió el anticuerpo primario y se realizaron dos lavados repetitivos con TRIS, los cortes fueron incubados con una dilución 1:500 de anticuerpo policlonal de conejo como anticuerpo secundario, y se realizaron dos lavados repetitivos con TRIS.
Los anticuerpos unidos se detectaron con el complejo avidina-biotina (Vectastain® ABC kit) y la diaminobenzidina como sustrato. Después de lavar repetidamente con TRIS, los cortes fueron contrateñidos con H&E. Todos los cortes fueron incubados bajo idénticas condiciones e igual concentración de anticuerpo, en la misma corrida, por lo tanto, la inmunotinción fue comparable. Todos los especímenes fueron examinados por el microscopio de luz Axiovert 200M® (Carl Zeiss, Jena, Alemania). Para el análisis morfométrico automatizado, el porcentaje de células positivas (color marrón) se determinaron con un analizador de imágenes computarizado KS-300 3.0® (Carl Zeiss, Jena, Alemania). Este equipo detecta automáticamente las células positivas determinando su porcentaje por campo. Cinco campos aleatorios fueron estudiados a una magnificación de 100 (área total 1,584,000 m2). Los resultados fueron expresados como porcentaje.
ANÁLISIS ESTADÍSTICO
La significancia estadística de la expresión de nNOS determinada como densidad relativa, entre los grupos de HBP y CaP, se procesaron estadísticamente utilizando el software "Prism 3.0" con la prueba de Fisher. Los valores densitométricos fueron presentados como media aritmética ± error estándar de unidades densitométricas, considerándose significativas las diferencias cuando p<0.05.
RESULTADOS
De un total de 84 pacientes, se obtuvieron 40 pacientes con el diagnóstico histopatológico de CaP y 44 pacientes con HBP. Dentro del grupo de pacientes con diagnóstico de CaP, la edad promedio fue de 65.3 años y la concentración de antígeno prostático específico preoperatorio en este grupo fue de 11.9 ng/mL. El puntaje en la escala de Gleason fue de 2 en un caso (2%), 3 en un caso (2%), 4 en siete casos (18%), 5 en seis casos (15%), 6 en seis casos (15%), 7 en 10 casos (25%), 8 en seis casos (15%) y 9 en tres casos (8%). A los 40 pacientes (100%) se les realizó prostatectomía radical, por tener diagnóstico de cáncer clínicamente localizado.
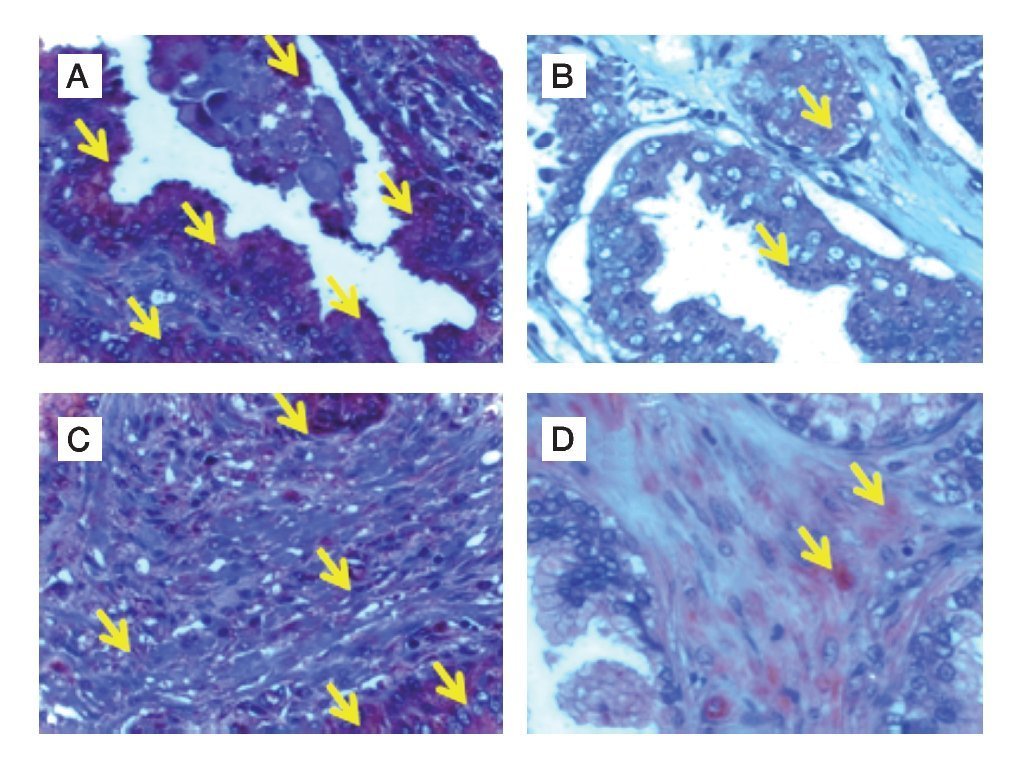
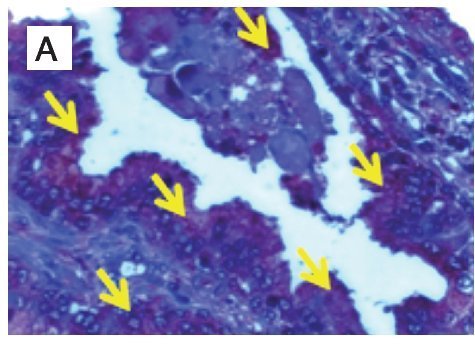
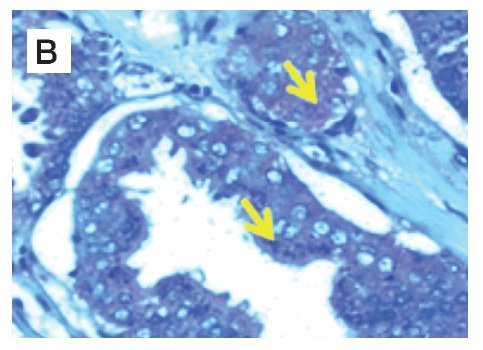
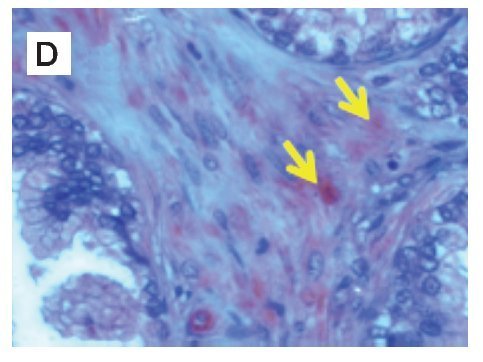
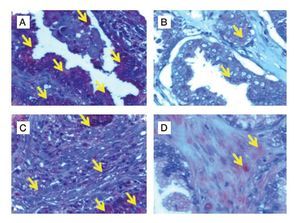
En el grupo de pacientes con diagnóstico establecido de HBP, se obtuvo una edad promedio de 67.5 años, el promedio de concentración de antígeno prostático específico preoperatorio fue de 5.8 ng/mL. A los 44 pacientes se les realizó resección transuretral de próstata y prostatectomía radical en algunos casos. La inmunoreactividad de la nNOS en tejido glandular con HPB expresada en unidades densitométricas relativas fue de 50 160 ± 20 000, comparada con 28 990 ± 9 923 en tejido con CaP (p<0.0001), y en estroma de tejido con HPB la densidad relativa fue de 38 480 ± 16 900 comparado con tejido de CaP, que mostró 10 530 ± 2 126 (p<0.0001) (Figura 1).
Figura 1. Localización de nNOS por inmunohistoquímica. A) y B) Imágenes representativas de la expresión de nNOS en cortes de tejido de glándula y estroma con A) y C) diagnóstico histopatológico de hiperplasia benigna prostática, B) y D) cáncer de próstata. Se observan las marcas inmunoreactivas en el área de tejido intraglandular y estromal, respetando núcleos celulares característicos de la localización de la enzima (citosólica) (flechas). Se muestra inmunotinción positiva para nNOS (color café o marrón). Las microfotografías son representativas y el campo representa 40x.
DISCUSIÓN
En nuestro estudio observamos una mayor expresión de nNOS en tejido de glándula y estroma en HPB 50 160 ± 20 000 y 38 480 ± 16 900, respectivamente, en comparación con tejidos de CaP, 10 530 ± 2 126 y 38 480 ± 16 900 (p<0.0001). Esto es consistente con los resultados obtenidos de estudios encontrados en la literatura médica, en los cuales la expresión nNOS se encontraba disminuida.26-30
Se ha descrito que el óxido nítrico con su consecuente producción de radicales libres, se encuentra asociado con la inhibición de la apoptosis.31,32 La producción del óxido nítrico es regulada por tres isoenzimas: la iNOS, mediada por transcripción que contribuye en mayor medida a la formación de este radical, pudiendo crear concentraciones patológicas, mientras que las otras isoenzimas, eNOS y nNOS, producen concentraciones fisiológicas en una cantidad menor.33-35
Esto concuerda con el resultado de nuestro estudio, ya que si se encuentra la posibilidad de una mayor concentración de radicales libres resultantes del estrés oxidante del óxido nítrico, la nNOS no debería estar sobre expresada ya que contribuye pobremente con la formación del mismo, e incluso puede estar disminuida por la mayor actividad de iNOS.36
Finalmente, otro mecanismo que podría explicar la disminución de la expresión de nNOS es por la inducción a través de citocinas en procesos tumorales, que aumenta la producción de óxido nítrico, la cual activa la enzima guanilato-ciclasa soluble, que resulta en un aumento de GMPc. Dicho incremento puede conducir al estímulo de la quinasa de las proteínas dependiente de GMPc, la fosforilación alterada de muchas proteínas endógenas, la disminución de la actividad de la enzima fosfolipasa C y la disminución del calcio citosólico.
La disminución de calcio citosólico ocasiona la inserción de un bucle de 40-50 a.a., que inhibe a la nNOS.34-37
CONCLUSIONES
El porcentaje de área marcada por campo de la enzima nNOS, se encuentra disminuida en los tejidos de CaP en comparación con los de HBP. Nuestro estudio es consistente con lo reportado en la literatura médica, el óxido nítrico está relacionado con factores inductores en cáncer, pero en su síntesis, la nNOS contribuye pobremente en su formación.
Agradecimientos
Este trabajo fue realizado con fondos de CONACYT (proyecto: SALUD- 2010-01-140535, del Fondo Sectorial de Investigación en Salud y Seguridad Social) y por el IPN (SAPPI, Proyecto SIP: 20113894). LAOA beca No.241493 y CRB beca No.265693 por el CONACYT. PIFI (IPN) No. 3387, 3391 y 3357; CAVJ, SAPM y JJMH. Se le Agradece a la Fundación Gonzalo Rio Arronte IAP, México, por la donación del Microscopio Confocal Axiovert 200 M.
Correspondencia:
Dr. Esaú Floriano Sánchez.
Sección de Posgrado e Investigación, Escuela Superior de Medicina,
IPN. Plan de San Luis y Díaz Mirón, Colonia Casco de Santo Tomas, Miguel Hidalgo.
C.P. 11340. México D.F., México.
Celular: (55) 3855 2702.
Correo electrónico: floriano_esa@yahoo.com