El ligamento periodontal es un tejido conectivo fibroso, de origen ectomesenquimal que contiene una población de células troncales postnatales multipotenciales, con capacidad clonogénica y alto índice de proliferación. Se ha conseguido cultivar células troncales postnatales multipotenciales a través de diferentes métodos de extracción, con algunos problemas técnicos. Por esta razón, se compararon seis diferentes métodos a fin de mejorar el aislamiento de células primarias del ligamento periodontal. Se aislaron células troncales postnatales multipotenciales a partir de 36 premolares sanos, que se cultivaron en medio de Eagle modificado por Dulbecco (BioWest) completo (adicionado con L-glutamina, 10% de suero fetal bovino y 1% de antibiótico) y en condiciones estándares de cultivo. Se realizaron los ensayos para proliferación celular mediante la técnica de 3-(4,5-dimetiltiazol-2-il)-2,5difeniltetrazolio, migración celular a través de la prueba de lesión del cultivo, y se evaluó su diferenciación osteogénica. Los cultivos realizados por triplicado con cada una de las técnicas publicadas, nos condujo a obtener una población mínima de células que fueron susceptibles a contaminarse. Se realizó con el «método simplificado»: por digestión enzimática y cultivo de explantos, con las células troncales postnatales multipotenciales obtenidas se observó una proliferación durante 14 días en condiciones estándares de cultivo ascendente, en las pruebas de migración las células troncales postnatales multipotenciales cubrieron totalmente la superficie lesionada a las 72 horas, se observó expresión positiva de CD90 en más del 80% de las células; expresión positiva a CD73 en un 70%, CD105 en un 60% y vimentina en un 90% de la población, así como un marcaje negativo a CD11b y CD45. Se observó una diferenciación osteogénica positiva a los 14 días mediante la expresión positiva a RUNX2 en al menos el 15% de las células y a osteocalcina en un 90%, así como las pruebas positivas a rojo de alizarina. Con los resultados obtenidos, podemos afirmar que el método simplificado permite aislar una población de células mesenquimales, que se pueden obtener a partir de premolares sanos extraídos.
Periodontal ligament is a fibrous connective tissue of ectomesenchymal origin which contains a multipotent postnatal stem cells population with clonogenic capacity and high proliferation index. Multipotent postnatal stem cells population culture has been achieved through several extraction methods, nevertheless some technical problems have been encountered. For this reason, in the present study, 6 different methods were compared so as to improve isolation of primary periodontal ligament cells. Multipotent postnatal stem cells population were isolated from 36 healthy premolars, which were then cultured in complete Dulbecco modified Eagle medium (BioWest) (added with L-glutamine, 10% fetal bovine serum and 1% antibiotic), in standard culture conditions. Assays for cell proliferation were conducted with 3-(4,5 dimethylthiazol-2yl)-2,5 diphenyltetrazolium technique as well as cell migration through crop injury test, after which osteogenic differentiation was assessed. Cultures were performed in triplicate with each of the published techniques; thus we were able to obtain a minimum population of cells susceptible to contamination. The «simplified method» was conducted through explant enzymatic digestion and culture: with obtained multipotent postnatal stem cells population, a 14 day proliferation was observed in standard conditions of ascendant culture; in migration tests, multipotent postnatal stem cells population totally covered injured surfaces after 72hours. CD90 positive expression was observed in over 80% of all cells; CD73 positive expression was found in 70% of cells, CD105 in 60% and vimentin in 90% of the population, as well as negative marking to CD11b and CD45. Positive osteogenic differentiation was observed after 14 days, through positive expression to RUNX2 in at least 15% of cells, and to osteocalcin in 90% as well as positive test to alizarin red. Based on obtained results we were able to affirm that the simplified method allows to isolate a population of mesenchymal cells, which might be obtained from extracted healthy premolars.
El ligamento periodontal es un tejido conectivo fibroso, compuesto de fibras, células y sustancia intercelular rica en colágeno, alto contenido proteico y polisacáridos. De origen ectomesenquimal. Tiene como funciones: 1) suspender el diente en su alvéolo óseo; 2) suministrar nutrientes al alvéolo y al cemento; 3) proteger los dientes; y 4) mantener la homeostasis de los dientes en su alvéolo por medio de la regeneración continua.1 Esta regeneración del ligamento periodontal (LPD) como un mecanismo fisiológico continuo, dio lugar a la teoría de que este tejido podía contener una subpoblación de células progenitoras.2 En el 2004, Seo y colaboradores3 publicaron que era posible que el LPD humano contuviera una población de células troncales postnatales multipotenciales, con capacidad clonogénica, con alto índice de proliferación y con capacidad de regenerar tejido periodontal.4–6
Se ha demostrado que las células troncales mesenquimales del ligamento periodontal (PDLSCs: periodontal ligament stem cells) son similares a otras células troncales mesenquimales en la expresión de los marcadores: STRO-1, CD146, CD90, CD29, CD44, CD13, CD105 y CD166, así como su capacidad autorregenerativa y multipotencialidad.3,7,8
Varios autores, después de aislar PDLSCs demostraron su capacidad para diferenciarse a linajes de tipo mesodérmico, diferenciándose en células similares a cementoblastos, osteoblastos, condrocitos, adipocitos, miofibroblastos y células formadoras de colágeno,9,10 incluso se ha investigado el potencial de las PDLSCs para dar lugar a células propias del sistema nervioso; así como cemento.11
Actualmente, se han conseguido cultivar PDLSCs a través de diferentes métodos de extracción, demostrando que el LPD es una buena fuente de células troncales para su potencial aplicación en medicina regenerativa; sin embargo, los métodos descritos hasta la fecha tienen algunos problemas técnicos. Por esta razón, se compararon seis métodos (Cuadro I) en un esfuerzo de mejorar el método de aislamiento de células primarias del LPD, ya que ninguno de los métodos reportados es preciso, por ello el objetivo de este trabajo fue presentar un método simplifi cado altamente reproducible para la extracción de dichas células.
Cuadro comparativo y explicativo de las técnicas empleadas para la extracción celular. Se subraya las diferencias entre ellos
| Método | Autores | Transporte y tratamiento previo | Procesamiento | Cultivo | Mantenimiento | Ventajas | Desventajas |
|---|---|---|---|---|---|---|---|
| Digestión enzimática con colagenasa tipo I | Vasandan AB, Shankar SR, Prasad P et al, 2013 (606 Vasandan AB, 2014) | En PBS al 1x adicionado con 1% de antibiótico/ antimicótico, 4 lavados adicionales con esta solución | 500 μL de colagenasa tipo I, a una concentración de 0.5 mg/mL durante 12 horas a 37°C | Se inactivó con un mililitro de DMEM completo. Se centrifugó a 1200 RPM durante 10 minutos. Se decantó el sobrenadante, el tejido sedimentado se resuspendió con dos mililitros de D-MEM completo | En placas de 6 multipocillos, 300 μL de la suspensión en cada pozo; se incubó en condiciones estándares. A las 24 horas de incubación del cultivo se realizó cambio del medio. El medio de cultivo se cambió cada 72 horas | Los lavados realizados son eficientes | Excesivo tiempo de digestión enzimática |
| Digestión enzimática con colagenasa tipo I | Seo BM, Miura M, Gronthos S et al, 2004 (607 Seo BM, 2004) | D-MEM completo, más 3 lavados durante 5 minutos | 500 μL de colagenasa tipo I en una concentración de 0.5 mg/Ml durante una hora a 37 oC | Se inactivó la reacción adicionando un mililitro de D-MEM completo. La suspensión se filtró con una malla de 70 μm de diámetro, se centrifugó a 1800 RPM durante 15 minutos y el sedimento se resuspendió con dos mililitros de D-MEM completo | En placas de 6 multipocillos se sembraron 500 μL de la suspensión, en condiciones estándares de cultivo. El medio de cultivo se cambió a los 7 días | Vitalidad de la muestra durante el transporte con D-MEM | Pérdida del tejido durante el filtrado; el primer periodo para cambiar el medio al cultivo es excesivo |
| Disgregación mecánica, cultivo de explantos | Tanaka K, Iwasaki K, Feghali KE et al, 2011 (608 Tanaka K, 2011) | D-MEM completo 10% de FBS, 1% L-glutamina y 0.1% de antibiótico/antimicótico, más 5 lavados durante 30 segundos | Se cortaron fragmentos de tejidos de aprox. 1 mm de DM (explantos) | Los explantos fueron colocados estratégicamente en cajas de 6 multipocillos con una cantidad mínima de D-MEM L completo El medio se cambió a las 24 horas para eliminar el tejido fl otante, y en intervalos de 72 horas | Los explantos se incubaron en condiciones estándares durante un periodo de 6-8 horas, esperando su adhesión al plato de cultivo. Luego, se adicionó 500 μL de DMEM completo. El medio se cambió a las 24 horas para eliminar el tejido flotante, y en intervalos de 72 horas | El uso de explantos daba altas expectativas para obtener el cultivo primario | Lavados con tiempo deficiente. Tiempo muy prolongado para la adhesión de los explantos |
| Digestión enzimática con tripsina/EDTA 0.25%/0.1% | Tanaka K, Iwasaki K, Feghali KE et al, 2011 (608 Tanaka K, 2011) | D-MEM completo 10% de FBS, 1% L-glutamina y 0.1% de antibiótico/antimicótico, más 2 lavados durante 2 minutos | En 500 μL de tripsina al 0.25% con EDTA al 0.1% se digirió el tejido durante 60 min a 37°C. En intervalos de 10 minutos la muestra fue agitada durante 30 segundos | Para detener la reacción enzimática se adicionaron 500 μL de D-MEM completo. La suspensión se filtró con una malla de 70 μm de diámetro. Se centrifugó la suspensión a 1800 RPM durante 15 minutos. Se desechó el sobrenadante y el sedimento se resuspendió con 2 mililitros de DMEM completo | En placas de 6 multipocillos se colocaron 500 μL de la suspensión en cada pozo. Se cambió el medio cada 72 horas | Con el uso de tripsina/EDTA, la digestión enzimática es favorecida con la agitación constante | Defi ciencia en los lavados. Tiempo prolongado para la digestión enzimática. Filtrado de la muestra |
| Digestión enzimática con colagenasa tipo I y transporte de la muestra en solución de Hanks | Gholamrezanezhad Ali, 2011 (609 Gholamrezanezhad Ali, 2011) | Solución de Hanks, a una temperatura de 4°C y se lavó 3 veces por un minuto | El tejido se centrifugó con solución de Hanks a 1500 RPM durante 10 minutos. Se eliminó el sobrenadante y el tejido se resuspendió con 500 μL de colagenasa tipo I una concentración de 0.5 mg/mL una hora a 37°C | La inactivación de la reacción se llevó un mililitro de D-MEM completo. La suspensión fue centrifugada a 1500 RPM durante 10 minutos, se eliminó el sobrenadante y el sedimento se resuspendió con dos mililitros de D-MEM completo | Se cultivaron 200 μL de la suspensión en placas de 6 multipocillos durante 4 horas a 37°C. Luego, se agregaron 500 μL de D-MEM completo. El medio fue sustituido por primera vez a los 5 días, y el cambio de medio se realizó posteriormente las 72 horas | Tiempo adecuado de incubación para esperar la adhesión de los explantos | Transporte en solución de Hanks. Lavados defi cientes |
| Técnica estandarizada digestión enzimática y cultivo de explantos | Ramírez RO, Trejo ICG, 2015 | D-MEM completo a una temperatura de 4 oC. Se realizaron 3 lavados de 5 minutos, con 3 mL de D-MEM suplementado con 5% de antibiótico | Digestión enzimática con 500 μL de tripsina/EDTA 0.25%/0.1%, durante 20 minutos, a 37°C. En intervalos de 5 minutos el tejido se agitó con un Vortex a 1000 RPM durante 30 segundos | La inactivación de la reacción se realizó con 500 μL de DMEM completo. Se centrifugó a 1800 RPM durante 10 minutos, se eliminó el sobrenadante y se resuspendió el tejido con 1 mililitro de DMEM completo | En placas de 6 multipocillos se sembraron entre 150-200 μL de la suspensión, se dejó en incubación durante 2-4 horas esperando la adhesión del tejido al plato de cultivo. Luego, se adicionó D-MEM completo y se cambió el medio a los 4 días posteriores al sembrado. El medio se cambió cada 72 horas | Se tomaron las ventajas que ofrecieron las técnicas anteriores |
Previo consentimiento informado avalado por el Comité de Bioética de la Facultad de Estudios Superiores Iztacala se obtuvieron 36 premolares sanos, por donación de pacientes de la Clínica de Especialidades Ortodónticas Naucalpan que pertenece a la Facultad de Estudios Superiores Iztacala de la Universidad Nacional Autónoma de México. Con los criterios que a continuación se describen: se incluyeron sólo pacientes sin alteraciones sistémicas, buena salud periodontal, dientes primeros y segundos premolares, tanto maxilares como mandibulares, izquierdos y derechos. Los criterios de exclusión fueron: pacientes con enfermedades sistémicas, pacientes con gingivitis y/o enfermedad periodontal, premolares con presencia de cálculo dental y/o presencia de caries y/o con reacción periapical.
Las muestras fueron trasladas en tres mililitros de medio D-MEM (BioWest) suplementado con 1% de antibiótico (penicillin-streptomycin Gibco® No Cl. 15140-122) a 4°C.
Las técnicas empleadas se describen detalladamente en el cuadro I, en todas las técnicas para el sembrado, se empleó D-MEM (BioWest) completo (adicionado con L-glutamina, 10% de FBS y 1% de antibiótico) y condiciones estándares de cultivo a 37°C con presencia del 5% de CO2.
Los subcultivos fueron realizados a una confluencia del 60/80% previo lavado con solución de Hank (Sigma Aldrich) durante 30 segundos. Se agregaron 500μL de tripsina/EDTA al 0.25%/0.1% (BioWest), durante 1-3 minutos, a una temperatura de 37°C. Realizando los subcultivos celulares en proporción 1/3.
Ensayo para proliferación celularSe realizaron sembrados celulares de 500 células en cajas de 24 multipocillos en la cual se sembraron por pocillo. La evaluación de la proliferación celular se realizó a 1, 3, 5, 7 y 14 días después del sembrado, mediante la adición de 50μL de MTT (Sigma Aldrich), que se incubó durante cuatro horas a 37°C con una atmósfera de 5% de CO2. Posteriormente se adicionaron 100 μL de dimetilsulfóxido (DMSO, Sigma Aldrich) para realizar la lectura de densidad óptica en un espectrofotómetro a una de longitud de onda de 540 nm.
Evaluación de migración celularCon las células en confluencia se realizó una lesión a lo largo del cultivo, causando pérdida de continuidad y se monitoreó el cultivo mediante fotografías a las 24, 48 y 72 horas.
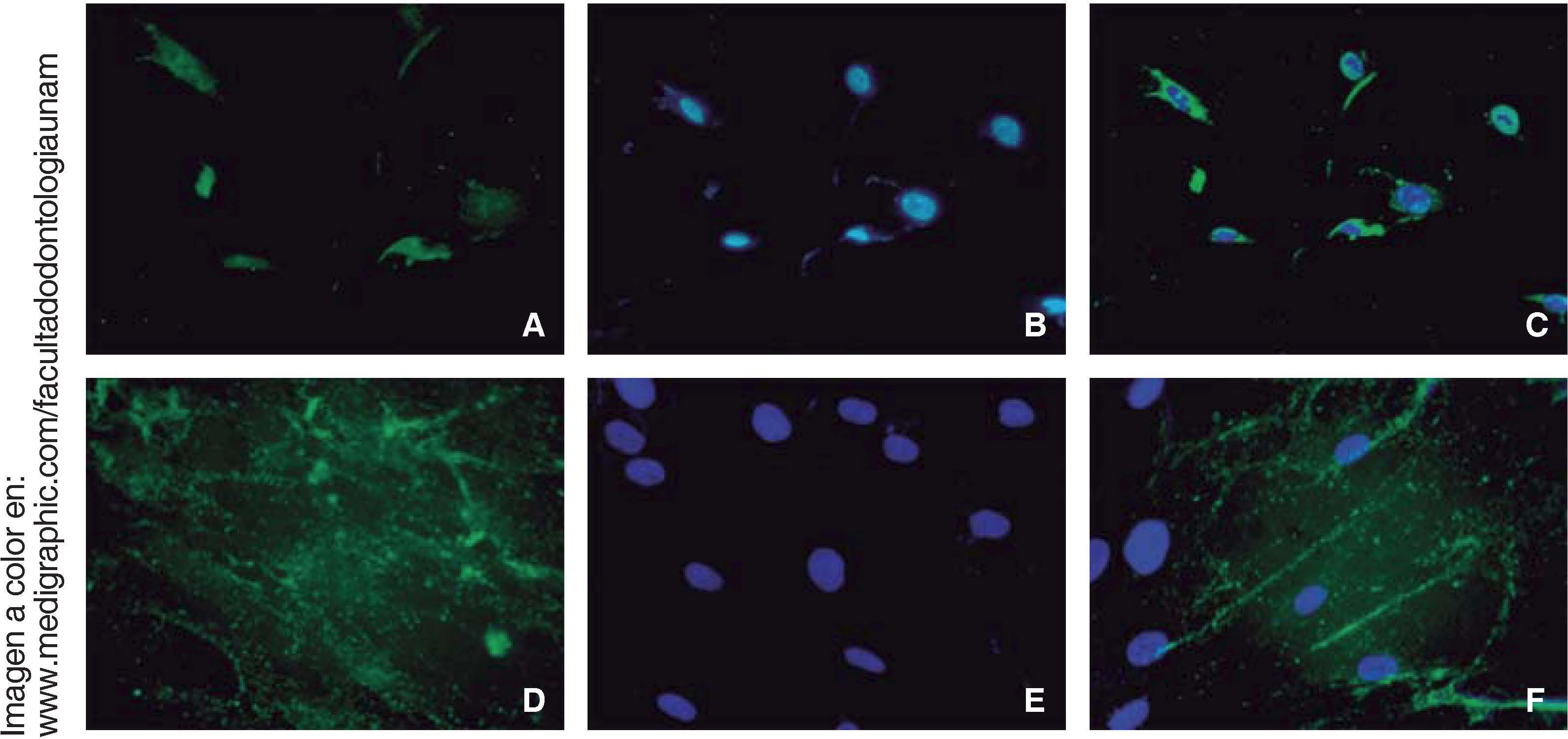
InmunocitofluorescenciaLas células fueron fijadas en tampón de fosfato de paraformaldehído al 4% durante 20min. El bloqueo se realizó en PBS con 3% de albúmina de suero bovino y 0.01% de Tritón-X 100. Las células se tiñeron con los siguientes anticuerpos de conejo antihumano conjugado con Fluor® 647, PE TRITC, FITC y DAPI (Fluoroshield®); RUNX2, osteocalcina, CD73, CD90, CD105 y vimentina (1:250 Santa Cruz); durante 45 minutos; las muestras fueron observadas en el microscopio de fluorescencia Zeiss Axio LAB1.
Diferenciación osteogénicaSe utilizaron 105 células, se sembraron en el pasaje número 3 y se les adicionó medio “StemPro Osteogenesis Differentiation Kit” (Gibco®), que fue sustituido cada 72 horas; durante 14 días.
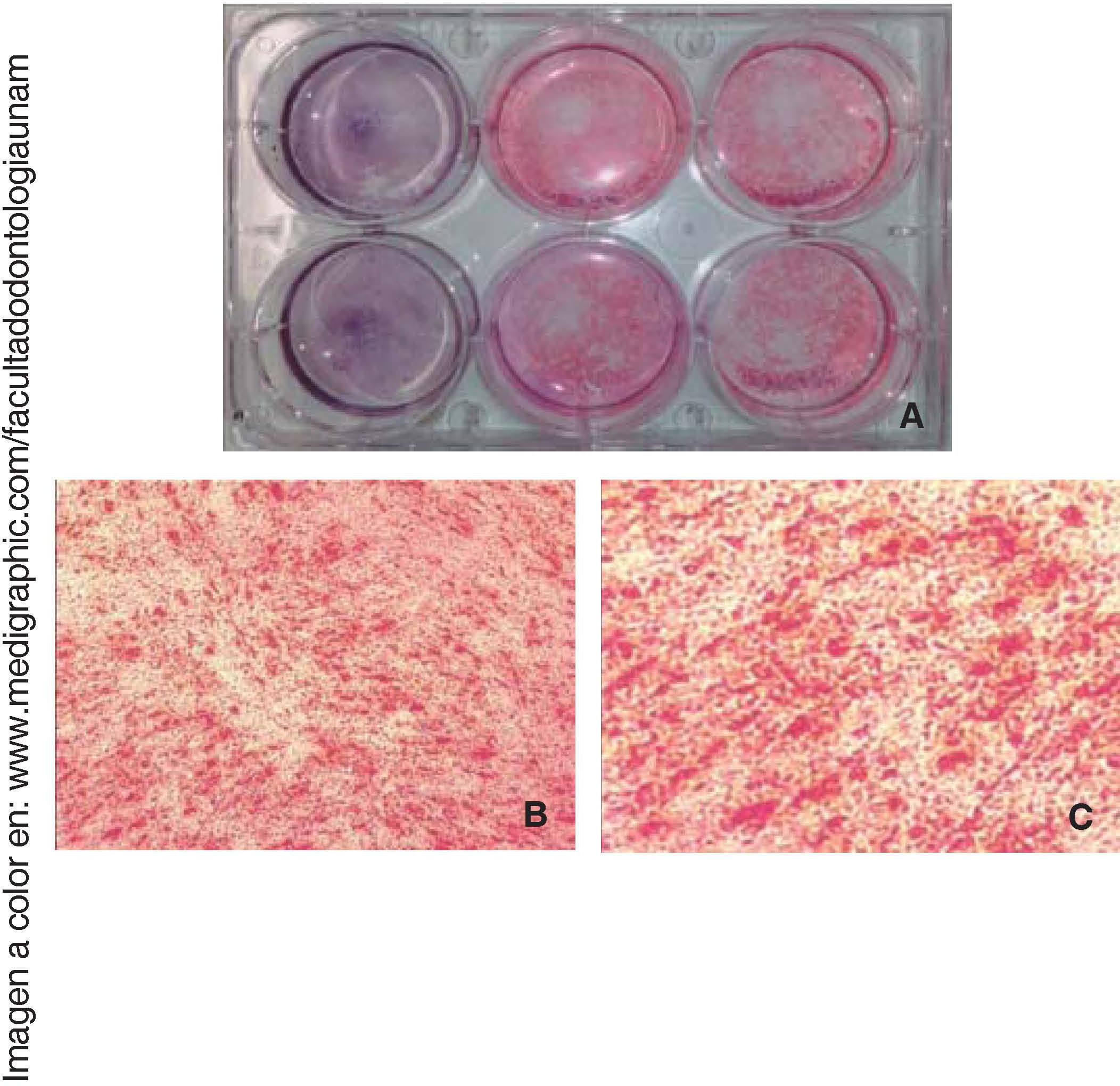
Tinción con rojo de alizarinaUna vez diferenciadas las células a los 7 y 14 días de cultivo fueron fijadas y teñidas con rojo de alizarina, se les realizaron tres lavados de cinco minutos con PBS Se agregaron 500μL de rojo de alizarina 0.1% (HYCEL®) y se dejó reposar durante 15 minutos a temperatura ambiente.
RESULTADOSObtención de la población celularLa poca especificidad técnica de los artículos encontrados influyó para lograr la obtención de la población celular; los cultivos realizados por triplicado con cada una de las técnicas expuestas, nos condujo a obtener una concentración mínima de células que no llegaban a confluencia, en algún caso después de siete días de cultivo no se obtenían células y en alguno las pocas células obtenidas fueron susceptibles a contaminarse, probablemente por el medio de transporte del diente y los lavados.
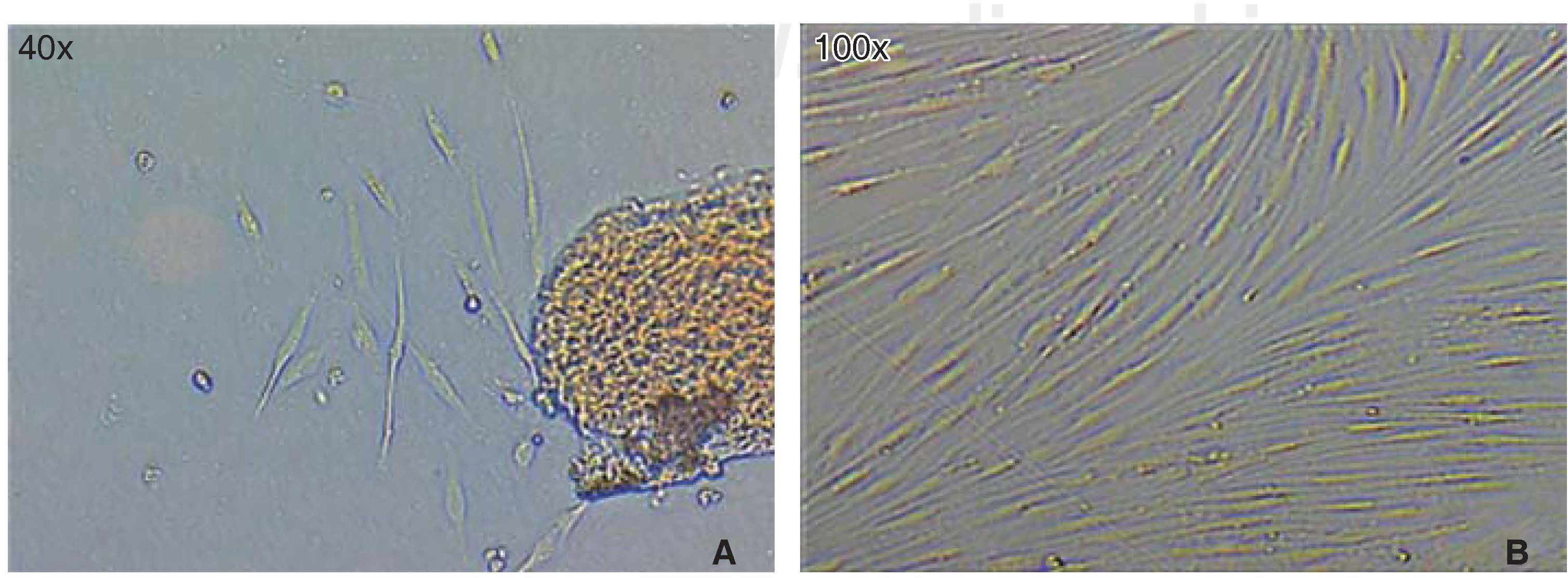
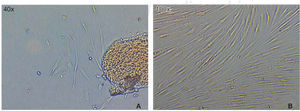
La población celular óptima para el estudio se logró obtener empleando la «técnica estandarizada digestión enzimática y cultivo de explantos». Una vez que se realizó la disección y sembrado del tejido periodontal, en las primeras 72 horas aparecieron células, que luego de 46 horas más mostraron una apariencia fibroblastoide en la periferia de los explantos cultivados llenando el plato de cultivo en un 65 a 70%, luego de esto, los explantos fueron eliminados con los lavados. A los siete días el plato de cultivo se encontraba con las células en confluencia (Figura 1).
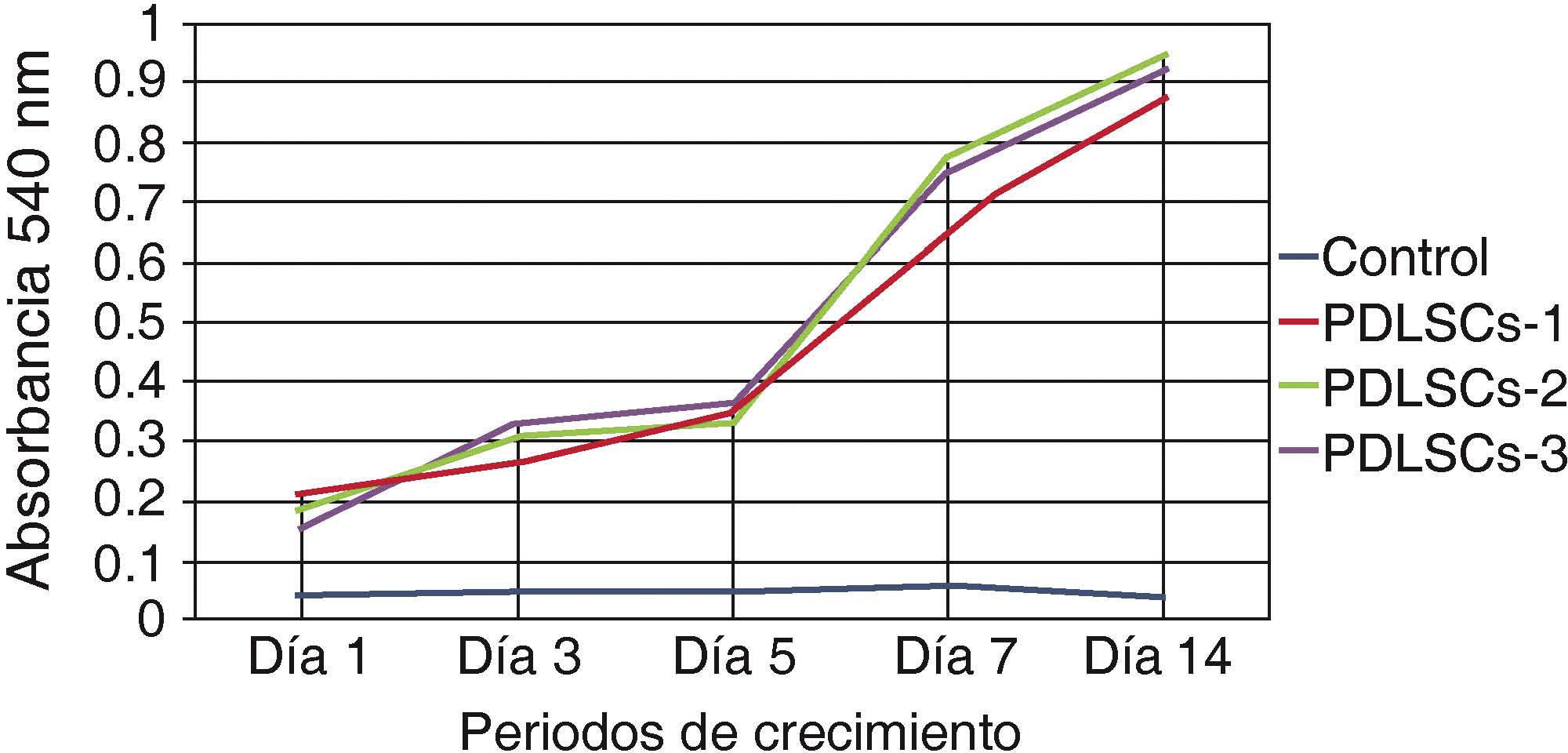
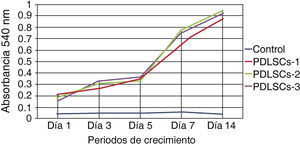
Viabilidad y/o proliferación celularSe realizó la evaluación de la capacidad de autorrenovación de la población celular obtenida mediante el ensayo de metiltiazoltetrazolio (MTT) 3-(4,5-dimetiltiazol-2 il)-2,5-bromuro difeniltetrazolio; la absorbancia medida por espectrofotometría es proporcional a la viabilidad/proliferación de las células.
Se sembraron 500 células en cajas de 24 multipocillos se evaluaron a 1, 3, 5, 7 y 14 días; se midió la absorbancia a una longitud de onda de 540nm; las mediciones obtenidas fueron graficadas. Se obtuvo una gráfica creciente, que corresponde a una concentración de células por la unidad de medida, demostrando así, que las células mantuvieron su proliferación durante 14 días en condiciones estándares de cultivo (Figura 2).
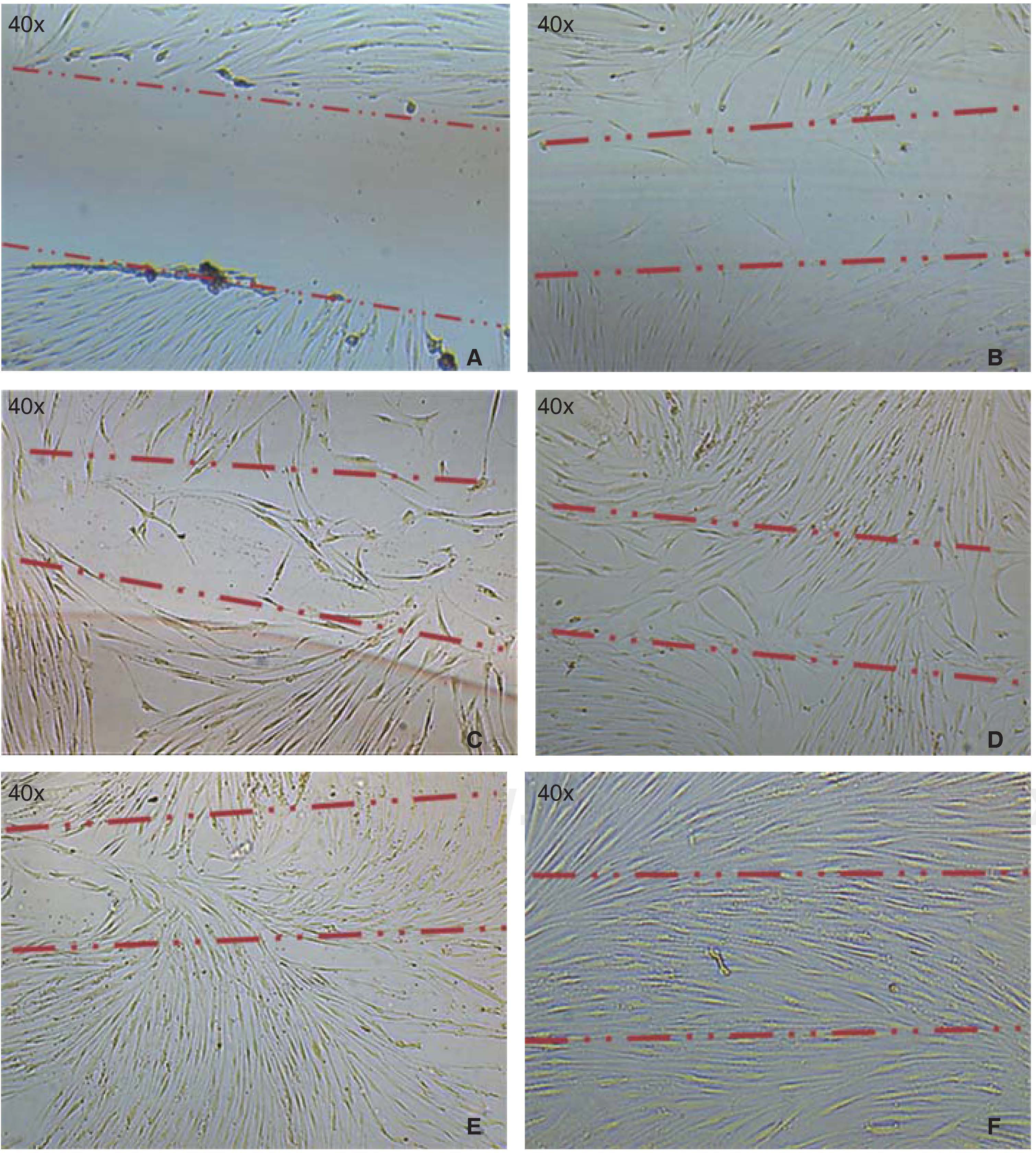
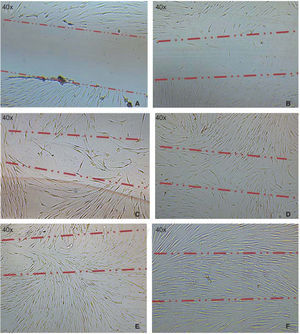
Capacidad de migración celularLa migración de las células hacia el área lesionada se observó a partir de las 12 horas después de realizarla, las células cubrieron entre un 10-20% del área crítica, a las 24 horas aumentó el número de células que cubrieron ya en un 40-60% la superficie del frasco de cultivo, posteriormente a las 48 horas las células se observaron en semiconfluencia y a las 72 horas las células cubrieron por completo el área, esto es observable en las imágenes (Figura 3).
A) Fotografía inmediata, después de realizar la lesión en el cultivo. B) A las 12 horas después de la lesión, se observa migración de un grupo de células recolonizando del 10 al 20% de la lesión. C) A las 24 horas se observa la migración de un grupo de células recolonizando el área dañada en un 40-60%. D) y E) A las 48 horas se observa que las células han cubierto en un 80-90%. F) A las 72 horas después de la lesión, las células llegan a confluencia nuevamente.
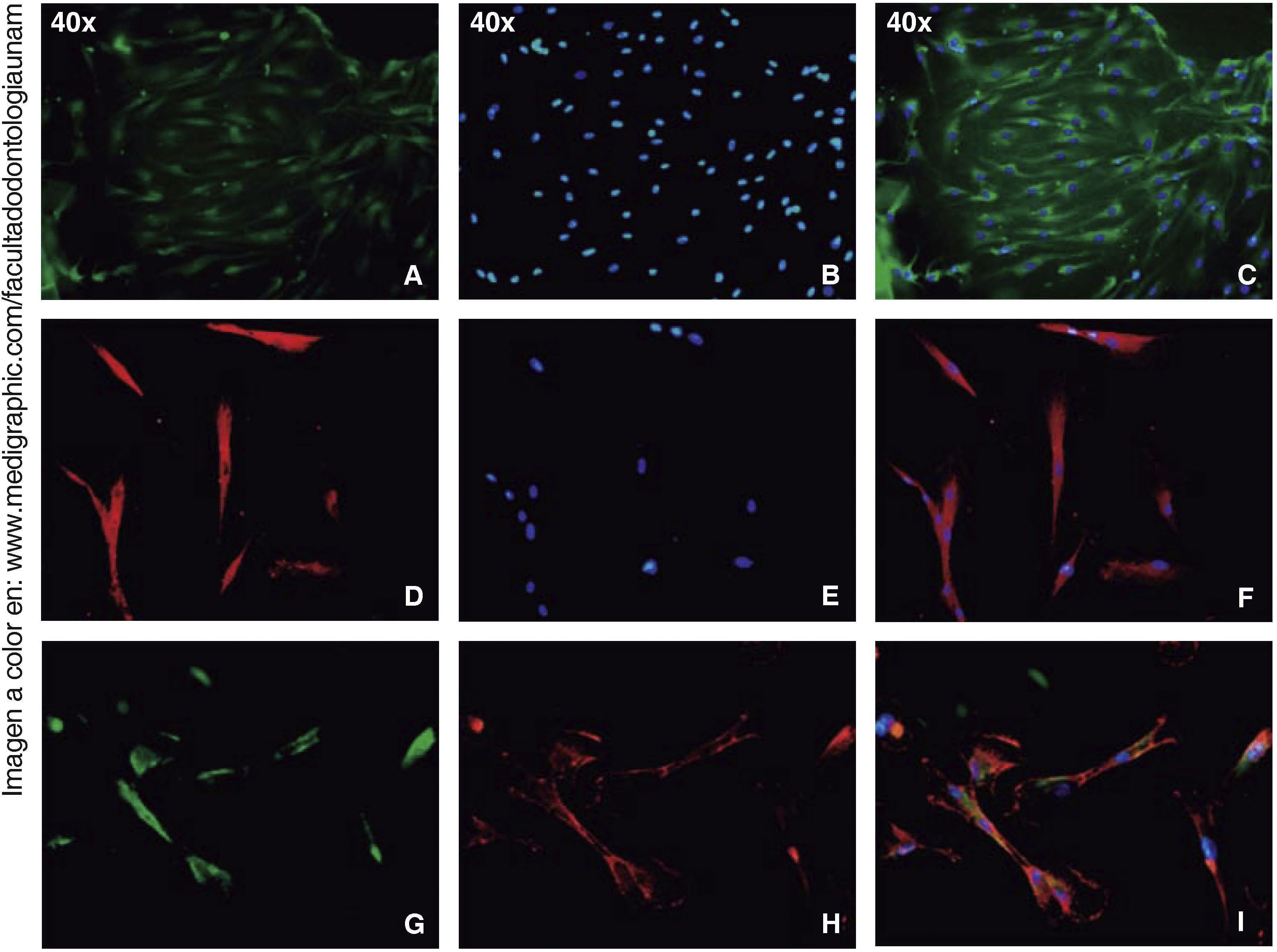
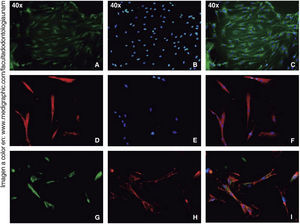
Los ensayos de inmunofluorescencia fueron realizados en el tercer subcultivo de nuestra población celular, luego de nuestro conteo, se observó expresión positiva de CD90 en más del 80% de las células; expresión positiva a CD73 en un 70%, CD105 en un 60% y vimentina en un 90% de la población (Figura 4).
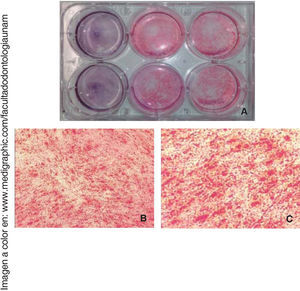
Diferenciación osteogénicaUna vez inducida la diferenciación ósea, las células perdieron su morfología fibroblastoide a los siete días, y adquirieron una morfología prismática, de apariencia cuboide y menos alargada, apareció también mayor cantidad de matriz extracelular y presencia de nódulos de calcificación, que se observaron mediante la tinción de rojo de alizarina el área cultivada y observada es de 9.6cm2(Figura 5).
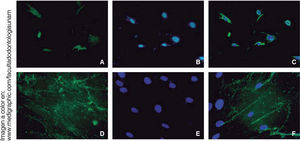
RUNX2 es un factor de transcripción indispensable para la maduración ósea que fue expresado en nuestra población celular en diferenciación osteogénica a los 14 días, en al menos el 15% de las células.
La osteocalcina es una proteína secretada en la etapa tardía de la diferenciación ósea; es capaz de unirse al calcio para su estabilización; la presencia de esta molécula a los 14 días en un 90% de las células nos indica la regulación de la mineralización (Figura 6).
DISCUSIÓNEl ligamento periodontal puede ser considerado como una fuente accesible, ya que los órganos dentales son considerados tejidos de desecho una vez extraídos, y en el caso de los pacientes que están bajo tratamiento de ortodoncia, la extracción es la mejor alternativa de tratamiento.12
Como han demostrado ya, las poblaciones obtenidas del ligamento periodontal tienen la capacidad de regenerar diversos tejidos13–16 y, recientemente se ha publicado información sobre el uso del ligamento periodontal como una fuente de células troncales; sin embargo, hacía falta llegar a un consenso sobre los protocolos usados, ya que éstos pueden ser muy inconsistentes y no permiten poder comparar claramente las poblaciones celulares obtenidas,17 por ello, conocer en profundidad el mecanismo de las técnicas empleadas nos permitió sugerir este «método estandarizado » centrado en mantener la integridad de la muestra, así como evitar su contaminación.18–20Este método de cultivo requiere de menor experticia en el manejo de los tejidos periodontales, por lo que es de fácil realización y evita posibles contaminaciones de los cultivos.
La capacidad de nuestras células derivadas de PDL para formar grupos de células clonogénicas adherentes de características similares a fibroblastos, se demostró por la formación de alrededor de 1 x 106 células generadas a partir de 1 x 103 células individuales cultivadas a baja densidad en siete días de cultivo. Esta población de células formadoras de colonias, que hemos denominado PDLSCs, mostró una alta tasa de proliferación por MTT, similar a la tasa observada por otros autores.3,8
Así, demostramos que el nuevo método mejoró, o al menos resultó efectivo para extraer una población de células semejantes a células mesenquimales del ligamento periodontal, que mostraron un perfil antigénico positivo a los marcadores de células mesenquimales, CD105, CD90, CD73 y vimentina que nos confirma su origen mesodérmico y estadio mesenquimal permiten reportar su estadio de células troncales mesenquimales.13–15,21
Las PDLSCs mostraron que pueden diferenciarse a la línea osteogénica en un tiempo igual o menor a ocho días, esto quizás se deba a su origen ectomesenquimal en armonía con lo ya mencionado por Cha Y. y cols. que se trata de una población celular que se diferencia22 expresando marcadores osteogénicos como: RUNX2, OCN y la formación de nódulos de mineralización.15
CONCLUSIONESCon los resultados obtenidos, podemos afirmar que el método simplificado permite aislar una población de células mesenquimales derivadas del ligamento periodontal de premolares sanos extraídos.
AgradecimientosAgradecemos al Dr. Marco Antonio Álvarez Pérez del Laboratorio de Ingeniería de Tejidos del postgrado de la Facultad de Odontología de la UNAM las facilidades prestadas.
Carrera de Cirujano Dentista, Laboratorio de Investigación en Odontología Almaraz/UBIMED.
Este artículo puede ser consultado en versión completa en http://www.medigraphic.com/facultadodontologiaunam