Los productos fluorados son utilizados principalmente por su efecto anticariogénico en el esmalte dental.
ObjetivoEl propósito de este estudio fue determinar la eficiencia de tres compuestos fluorados en el tratamiento del esmalte desmineralizado.
MétodoUna superficie desmineralizada fue producida por exposición en solución desmineralizante en el esmalte de 120 terceros molares permanentes durante 96 horas. Se dividieron aleatoriamente en cuatro grupos para recibir tratamiento tópico con los siguientes productos fluorados: 1) fluoruro de plata amoniacal, 2) difluorsilano, 3) flúor fosfato acidulado y 4) un grupo control. Las muestras fueron inmersas en un sistema de pH cíclico (pH 4.4 a 7.0) y recuperadas a 5, 10 y 15 días para ser observadas bajo luz polarizada con solución de Tholuet en un fotomicroscopio y determinar la remineralización de acuerdo con la birrefringencia que mostraron. Resultados: El grupo tratado con fluoruro de plata amoniacal mostró una diferencia significativa con los otros grupos a 5 y 10 días. Por otra parte, los resultados a los 10 días para el flúor fosfato acidulado se mantuvieron iguales a los 15 días.
ConclusionesEl grupo tratado con fluoruro de plata amoniacal presentó mayores cambios que los grupos tratados con flúor fosfato acidulado, difluorsilano y control.
Fluoride-containing products are mainly used due to their anticariogenic effect upon dental enamel.
ObjectiveThe aim of the present study was to determine the efficiency of three fluorinated compounds when used on demineralized enamel.
MethodA de-mineralized surface was obtained by means of exposing the enamel of 120 permanent third molars to a demineralizing solution for 96 hours. Molars were randomly divided into four groups in order to receive topical treatment with the following fluorinated compounds: 1) silver ammonium fluoride, 2) difluorsilane, 3) acidulated phosphate fluoride and 4) a control group. All samples were immersed in a cyclic pH system (pH 4.4 to 7.0) and retrieved after 5, 10 and 15 days in order to be observed. Samples were examined under polarized light and Tholuet solution in a photomicroscope (Zeiss, Germany) in order to determine remineralization according to exhibited birefringence. Results: After 5 and 10 days, the group treated with silver ammonium fluoride showed significant difference with respect to other groups. Nevertheless, acidulated phosphate fluoride 10-day results remained equally unaltered at 15 days.
ConclusionsThe group treated with silver ammonium fluoride presented more significant changes than groups treated with silver ammonium fluoride, difluorsilane as well as the control group.
El esmalte dental se compone de un conjunto de rismas que se extienden desde la unión esmaltedentina hacia la superficie exterior. Tales prismas tienen un espesor de 10,000 A y una longitud de hasta 3mm. Las propiedades de dureza y densidad se derivan de las características estructurales y la distribución de estos prismas.1 La composición química fundamental consta de Ca+2, P-4, O-2 en diferentes formas cristalinas (hidroxiapatita, fluorapatita, β-Whitlockita, etcétera) que por sus características cristalográficas han sido denominadas «apatitas». El esmalte, dentina, cemento y hueso difieren en su composición en érminos de: a) cantidad y tipo de fases orgánicas presentes, b) tipo de fases inorgánicas, c) cantidad de agua, d) concentración de elementos menores en la ase inorgánica, e) tamaño, morfología, orientación y rganización del cristal de la apatita biológica con respecto a la matriz orgánica.2
El esmalte es el componente inorgánico o mineral más denso, contiene cantidades de cerca del 95% del peso (87% vol.), en comparación con la dentina y el cemento, que tienen un 70% (47% vol.), y el hueso, un 65% (47% vol.). Las fases inorgánicas del esmalte, dentina y hueso difieren en su radio molar y peso de Ca/P, y en la concentración de elementos menores como CO3, Mg+2, Na2+ y Cl+5. La cantidad de Ca/P radio molar del esmalte humano maduro es cerca de 1.64.2
En la fase inicial de la síntesis del esmalte, la precipitación de iones Ca-2, O-2 y moléculas de PO4 y el crecimiento cristalino se expresan en forma de cintas largas y delgadas; estos cristales incipientes se encuentran desorientados, siguen rutas onduladas y carecen de los bordes rectos y de las superficies planas de los cristales bien ordenados. Los cristales maduros se desarrollan mediante un lento engrosamiento de dichas cintas. Sin embargo, es probable que algunos defectos presentes en las cintas permanezcan atrapados en los núcleos de los cristales maduros, lo cual influye en la estabilidad de estos cristales y los modelos de disolución ácida del esmalte.1
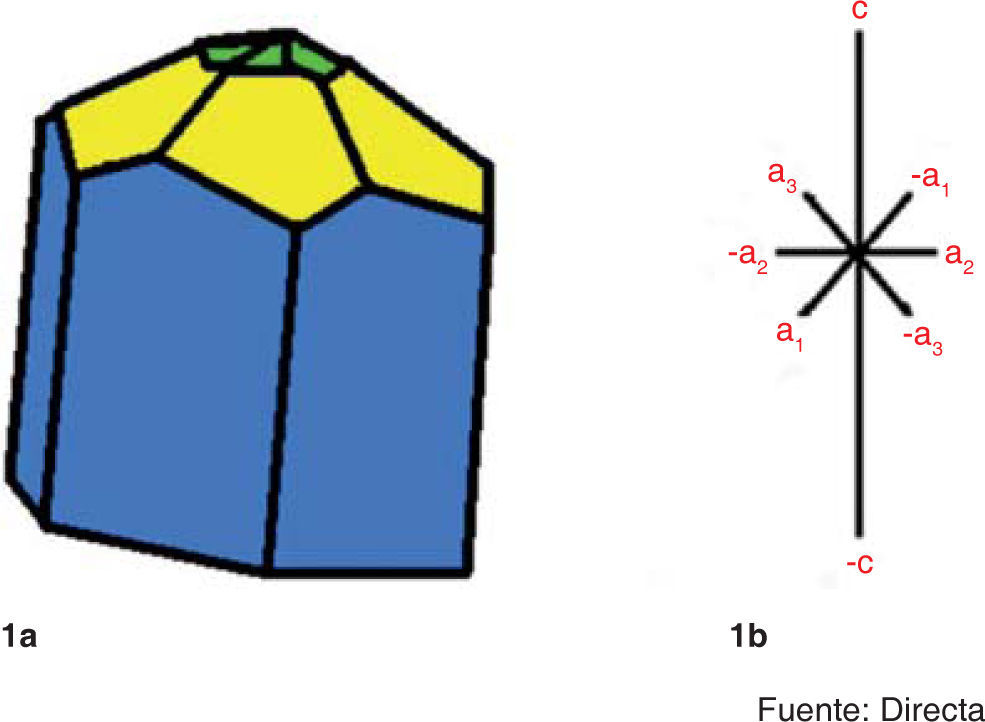
La morfología de los cristales es hexagonal debido a que los ejes «a» y «b» de la célula forman un ángulo de 120° y presentan longitudes iguales; el eje «c» es perpendicular a los otros dos (Figura 1). La dimensión longitudinal de un cristal de apatita del esmalte se corresponde con el eje «c» de la célula unidad de apatita.1
En la química de la solubilidad del esmalte en soluciones ácidas, intervienen cambios en la composición de la apatita inducidos por el intercambio de iones entre las fases cristalina y líquida; por lo tanto, la apatita no tiene un producto de solubilidad constante. La solubilidad aumenta con disminución del pH y es similar a la del fosfato de calcio secundario a pH=6.0 y a la del fosfato de calcio primario a pH=4.0. La presencia de carbonato tiende a aumentar la solubilidad de la apatita del esmalte, mientras el fluoruro tiende a disminuirla. En soluciones ácidas, la solubilidad de la apatita del esmalte se afecta por la concentración y viscosidad de los amortiguadores disponibles, la razón de volumen mineral/amortiguador, así como la acción interiónica que ocurre durante el proceso de disolución.3
Estudios de cinética química muestran que la difusión de iones de hidrógeno y de moléculas de ácido no disociado en el esmalte, así como la velocidad de reacción entre el ácido y el mineral, son de suma importancia para el control de la velocidad y el grado de ataque ácido. Barreras a la difusión en la superficie del diente o en la capa externa del esmalte reducen la velocidad de disolución ácida y retardan la desmineralización de la superficie. Una vez que pasan la capa superficial protectora, los iones ácidos están en libertad de reaccionar con la estructura del diente y disolverla. La repetición cíclica de estos procesos de difusión regulados conduce a la descalcificación profunda de la estructura del diente.3
Desde hace varias décadas se ha documentado el efecto preventivo que ejerce el fluoruro sobre la presencia de la caries dental, debido a la rápida incorporación del F en los cristales de apatita de los tejidos duros del diente, lo cual resulta en una estructura menos soluble a los ácidos.
La literatura refiere que en la lesión cariosa incipiente se puede detener el avance o hacerlo reversible, a este proceso se le refiere como «remineralización».4-7
El término «remineralización» se utilizó originalmente para describir la reparación completa de la región dental desmineralizada. Esto fue observado clínicamente como la desaparición de las lesiones blancas incipientes en el esmalte. Alternativamente, el término «remineralización» puede ser us8ado para describir el proceso de depósito de mineral.8
La remineralización actúa por medio de dos procesos: a) la reducción del tamaño de la lesión y b) el aumento de la resistencia a la progresión cariosa.8
Durante el ataque del ácido el incremento de fluoruro da por resultado una precipitación de fluorhidroxia-patita principalmente en la capa superficial del esmalte. El leve incremento de la concentración de fluoruro proporciona una fuerte remineralización.9,10 Por lo tanto, la acción del fluoruro es por medio de:
- a)
Sus propiedades antibacteriales durante la formación de ácido fluorhídrico, el cual interfiere con enzimas involucradas en la glicólisis.
- b)
Inhibe la disolución de calcio y fosfato en la subsuperficie del esmalte en lesiones cariosas incipientes durante el intercambio ácido (desmineralización).
- c)
Promueve la remineralización ayudando al calcio y fosfato a precipitarse en la superficie del esmalte para cristalizarse en una superficie más ácido resistente.11,12
El conocimiento del efecto del fluoruro sobre la desmineralización y remineralización fue ampliado cuando se estudió bajo el método llamado pH cíclico, condiciones en las cuales especímenes de esmalte o dentina son sometidos a cambios de pH, como ocurre en la cavidad oral.13
Para el tratamiento preventivo de lesiones cariosas, se han utilizado una amplia gama de recursos químicos que varían su composición y presentación. Sin embargo, tienen en común el propósito de reducir el avance de lesiones destructivas como la caries.
El fluoruro tópico en su presentación en gel es el más empleado en la prevención de la caries en la clínica dental, es la formulación compuesta por 1.23% de fluoruro de sodio y ácido fosfórico al 0.1 M con un pH de 3.2 a 3.4, conocido como fluoruro fosfato acidulado (FFA); esta composición provee altas concentraciones de fluoruro en un ambiente ácido para promover la captación de fluoruro.5 La fluorapatita resultante es más estable y de mayor retención. El tiempo de aplicación es de cuatro minutos en dientes con profilaxis, aislamiento y secado.3,14,15
En 1975 se introdujo bajo el nombre comercial de Fluor Protector™ (Vivadent, Liechtenstein) un sistema de barniz a base de poliuretano conteniendo el 0.1% de flúor en la forma de difluorsilano (DFS).16 Su mecanismo de acción está basado en los siguientes factores: controla el proceso de remineralización, incorpora el fluoruro dentro de las capas del esmalte, por lo que remineraliza las lesiones de caries incipiente. El Fluor Protector™ usualmente se adhiere a la superficie dental por más de 24 horas,14,17 y se obtienen mejores resultados si se realizan aplicaciones periódicas cada seis meses.18
En 1970 un compuesto a base de fluoruro de plata amoniacal (FPA) (380mg por 1mL)19,20 fue empleado para la detención del avance de la lesión cariosa; se le comercializa con el nombre de Saforide™ (J. Morita, Japón). La literatura menciona que la inhibición y detención de la caries promovida por el FPA es el resultado de:21
- a)
La unión de iones de plata y proteínas (proteínas bacterianas y proteínas de dentina cariosa infectada) que promueven una coagulación instantánea y forman proteínas de plata.
- b)
La inhibición de enzimas bacterianas (tripsina, colagenasa) consistentes de proteínas, por lo que se previene una posterior desnaturalización del colágeno de la dentina.
- c)
Se detiene la degeneración de dentina afectada en dentina infectada.
- d)
El fluoruro ayuda en la remineralización de la dentina afectada.
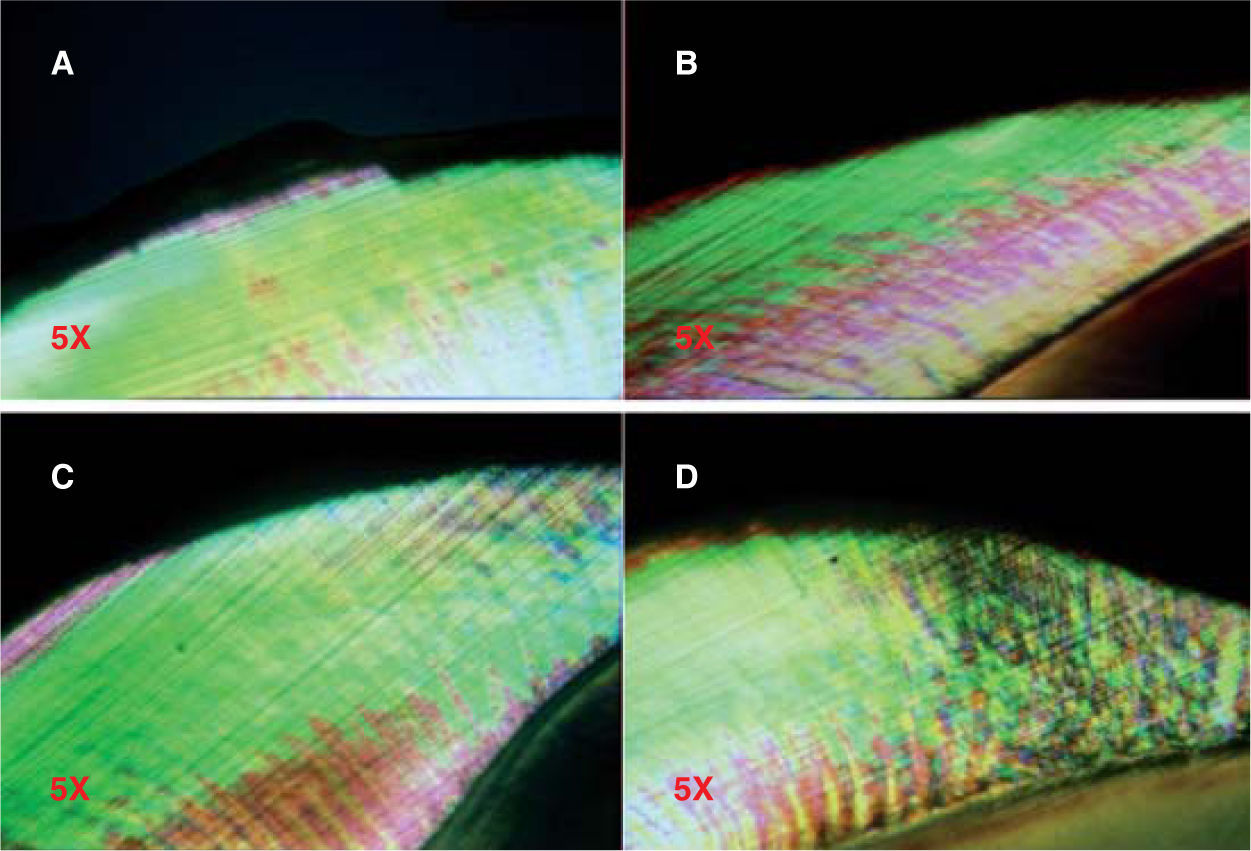
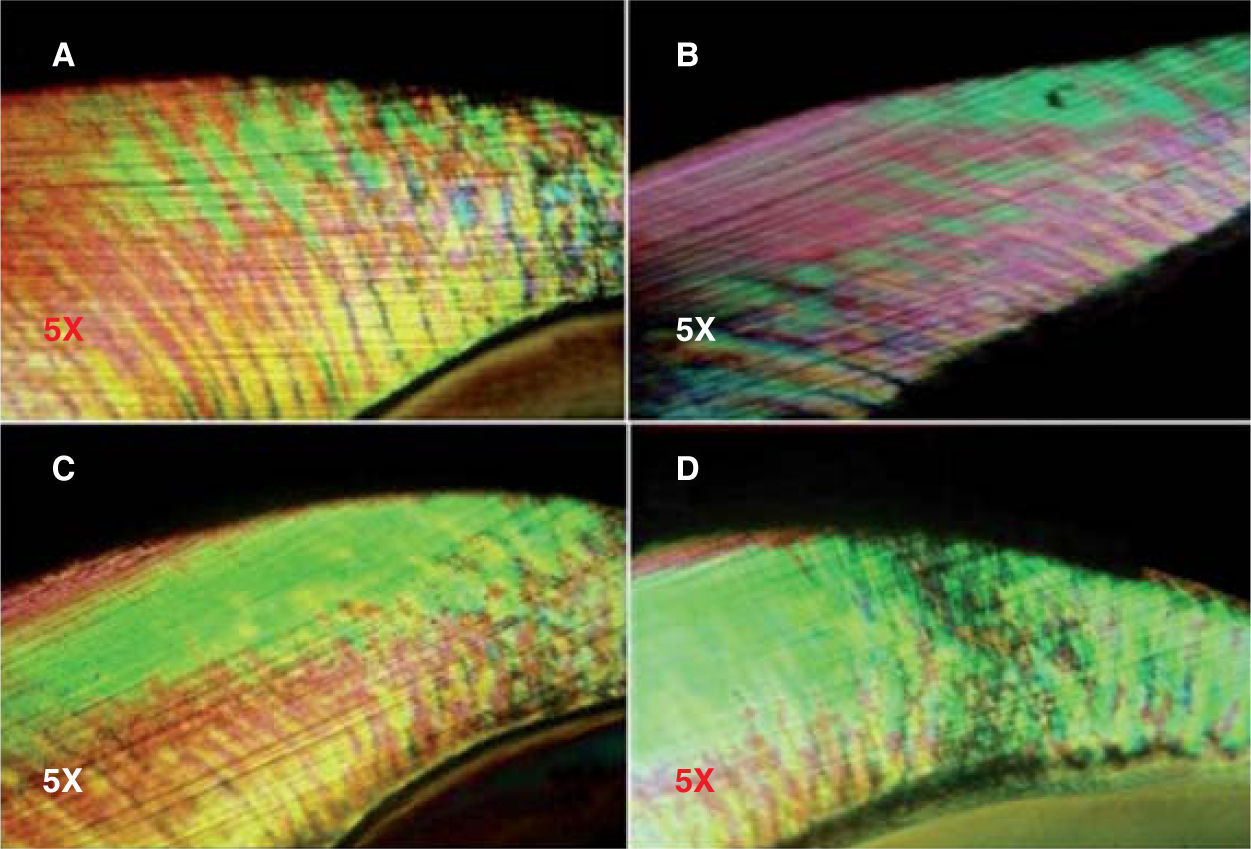
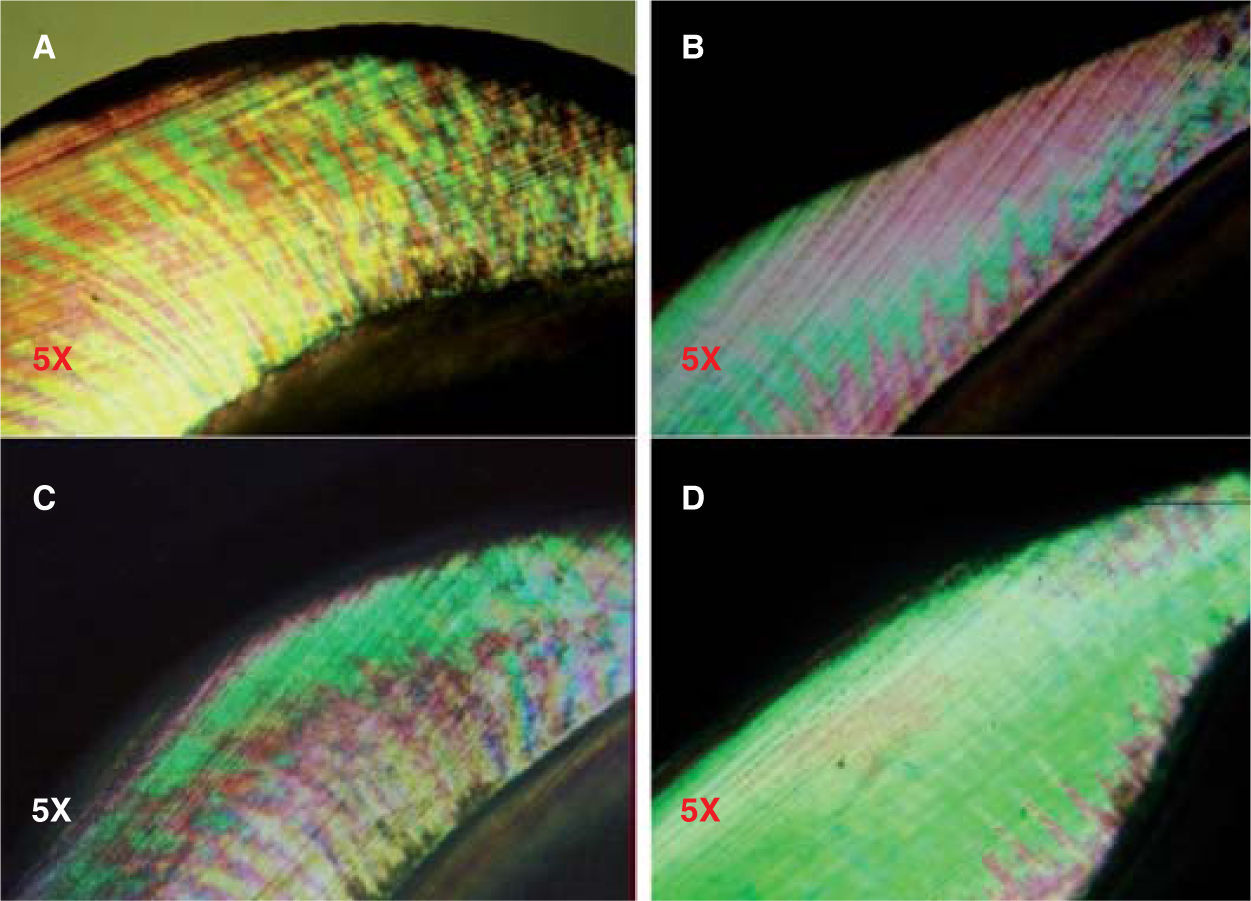
Para valorar la remineralización bajo luz polarizada, el cuerpo de la lesión es observado como la región que muestra birrefringencia positiva, y es representado de color verde. La superimposición del haz de luz es el área de la región del cuerpo después de exponerse a los fluidos orales, el cual ha sido reproducido en color rojo. Después de la exposición a los fluidos orales que contienen iones de flúor agregados, la región del cuerpo es superimpuesta sobre el diagrama en un contorno azul.5
El objetivo de este trabajo fue determinar la eficiencia de tres compuestos fluorados en la inhibición de la progresión de lesiones cariosas incipientes bajo condiciones cíclicas de pH in vitro.
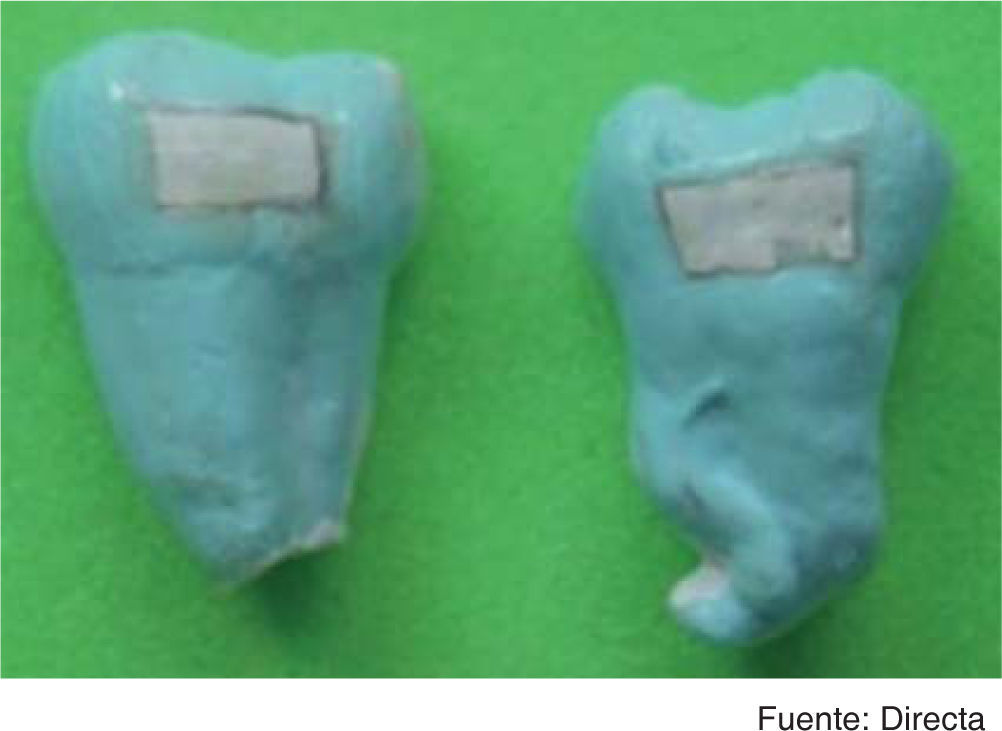
MetodologíaPreparación de las muestrasSe utilizaron 120 terceros molares que cumplieron los criterios de participación establecidos (sanos, no erupcionados, con integridad coronaria y sin defectos estructurales visibles en el esmalte), los dientes fueron preparados según el método descrito por Klein22 y colaboradores; a continuación se hace una breve descripción del método: se elimina el tejido blando radicular y se realiza profilaxis23 con pasta profiláctica sin flúor (QOM, México); posteriormente, fueron seccionados24 con un disco de diamante (Allied High Tech Products, USA) en sentido mesiodistal y en el eje longitudinal, bajo irrigación constante. Cada espécimen fue cubierto con barniz ácido resistente (Revlon, Francia), a excepción de un área de 3.0x6.0mm en la cara labial o lingual (Figura 2).
Los especímenes fueron colocados en una solución desmineralizante elaborada con 2.2mM CaCl2, 2.2mM NaH2PO4, 0.05 M de ácido acético y pH ajustado a 4.4 por la adición de KOH a 1 M durante 96 horas, para producir la lesión inicial8,24-27 en el esmalte, a temperatura constante de 37 °C. Se formaron aleatoriamente cuatro grupos de 30 dientes cada uno, en los cuales se aplicaría uno de los siguientes compuestos fluorados:
- 1)
Fluoruro de plata amoniacal, FPA (Saforide™, J. Morita, Japón).
- 2)
Difluorsilano, DFS (Flúor Protector™, Ivoclar, Germany).
- 3)
Flúor fosfato acidulado, FFA (Sultán™, USA).
- 4)
Grupo control, GC (Sin tratamiento).
Todos los especímenes fueron colocados en el siguiente modelo de pH cíclico:4,28,29
- •
Tres horas en solución desmineralizante.
- •
Colocación del compuesto fluorado (FPA, DFS, FFA y GC) y espera de cuatro minutos.
- •
21 horas en solución remineralizante.
La solución remineralizante estuvo compuesta por: 1.5mM CaCl2, 0.9mM NaH2PO4, y 0.15mM de KCl a pH=7.0.8,24-27 Esta solución se aproximó a la supersaturación de minerales de apatita encontrados en saliva y es similar a la utiliza8da por Ten Cate y Duijsters, según refiere Itthagarun.8
Los recipientes con las muestras se mantuvieron a temperatura constante (37 °C) y humedad absoluta durante los 15 días del modelo de pH cíclico.29 Las soluciones fueron preparadas y cambiadas cada tercer día.
Valoración de la lesiónCada cino días se seleccionaron aleatoriamente 10 muestras de cada grupo para evaluar la remineralización. Las muestras se montaron en bloques de resina acrílica autocurable para realizar cortes longitudinales (100-120 μm) utilizando una recortadora de disco de diamante (Figura 3).
La determinación del efecto de compuestos fluorados sobre el esmalte fue evaluada mediante la observación de los cortes utilizando un fotomicroscopio Axiophot (Carl Zeiss, Germany) en objetivos de trabajo de 5X y 10X bajo la técnica de luz polarizada y filtros de luz azul y gris. Los medios para la birrefringencia fueron el agua desionizada y soluciones de Tholuet con índice de refracción (IR) de 1.41 y 1.47. Se obtuvieron registros fotográficos individuales y se evaluaron los cambios en la birrefringencia.8,22,26,27,29
Los datos referentes al número de muestra, tinción utilizada y escala de valoración (Cuadro I) fueron anotados en una hoja de captura de datos.
Los datos obtenidos fueron capturados y organizados en una base de datos (Excel, Microsoft Inc, USA) y tratados estadísticamente en el programa Sigma Stat for Windows versión 2.0 (Jandel Corporation Software Inc, USA), para analizarlas mediante la aplicación del análisis de varianza (ANDEVA).
ResultadosDe los 120 dientes se realizaron cuatro cortes por diente, obteniendo un total de 480 especímenes. Cada espécimen fue observado de manera aleatoria y ciega. Para lograr la estandarización de la observación, ésta fue realizada por un solo observador previamente calibrado.
Los datos se organizaron en función del tiempo y tipo de tratamiento, de acuerdo con los criterios establecidos previamente.
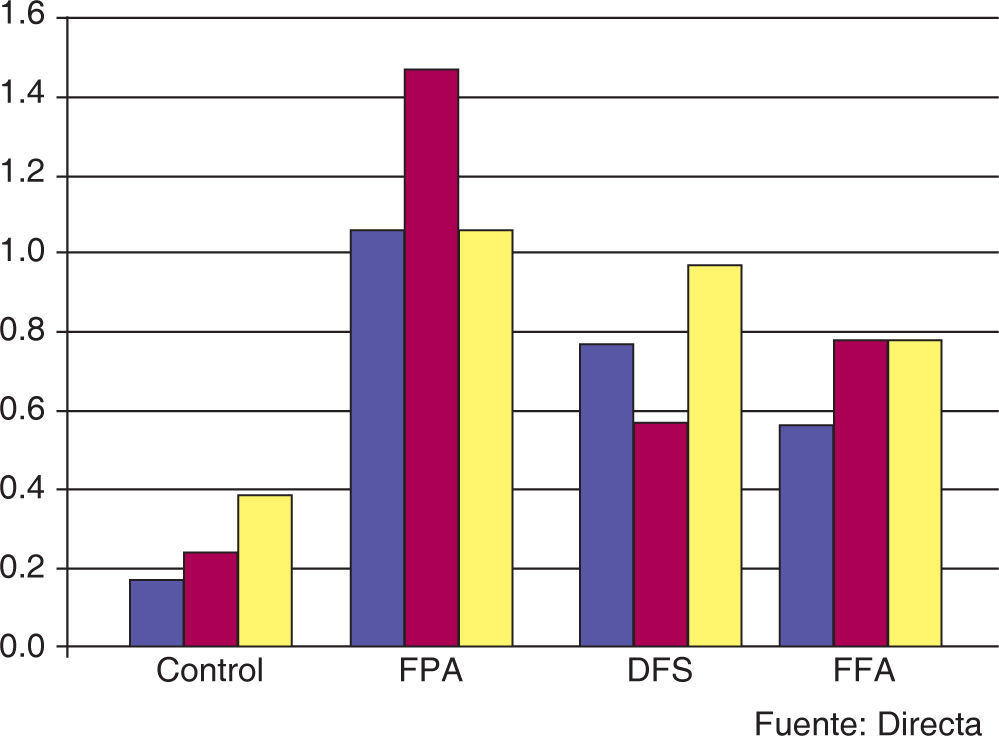
Los cambios en la apariencia del esmalte se encuentran en el cuadro II, que contiene los resultados de la observación bajo luz polarizada de los especímenes tratados con los compuestos fluorados.
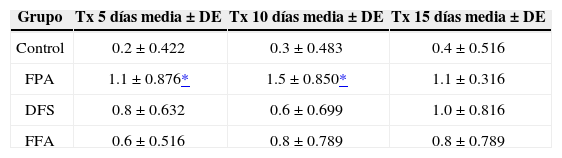
Medias y desviación estándar (DE) de la remineralización observada bajo luz polarizada en esmalte tratado en pH cíclico.
| Grupo | Tx 5 días media ± DE | Tx 10 días media ± DE | Tx 15 días media ± DE |
|---|---|---|---|
| Control | 0.2 ± 0.422 | 0.3 ± 0.483 | 0.4 ± 0.516 |
| FPA | 1.1 ± 0.876* | 1.5 ± 0.850* | 1.1 ± 0.316 |
| DFS | 0.8 ± 0.632 | 0.6 ± 0.699 | 1.0 ± 0.816 |
| FFA | 0.6 ± 0.516 | 0.8 ± 0.789 | 0.8 ± 0.789 |
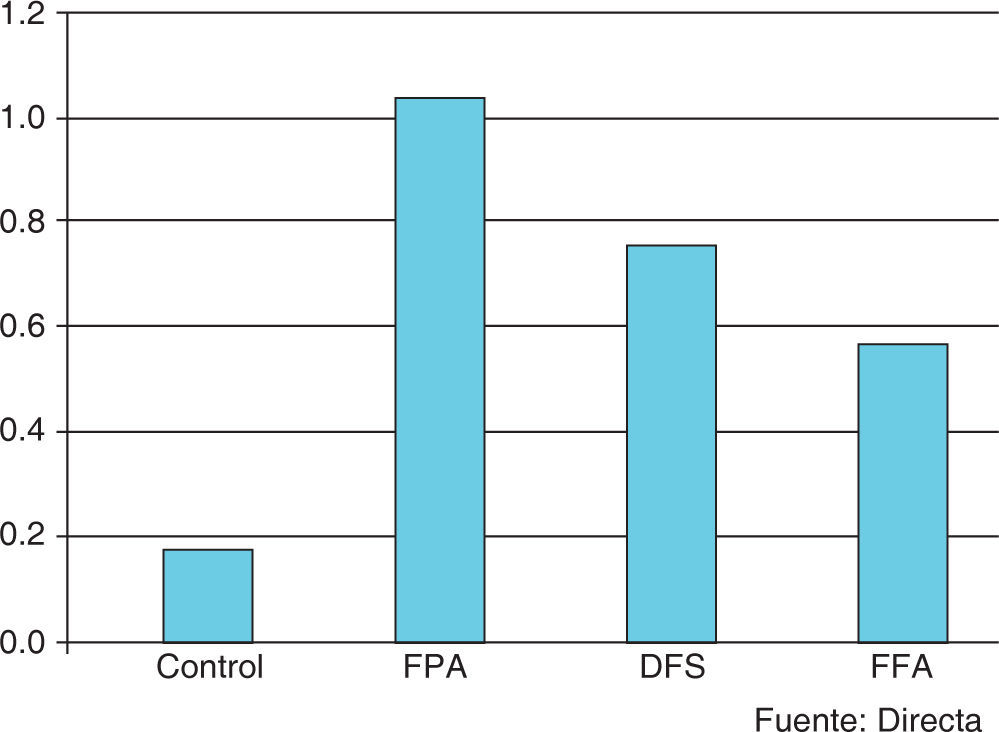
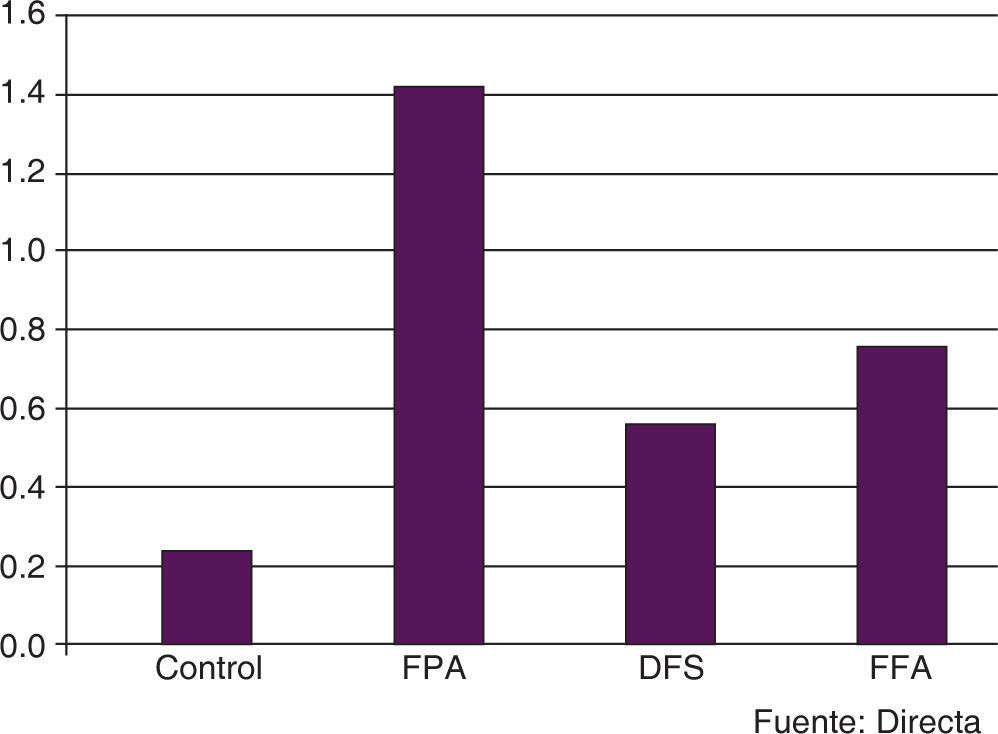
De los especímenes observados a los cinco días de tratamiento con soluciones fluoradas (Figura 4), se encontró que el grupo de FPA mostró la media más alta (1.1 ± 0.876), seguido por el grupo de DFS (0.8 ± 0.632) y el grupo FFA (0.6 ± 0.516) (Figura5); en el GC se observó la menor media de todos los grupos (0.2 ± 0.422). El análisis estadístico de los datos indicó que los grupos donde se encontró la mayor diferencia de valores fueron FPA y GC; la comparación entre estos grupos mostró una diferencia estadísticamente significativa (p=0.024), lo que no sucedió al buscar una asociación de los grupos DFS y FFA con el grupo control.
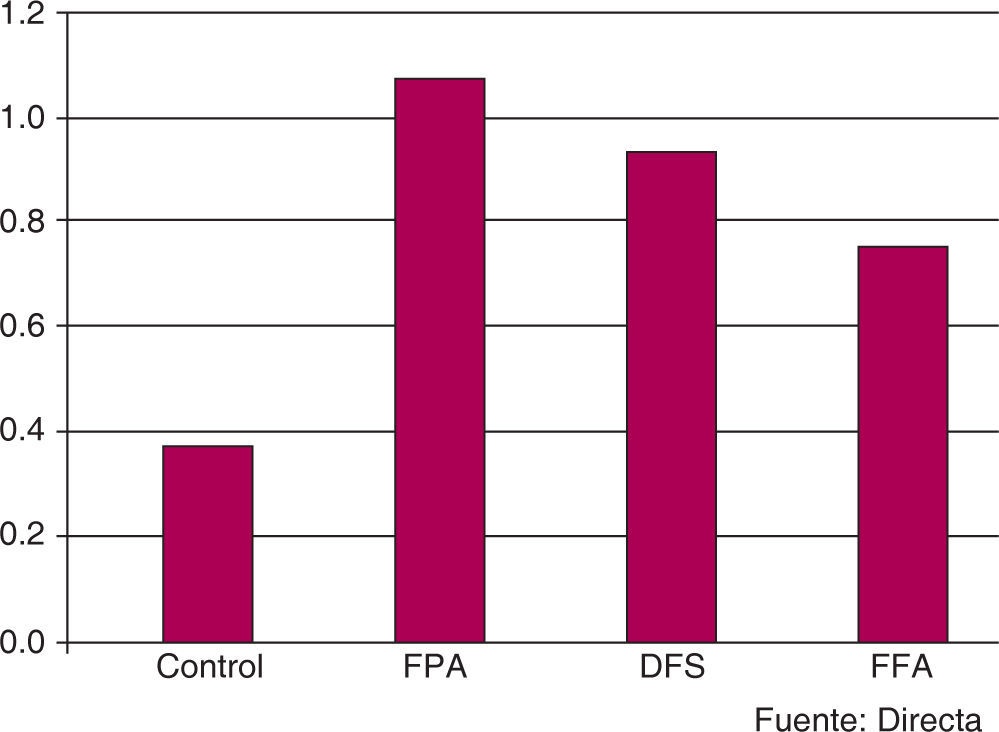
A los 10 días de tratamiento, el grupo de FPA nuevamente mostró la media más alta, con un valor de 1.5 ± 0.850; posteriormente, el FFA (0.8 ± 0.789), el DFS (0.6 ± 0.699) y, finalmente, el GC (0.3 ± 0.483) (Figuras 6y7). El análisis de los datos permitió establecer una diferencia estadísticamente significativa (p=0.013); sin embargo, en la determinación intergrupal de las diferencias, únicamente pudo establecerse la diferencia entre el GC y el grupo FPA (p<0.05).
A los 15 días de tratamiento, la media obtenida para los grupos FPA, DFS y FFA fue 1.1 ± 0.316, 1.0 ± 0.816 y 0.8 ± 0.789, respectivamente; para el GC fue 0.4 ± 0.516 (Figuras 8y9). En el análisis de varianza no se pudieron establecer diferencias estadísticamente significativas (p=0.083).
Los especímenes tratados con FPA a 5, 10 y 15 días mostraron una media de 1.1 ± 0.876, 1.5 ± 0.850 y 1.1 ± 0.316, respectivamente, lo que indica que a los 10 días de tratamiento se obtuvieron los valores más elevados; sin embargo, no se pudo establecer una diferencia estadísticamente significativa en las muestras de este grupo (p=0.401).
Los especímenes tratados con DFS mostraron una media de 0.8 ± 0.632 a los cinco de tratamiento, con un descenso a los 10 días, obteniendo una media de 0.6 ± 0.699 y 1.0 ± 0.816 a 15 días de tratamiento (Figura 10).
En el grupo FFA, los especímenes a los cinco días mostraron una media de 0.6 ± 0.516, a los 10 y 15 días de tratamiento mostraron una media de 0.8 ± 0.789, lo que indica que fue constante el comportamiento del FFA. El análisis estadístico en este grupo no mostró diferencias estadísticamente significativas (p=0.846). En el grupo control se obtuvo una media de 0.2 ± 0.422 a 5 días, 0.3 ± 0.483 y 0.4 ± 0.516 para 10 y 15 días en los diferentes tiempos de tratamiento.
DiscusiónEn la literatura se han reportado gran cantidad de métodos para valorar la progresión cariosa, entre ellos se encuentra el modelo de pH cíclico, como lo refieren Itthagarun, Klein, Ivancakova y Orth.8,22,26,27,29 El propósito del método de pH cíclico es la reproducción de las condiciones de desmineralización-remineralización que se presentan en la cavidad bucal. Se han descrito diferentes versiones del método de pH cíclico,4,8,26,27,30 lo que varía entre cada uno de ellos es principalmente el intervalo de tiempo en que es sometido el espécimen a los periodos de remineralización y desmineralización.
En 1995 Seppa y colaboradores realizaron un estudio comparando el efecto anticariogénico del fluoruro en su presentación en gel y barniz (FFA y FNa, respectivamente); los resultados mostraron diferencias no estadísticamente significativas, concluyendo así que el barniz de flúor es tan efectivo como el flúor en gel.31
De la Cruz realizó un estudio in vivo en 2001 para valorar la resistencia del esmalte dental ante el ataque ácido antes y después de la aplicación tópica de diferentes agentes fluorados (FFA, FNa y barniz de flúor); De la Cruz determinó que todos los tratamientos mostraron un incremento de la resistencia al ataque ácido; asimismo, los resultados indicaron que el grupo tratado con barniz de flúor presentó mayor homogeneidad de efecto sobre el esmalte dental.32
En 2002, Chu y colaboradores valoraron la eficacia del FPA y FNa para el tratamiento de la detención de caries, determinando que la aplicación anual de FPA presentó resultados mayormente satisfactorios que el FNa, concluyendo que el FPA tiene mayor eficacia en el tratamiento del arresto de la caries.33 Esto puede ser explicado debido a la formación de fosfatos de plata en la superficie del diente después de la aplicación de FPA.34
Nelson, mediante la técnica de microsonda de protón, mide en alta resolución en un perfil transverso el calcio y flúor a través de la lesión artificial utilizando carbón amorfo apoyado del microscopio electrónico de barrido.30
Ten Cate4,24 y Mukai28 valoraron la lesión del esmalte por medio de microradiografía; mediante esta técnica determinaron niveles de Ca, P y fluoruro presentes en un medio después de aplicar el agente fluorado. Sus resultados mostradron un incremento en Ca y F solamente en los 15 días posteriores al tratamiento. En esta técnica la muestra estudiada se pierde.
Para medir el aumento de niveles de calcio, Dam-men utilizó la espectometría de absorción atómica y la cromatografía de gas para medir los niveles de flúor en muestras disueltas en ácido.26,27
En los procedimientos cuantitativos mencionados anteriormente se requieren de sofisticadas técnicas instrumentales para la caracterización de las muestra; debido a esto, la determinación del efecto remineralizante por medio de la interpretación de la imagen bajo luz polarizada (LP) ofrece ventajas con respecto a las técnicas empleadas por otros investigadores. En este trabajo, el empleo de LP (técnica cualitativa) permitió conocer de manera sencilla el efecto de los distintos compuestos fluorados en el esmalte, lo cual también ha sido reportado por Klein y Orth,22,29 aunque es importante mencionar que el uso de técnicas cuantitativas arroja resultados más específicos del comportamiento elemental en el proceso de remineralización.
De los compuestos fluorados probados, el FFA y el DFS han sido ampliamente estudiados y sus resultados son conocidos. Sin embargo, los reportes en la literatura sobre el FPA son escasos; es un producto al cual se le ha considerado como un recurso para detener la progresión de la caries en odontopediatría y como medicación intraconducto en tratamientos endodónticos. A excepción de los reportes de Chu y colaboradores,33 no hay información con respecto a la comparación del FPA y el FNa.
El efecto del FPA sobre el esmalte desmineralizado se manifi esta no sólo en lesiones cariosas33 sino también en la remineralización, ya sea interpretada como el aumento en la resistencia del esmalte al ataque ácido, o bien, en el desempeño mejorado del tratamiento de reconstrucción atraumática en odontopediatría.
En este trabajo, el FPA mostró un mejor desempeño sobre el esmalte desmineralizado que el FFA y el FNa, debido a factores asociados a la alta concentración de F- (38%)34 y la gran reactividad del F- con respecto a la estructura química de la hidroxiapatita, por la sustitución de grupos funcionales OH- por los de F-.
Si bien no hubo diferencias entre el FFA y el FNa durante el periodo experimental, el FPA sí mostró diferente comportamiento a los 5 y 10 días de tratamiento, pero a los 15 ya no hubo diferencia con respecto a los demás grupos. Esto puede ser debido a un proceso de saturación del medio donde actúa el FPA, lo cual no es del todo malo si se considera que las aplicaciones continuas y prolongadas pueden llegar a causar efectos adversos, tales como fluorosis.35
ConclusionesEn este estudio el FPA fue el compuesto fluorado más efectivo para el tratamiento de la caries incipiente.
El grupo tratado con FPA presentó mayores cambios que los tratados con FFA, DFS y control.
El modelo de pH cíclico provee cambios constantes controlados, simulando las condiciones presentes en la cavidad oral.
La desmineralización y remineralización del esmalte en lesiones cariosas incipientes puede ser valorada de manera efectiva mediante luz polarizada.
Trabajo apoyado por proyecto IN121205 PAPIIT, DGAPA, UNAM.