El objetivo de esta investigación fue evaluar in vitro la respuesta de fibroblastos gingivales contra diferentes selladores endodónticos mediante cultivos celulares, en un lapso de 96 horas. Los resultados obtenidos a intervalos de tiempo de 0, 1, 2, 3, 6, 24, 48, 72 y 96 horas fueron utilizados para determinar la citotoxicidad de los selladores. Cultivos de fibroblastos gingivales sin ningún sellador y con Sealapex fueron utilizados como controles positivos y negativos respectivamente. Los resultados fueron comparados con los controles negativos y analizados estadísticamente por medio de la prueba t Dunnett (p ≤ 0.05). Los cementos selladores investigados fueron: ProRoot MTA gris y blanco CPM, MTA Angelus, Sealapex y GuttaFlow. Los resultados demostraron que a pesar de que el ProRoot MTA (gris y blanco) MTA Angelus, CPM y GuttaFlow demostraron tener un potencial citotóxico menor que el Sealapex, no se encontraron diferencias estadísticas significativas.
The aim of this study was to evaluate in vitro the response within 96 hrs of gingival fibroblasts cultures against different endodontic sealers, The results obtained at intervals of 0, 1, 2, 3, 6, 24, 48, 72 and 96 hrs were used to determine the cytotoxicity of the endodontic sealers. Gingival fibroblast cultures without root canal sealer and with Sealapex were used as negative and positive controls, respectively. The results were compared with negative controls and statistically analyzed with the Dunnett t test (p ≤ 0.05). The endodontic Sealers investigated were ProRoot MTA gray and white, CPM, MTA Angelus, Sealapex and GuttaFlow. The results showed that eventhough ProRoot MTA (gray and white) MTA Angelus, CPM and GuttaFlow proved to have a lower cytotoxic potential than Sealapex, no statistical significant differences were established.
Diferentes materiales, como amalgama, óxido de zinc-eugenol, IRM, Super EBA, hidróxido de calcio, y ionómero de vidrio se han utilizado en el tratamiento endodóntico de lesiones iatrogénicas, como lo son perforaciones de la raíz y/o del piso de la cámara pulpar.1 Sin embargo, con ninguno de estos materiales ha sido posible lograr un sellado satisfactorio de dichas lesiones, por lo que no ha sido posible hasta ahora promover una regeneración de los tejidos periapicales2 afectados por las perforaciones. Actualmente se ha propagado el empleo de un cemento a base de mineral trióxido agregado (ProRoot MTA) para este fin.
El ProRoot MTA recibió su aprobación por U.S. Food and Drug Administration en 1998. Desde su descripción en la literatura endodóncica por Lee et al. en 1993,3 el ProRoot MTA ha sido utilizado en tratamientos tanto quirúrgicos como no quirúrgicos. La composición química del ProRoot MTA ha sido analizada en diversas investigaciones, con Rayos X, espectrómetro de energía dispersa y con el microscopio electrónico.4-7 El mineral trióxido agregado (ProRoot MTA), consiste en un polvo de partículas fi nas hidrofílicas, que endurecen en presencia de humedad. El resultado es un gel coloidal que solidifica a una estructura sólida en menos de 4 horas.5 El ProRoot MTA está compuesto de silicato tricálcico, aluminio tricálcico, óxido tricálcico y óxido de silicato, así como una cantidad menor de óxidos minerales, los cuales de acuerdo al fabricante son responsables de las propiedades físicas y químicas específicas de este material.8 El óxido de bismuto que contiene el ProRoot MTA le proporciona una radiopacidad adecuada, la cual de acuerdo a Torabinejad et al.5 es mayor (7.17 aluminio) que la de la gutapercha (6.1 aluminio) reportada por Shah et al.4 y la de la dentina, haciendo fácilmente discernible en las radiografías. De acuerdo a Torabinejad et al.9 la composición físico-química del ProRoot MTA permite que se obtenga una mejor adaptación y por lo tanto también un mejor sellado marginal de este material en comparación con el Super EBA y la amalgama. En la actualidad existen dos tipos de cementos ProRoot MTA; el gris y el blanco. Una de las desventajas del ProRoot MTA gris colocado en una cavidad de obturación, es que este material puede comprometer la estética del diente tratado. Primordialmente fue por este motivo que se introdujo el ProRoot MTA blanco, con la finalidad de eliminar una posible pigmentación de los dientes y de los tejidos adyacentes.8
Torabinejad et al.5 analizaron el ProRoot MTA bajo el microscopio electrónico el cual mostró tener una estructura específica dividida en óxido de calcio y fosfato de calcio. El óxido de calcio se observó como cristales discretos y el fosfato de calcio como una estructura amorfa, aparentemente sin cristales y con apariencia granular. El ProRoot MTA no contiene hidróxido de calcio, pero el óxido de calcio al reaccionar con los fluidos tisulares puede provocar la formación de hidróxido de calcio in situ.10
La capacidad de promover una regeneración tisular, como en apexificaciones, perforaciones, obturaciones retrógradas o cualquier otro procedimiento clínico empleado para sellar una comunicación entre el sistema de conductos radiculares y el tejido periapical, es un efecto deseable para cualquier material usado como sellador endodóntico. Análisis histológicos11-13 han reportado que existen pocos materiales dentales los cuales al ser colocados en contacto con los tejidos periodontales inducen cementogénesis y por lo tanto una regeneración de los tejidos periapicales como el caso del ProRoot MTA.
El comportamiento de ProRoot MTA en cultivos celulares ha sido evaluado con células similares a osteoblastos, denominadas Mg-63.14 Los autores reportan que al material parece ofrecer un sustrato propicio para la activación de los osteoblastos y por lo mismo estimula la formación de fosfato de calcio el cual favorece la comunicación con el contenido celular. Durante esta fase el material no se observaron cristales de hidroxiapatita al análisis del microscopio electrónico de barrido, lo que ocasiona un cambio en el comportamiento celular, de manera que se estimula un crecimiento óseo sobre el sustrato.14 Pistorius et al.15 demostraron en cultivos celulares que los fibroblastos gingivales empleados cuando estaban en contacto directo con el ProRoot MTA mostraban una capacidad para sintetizar proteína aparentemente sin alteraciones en comparación a los controles y similar a la del titanio, por lo que deducen que su biocompatibilidad es semejante a la del titanio. Además los autores reportan un potencial de proliferación celular normal; al contrario de la observada con amalgama.
Además de analizar los posibles efectos tóxicos de los materiales de obturación radicular en cultivos celulares14-22 existen observaciones en dientes de perro y mono13,23,24 y en implantes subcutáneos y óseos en animales.6,10,2,26 Torabinejad et al.25,26 examinaron la reacción ósea después de haber implantado ProRoot MTA, amalgama, IRM y Super EBA en tibias y mandíbulas de cobayos y evidenciaron el alto grado de biocompatibilidad del ProRoot MTA ya que presentó la respuesta histológica más favorable debido a la ausencia de inflamación alrededor de la región de los implantes y a la mayor cantidad de aposición de tejido óseo alrededor de los implantes observada. El mismo grupo de investigadores asevera que los resultados de esta investigación y con los obtenidos con ProRoot MTA en investigaciones previas, cuando fue investigado como material de obturación retrógrada9,27,28 y como material para recubrimiento pulpar directo29 pueden ser corroboradas. Torabinejad et al.23 investigaron el ProRoot MTA y amalgama como materiales obturación retrógrada en conductos radiculares de perros y analizaron la reacción de los tejidos periradiculares histológicamente a las 10 y 18 semanas. Encontraron una menor extensión y severidad de inflamación periradicular en los dientes tratados con ProRoot MTA. Además observaron una mayor aposición ósea adyacente al ProRoot MTA comparado con la amalgama y también encontraron la presencia de cemento radicular sobre la superficie del ProRoot MTA frecuentemente. Basados en estos resultados, los autores recomiendan la utilización del ProRoot MTA como el material más adecuado para la obturación retrógrada.
El elevado costo del ProRoot MTA es la razón por la cual se haya alentado la producción de productos similares, como el MTA Ángelus y CPM, los cuales, los fabricantes aseveran que tienen las mismas características, pero a un costo más reducido. El objetivo de esta investigación fue el analizar el potencial citotóxico del los cementos selladores CPM y MTA Angelus en comparación al del MTA blanco y gris en cultivos de fibroblastos gingivales.
Material y métodosEn esta investigación, se incluyeron los cementos selladores tipo Portland ProRoot MTA gris y blanco (Dentsply Tulsa Tulsa, OK, USA), CPM (Medix/México D.F., México) MTA Angelus (Londrina/Laraná, Brasil) y como controles negativos los selladores de conducto radicular Sealapex (Kerr Sybron/Romulus, MI USA) y Guttaflow (Roeko Colténe Whaledent/Langenau, Alemania).
Los fibroblastos gingivales humanos utilizados se obtuvieron de una biopsia de tejido conectivo durante la cirugía periodontal de un paciente sano sin antecedentes clínicos. Se utilizaron líneas celulares del 4o al 9o pasaje los cuales garantizaron, por ser de los pasajes más jóvenes, un metabolismo y una tasa de división altos sin mutaciones significativas.
El cultivo se llevó a cabo de acuerdo a un método (ING) establecido y conocido.30,31 La biopsia se fijó en trozos pequeños con vaselina en cajas Petri de plástico con una superficie de 8.8 cm2 (Nunc/Wiesbaden, Alemania) y se cubrieron con una solución de nutrientes. Para su mejor conservación los cultivos se conservaron en frascos de cultivo para tejidos (185 cm2/Greiner/Frikenhausen, Alemania) o de 25 cm2 (Nunc/Wiesbaden, Alemania) en una campana de flujo laminar (FunctionLine/Heraeus Kulzer, Hanau, Alemania) a una temperatura constante de 37 °C y en una atmósfera con 95% de humedad relativa, sodio al 5% y con una saturación de 5% C02. Para garantizar un crecimiento constante y reproducible de las células el medio de cultivo se conservó a un pH de 11. El medio fue cambiado después de comprobar el crecimiento celular bajo un microscópico modelo (Diavert Leitz/Wetzlar, Alemania). El control del crecimiento celular comprendía una evaluación subjetiva de la densidad del césped celular y probables cambios morfológicos de las células cultivadas como anomalías nucleares como vacuolización y muerte celular.32 Una vez que alcanzaron un consistencia confluente formando una capa única de células (mono-capa), fueron separadas y utilizadas para formar pasajes. Una mono-capa celular confluente, que se formó de tres a cuatro días, fue utilizada para los experimentos. Posteriormente se realizó una activación enzimática por medio de una solución de EDTA (200 mM, Tecnologías de la Vida/Paisley, Escocia) tripsinizada bajo control microscópico (40 X). Los cambios del medio se llevaron a cabo en estricto cumplimiento con las medidas de higiene.
Los materiales (10 mg) fueron mezclados de acuerdo a las indicaciones de los fabricantes con una espátula estéril y se les permitió fraguar por lo menos 15 h bajo luz ultravioleta para prevenir posibles contaminaciones de los mismos. Posteriormente fueron depositados en cajas de Petri para cultivos celulares cubriéndolos con 30,000 células y 200 uL del medio DNEM/F12 (Dulbecco’s modified Eagle’s basal medium) suplementado con suero al 10% de feto de becerro (Grand Island Biological Co. Grand Island NY, USA). 50 UI/mL de penicilina y 50 mg/mL de estreptomicina (Seromed; Seromed Biochrom-Produkte, Wiesbaden, Alemania) fueron agregados como nutrientes. Las células fueron subcultivadas por medio de tripsinisación con un método descrito previamente.19 Cultivos de fibroblastos gingivales sin ningún sellador y con Sealapex fueron utilizados como controles negativos y positivos respectivamente. La viabilidad o tasa de proliferación celular se determinó midiendo la intensidad de la tinción con Alamar Blue con un fluorómetro de microplacas de fluorescencia (FLX 800 Reader, Bio-Tek Instruments/ Winooski, VA, USA) con una excitación de 538 nm y emisión de longitud de onda de 600 nm durante cuatro días. Los cultivos celulares se mantuvieron en una incubadora de gas (Functionline, Heraeus Kulzer/Hanau) a una temperatura constante de 37 °C. La estructura celular fue observada por medio de las tinciones fluorescentes Phallacidin y DAPI. DAPI (4’,6-diamina-2-fenilindola) es una tinción fluorescente que tiñe el DNA de los núcleos de las células azul. Phallacidin es también una tinción fluorescente y tiñe el esqueleto citoplasmático celular con un color verde. Ambas tinciones permiten observar las reacciones celulares en los cultivos bajo el microscopio de fluorescencia.
Evaluación del potencial de proliferación celularLa medición del potencial de proliferación celular se llevó a cabo en nueve diferentes tiempos de incubación (0, 1, 2, 3, 6, 24, 48, 36 y 96 h). Durante este periodo no fue necesario cambiar el medio de cultivo celular ya que las células sobrevivieron sin que la función del Alamar Blue fuera alterada.
Se consideró como hipótesis nula H0 el hecho de que el potencial de proliferación de los fibroblastos gingivales no sufre cambios en el transcurso de cuatro días (96 h). La comparación se realizó con controles negativos. El análisis descriptivo de los resultados contiene los promedios y desviaciones estándar de las mediciones realizadas con los distintos cementos (n=15). Posibles diferencias significativas fueron establecidas por medio de las pruebas de Kolmogroff-Smirnoff y Kruskal-Wallis a un nivel de confidencia de<5%.
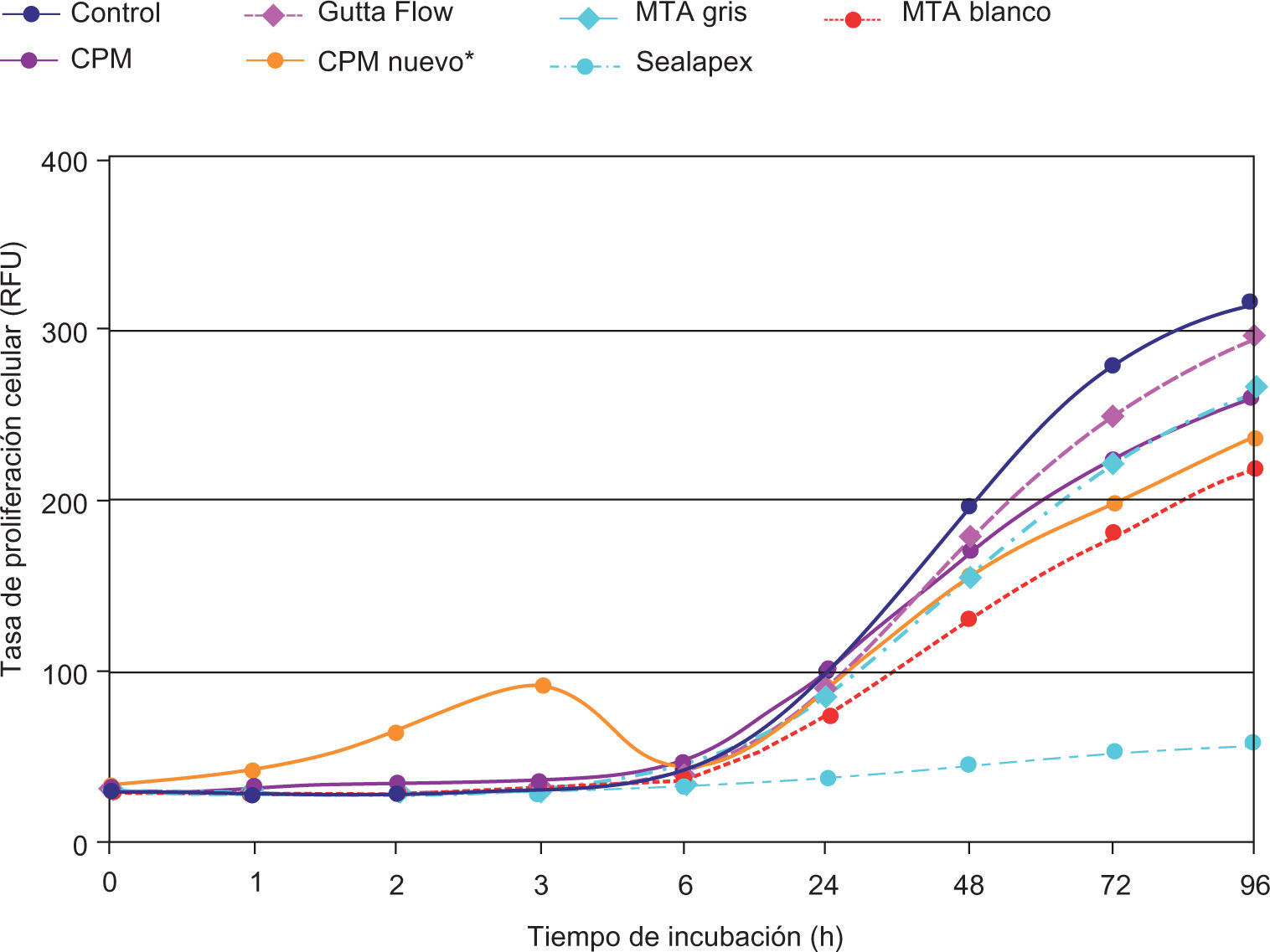
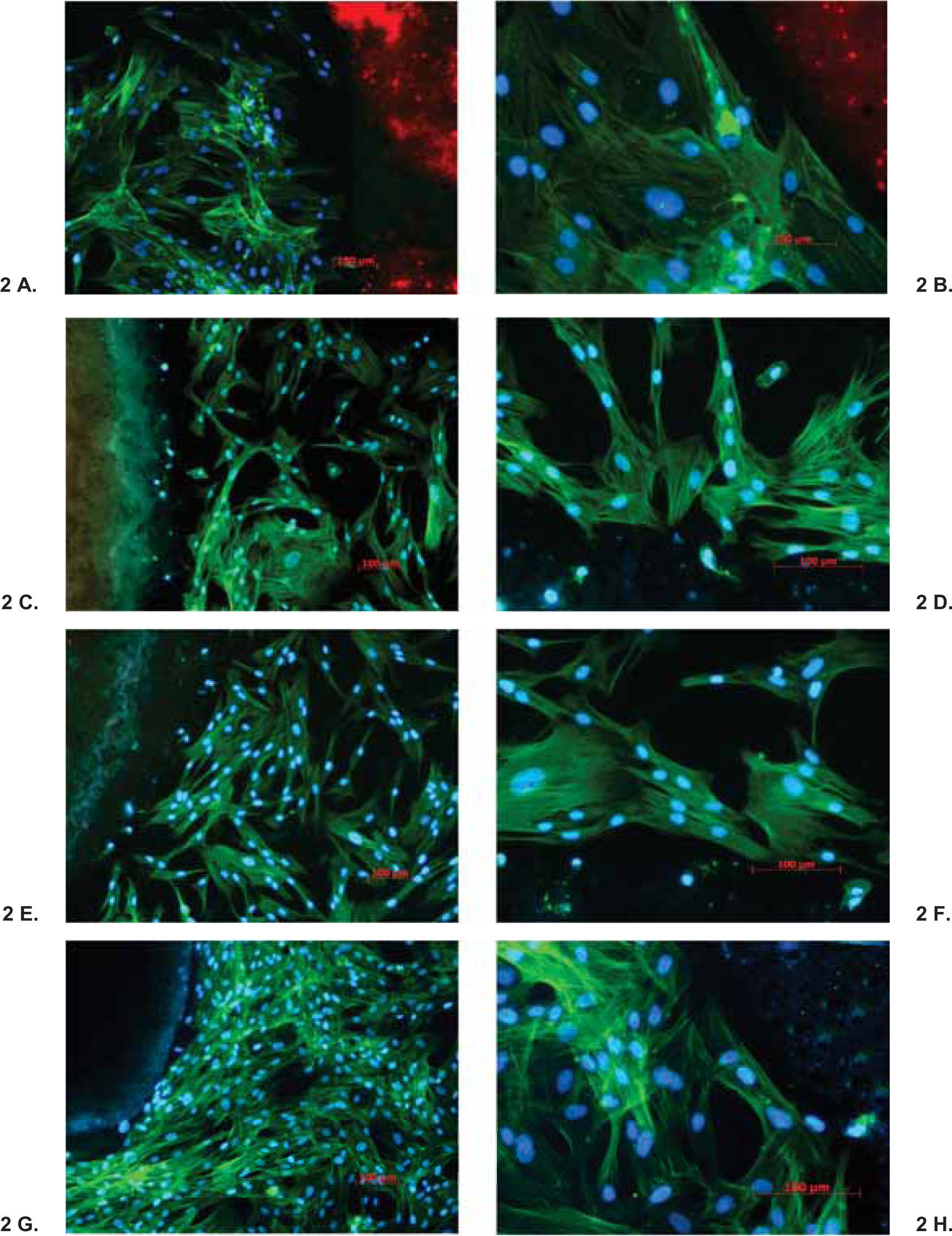
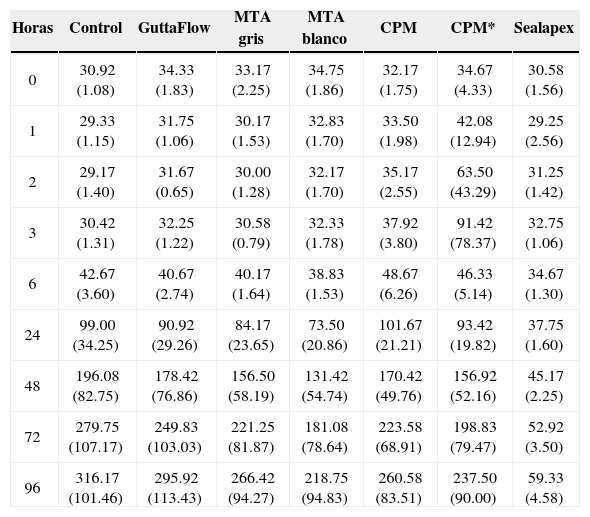
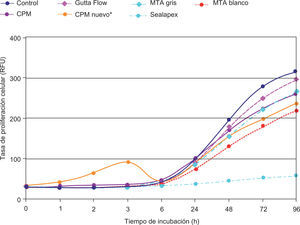
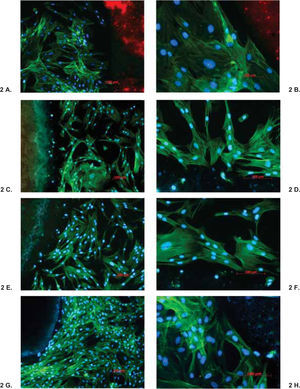
ResultadosEl análisis descriptivo está contenido en el cuadro I. Se observó a las 3 h de incubación que la proliferación más alta registrada de los fibroblastos fue con el cemento CPM; mas sin embargo a partir de las 6 h y hasta las 96 h de incubación se observó con el CPM una reacción muy similar a la de los demás cementos. Los resultados demostraron que no hay diferencias estadísticas significativas entre los cementos investigados y controles negativos; solamente el Sealapex demostró una diferencia significativa con respecto a los demás cementos y control a partir de las 48 h de incubación y hasta el final de la prueba (Figura 1). Las reacciones de los fibroblastos gingivales con los materiales investigados después de haber teñido los cultivos con las tinciones Phallacidin y DAPI se pueden observar en las figuras 2A-2J.
Promedios y desviaciones estándar de los resultados obtenidos con los distintos materiales de obturación a distintos tiempos de incubación.
| Horas | Control | GuttaFlow | MTA gris | MTA blanco | CPM | CPM* | Sealapex |
|---|---|---|---|---|---|---|---|
| 0 | 30.92 (1.08) | 34.33 (1.83) | 33.17 (2.25) | 34.75 (1.86) | 32.17 (1.75) | 34.67 (4.33) | 30.58 (1.56) |
| 1 | 29.33 (1.15) | 31.75 (1.06) | 30.17 (1.53) | 32.83 (1.70) | 33.50 (1.98) | 42.08 (12.94) | 29.25 (2.56) |
| 2 | 29.17 (1.40) | 31.67 (0.65) | 30.00 (1.28) | 32.17 (1.70) | 35.17 (2.55) | 63.50 (43.29) | 31.25 (1.42) |
| 3 | 30.42 (1.31) | 32.25 (1.22) | 30.58 (0.79) | 32.33 (1.78) | 37.92 (3.80) | 91.42 (78.37) | 32.75 (1.06) |
| 6 | 42.67 (3.60) | 40.67 (2.74) | 40.17 (1.64) | 38.83 (1.53) | 48.67 (6.26) | 46.33 (5.14) | 34.67 (1.30) |
| 24 | 99.00 (34.25) | 90.92 (29.26) | 84.17 (23.65) | 73.50 (20.86) | 101.67 (21.21) | 93.42 (19.82) | 37.75 (1.60) |
| 48 | 196.08 (82.75) | 178.42 (76.86) | 156.50 (58.19) | 131.42 (54.74) | 170.42 (49.76) | 156.92 (52.16) | 45.17 (2.25) |
| 72 | 279.75 (107.17) | 249.83 (103.03) | 221.25 (81.87) | 181.08 (78.64) | 223.58 (68.91) | 198.83 (79.47) | 52.92 (3.50) |
| 96 | 316.17 (101.46) | 295.92 (113.43) | 266.42 (94.27) | 218.75 (94.83) | 260.58 (83.51) | 237.50 (90.00) | 59.33 (4.58) |
Representación lineal del comportamiento de los fibroblastos gingivales en contacto con los materiales investigados y los controles negativos. El potencial de desarrollo celular es muy semejante entre todos los materiales a excepción del CPM durante las primeras seis horas y el Sealpex después de seis horas de cultivo.
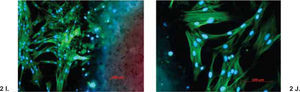
A-J. Reacción de fibroblastos gingivales de origen humano con GuttaFlow (A y B), CPM (C y D), MTA Angelus (E y F), MTA gris (G y H) y MTA blanco (I y J) teñidos con Phallacidin y DPAI. DPAI es un ácido nucleico y tiñe el DNA por lo que el núcleo de las células adquiere un color altamente fluorescente azul. Por el contrario Phallacidin tiñe el citoplasma de las células con un color verde. Phallacidin tiñe la actina f en concentraciones a nivel nanomolar y es empleado para marcar, identificar y cuantificar actina f en secciones de tejido y cultivos celulares. En las fotografías se puede observar que el crecimiento de los fibroblastos fue estimulado por los materiales investigados y que las células formaron un red con una estructura tridimensional y que prolongaciones celulares alcanzaron a penetrar en el material investigado (A, C, E, G e I 100x; B, D, F, H y J 200x).
El potencial de proliferación celular es el parámetro fundamental para saber si los cementos investigados desarrollan un efecto citotóxico. Para el análisis estadístico, se tomó el control de fibroblastos sin contacto con algún cemento y la incubación con los cementos en un lapso de 96 h.
DiscusiónLos materiales usados en endodoncia frecuentemente son colocados en contacto directo con el tejido periodontotal. Esto es particularmente cierto para los materiales usadas como selladores de obturación retrógrada. Por lo que es esencial que los materiales selladores, además de cumplir con otras demandas propias de los mismos, no sean tóxicos si no que bio-compatibles para los tejidos periodontales.33 El potencial citotóxico es uno de los parámetros más comúnmente usado en estudios in vitro para determinar el grado de biocompatibilidad de un material sellador endodóntico. Por lo general se trata de pruebas simples y rápidas por medio de las cuales se obtienen resultados cuantificables y por lo tanto valiosos para poder evaluar la posibilidad de uso clínico de un material determinado. Diversos métodos de cultivos celulares como la observación de la inhibición del crecimiento celular, pruebas de permeabilidad de la membrana celular, pruebas de actividad enzimáticao el registro de injuria y/o muerte celular34,35 han sido usados para determinar la citotoxicidad de distintos materiales dentales.
En esta investigación se estudió in vitro la citotoxicidad de distintos cementos utilizados en endodoncia. Cuando un material investigado produce una reacción citotóxica alta y constante con algún método de investigación in vitro en cultivos celulares, es posible asumir que dicho material también ejerza una alta toxicidad en tejidos vitales.16,21 El grado de toxicidad de un material de obturación retrógrada también puede ser investigado por medio de su implantación en tejido subcutáneo, óseo o muscular de animales evaluando la reacción tisular local causada y por medio de la reacción in vivo del tejido blando causado por el material a prueba en humanos o animales.35 Los resultados de las pruebas de citotoxicidad in vitro no pueden ser extrapoladas por completo a una situación in vivo, en donde se presentan sistemas multicelulares y procesos immunológicos los cuales no es posible emular en su totalidad y complejidad en el laboratorio. En estudios similares15,16,19-22,36,37 fibroblastos gingivales humanos también han sido utilizados para investigar la citotoxicidad de distintos materiales dentales y debido a que los materiales dentales están en estrecha proximidad con los fibroblastos gingivales en la cavidad oral los autores les atribuyen una mayor relevancia clínica. Los distintos autores enfatizan además que este tipo de células son sensibles, fácilmente aisladas y cultivadas. Willershausen et al.22 realizaron un estudio para investigar la biocompatibilidad de diferentes selladores endodónticos utilizando para ello tres líneas celulares (fibroblastos nasales, fibroblastos gingivales y células tumorales epiteliales). El crecimiento, la morfología y el contenido proteico celular así como la liberación de prostaglandina PGE2 fueron los parámetros utilizados para determinar la citotoxicidad de los selladores estudiados. Los autores, basados en las observaciones realizadas, recomiendan el empleo de una línea celular humana diploide y sensible, como los fibroblastos gingivales, ya que este tipo de células resultaron ser las más indicadas para este tipo de investigaciones.
El empleo del colorante Alamar Blue como indicador Redox, el cual al no ser tóxico, resulta ser un método idóneo para determinar cambios colorimétricos y señales fluorescentes en respuesta a una actividad metabólica determinada, y por lo tanto es posible cuantificar la proliferación de líneas celulares humanas o animales, bacterias y hongos. El Alamar Blue es un método más sensible y sencillo en comparación con otros indicadores utilizados en otras investigaciones.16-18 Los resultados de esta investigación demuestran que los niveles de fluorescencia obtenidos con el Alamar Blue aumentaron de forma casi lineal después de seis horas de cultivo hasta el final de los mismos con excepción del Sealapex. Los resultados obtenidos por Willershausen et al.22 con el Sealapex y con fibroblastos gingivales son similares a los obtenidos en este estudio. Los resultados de esta investigación son aparentemente contrarios a los obtenidos en otras similares18,21 en las cuales se ha reportado una citotoxicidad relativamente baja del Sealapex. Es necesario señalar que la comparación directa entre los resultados obtenidos en éste y las investigaciones anteriormente mencionadas es problemática ya que en esta investigación se utilizó al Sealapex como control positivo y fue comparado con materiales los cuales debido a su composición química de antemano se presumía y/o sabía que su citotoxicidad sería más baja que la del Sealapex.
Camp et al.36 describen que el tiempo de incubación es un factor importante para la cuantificación de la citotoxicidad del Pro Root MTA. Los autores sugieren que existe una relación entre la solubilidad del material de obturación y su disolución en medio de cultivo. En esta investigación no se observó una disolución de los materiales en el medio de cultivo ya que a éstos se les permitió fraguar por más de 15 h antes de que fueran cubiertos con el medio de cultivo. Una de las desventajas del método empleado en esta investigación podría ser que la citotoxicidad de los materiales durante su fase de fraguado pudiera ser mayor que la observada. Sin embargo, la ventaja de esta metodología es que los materiales al haber fraguado completamente no se pueden disolver en el medio y por esa razón es posible cuantificar su cito-toxicidad durante un lapso más largo de tiempo sin tener la inseguridad de que las mismas no sean verídicas al haber sido disueltos los materiales en medio de cultivo. Nuestros resultados muestran que el grado de fluorescencia obtenida con el CPM resultó ser relativamente alta inmediatamente después de la adición del Alamar Blue y hasta tres horas después de su incubación, lo que sugiere una citotoxicidad del material relativamente baja. Sin embargo, durante las primeras tres horas de incubación no es posible que exista una proliferación celular, por lo que a pesar de todo no es posible descartar la posibilidad de que el CPM produzca alguna reacción citotóxica durante las primeras horas de incubación con fibroblastos gingivales. En otros estudios17,21,38 en los cuales el fraguado de los materiales fue excluido como parámetro, se investigó la citotoxicidad de cementos selladores a base de hidróxido de calcio y de obturación retrógrada luego de haberles permitido fraguar por espacio de hasta 48 h en cultivos celulares con fibroblastos gingivales humanos. Los resultados reportados en estos estudios son similares a los nuestros a pesar de que en algunos de ellos se investigaron cementos con propiedades químicas similares a los investigados en este estudio pero de otras casas comerciales.
Osorio et al.16 realizaron un estudio con cultivos celulares de fibroblastos de ratones (L-929) y gingi-vales humanos para determinar la actividad enzimática mitocondrial y el número de células viables de cementos selladores y de obturación retrógrada para conductos radiculares. Los autores reportaron que el ProRoot MTA no causó reacciones citotóxicas. Estos resultados son similares a los obtenidos en esta investigación. El ProRoot MTA demostró una citotoxicidad relativamente alta al principio del experimento pero al final del periodo de incubación decreció notablemente; sin embargo, de acuerdo a los resultados obtenidos en esta investigación, no es posible aseverar que el material sea inerte y que no haya causado citotoxicidad alguna. Holland et al.10 investigaron la reacción del tejido periapical en dientes de perro obturados con gutapercha y Ketac-Endo y ProRoot MTA luego de un periodo de seis meses realizaron un examen histopatológico. Los resultados revelaron ausencia total de reacciones inflamatorias del tejido periapical y cierre total del foramen apical de todos los dientes obturados con ProRoot MTA. Los dientes sellados con Ketac-Endo presentaron dos casos de cierre apical parcial y reacciones inflamatorias crónicas leves en el tejido periapical en los casos sobre obturados, mientras en los casos no sobre obturados se observó ausencia total de inflamación en algunos casos e inflamación leve en otros. Los autores concluyen que a pesar de que el ProRoot MTA presentó resultados más favorables que Ketac-Endo, ambos materiales pueden ser considerados como biocompatibles con el tejido periapical. Los resultados histológicos de esta investigación aligual a los obtenidos en este estudio, a pesar de que fue realizado con cultivos celulares, sugieren que los materiales a base de mineral trióxido agregado tienen un potencial tóxico y/o citotóxico bajo y su empleo en la endodoncia puede ser recomendado prácticamente sin restricción alguna.
Los resultados de esta investigación son similares a los obtenidos en otras investigaciones16,21 y demostraron que todos los materiales, a excepción del CPM, produjeron una cierta irritación celular durante las seis primeras horas de incubación. A partir de la séptima hora de incubación se observó un incremento constante de la proliferación celular hasta las 96 h de incubación. El mismo comportamiento fue observado en los fibroblastos gingivales utilizados como control con excepción del Sealapex el cual demostró no tener un incremento en la proliferación celular tan acentuado como con los demás materiales investigados.
ConclusionesLos resultados de esta investigación demostraron:
- •
Que el CPM, ProRoot MTA (gris y blanco), MTA Angelus y GuttaFlow no inhiben el potencial de proliferación de los fibroblastos gingivales,
- •
Que el Sealapex tiene una tendencia a ser más citotóxico que los otros materiales investigados y
- •
Que, basados en el efecto citotóxico de los materiales investigados, se puede recomendar su empleo como cementos selladores en la práctica endodóncica.