Existen diversos materiales de retroobturación, pero poco se sabe de su toxicidad sobre fibroblastos gingivales.
ObjetivoEvaluar la citotoxicidad de tres materiales de retroobturación sobre fibroblastos gingivales humanos y fibroblastos de la línea L929.
Material y métodosLos medios condicionados de los materiales de retroobturación EndoSequence® BC RRMTM (ERRM), trióxido mineral agregado MTA Angelus® blanco (MTA) y material de restauración intermedia (IRM®) se obtuvieron en fresco, al tiempo de fraguado, y después de 1, 24 y 72 horas del tiempo de fraguado. La morfología celular fue evaluada por microscopia de luz y la viabilidad celular fue evaluada a través de la actividad metabólica mitocondrial con 3-(4,5-dimetiltiazol-2-il)-2,5-difenil bromuro de tetrazolio (MTT). El análisis estadístico se realizó por ANOVA.
ResultadosEl material ERRM no mostró efectos citotóxicos sobre los fibroblastos. Sin embargo, el MTA y el IRM® mostraron citotoxicidad moderada y alta, respectivamente. Esto revela que el MTA y el IRM® no son completamente inocuos.
ConclusiónLos materiales biocerámicos como el ERRM pueden ser considerados los materiales de retroobturación más biocompatibles.
Presently there are many retrofilling materials in the market, nevertheless, little is known about their toxicity on gingival fibroblasts.
ObjectiveTo assess cytotoxicity of three materials to human gingival fibroblasts and L929 mouse fibroblasts cell line.
Material and methodsEndoSequence® BC RRMTM (ERRM; root repair material), white MTA Angelus® (MTA) and intermediate restoration material (IRM®) conditioned media were obtained when materials were freshly mixed, at setting time and after 1, 24 and 72hours of setting time. Cell morphology was assessed with light microscopy and cell viability was assessed through mitochondrial metabolic activity with 3-(4,5-dimethylthiazole-2-yl)- 2,5-diphenyltetrazolium bromide (MTT). Statistical analysis was conducted with ANOVA.
ResultsWe found that ERRM material did not exhibit cytotoxic effects on used fibroblast, nevertheless, MTA and IRM® respectively exhibited moderate and severe cytotoxicity, thus indicating the materials were not fully harmless.
ConclusionBioceramic cements like ERRM could be considered the most compatible retrofilling-materials.
La cirugía en endodoncia está indicada cuando el tratamiento de conductos fue fallido o cuando existe alguna contraindicación para realizar el tratamiento de conductos convencional.1 En una cirugía periapical, primero se hace una incisión para descubrir la parte apical del diente infectado, luego se elimina el tejido infectado mediante curetaje del área, posteriormente se prepara el sitio de retroobturación, se retroobtura con un material de retroobturación y finalmente se sutura la incisión. En este procedimiento se usan materiales de retroobturación que idealmente proveen un sellado apical y facilitan la reparación de los tejidos periapicales.2 El uso del microscopio, el desarrollo de técnicas quirúrgicas, el mejoramiento de la iluminación y la accesibilidad a nuevos materiales de retroobturación contribuyen en gran medida al éxito de las cirugías periapicales.3,4 Estos avances han marcado una nueva era en la cirugía en endodoncia.5
Un material de retroobturación ideal debe tener una buena adhesión a la dentina, un buen sellado, estabilidad dimensional, insolubilidad a fluidos tisulares, buena compresibilidad, buen tiempo de trabajo y endurecimiento rápido. Además, debe ser reabsorbible, radiopaco, de fácil manipulación y biocompatible con los tejidos del huésped.6–8 Dentro de los materiales que han sido utilizados para retroobturación se encuentran la amalgama, materiales de resina, cementos de óxido de zinc y eugenol, cementos de ionómero de vidrio, cementos de policarboxilato, Cavit™ y la gutapercha.9
La amalgama era el material más utilizado en cirugías periapicales. Sin embargo, no tiene buenos resultados clínicos.4 Después de la amalgama, se implementó el uso de cementos a base de óxido de zinc y eugenol. Algunas desventajas de estos cementos son su largo tiempo de fraguado y su alta solubilidad. Una mejora a este tipo de cementos fue añadir polimetilmetacrilato. El material de restauración intermedia (IRM®) es el resultado de esta mejora. Este material es fácil de manipular, fácil de mezclar, tiene mejor capacidad de sellado, menor tiempo de fraguado4 y buenos resultados postoperatorios.10 Sin embargo, este cemento no es biocompatible, pues muestra reacciones inflamatorias en el tejido perirradicular.3 Otro cemento es el trióxido mineral agregado (MTA) que contiene silicato de calcio principalmente. Fue desarrollado en la Universidad Loma Linda, California en 1993 y comercializado en 1999. El MTA tiene una excelente capacidad de sellado y buenos resultados a largo plazo. Además, es un material biocompatible con los tejidos, pues no muestra reacciones inflamatorias perirradiculares.11 Más aún, tiene capacidad de reparación mediante la formación de tejidos duros y posee propiedades antibacterianas.7 Aunque el MTA como material de retroobturación ha ganado reconocimiento desde su introducción en el mercado endodóncico, es un material de difícil manipulación12 y es difícil de colocar durante el tratamiento.13 Finalmente, otro inconveniente es su largo tiempo de fraguado.6,11 El MTA ha sido mejorado variando su composición. El MTA Angelus® (Angelus, Londrina, Brazil) es una de estas variantes.12 El MTA Angelus® blanco tiene mayores cantidades de carbonato de calcio, silicato de calcio y fosfato de zinc y bario. Estos elementos contribuyen a mejorar el tiempo de fraguado y su facilidad de manipulación.6,14 Sus características físicas y químicas son similares al MTA original.15 Un nuevo material de retroobturación llamado EndoSequence® BC root repair material (ERRM), se compone de la combinación de silicato de calcio y fosfato de calcio.16 Este material es hidrofílico, homogéneo y posee estabilidad dimensional excepcional.17,18 También es un material altamente radiopaco. Esta propiedad hace que sea fácil de colocarlo durante el tratamiento y fácil de identificarlo en las radiografías. Su pH es de 12.8 lo que permite funcionar como agente antibacteriano. Su pH disminuye de forma constante durante un periodo de siete días6,19 y sus propiedades físicas y mecánicas son similares al MTA pero con mejores características de manejo y ajuste.1
BiocompatibilidadEl MTA es un material biocompatible.8,14 Torabinejad y sus colaboradores mostraron que el MTA, tanto fresco como fraguado, es menos citotóxico que el IRM®.8,20 Además el MTA no interfiere con la adhesión celular.8,17
El MTA y el IRM® han sido ampliamente estudiados y son usados como materiales de retroobturación.10 Ambos poseen una buena capacidad de curación apical en estudios clínicos prospectivos.3 El fabricante de ERRM menciona que éste posee excelentes características físicas y biocompatibilidad aceptable, dando resultados muy favorables cuando es usado como material de retroobturación, aunque existe poca literatura sobre esto. Existen diferentes materiales de retroobturación en el mercado. Sin embargo, pocos reportes comparativos de su citotoxicidad en fibroblastos se han documentado. Por lo anterior, el propósito de este trabajo es conocer la citotoxicidad de los materiales de retroobturación MTA Angelus® blanco, IRM® y EndoSequence® BC RRMTM (ERRM) sobre cultivos de fibroblastos gingivales humanos (FGH) y fibroblastos de línea celular de ratón L929.
MATERIAL Y MÉTODOSMateriales de retroobturaciónTres materiales de retroobturación fueron utilizados en este estudio. El material de restauración intermedia o IRM® que es un cemento a base de óxido de zinc y eugenol; el mineral trióxido agregado MTA Angelus ® blanco (MTA), y el EndoSequence® BC RRMTM o material de reparación de la raíz (ERRM), que es un material biocerámico (Cuadros I y II). Los cementos fueron preparados como se indica en el cuadro II.
Materiales de retroobturación, composición y fabricante
| Material | Composición | Fabricante |
|---|---|---|
| Mineral trióxido agregado | Polvo: óxido de zinc y polimetilmetacrilato | Dentsply International, Milford DE, USA |
| IRM® | Líquido: eugenol | (Intermediate Restorative Material; Dentsply Sirona Global Headquarters, York, USA) |
| MTA Angelus® blanco | Silicato tricálcico, silicato dicálcico, óxido de bismuto, residuos insolubles de sílice cristalina, óxido de calcio y sulfatos de potasio y sodio | Angelus, Londrina-PR-Brasil |
| EndoSequence® BC RRMTM (ERRM) | Silicatos de calcio, óxido de zirconio, pentóxido de tantalio, fosfato monobásico de calcio y agentes de relleno | Brasseler, Savannha GA, USA |
Preparación de los materiales de retroobturación
| Material | Preparación | Tiempo de Fraguado |
|---|---|---|
| Mineral trióxido agregado IRM® | Una y media cucharadas de polvo y una cucharada de líquido | 10 minutos |
| MTA Angelus® blanco | Una cucharada de polvo y una gota de agua destilada | 2.45 h |
| EndoSequence® BC RRMTM (ERRM) | Material premezclado | 2 h |
Los medios condicionados y sus diluciones respectivas se obtuvieron siguiendo la norma ISO 10993-5:2009 (Organización Internacional de Estandarización 2009).18 Brevemente, cilindros estériles de teflón (5.5mm diámetro externo x 2mm de altura x 3mm de grosor) fueron colocados sobre cuadrados estériles de hojas de teflón Mylar (1.1 x 1.1 cm), y llenados con los cementos en fresco (ambos de Tetraflón de México S.A. de C.V., Toluca, Estado de México). Los cilindros fueron posteriormente colocados en cajas de 24 pozos (Corning Inc., Corning, NY). A cada pozo se agregaron 1.5mL de medio Eagle modificado por Dulbecco (DMEM; GIBCO, Invitrogen, Grand Island, NY, USA) suplementado con 10% de suero fetal bovino (ByProductos S.A. de C.V., Guadalajara, Jalisco, México), 8 mM L-glutamina, y antibióticos (10,000 unidades/mL penicilina, 10,000 μg/mL estreptomicina, y 25 μg/mL de Fungizone®; GIBCO, Invitrogen, Grand Island, NY, USA). El medio de cultivo se dejó en contacto con los materiales de retroobturación por diferentes tiempos: en fresco (0 h), al tiempo de fraguado (Cuadro II) y a 1, 24 y 72 horas después de su fraguado. Después de cada tiempo se recolectó el medio condicionado en tubos Eppendorf y se guardó -20°C, hasta su uso. Como control de medio condicionado se recolectaron medios que no fueron expuestos a ningún cemento, a los mismos tiempos. De cada uno de los medios condicionados se prepararon tres diluciones: 1/10, 1/100 y 1/1,000.
Líneas celularesFibroblastos de ratón de la línea celular L929 y fibroblastos gingivales humanos (FGH) fueron utilizados en el presente estudio. Los FGH fueron obtenidos de tejido gingival donado por pacientes sanos. Estos procedimientos fueron aprobados por el Comité de Ética correspondiente, así como todos los donadores firmaron el formato de consentimiento informado. Los fibroblastos gingivales fueron obtenidos de la siguiente manera: el tejido gingival fue colocado en DMEM bajo condiciones estériles, lavado y dividido en pequeñas piezas (1mm3). Los cortes de tejido gingival fueron colocados en 3mL de DMEM en tubos de 50mL. Después, el medio fue removido y 5mL de medio fresco conteniendo 5 mg/mL de colagenasa tipo IV (Sigma-Aldrich Co., St. Louis, MO, USA) se añadieron al tubo. El tubo fue puesto en baño maría a 37°C por dos horas, agitando el tubo por 30 segundos cada 30 minutos. Luego el tubo fue centrifugado a 377g por dos minutos, el sobrenadante fue removido, y las células se resuspendieron en 5mL DMEM suplementado. Finalmente la suspensión de células se transfirió a una caja de cultivo de 25cm2 (Corning Inc., Corning, NY, USA). La caja fue incubada a 37°C con 5% CO2 por 24 horas. Células no adheridas fueron removidas y los fibroblastos gingivales humanos se dejaron crecer hasta alcanzar la confluencia.21
Cultivo celularLos fibroblastos fueron cultivados en DMEM (GIBCO, Grand Island, NY), suplementado. Los cultivos celulares se mantuvieron en botellas de cultivo de 75cm2 (Corning, Inc., Corning, NY) hasta que llegaron a un 80-90% de confluencia y se subcultivaron. Para esto, los fibroblastos se despegaron con 0.05% de tripsina/EDTA (GIBCO, Invitrogen, Grand Island, NY). La tripsina fue neutralizada con un volumen igual de medio de cultivo fresco. La suspensión celular fue centrifugada tres minutos a 1,500rpm. El sobrenadante fue desechado y el botón celular fue resuspendido en 5mL de medio fresco. Un cuarto de la resuspensión fue colocado en una botella de cultivo nueva para continuar el cultivo. Todos los experimentos se realizaron entre los subcultivos tres y 10.
Morfología celularPara evaluar la morfología celular se sembraron 104 fibroblastos/pozo en cajas de cultivo de 96 pozos (Corning, Inc., Corning, NY) en un volumen final de 100 μL de medio de cultivo por pozo. Los cultivos se mantuvieron en un incubador durante 24 horas (NuaireTM, Plymouth, USA) a 37°C, 95% de humedad relativa y 5% de CO2. Después de 24 horas, tiempo necesario para permitir que los fibroblastos se adhirieran a los pozos, se removió el medio de cultivo, y se colocaron 100 μL de cada uno de los medios condicionados correspondientes durante otras 24 horas. Al cabo de este tiempo, se evaluó la morfología en un microscopio modelo IX70 Olympus (Center Valley, PA, USA). Las imágenes fueron capturadas con una cámara Evolution-VF Cooled Color de Media Cybernetics (Rockville, MD, USA), y con el programa de computadora Q Capture pro 6.0 de QImaging Surrey (British Columbia, Canadá).
Ensayo de actividad metabólica (reducción MTT)El potencial citotóxico de los materiales de retroobturación fue evaluado con base en la norma ISO 10993-5:2009 (Organización Internacional de Estandarización 2009) usando el ensayo de 3-(4,5-dimetiltiazol- 2-il)-2,5-difenil bromuro de tetrazolio (MTT), (Sigma-Aldrich Co., St. Louis, MO, USA).21 Brevemente, a los mismos cultivos que fueron utilizados para tomar las fotografías de fibroblastos, se les retiró el medio condicionado y se les agregó 50 μL de una disolución de 1 mg/mL de MTT en cada pozo. Los cultivos fueron cubiertos de la luz y mantenidos a 37°C con 5% CO2, por dos horas. Después de este tiempo se retiró el MTT y se agregaron 100 μL de isopropanol (TECSIQUIM, TSQ, Iztacalco, Ciudad de México) a cada pozo. Los cultivos fueron incubados 30min a temperatura ambiente. Pasado este tiempo, la absorbancia de la disolución fue medida a 590nm en un lector de placas modelo Synergy HT, marca Bio-Tek (Vermont, USA). Los valores de absorbancia fueron normalizados considerando como 100% la absorbancia obtenida de cultivos no tratados.
EstadísticaPara determinar posibles diferencias entre los grupos de cementos y entre los diferentes tiempos, se realizó un análisis de varianza (ANOVA) de una vía, para muestras iguales. La prueba post hoc utilizada fue Tukey, usando el programa KaleidaGraph® versión 3.6.2 para Mac (Synergy Software; Reading, PA, USA). Las condiciones se consideraron diferentes estadísticamente cuando el valor de p fue ≤ 0.05.
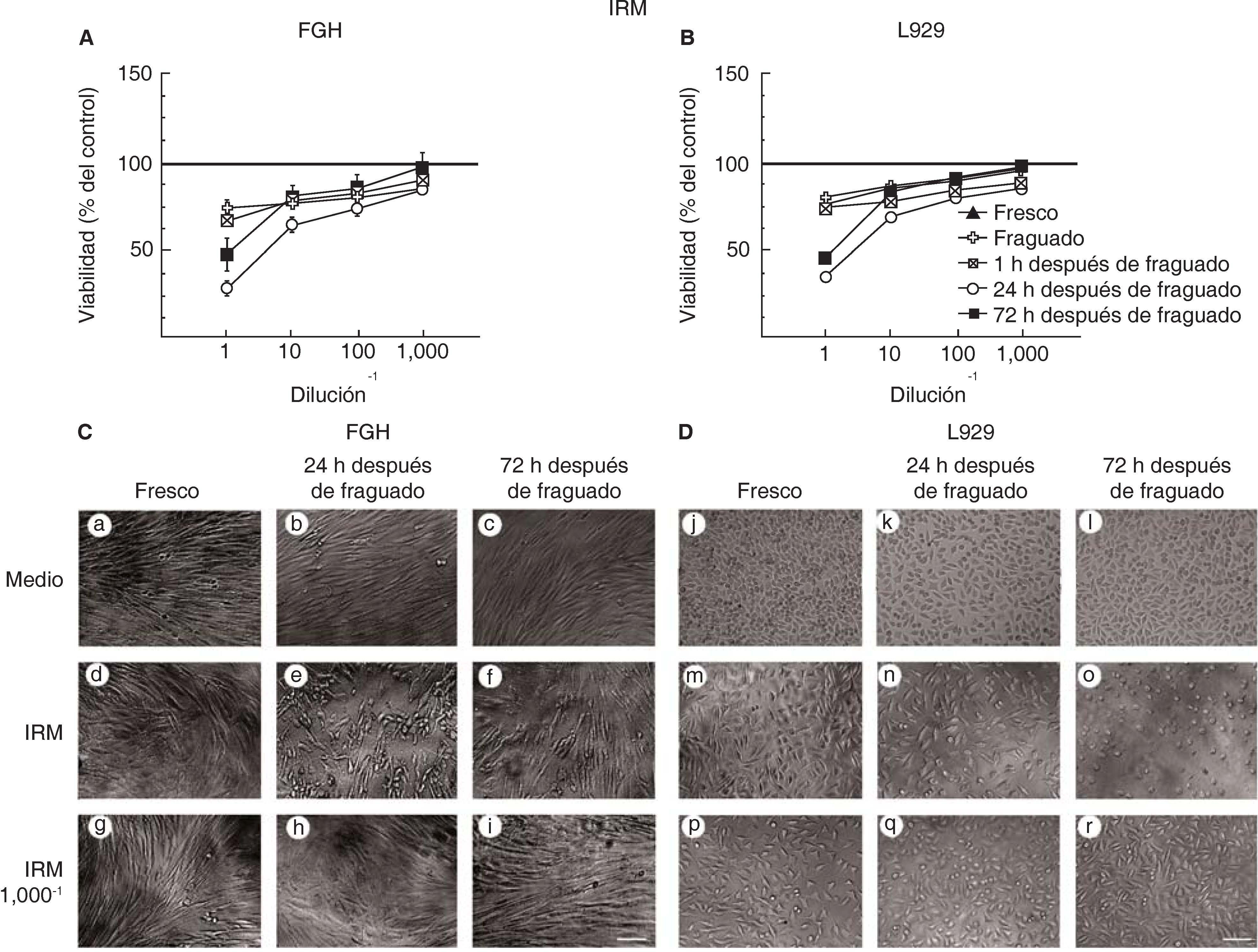
RESULTADOSLas células expuestas a medio condicionado del material de restauración intermedia (IRM®) después de 24 horas de fraguado son dañadas. Las células presentan una morfología normal cuando fueron expuestas a medio condicionado de 72 horas de fraguado.
La viabilidad no se alteró en los fibroblastos gingivales humanos (Figura 1A) y los fibroblastos de la línea celular L929 (Figura 1B) que fueron expuestos al material IRM® en condiciones de fresco, fraguado y una hora después del fraguado. Sin embargo, la viabilidad celular fue de sólo 30% cuando el medio condicionado fue de 24 horas después del fraguado. La viabilidad fue cerca de 50% cuando los fibroblastos fueron expuestos a medio condicionado de 72 horas después del fraguado. La viabilidad celular se mantuvo entre el 80 y el 90% en todas las diluciones en todos los tiempos a excepción de 24 horas después del fraguado (Figuras 1A y 1B).
Viabilidad de fibroblastos gingivales humanos (FGH; panel A) y fibroblastos de ratón de la línea celular L929 (panel B) después de la exposición a IRM®. Los símbolos representan: cemento fresco (triángulo negro), fraguado (cruz blanca), a 1 h (cuadrado tachado), a las 24 h (círculo blanco) y a las 72 h de fraguado (cuadrado negro). El 100% de viabilidad celular representa la condición sin cemento (línea negra en 100%). Los datos representan el promedio del porcentaje de viabilidad celular de tres experimentos independientes, realizados por triplicado. Microfotografías de FGH (panel C) y L929 (panel D) expuestos a medio, al medio condicionado de IRM® concentrado y a una dilución del medio condicionado de IRM® 1/1,000. Escala 100 μm.
Los fibroblastos gingivales humanos (Figura 1C) o los fibroblastos L929 (Figura 1D) no tratados muestran una morfología similar a la de los fibroblastos con los medios condicionados en fresco, fraguado y una hora después de fraguado. Sin embargo, después de 24 horas después del fraguado, los fibroblastos han perdido su capacidad de mantener una monocapa homogénea (Figuras 1C y 1D panel e y n, respectivamente). A las 72 horas después del fraguado, el IRM® causa un daño severo en los fibroblastos L929, éstos tienen una morfología redondeada (Figura 1D panel o). Por el contrario, la morfología celular no se ve afectada al diluir el IRM®(Figuras 1C y 1D panel g-i y p-r, respectivamente).
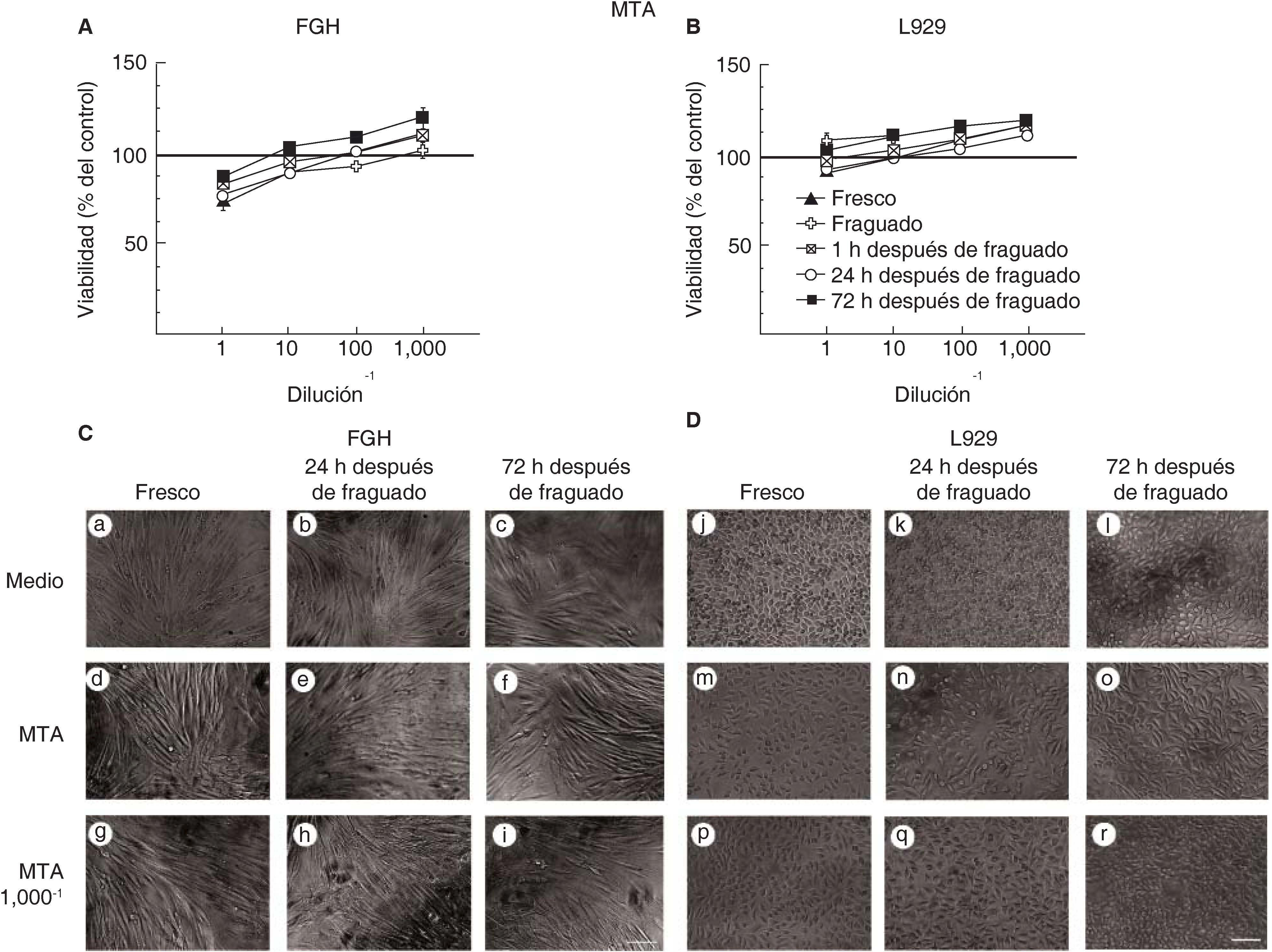
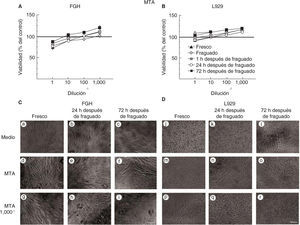
Las células expuestas a medio condicionado del material de restauración intermedia MTA Angelus® blanco (MTA) se mantienen viables y muestran una morfología típica de fibroblastos.
La viabilidad no se alteró ni en los fibroblastos gingivales humanos (Figura 2A) ni en los fibroblastos de la línea celular L929 (Figura 2B) que fueron expuestos al material MTA. Más aún, los fibroblastos expuestos a diferentes diluciones de medios condicionados de MTA mostraron una mayor actividad metabólica que los fibroblastos sin tratamiento. Por lo consiguiente, la actividad metabólica fue menor en los fibroblastos no tratados que en los fibroblastos tratados con diluciones 1/100 y 1/1,000 de medios condicionados de 72 horas después de fraguado (Figuras 2A y 2B). En concordancia, los fibroblastos gingivales humanos tuvieron una forma típica bipolar y elongada y se mantuvieron adheridos a la caja de cultivo en todos los tiempos evaluados (Figura 2C). De forma similar, los fibroblastos de la línea L929 tuvieron una forma típica triangular elongada y se mantuvieron viables (Figura 2D).
Viabilidad de fibroblastos gingivales humanos (FGH; panel A) y fibroblastos de ratón de la línea celular L929 (panel B) después de la exposición a MTA. Los símbolos representan: cemento fresco (triángulo negro), fraguado (cruz blanca), a 1h (cuadrado tachado), a las 24h (círculo blanco) y a las 72h de fraguado (cuadrado negro). El 100% de viabilidad celular representa la condición sin cemento (línea negra en 100%). Los datos representan el promedio del porcentaje de viabilidad celular de tres experimentos independientes, realizados por triplicado. Microfotografías de FGH (panel C) y L929 (panel D) expuestos a medio, al medio condicionado de MTA concentrado y a una dilución del medio condicionado de MTA 1/1,000. Escala 100μm.
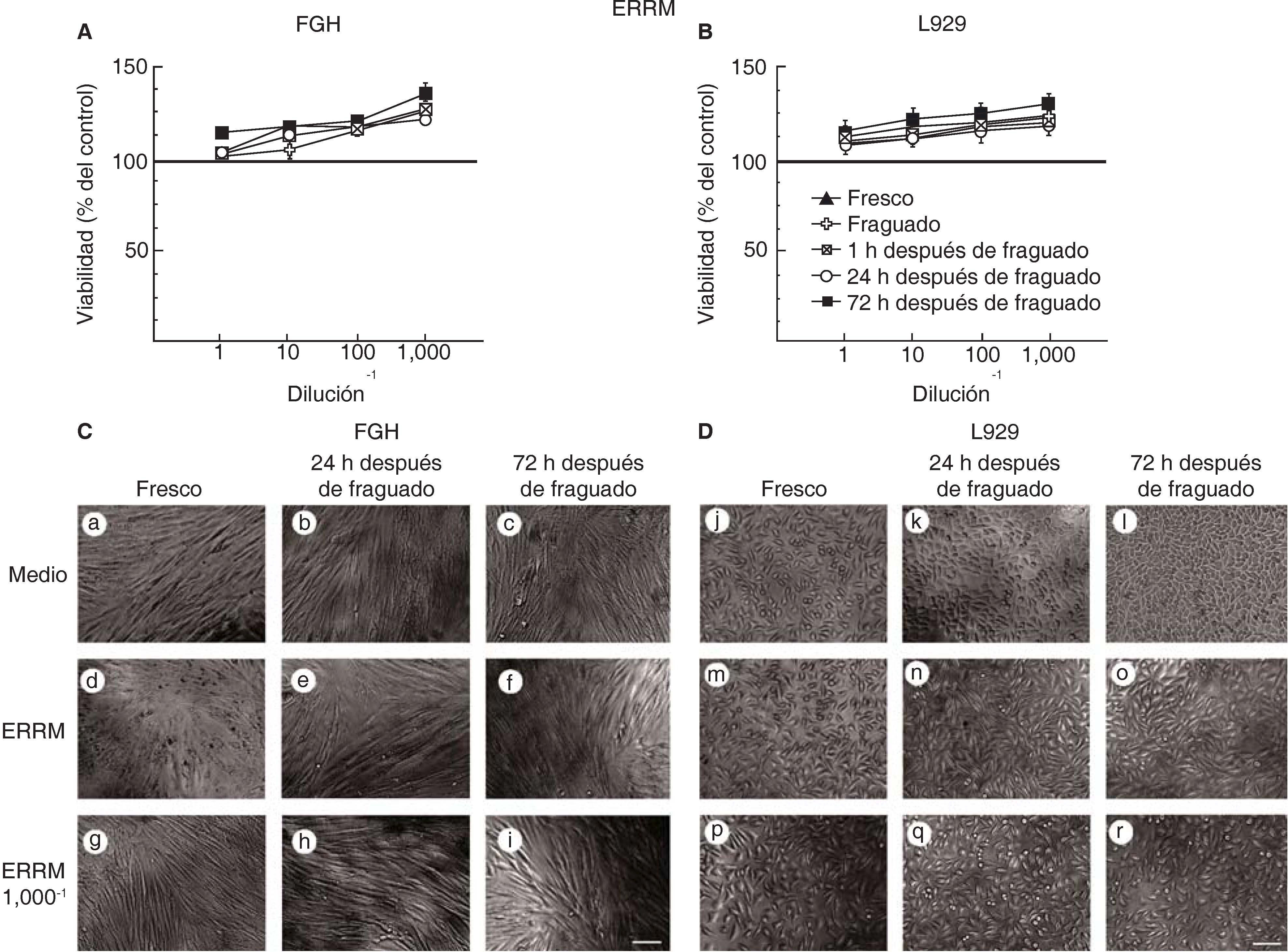
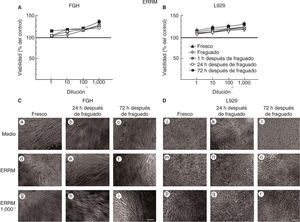
Las células expuestas a medio condicionado del EndoSequence® BC RRMTM (ERRM) se mantienen viables, muestran una morfología típica de fibroblastos y tienen mayor actividad metabólica.
De manera similar al tratamiento con MTA, la viabilidad no se alteró ni en los fibroblastos gingivales humanos (Figura 3A) ni en los fibroblastos de la línea celular L929 (Figura 3B) que fueron expuestos al material ERRM. Interesantemente, los fibroblastos expuestos a diferentes diluciones de medios condicionados de ERRM mostraron una mayor actividad metabólica y una mayor viabilidad que los fibroblastos no tratados. En concordancia, los fibroblastos gingivales humanos y los fibroblastos de la línea L929 mantuvieron una forma típica de fibroblastos y se mantuvieron adheridos a la caja de cultivo en todos los tiempos evaluados (Figuras 3C y 3D, respectivamente).
Viabilidad de fibroblastos gingivales humanos (FGH; panel A) y fibroblastos de ratón de la línea celular L929 (panel B) después de la exposición a EERM. Los símbolos representan: cemento fresco (triángulo negro), fraguado (cruz blanca), a 1h (cuadrado tachado), a las 24h (círculo blanco) y a las 72h de fraguado (cuadrado negro). El 100% de viabilidad celular representa la condición sin cemento (línea negra en 100%). Los datos representan el promedio del porcentaje de viabilidad celular de tres experimentos independientes, realizados por triplicado. Microfotografías de FGH (panel C) y L929 (panel D) expuestos a medio, al medio condicionado de EERM concentrado y a una dilución del medio condicionado de EERM 1/1,000. Escala 100μm.
Una estimación anual de procedimientos endodóncicos menciona que aproximadamente el 5.5% de estos procedimientos involucran cirugía periapical.13 El objetivo del procedimiento quirúrgico es eliminar satisfactoriamente los procesos patológicos que se forman en el periápice.13 En este caso es necesario utilizar materiales de retroobturación que sean biocompatibles. Existen diferentes materiales de retroobturación en el mercado. Sin embargo, pocos reportes comparativos de su citotoxicidad en fibroblastos gingivales humanos se han documentado. Por esta razón, en este trabajo evaluamos la biocompatibilidad de tres diferentes cementos de retroobturación en cirugía periapical, evaluando su potencial citotóxico. Un cemento, de recién lanzamiento al mercado mexicano EndoSequence® BC RRMTM o material de reparación de la raíz (ERRM), y dos cementos ya conocidos IRM® y MTA Angelus® blanco fueron comparados en las mismas condiciones experimentales.
La citotoxicidad fue evaluada siguiendo la norma internacional ISO 10993-5 (ISO 10993. 2009), en donde se describen las pruebas para medir la citotoxicidad de materiales in vitro. La citotoxicidad fue evaluada usando fibroblastos gingivales humanos (FGH) y fibroblastos de ratón de la línea celular L929. Los fibroblastos gingivales humanos fueron elegidos para imitar la respuesta celular inducida por los cementos en el tejido periapical después de la obturación endodóntica. Las células L929 poseen una alta sensibilidad a los productos tóxicos.22,23 La citotoxicidad se evaluó usando dos parámetros: la morfología y la viabilidad celular. Estos parámetros fueron evaluados utilizando los cementos en diferentes condiciones, fresco, fraguado, 1, 24 y 72 horas después del tiempo de fraguado.
La mayoría de los estudios sobre citotoxicidad de materiales utilizados en endodoncia, se basan en la toxicidad de materiales fraguados.2 Sin embargo, los materiales en fresco liberan una gran cantidad de subproductos químicos que probablemente sean citotóxicos para las células. Sin embargo, en virtud de las condiciones clínicas (in vivo), estos subproductos se diluyen en el fluido de los tejidos intersticiales y son eliminados a través de la vasculatura. Por lo tanto, se ha estudiado el efecto citotóxico de los materiales diluidos.2,24
En el presente estudio encontramos que el IRM®, que es un cemento a base de óxido de zinc y eugenol es el material menos biocompatible a las 24 y 72 horas después del tiempo de fraguado. Este hecho concuerda con otros trabajos recientes donde se ha observado su alta toxicidad.4,8,25,26 Una de las explicaciones de esta elevada citotoxicidad es que tanto el eugenol como el zinc son citotóxicos.18,27 Se piensa que el zinc liberado es en parte responsable de su prolongado efecto citotóxico.28 Otra explicación es que las variaciones en la composición de los materiales reforzados pueden afectar la tasa de disolución y la liberación de eugenol, causando variaciones en su citotoxicidad.4,29 Además, en el IRM®, el eugenol puede tener una afinidad para el polimetilmetacrilato, limitando su liberación de este material haciéndolo menos citotóxico.4 Otra explicación es que cuando el IRM® se usa como material de retroobturación se recomienda usar mayor proporción de polvo que de líquido, ya que posee grandes ventajas de manipulación, corto tiempo de fraguado, y disminución de toxicidad y solubilidad.30
Nosotros observamos que el IRM® no es citotóxico si el material se diluye. En concordancia con esto, Trope et al.31 en un estudio histológico confirmaron la buena respuesta de los tejidos al usar IRM®.4 Los beneficios del IRM® es su bajo costo, fácil de mezclar, y fácil de manipular. Varios estudios han demostrado resultados positivos utilizando este material en cirugía perirradicular.3,10,11,31
Debido a que los materiales utilizados en endodoncia no poseen todas estas características ideales, el MTA se desarrolló inicialmente como un material de retroobturación y, posteriormente, se ha usado para recubrimiento pulpar, pulpotomía, apicogénesis, apicoformación, reparación de perforaciones radiculares, y como un material de obturación del conducto radicular. El MTA ha sido reconocido como un material bioactivo, osteoconductor y biocompatible. Se han publicado diversas revisiones acerca de las propiedades químicas del MTA, biocompatibilidad y aplicaciones clínicas.7,13,14 En este estudio encontramos que con el mineral trióxido agregado (MTA) la citotoxicidad fue casi nula en fresco lo que concuerda con recientes trabajos publicados,1,6,8,16,32 donde se ha encontrado al MTA como un material de retroobturación altamente biocompatible.
De igual manera Kim y Kratchman5 mencionan en su artículo que el MTA es el material de retroobturación más biocompatible y que puede ser usado con mejores resultados predecibles en cirugía endodóncica.33 Los resultados de nuestro estudio también concuerdan con otros que demuestran la elevada biocompatibilidad del MTA en comparación con el IRM®.8,17
El material ERRM de recién introducción en México no mostró citotoxicidad sobre fibroblastos, por el contrario, mostró un incremento en la actividad metabólica de los fibroblastos. Esto lo hace el material más biocompatible de este estudio. Sin embargo, en otros estudios se ha visto que posee cierto grado de citotoxicidad, similar a la del MTA.6,16,27
CONCLUSIONESEl material de retroobturación EndoSequence® BC RRMTM o material de reparación de la raíz (ERRM) es el material más biocompatible y el IRM® es más citotóxico que el MTA.
El proyecto se realizó con apoyo financiero obtenido de la Dirección General de Asuntos del Personal Académico, UNAM (Proyecto IA202013 a EUQ). A la Maestra en IBB Nancy Mora Pérez por su apoyo técnico.
Departamento de Endodoncia. División de Estudios de Postgrado e Investigación, Facultad de Odontología.
Este artículo puede ser consultado en versión completa en http://www.medigraphic.com/facultadodontologiaunam