El propósito de este estudio fue evaluar el grado de cito-toxicidad in vitro que presenta el propóleo sobre leucocitos polimor-fonucleares.
Material y métodosEstudio experimental, controlado, in vitro. Procedimiento estadístico de: análisis de varianza de repetidas medidas y post-hoc de Scheffé, estableciendo una significancia estadística de p < 0.05. Se tomaron 10 mL de sangre venosa periférica de seis individuos sanos, ambos sexos entre 20 y 30 años de edad escogidos al azar para obtener los leucocitos.
ResultadosAnálisis de Scheffé con 95% de confiabilidad para comparación entre grupo control y grupo experimental: significativo con p 0.0001 para propóleo 1, control 1 y propóleo 2, control 2, para propóleo 1, propóleo 2, p 0.5002/control 1, control 2, p 0.9621.
ConclusionesEl propóleo en dilución 1:4 aplicado a leucocitos polimorfonucleares durante1-2 horas en el experimento provocó muerte celular en un 70%; dando significancia estadística.
The aim of the present study was to assess the extent of propolis´ in vitro cytotoxicity on polymorphonuclear leukocytes.
Materials and methodsThe present study was an in vitro, controlled, experimental endeavor. Statistical procedure entailed variance analysis of repeated measures as well as Scheffe’s post-hoc. A p < 0.05 statistical significance was established. To obtain leukocytes,10 mL of peripheral venous blood was harvested from six randomly selected, healthy, 20-30 year old subjects, of both genders.
ResultsScheffe’s analysis with 95% reliability for comparison between control and experimental groups. Significant with p 0.0001 for propolis 1 control 1 and propolis 2 control 2. For propolis 1 propolis 2, p 0.5002/control 1 control 2, p 0.9621.
ConclusionsIn the present experiment propolis at a 1:4 dilution applied for 1-2 hours to polymorphonuclear leukocytes caused 70% cellular death. This resulted in statistical significance.
Recientemente un material denominado propóleo destaca en el área de investigación en productos naturales donde la literatura lo reporta como bactericida, analgésico, fungicida, antiinflamatorio, cicatrizante, y anticariogénico.1
Esta resina es producida por las abejas mezclando sustancias recogidas de plantas en brotes, botones florales y exudados resinosos, originando un material para cerrar huecos, embalsamar insectos muertos en el interior de la colmena y protegerse de la invasión de insectos y microorganismos.2 Los incas curaban infecciones febriles, mientras que en en Europa fue utilizado por los franceses en los franceses en los siglos XIII y XIV para tratamiento de llagas. Sus efectos terapéuticos se atribuyen a diversos compuestos fenólicos que lo componen siendo los flavonoides los principales y algunos ácidos fenólicos, esteres, aldehídos, alcoholes y cetonas.3-5
La composición fisicoquímica del propóleo es:
- •
Resinas y bálsamos aromáticos 50-80%.
- •
Aceites esenciales y otras sustancias volátiles (4.5 a 15%).
- •
Ceras (12-15%).
- •
Polen (5-11%).
- •
Flavonas, flavonoides, flavononas, dihidroflavonas.
- •
Alcohol bencílico, benzalcénido y ácido benzoico.
- •
Derivados del alcohol cinámico, cumarinas, triglicéridos fenólicos.
- •
Otros elementos aromáticos, monoterpenos, hexaterpenos, triterpenos.
- •
Ácidos grasos poliinsaturados y ácido linoleico.
- •
Vitaminas A, B1, B2, B6, C, E, ácido nicotínico, ácido pantoténico.
- •
Cobre, manganeso, magnesio, níquel, plata, silicio, vanadio, zinc.
Al nacer el individuo se expone a un sinnúmero de microorganismos con los cuales no había tenido contacto, éstos pueden llegar a ser parte de su flora normal o bien pueden provocar una enfermedad que traerá como consecuencia un tipo de respuesta inmune que puede ser inespecífica, donde intervienen los leucocitos polimorfonucleares neutrófilos (LPMN) o específica donde interactúan tanto los linfocitos T como B.6,7
Los LPMN son las principales células fagocíticas encontradas en sangre periférica correspondiendo a un 50-70% del total de las células de la serie blanca.7 Se les considera la segunda línea de defensa del cuerpo humano, puesto que la primera línea de defensa corresponde a la piel y mucosas.6 Su vida media es de 8-20 horas en circulación, la cual aumenta al entrar en tejidos infectados o inflamados.8
El desplazamiento de los LPMN desde el capilar hasta el sitio de la lesión consta de varias etapas: 1. Marginación: contacto de los LPMN con las paredes endoteliales. 2. Adherencia al endotelio: mediante selectinas e integrinas. 3. Diapedesis: migración transendotelial; para que esto suceda es necesario que ocurra la quimiotaxis es decir que los LPMN sean atraídos hacia el foco de infección mediante diferentes moléculas como: IL-8 (interleucina 8), factor C5a del complemento, LTB4 (leucotrieno B4) entre otros. Fagocitosis y muerte celular. La destrucción del microorganismo en el interior del neutrófilo se produce a través de dos mecanismos, uno que es dependiente de oxígeno y el otro independiente del oxígeno.9
Una vez que el neutrófilo ha cumplido su función muere por apoptosis (muerte celular programada) con algunas alteraciones características por ejemplo, incrementa la expresión de marcadores de superficie de fosfatidilserina lo que ayuda a los macrófagos a eliminarlos, evitando así, la posible liberación de su contenido citotóxico al medio extracelular lo que constituye un beneficio del neutrófilo apoptótico puesto que reduce la inapropiada respuesta inflamatoria, modelo que se basa en la estrategia de proveer un beneficio a una excesiva respuesta en una infección microbiana.10 En nuestra línea de investigación sobre los LPMN hemos desarrollado un modelo para aislar y purificar LPMN de sangre periférica y después enfrentarlos a diferentes sustancias, en este caso propóleo para medir si era capaz de tener efecto citotóxico.
Material y métodosEstudio experimental, controlado, in vitro, con procedimiento estadístico de: análisis de varianza de repetidas medidas y post-hoc de Scheffé, significancia estadística de p < 0.05. La sangre obtenida se mezcló con heparina (Inhepar) a razón de 5,000 U por mL de sangre para evitar la coagulación y atrapamiento de los leucocitos en tubos de ensayo de 16 × 150 con 3 mL de dextrán (Sigma co.) al 3%. Del tubo anterior se pasa la sangre a otro tubo, al que se agregó previamente dextrán al 3%, esta manipulación debe hacerse con pipeta Pasteur estéril y con muchísimo cuidado procurando que resbale la sangre por las paredes del tubo para que no se lisen los glóbulos rojos. Se incubó a 37°C por una hora tratando de simular las condiciones del cuerpo humano y se recolectó plasma rico en leucocitos en tubos de 13 × 100. Al retirarlo de la incubadora se podían apreciar dos fases: una superior o sobrenadante rica en leucocitos y la inferior o sedimento formado principalmente por glóbulos rojos y plaquetas. Se centrifugó la sangre a 180 g (1,200 rpm) durante tres minutos (centrífuga Fisher Scientific) y se descartó el sobrenadante que no contenía células y quedó el botón del fondo del tubo que corresponde a leucocitos. Se lavó tres veces con medio de cultivo comercial RPMI-1640, y para eliminar el exceso de dextrán. Se separan gentilmente las células para proceder a contar. La población celular obtenida se ajustó a una concentración de 12 × 106 células por mL realizando una mejor cuenta leucocitaria; con ayuda de la cámara de Neubauer y microscopios de luz Leica y Van Guard y un contador manual.
Diseño experimental. Nuestro sistema in vitro contó con los siguientes reactivos:
- 1.
Tubo muestra problema, contenía células, propóleo, medio RPMI-1640, ensayado a dos tiempos una y dos horas. El propóleo a una dilución de 1:4 que es la concentración mínima inhibitoria; obtenida de experimentos anteriores realizados por Lara, Tinoco y colaboradores.11
- 2.
Control de viabilidad, que se realizó con células y medio de cultivo RPMI-1640 como grupo control. Se dejó en la incubadora a 37°C, una muestra de cada grupo a una y dos horas. Se observaron los resultados contando células muertas y vivas utilizando el colorante azul de tripano al 5% evaluando las células teñidas de azul como muertas o no viables, por la entrada del colorante a través de la membrana y pared celular y las células vivas refrin-gentes sin coloración y sin daño celular. En los tubos se agregó 0.5 mL de propóleo en concentración de 1:4 más, 0.5 mL de células más medio. Después de incubarse por una y dos horas se observaron las imágenes en donde se apreció la aglutinación ocasionada y varios leucocitos polimorfonucleares en color azul señal que indica muerte celular.
- 3.
Pureza en la obtención de LPMN, la separación de los leucocitos polimorfonucleares neutrófilos se llevó a cabo con una pureza del 95 al 100% demostrada mediante la tinción de Wright bajo microscopia en objetivo de 40x.
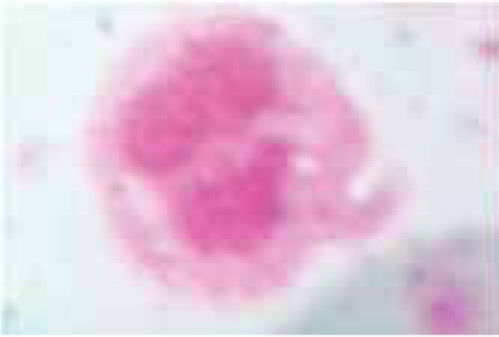
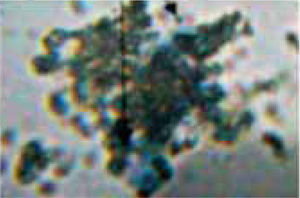
En la figura 1, podemos observar un leucocito obtenido por la técnica de purificación de dextrán teñido con Wright, el rango de viabilidad con este método fue bastante alto alcanzando un 95-100% de pureza.
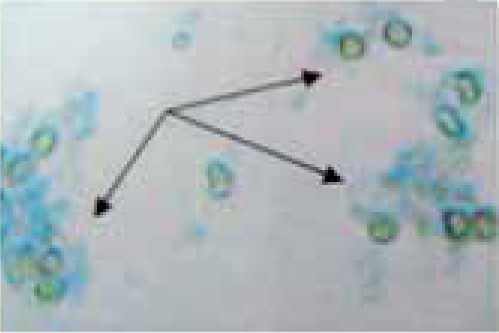
En la figura 2, podemos apreciar a los leucocitos vivos que no los afectó el propóleo puesto que aparecen hialinos al no incorporar el colorante azul tripano mientras que los LPMN muertos van a teñirse de color azul.
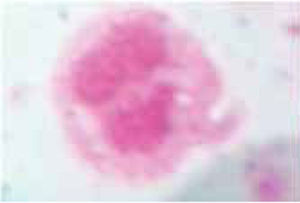
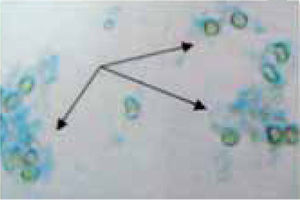
En la figura 3, vemos marcada la aglutinación efectuada por el propóleo, y en la figura 4 se observan los leucocitos muertos, teñidos en azul al incorporar el colorante azul Tripano al 5%.
Resultados mostrados anteriormente, cuantificados; denotan estadísticamente lo siguiente en base a seis repeticiones efectuadas
En el cuadro I encontramos los resultados de seis experimentos donde se muestra el número de células vivas y muertas a la hora y a las dos horas; teniendo un control con cuenta basal de 12,000,000 de leucocitos polimorfo nucleares neutrófilos (LPMN).
Cálculo de células vivas y muertas después de periodos de una y dos horas.
| Experimento 1. |
| Tubo uno: propóleo + células = medición basal 12,000,000. |
| A una hora: células vivas 3,600,000 células muertas 8,400,000. |
| A dos horas: células vivas 3,000,000 células muertas 9,000,000. |
| Tubo dos: células + medio = medición basal 12,000,000. |
| A una hora: células vivas 11,400,000 células muertas 600,000. |
| A dos horas: células vivas11,400,000 células muertas 600,000. |
| Experimento 2. |
| Tubo uno: propóleo + células= medición basal 12,000,000. |
| A una hora: células vivas 3,600,000 células muertas 8,400,000. |
| A dos horas: células vivas 3,000 000 células muertas 9,000,000. |
| Tubo dos: células + medio = medición basal 12,000,000. |
| A una hora: células vivas 11,600,000 células muertas 840,000. |
| A dos horas: células vivas 10,800,000 células muertas 1,200,000. |
| Experimento 3. |
| Tubo uno: propóleo + células= medición basal 11,000,000. |
| A una hora: células vivas 4,620,000 células muertas 6,380,000. |
| A dos horas: células vivas 4,400,000 células muertas 6,600,000. |
| Tubo dos: células + medio = medición basal 11,000,000. |
| A una hora: células vivas 10,890,000 células muertas 110,000. |
| A dos horas: células vivas 9,900,000 células muertas 1,100,000. |
| Experimento 4. |
| Tubo uno: propóleo + células = medición basal 12,000,000. |
| A una hora: células vivas 3,600,000 células muertas 8,400,000. |
| A dos horas: células vivas 3,000,000 células muertas 9,000,000. |
| Tubo dos: células + medio = medición basal 12,000,000. |
| A una hora: células vivas 11,640,000 células muertas 360,000. |
| A dos horas: células vivas 11,520,000 células muertas 480,000. |
| Experimento 5. |
| Tubo uno: propóleo + células = medición basal 12,000,000. |
| A una hora: células vivas 1,560,000 células muertas 10,440,000. |
| A dos horas: células vivas 1,200,000 células muertas 10,800,000. |
| Tubo dos: células + medio = medición basal 12,000,000. |
| A una hora: células vivas 11,400,000 células muertas 600,000. |
| A dos horas: células vivas 11,400,000 células muertas 600,000. |
| Experimento 6. |
| Tubo uno: propóleo + células = medición basal 12,000,000. |
| A una hora: células vivas 3,240,000 células muertas 9,960,000. |
| A dos horas: células vivas 600,000 células muertas 11,400,000. |
| Tubo dos: células + medio= medición basal A una hora células vivas 11,400,000 células muertas 600,000. |
| A dos horas: células vivas 11,400,000 células muertas 600,000. |
Posteriormente procedimos a desglosar el número de LPMN vivos y muertos a la hora y dos horas de cada experimento, encontrando en nuestros resultados el control de una población aproximadamente tres veces mayor del conteo de viabilidad que cuando el propóleo estaba presente.
Cabe señalar que la cuenta basal inicial fue ajustada a 12,000,000 de LPMN en cada experimento estandarizando así la población para evitar fluctuaciones que pudiesen afectar los resultados.
Cuando se hizo el análisis estadístico éste mostró diferencia estadística significativa entre el propóleo 1 (medido a la hora de incubación) y el control 1 con un valor p < 0.0001, lo mismo fue para el propóleo 2 (medido a las dos horas de incubación) frente al control dos con un valor p < 0.0001.
El análisis arroja lo siguiente (Cuadro II):
Análisis de Scheffé con 95% de confiabilidad entre grupo control y experimental.
| Propóleo 1 propóleo 2 = mean diff. 836666.667 p-value 0.5002 |
| Propóleo 1 control 1 = mean diff. -8018333.333 p-value < 0.0001 |
| Propóleo 2 control 2 = mean diff. -8570000.000 p-value < 0.0001 |
| Control 1 control 2 = mean diff. 285000.000 p-value 0.9621 |
La capacidad antimicrobiana del propóleo ha sido ampliamente estudiada y demostrada por Bretz y su grupo; Koo y asociados; Hegazi AG, El Hady FK, Drago M y colegas.2,4,11-13 Su toxicidad ha sido poco investigada, encontrándose una limitada cantidad de estudios realizados en células vivas por tal razón se utilizaron leucocitos polimorfonucleares neutrófilos, células fácilmente recuperables de la sangre periférica que son la segunda línea de defensa del cuerpo humano; y están implicadas en los procesos antiinfecciosos y antibacterianos, características primordiales mencionadas también para el propóleo. La separación de leucocitos se basó en el método utilizado por Arce Mendoza, Tinoco Cabriales (1984) en la medición de la quimiotaxis leucocitaria en el efecto de las tetraciclinas.14,15 Los resultados reflejan que la pureza en la obtención de las células fue la adecuada puesto que al ser teñidas por el método Wright y aparecen de color morado y con sus núcleos característicos (Figura 1). Respecto a nuestro control de viabilidad celular fue bastante alto, 95 a 100% en donde los leucocitos aparecen refringentes y por lo tanto vivos.
En nuestro tubo de ensayo al que se agregó propóleo a las células vimos una marcada aglutinación, lo cual proponemos pueda ser uno de los mecanismos de efecto antibacterial que está siendo estudiado por diversos autores como Koo, Park y colaboradores.4,16
Además tenemos que las poblaciones celulares con las que trabajamos (medición basal) fue constante (estandarizada) 12,000,000 de leucocitos como población celular inicial, encontrando en el control una población tres veces mayor del conteo de viabilidad que cuando se utilizó propóleo; resultado repetitivo en las diferentes muestras cuantificadas sin haber diferencia aparente significativa a la hora y dos horas, corroborando con esto que efectivamente el propóleo está actuando con una constante toxicidad sobre las células empleadas, situación que coincide con Scheller y su grupo que trabajando con ratones aplicaron etanol y extracto de propóleo, encontraron importantes cambios patológicos en hígado los cuales fueron transitorios y reversibles dentro de dos a cuatro semanas después de aplicación intravenosa.
Aunque autores como Ramírez y asociados17 reportan que el propóleo a dosis altas por vía digestiva en animales (10 a 15 mg/kg de peso) no producen efecto tóxico ni disturbio patológico aun a largo plazo, esto pudiera tener cierta relación a un efecto dosisrespuesta.
Nuestros resultados de acuerdo a variable-tiempo no fueron significativos. Mientras que las diferencias entre grupo control a la hora arrojaron diferencias estadísticamente significativas p < 0.0001. También el de dos horas y su control p < 0.0001. Esto es paradójico de acuerdo a los resultados encontrados por Magro Filho y Carballo18 que refieren que el propóleo produce acelerada reparación epitelial post-extracción en ratas.
Mientras que Seheller y asociados, usando propóleo encontraron estimulación del proceso regenerativo en perros y Stojko y Seheller reportan también en perros aceleración en la osteogénesis y regeneración del tejido óseo con marcado efecto antibacteriano. Aunque cabe señalar que ellos no estaban midiendo muerte celular, además de que suponemos que estamos usando propóleos de diferente forma de preparación o extracción, lo cual puede afectar los resultados, puesto que como producto alternativo no tienen una estandarización precisa.
Finalmente se debe recordar que los experimentos que realizamos son in vitro y que al interactuar in vivo los elementos implicados en este experimento podría ocurrir un efecto Buffer del organismo, ya que al diluirse el propóleo en nuestro nuestro sistema humano puede minimizar el efecto tóxico hacia los LPMN más no así su efecto bactericida y antiinflamatorio.
Facultad de Odontología de la Universidad Autónoma de Ta-maulipas (UAT).