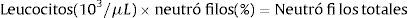La neutropenia cíclica ocurre debido a que los niveles de producción celular por parte de las células madre de la médula ósea fluctúan, es decir, cambian durante el ciclo; aunque el número es recurrentemente bajo, su función es normal. Fue descrita por primera vez por Leale en 1910, con carácter autosómico dominante. Se presenta aproximadamente cada 21 días con un rango de 14 a 36 días durando un total de 3 a 6. Durante el periodo en el que existen pocos neutrófilos circulantes, el paciente es susceptible a las infecciones. Dentro del cuadro clínico se presentan: susceptibilidad a infecciones, cuadros febriles, fatiga, úlceras orales, impétigo, aumento de ganglios linfáticos, periodontitis, estomatitis. Es importante manejar estomatológicamente a estos pacientes, previa interconsulta con médico tratante, prevenir cuadros infecciosos bajo un esquema profiláctico a base de amoxicilina 50mg/kg peso o clindamicina 20mg/kg peso, revisar biometría hemática reciente (máximo 10 días previos al tratamiento); en tratamientos de urgencia se manejará de forma conservadora el dolor e infección; uso de enjuagues con clorhexidina al 0.12% y solución Philadelphia en caso de ser necesario.
Cyclic neutropenia occurs due to the fluctuation of cellular production levels of bone marrow stem cells. This is to say, they change during the cycle, and although numbers are recurrently low, function is normal. Cyclic neutropenia was first described by Leale in 1910 with dominant autosomal character. It manifests approximately every 21 days, with range of 14 to 36 days, lasting 3-6 days per episode. During the time when there are few circulating neutrophils, the patient is susceptible to infections. The clinical picture of this process includes: susceptibility to infection, feverish conditions, oral ulcers, impetigo, increased lymph nodes, periodontitis and stomatitis. It is important to stomatologically handle these patients; after inter-consultation with treating physician, prevent infection in a prophylactic scheme based on amoxicillin 50mg/per kg weight or clindamycin 20mg/per kg weight, review recent blood count results (maximum ten days before treatment). In emergency treatments pain and infection will be handled conservatively, with use of 0.12% chlorhexidine mouthwashes and Philadelphia solution when necessary.
Los pacientes con neutropenia cíclica presentan una disminución periódica del número de neutrófilos, siendo esto un trastorno poco frecuente, caracterizado por episodios habituales de fiebre.
La neutropenia cíclica ocurre porque los niveles de producción celular por parte de las células madre de la médula ósea fl uctúan, es decir, cambian durante el ciclo. Aunque el número es recurrentemente bajo, su función es normal.
Los neutrófi los son granulocitos polimorfonucleares, miden de 8 a 12 micrómetros aproximadamente, es el leucocito más abundante en sangre y vive 72 horas después de haber salido de la médula ósea, siendo así una célula fagocítica, móvil, de consistencia gelatinosa; puede atravesar fácilmente los vasos sanguíneos y responder a estímulos de infección e infl amación a las cinco horas de haber iniciado estos procesos.
De esta forma, la neutropenia es la disminución significativa en el número de neutrófilos polimorfonucleares por mm3 de sangre periférica, causado por una alteración en la producción celular, destrucción excesiva de tejidos periféricos, inmaduración celular o una distribución alterada de células.1
Estos pacientes presentan cierta susceptibilidad a infecciones; por lo tanto, la neutropenia se clasifica de la siguiente manera:
- a)
Duración: aguda, crónica.
- b)
Estado de reserva medular: conservada o baja.
- c)
Severidad: leve, moderada o severa.
- d)
Naturaleza u origen:
1) Adquirida: medicamentos:
- •
Anticonvulsivos.
- •
Antihistamínicos.
- •
Barbitúricos.
- •
Fármacos quimioterapéuticos.
- •
Diuréticos.
- •
Sulfamidas/antibióticos.
2) Congénita:
- •
Enfermedad de Kostmann.
- •
Sx. de Shwachman.
- •
Neutropenia cíclica.
- •
Mielocatesis.
Fue descrita por primera vez por Leale en 1910, con carácter autosómico dominante, resultado de la mutación del gen EIA2 posición 13.3 del brazo corto del cromosoma 19 que codifica la elastasa neutrofílica. Es un periodo que se presenta dentro de un rango de 14 a 36 días, normalmente por el día 21, con una duración de entre 3 a 6 días. Durante el periodo en el que existen pocos neutrófilos circulantes, es más común que se presenten infecciones.2
Existe una interrupción en la producción de las células madre de la médula ósea; esto causa el efecto del fenómeno cíclico, lo que provoca desde una producción normal hasta un severo estancamiento en la maduración del neutrófilo. El uso como tratamiento farmacológico del factor estimulante de colonias de granulocitos (G-CSF) promueve la maduración de células precursoras a neutrófilos.
En condiciones normales, el G-CSF es producido principalmente en la médula ósea. Cuando hay una infección bacteriana, la producción de G-CSF aumenta debido al estímulo que producen algunos componentes del agente infeccioso sobre las células del sistema inmune. El resultado fi nal es un aumento de la maduración de neutrófi los en la médula ósea, una mayor liberación de éstos al torrente sanguíneo y la activación de las funciones de dichas células, es decir, de su habilidad para destruir agentes patógenos.
En cuanto a su incidencia se presentan dos casos por un millón de habitantes.3
Dentro del cuadro clínico se presentan las siguientes manifestaciones: susceptibilidad a infecciones, cuadros febriles, fatiga, impétigo, aumento en el tamaño de ganglios linfáticos, periodontitis, queilitis, estomatitis.
El diagnóstico se obtiene cuando se demuestran episodios de menos de 200 neutrófilos totales por mm3 de forma cíclica cada tres semanas por un periodo de 3 a 6 días; la biometría hemática debe ser realizada 2 o 3 veces por semana durante ocho semanas para confirmar.
Su tratamiento es la administración vía intramuscular de «factor estimulante de colonias de granulocitos (G-CSF)» cuya función, como su nombre lo indica, estimula la producción de neutrófilos y acorta la duración de la neutropenia, lo cual lleva a una reducción de los síntomas. Si el paciente no reacciona de forma adecuada se empleará el uso de trasplante de médula ósea, o bien, corticoesteroides.
Conforme pasan a la etapa de la adolescencia, los pacientes presentan una disminución de los síntomas y los ciclos son menos notorios.4
PROTOCOLO PARA VALORACIÓN ESTOMATOLÓGICA DE PACIENTE CON NEUTROPENIA CÍCLICA DEL HOSPITAL INFANTIL DE MÉXICO «FEDERICO GÓMEZ»1) Identificación de padecimiento, determinar y detectar signos y síntomas característicos del padecimiento.
2) Interconsulta con hematólogo pediatra tratante sobre:
- a)
Estado actual del paciente.
- b)
Biometrías hemáticas recientes (conteo de neutrófilos totales).
- c)
Etapa del ciclo neutropénico en que se encuentra el paciente.
- d)
Tipo de tratamiento farmacológico que utiliza el paciente para controlar su ciclo neutropénico.
3) Problemas potenciales que se pueden presentar:
- a)
Formación de procesos infecciosos.
- b)
Periodontitis.
- c)
Estomatitis herpética.
- d)
Presencia de dolor agudo.
- e)
Datos de trombocitopenia cuando es de origen adquirido por fármacos quimioterapéuticos.
4) Para prevenir complicaciones es importante seguir:
- a)
Esquema profi láctico antibacteriano a base de amoxicilina 50 mg/kg peso o bien clindamicina 20 mg/kg peso en caso de alergia, para evitar procesos infecciosos, utilizándolo ya sea como esquema terapéutico (cada 8 horas por 7 días) cuando sean citas consecutivas, o bien como esquema profi láctico (una hora antes de iniciar el tratamiento dental, dosis única) cuando se realicen tratamientos de emergencia o citas aisladas.
- b)
Revisar el número de neutrófilos totales en una biometría hemática antes y después del tratamiento dental.
5) Modificaciones del plan de tratamiento:
- a)
Si el recuento de leucocitos cae bruscamente, se deben emplear antibióticos para evitar infección postoperatoria.
6) Tratamientos de urgencia:
- a)
Evitar el uso de antiinflamatorios no esteroideos, en especial el ácido acetilsalicílico en datos de trombocitopenia; sin embargo, se puede utilizar paracetamol.
- b)
Uso de solución Philadelphia en presencia de estomatitis:
- •
Subsalicilato de bismuto 20mL.
- •
Clorhidrato de difenhidramina 10mL.
- •
Sucralfato ½ tableta.
- •
Xilocaína 2mL.En colutorios de 5mL, cada 6 horas.
- •
- c)
Empleo de técnica paliativa de limpieza bucal.
- d)
Uso de enjuagues con clorhexidina al .12%.
La inmunosupresión se define como la inhibición de uno o varios componentes del sistema inmunitario; ésta se produce como resultado de alguna enfermedad subyacente o intencional mediante el uso de medicamentos o tratamientos como radiaciones. Estos pacientes se encuentran en mayor riesgo de sufrir infección y aun las infecciones periodontales pequeñas pueden convertirse en peligrosas para la vida si la supresión inmunitaria es grave. Pueden aparecer infecciones intrabucales bacterianas, virales y micóticas.
El tratamiento de estas personas se orienta hacia la prevención de las complicaciones bucales, que son capaces de poner en peligro la vida. El mayor riesgo de infección ocurre en periodos de inmunosupresión extrema; por ello, el tratamiento debe ser conservador y paliativo.
Los órganos dentarios con pronóstico desfavorable se extraen y se efectúa el desbridamiento a fondo de los remanentes para minimizar la carga microbiana. El odontólogo debe enseñar y destacar la importancia de la higiene bucal.7
Se indican enjuagues con agentes antimicrobianos, como la clorhexidina al .12%, en especial en pacientes con mucositis, para evitar una infección secundaria.8
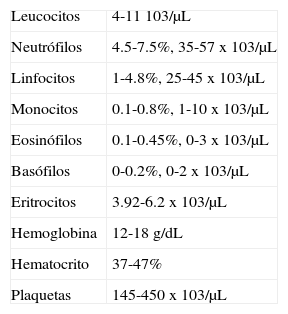
BIOMETRÍA HEMÁTICALa biometría hemática es primordial para el manejo de enfermedades hematológicas, siendo un auxiliar de diagnóstico; incluye cuenta plaquetaria, leucocitaria, eritrocitaria, hemoglobina y hematocrito; determina el número, variedad, porcentaje, concentración y calidad de las células sanguíneas.
Por lo que es de suma importancia conocer los valores normales de cada grupo de células para saber en qué momento se puede realizar una rehabilitación bucal de forma segura y sin complicaciones.
Datos normales en el Hospital Infantil de México «Federico Gómez»:
En caso de tratar con pacientes que presentan desórdenes hematológicos es obligatorio saber cómo se puede obtener el NAN (número absoluto de neutrófilos).
Por lo tanto:
> de 2,000 x mm3 NAN ------- se puede atender sin necesidad de administrar antibióticos profilácticos.
1,000 a 2,000 x mm3 NAN ------- se deben administrar antibióticos profilácticos para cualquier tipo de procedimiento dental.
< de 1,000 x mm3 NAN ------- paciente con inmunosupresión severa, únicamente se debe atender con carácter paliativo.
En caso de presentar datos de trombocitopenia se debe considerar el reemplazamiento plaquetario si el recuento de plaquetas es menor a 80.000 por mm3.5
PRESENTACIÓN DEL CASO CLÍNICOPaciente femenino de 15 años de edad con un peso de 30.200kg y una talla de 134 cm; dentro de sus antecedentes perinatales padeció sufrimiento fetal; permaneció en incubadora durante el primer mes de vida; no recibió alimentación por medio de seno materno; presentó problemas de lenguaje y múltiples infecciones respiratorias en su niñez.
Dentro de sus antecedentes heredofamiliares cuenta con madre de 35 años y un hermano de 6 años aparentemente sanos, padre de 34 años con antecedentes de neutropenia cíclica, abuela materna finada por hidropesía.
Respecto a sus antecedentes personales patológicos, ingresó por primera vez al Hospital Infantil de México «Federico Gómez» en agosto de 1994 por presentar un cuadro de tos de dos meses de evolución; una serie de posibles diagnósticos se dieron a la familia los cuales se mencionan a continuación:
- •
A los 6 años de vida le diagnostican neutropenia tóxica y trastorno de lenguaje.
- •
A los 7 años se detecta un soplo fisiológico, presencia de abscesos perianales y anemia leve.
- •
A los 8 años se observan datos de neutropenia crónica.
- •
A los 9 años, aunado al probable diagnóstico de neutropenia crónica, se observan signos de anemia leve no descompensada.
- •
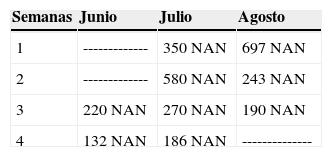
A los 10 años se verifica su diagnóstico real gracias a una serie de estudios de laboratorio; se realizaron 10 biometrías hemáticas cada semana tomando en cuenta principalmente el número de neutrófilos totales, comprobando que en todas las biometrías hemáticas tomadas presentaba un número de neutrófilos absolutos o totales (NAN) por debajo de los índices normales (Cuadro 1); también clínicamente se encontró que la paciente padecía incontinencia urinaria y desnutrición de segundo grado; desde entonces ha sido sometida a tratamiento por parte del Departamento de Hematología de dicho hospital con «factor estimulante de colonias de granulocitos (G-CSF)» aproximadamente cada mes hasta la fecha, si las condiciones económicas lo permitían.
- •
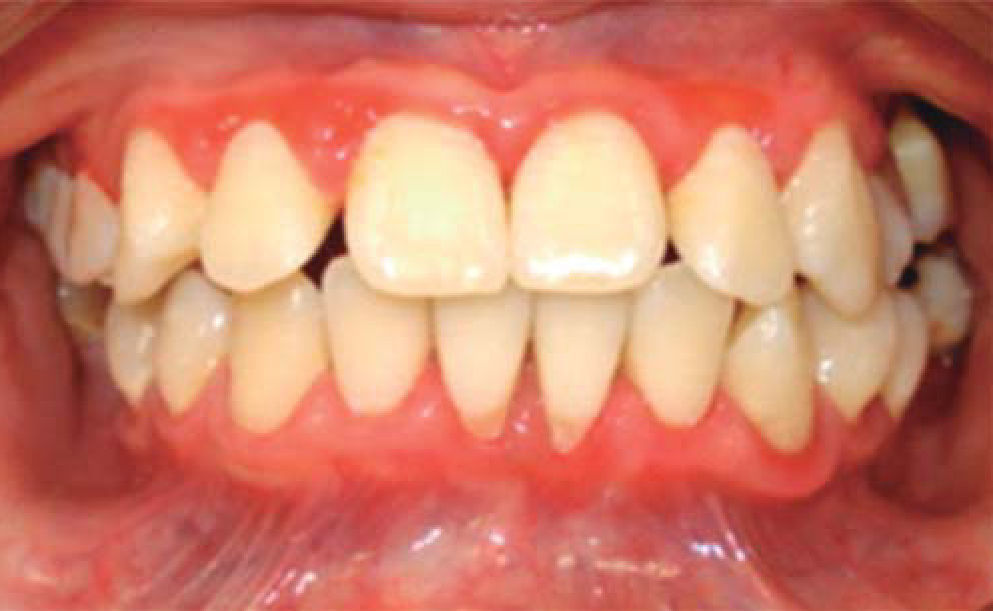
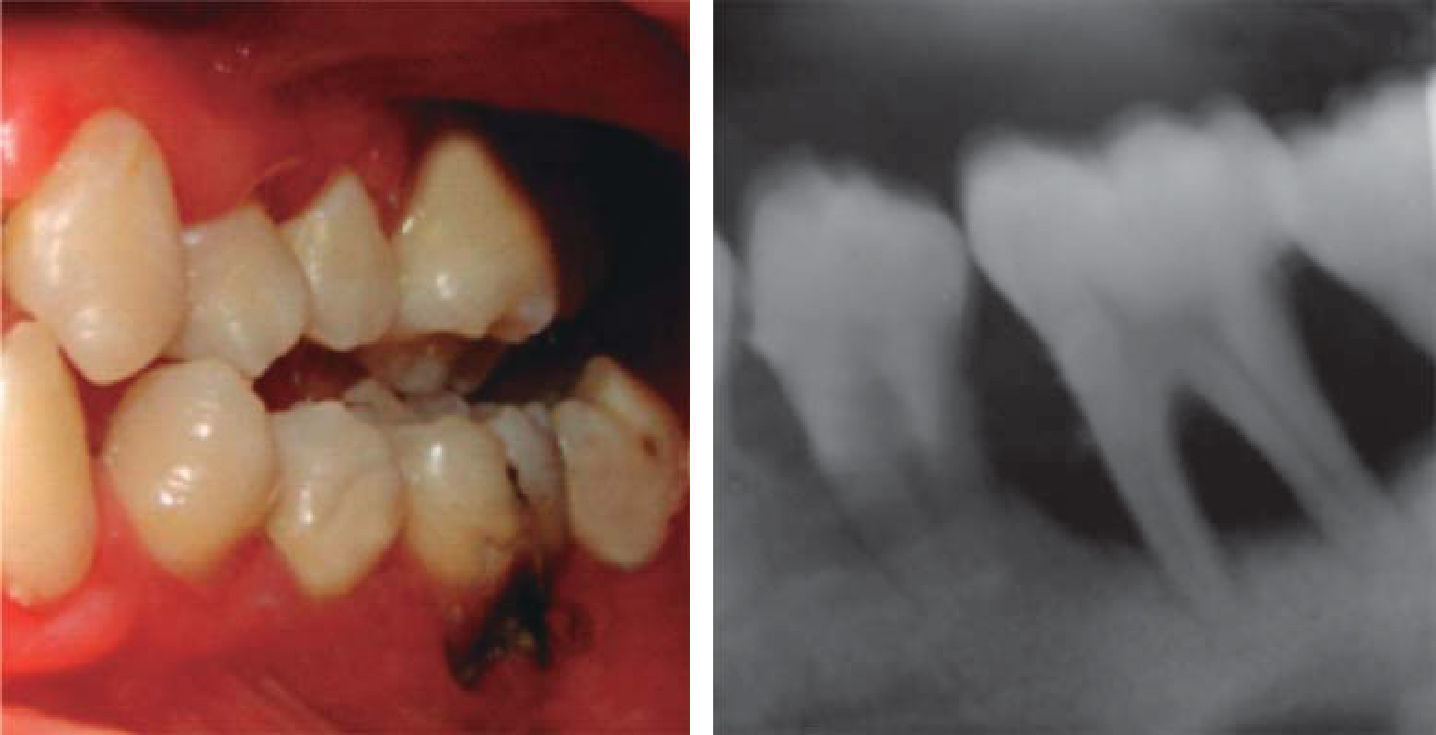
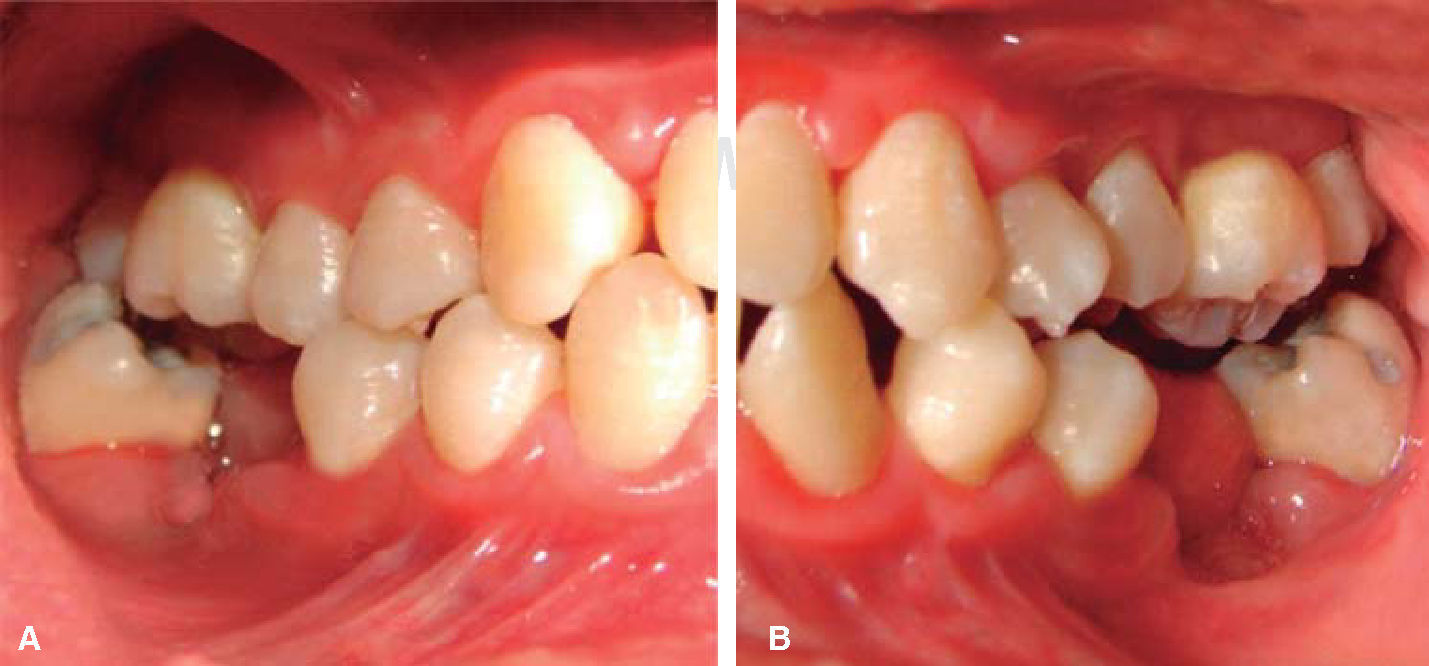
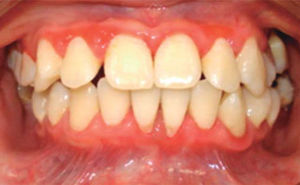
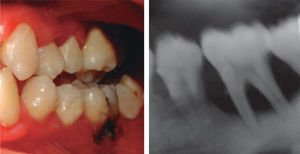
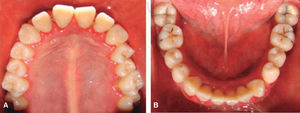
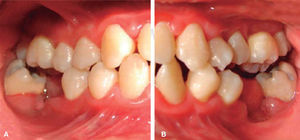
A los 15 años acudió al Servicio de Estomatología Pediátrica referida por el Departamento de Hematología del Hospital Infantil de México «Federico Gómez»; se realizó un examen clínico y radiográfico de cavidad bucal observándose lo siguiente: gingivitis general asociada a biofilm dental, periodontitis, tejidos blandos con adecuada hidratación coloración y vascularización, adecuada implantación de frenillos, procesos alveolares íntegros continuos y simétricos, dentición permanente con malposición dental, presencia de espacios interdentales (Figura 1), resorción ósea (Figura 2), lesiones cariosas de diversos grados en órganos dentales 17, 16, 15, 14, 24, 25, 26, 27, 37, 36, 35, 46 y 47 (Figura 3), queilitis angular, lesiones blancas y en progreso, registrando un alto índice de riesgo a caries según los criterios de valoración establecidos por Tinanoff.6
Se realizó interconsulta con el Departamento de Hematología, en donde se decidió llevar al mismo tiempo el tratamiento tanto hematológico como estomatológico, esto debido al dolor que presentaba la paciente.
Por lo tanto, se planearon una serie de biometrías hemáticas (siendo un total de 7), las cuales se debían tomar desde un día antes de comenzar nuestra rehabilitación bucal hasta dos días después de terminarla con la finalidad de verificar el conteo de neutrófilos totales.
El medicamento seleccionado por el Departamento de Hematología se administró 48 horas antes del tratamiento bucal (Figura 4); en la primer biometría hemática obtenida se observaron datos de neutropenia (460 neutrófilos totales), por lo que se decidió comenzar la rehabilitación bucal al día siguiente.
Al día siguiente se realizó biometría hemática nueva y observamos 4,200 neutrófilos totales, por lo que se decidió comenzar con el tratamiento dental, el cual se realizó en 3 fases:
- •
Fase I: programa higiénico preventivo en donde se tomaron medidas higiénico-preventivas como el controlar la placa dentobacteriana, cepillado después de cada alimento con pasta dental que contenga de 1,000 a 1,500ppm de flúor, aplicaciones tópicas cada tres meses ya que es un paciente considerado de alto riesgo a caries (técnica de Stillman modificada); se implementó el uso de hilo dental, alimentos con horario, disminuir ingesta de carbohidratos y azúcares refinadas, así como evitar ingerir alimentos entre comidas.
- •
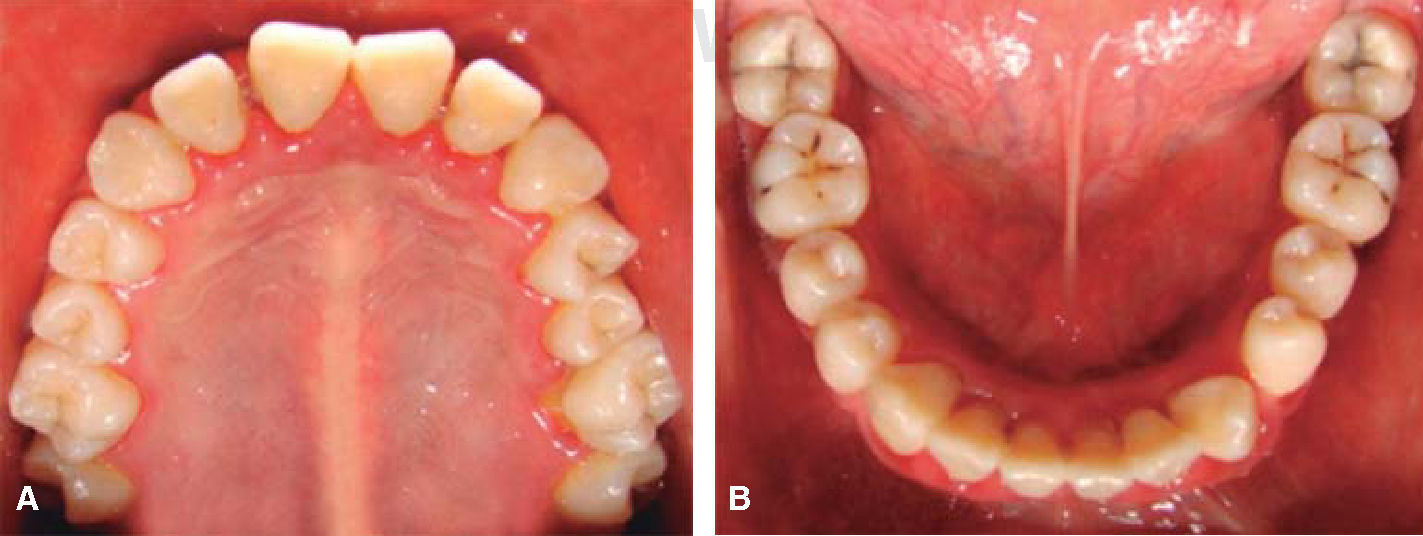
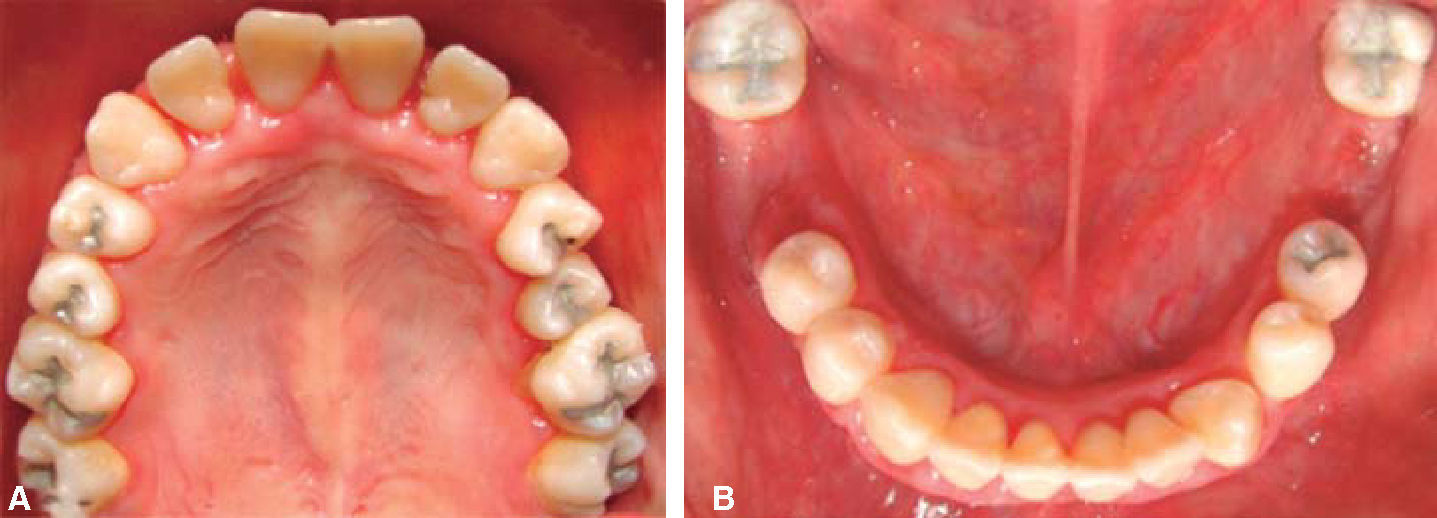
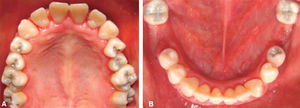
Fase II: terapia restaurativa; se monitorearon lesiones blancas; se restauraron lesiones cavitadas y en progreso; se empleó un tratamiento agresivo para minimizar la progresión de caries, usando lidocaína con epinefrina al 2% a la dosis recomendada por «Clinical action of specific agents. Handbook of local anesthesia» del Dr. Stanley Malamed (4.4 mg/kg), administrando una dosis total de 36mg en cada cita.6 La rehabilitación bucal consistió, por lo tanto, en obturación con amalgama (O.D. 17, 16, 15, 14, 24, 25, 26, 27, 37, 35, 47) y extracciones dentales (O.D. 46, 36) empleando técnicas de manejo conductual; se revisaron últimas notas del Departamento de Hematología, haciendo interconsulta personal con su hematólogo pediatra tratante, revisión de resultado diario de biometría hemática (conteo de neutrófilos totales), verificar la aplicación de «factor estimulante de colonias de granulocitos (GCSF)» por parte del Departamento de Hematología, así como cuidados de higiene bucal y uso de enjuagues con clorhexidina; únicamente el día en que se realizaron las extracciones se mandó profilaxis antibacteriana a base de amoxicilina 50 mg/kg peso una hora antes de iniciar el tratamiento con la finalidad de evitar la formación de procesos infecciosos o alguna complicación postoperatoria. Todo el procedimiento restaurativo se realizó en tres citas cortas (Figuras 5 y 6).
- •
Fase III: atención multidisciplinaria; aparte de estar en comunicación con el Departamento de Hematología se llevó el caso con el Departamento de Periodoncia con la finalidad de controlar los procesos infecciosos e implementar adecuadas técnicas de higiene bucal.
También se contó con la ayuda del Departamento de Nutrición con la finalidad de brindar consejos dietéticos.
CONCLUSIONESLos trastornos hematológicos constituyen uno de los problemas de mayor interés a considerarse por el odontólogo en su práctica diaria. La susceptibilidad a procesos infecciosos hace de ellos un grupo especial que amerita atención cuidadosa para sortear complicaciones postoperatorias. La investigación de un trastorno hematológico requiere de un estudio clínico y de laboratorio muy cuidadoso.
De acuerdo con la literatura, existen dos tipos de trastornos leucocitarios: leucocitosis y leucopenia, los cuales provocan que el sistema de defensa del organismo se encuentre afectado.
Existen asimismo muchas causas para la reducción del número de leucocitos (4-11 mm3) en la sangre. Un paciente con leucopenia grave es susceptible a infecciones así como a enfermedad periodontal, siendo estos problemas potenciales graves en relación con el tratamiento dental; para prevenir estas complicaciones es importante tener un recuento seriado de células blancas y elegir el momento justo del ciclo cuando el recuento esté muy próximo al nivel normal, así como saber prescribir profilaxis antibiótica si es necesario.
El estomatólogo pediatra, como parte del equipo multidisciplinario en el tratamiento de pacientes médicamente comprometidos, debe comprender el protocolo de atención a niños con alteraciones hematológicas, en este caso glóbulos blancos:
- 1)
Identificar el padecimiento, así como signos y síntomas del mismo.
- 2)
Interconsultar con hematólogo tratante el estado completo actual del paciente.
- 3)
Identificar los problemas potenciales que se pueden presentar antes, durante o después del tratamiento.
- 4)
Determinar un esquema profiláctico antibacteriano.
- 5)
Revisar el número de neutrófilos totales en biometría hemática antes, durante y después del tratamiento dental.
- 6)
En caso de presentarse tratamientos de urgencia en donde el paciente se encuentre en la etapa más baja en el número de neutrófilos totales dentro de su ciclo, se debe evitar el uso de ácido acetilsalicílico y antiinflamatorios no esteroideos, ya que seguro presenta datos de trombocitopenia; sin embargo, se puede usar de forma paliativa el uso de paracetamol con o sin codeína, enjuagues de solución Philadelphia o clorhexidina como auxiliares en su técnica de limpieza bucal hasta que sus condiciones mejoren.
Siguiendo paso a paso el manejo estomatológico de pacientes con trastornos hematológicos decidimos atender con toda confianza a un paciente femenino de 15 años de edad; cabe mencionar que a pesar de tener guías dentro de la literatura, como son el saber el estado actual del paciente, contar con biometría hemática reciente y esquema antibiótico profiláctico; en este caso se presentó una serie de alteraciones hematológicas, lo que provocó el retraso de la rehabilitación bucal; una vez controlado el número de neutrófilos totales de nuestra paciente se decidió continuar, obteniendo resultados satisfactorios y sobre todo evitando comprometer su vida.
El identificar tratamientos de urgencia bucal y saber solucionarlos, como parte de un equipo multidisciplinario, principalmente con un especialista hematológico, nos facilitará una rehabilitación completa, segura y sin complicaciones.
Es importante considerar que son pacientes descuidados bucodentalmente ya que no hay guía específica de prevención y programas de protección. El control postoperatorio, así como las citas de revisión, son de suma importancia para mantener en control al paciente.
Hospital Infantil de México «Federico Gómez»