Los factores celulares y moleculares que regulan los procesos de formación y mineralización del cemento son poco conocidos hasta la fecha. Principalmente esto se debe a que no existe un marcador biológico de este tejido. Nosotros recientemente hemos aislado, clonado y expresado una proteína derivada del cemento radicular humano llamada proteína del cemento. Esta proteína es expresada por cementoblastos y células progenitoras del periodonto. El objetivo de este trabajo fue el de expresar la proteína del cemento en células de Drosophila melanogaster para en un futuro, determinar sus modificaciones postraduccionales. Nuestros resultados muestran que hemos establecido una línea celular que expresa constitutivamente y de forma estable la proteína del cemento. Esto es de singular importancia, ya que en un futuro mediato, estas células serán el vehículo para la producción de la proteína del cemento en cantidades suficientes para determinar su papel durante el proceso de la formación del periodonto de novo en modelos animales y de un modo predecible.
To the present date, molecular and cellular factors which regulate cement formation and mineralization processes are not well known. This is mainly due to the lack of a biological marker for this type of tissue. We have recently isolated, cloned and expressed a protein derived from human radicular (root) cement, called cement protein. This protein is expressed by cementoblasts as well as periodontium progenitor cells. The aim of the present work was to express cement protein in Drosophila melanogaster cells, so as to determine, in the future, its post-translational modifications. Our results show we have established a cellular line which expresses protein cement in an essential and stable fashion. This fact is of unique importance, since in the mediate future these cells will become the vehicle for cement protein production in sufficient amounts to determine in a predictable manner, its role during the process of de novo periodontium formation process in animal models.
Uno de los mayores problemas en la enfermedad periodontal es la destrucción de los tejidos que proveen la inserción de los dientes al hueso alveolar. Las estrategias terapéuticas para resolver este problema están dirigidas a lograr la completa regeneración de los tejidos periodontales.1 A pesar de los avances respecto a la osteogénesis, los procesos que regulan la cementogénesis son poco conocidos, por lo que nuestro entendimiento del cemento y de la regeneración del periodonto permanece oscuro.2 Avances substanciales en el campo de la formación de hueso, esmalte y la dentina han tomado lugar debido a la disponibilidad de marcadores específicos que facilitan la identificación de estos tejidos.3 En contraste, la falta de marcadores específicos para el cemento ha limitado nuestro conocimiento acerca de los mecanismos que controlan la diferenciación de células cementoblásticas, la formación del cemento y el desarrollo del periodonto. Esfuerzos de diversos laboratorios, incluyendo el nuestro, han resultado en el aislamiento de varias proteínas putativas específicas del cemento, como son: la proteína de 55kDa llamada proteína de adhesión al cemento (CAP),4,5 una proteína relacionada y derivada del cementoblastoma humano (CP),6 un factor mitogénico conocido como factor de crecimiento del cemento radicular (CGF) e isoforma del factor de crecimiento parecido a la insulina (IGF-I)7 y una proteína de 72 kDa, CEM-1.8 La caracterización completa de estas proteínas ha sido difícil y en algunos casos no existente. Recientemente, nuestro laboratorio aisló y caracterizó un gen derivado de una biblioteca de DNAc (DNA complementario llamado «proteína del cemento CEMP1») que parece ser específico para células del linaje de las células cementoblásticas y subpoblaciones celulares del ligamento periodontal.8 Datos preliminares sugieren que la proteína hrCEMP1 de E. coli tiene un efecto en la proliferación y la actividad de la fosfatasa alcalina en las células cementoblásticas, así como es importante determinar si la proteína tiene un efecto en otras funciones celulares. No obstante, los análisis de la estructura primaria CEMP1, utilizando la base de datos de PROSITE, revelaron que la proteína puede ser modificada postranscripcionalmente. Para determinar estas modificaciones es preciso utilizar sistema celular de expresión de Drosophila (DES Invitrogen, CA). Este sistema ofrece la ventaja sobre otros sistemas de expresión de mamíferos, que puede producir grandes cantidades de proteína recombinante. Por lo tanto, el principal objetivo de este proyecto es expresar este gen en un sistema celular eucarionte en células emmbrionarias de Drosophila melanogaster DML-2; esto, con el objetivo de poder obtener cantidades suficientes de esta proteína para determinar sus cualidades en cuanto a su actividad biológica.
Materiales y métodosTransfección del gen cemp1 en células dml-2El sistema de expresión en células de Drosophila que se utilizó, fue el adquirido a Invitrogen (Carlsbad, CA). Se siguieron los procedimientos descritos por el fabricante; brevemente, el cDNA de la proteína CEMP1 se clonó en el plásmido pMT/BiP/CEMP 1-His, en la cual, el extremo N-terminal de la proteína hCEMP1 se fusionó con la secuencia señal de BiP, mientras que en su extremo C-terminal se fusionó un péptido (histidina)6 X (la construcción fue confirmada mediante secuenciación). La transcripción de la proteína CEMP1 se encuentra bajo la regulación del promotor de la metalotioneína (MT). Se utilizó para transfectar células embrionarias S2 de Drosophila melanogaster y el plásmido; sin la secuencia codificante para la proteína CEMP1 se utilizó como control negativo. Las células transfectadas se indujeron para expresar la CEMP1 mediante la adición de CuSO4. Las células S2 y su medio de cultivo fueron probadas para la expresión de CEMP1 mediante Western blot, utilizando un anticuerpo anti-His 6X y anti hrCEMP1. Después de confirmar que la expresión de CEMP1 fue adecuada, las células S2 se cotransfectaron con el vector pMT/BiP/CEMP1-His y el vector de selección pCoHygro. Las células crecieron en un medio de expresión completo DES con higromicina B para su selección y en un medio de expresión estable durante 8 semanas. El medio de selección se reemplazó cada 5 días para seleccionar células resistentes que se establecieron como línea celular estable. Dichas células se indujeron con 500 μM deCuSO4/mL; las células y el medio se evaluaron y las líneas celulares se seleccionaron con el más alto rendimiento de CEMP1. La proteína recombinante se purificó pasando el medio por una columna de agarosa Ni-NTA. La pureza fue determinada por medio de un gel de poliacrilamida con dodecilsulfato de sodio (SDS-PAGE), tinción con plata y Western blot.
Inmunolocalización de la proteína cemp1 (proteína del cemento) en células dml-2 de drosophilaPara determinar si las células transfectadas con el gen CEMP1 expresaban esta proteína, se llevaron a cabo ensayos de inmunolocalización en estas células como se describe a continuación: las células DML-2 fueron sembradas a baja densidad (5x102) en cajas estériles Lab-Tek de ocho pozos; se dejó a las células adherirse durante toda la noche y se cultivaron durante tres días. Las células fueron fijadas en formaldehído al 3.7% y se llevaron a cabo los procedimientos de inmunolocalización. El número de células reactivas al anti-hrCEMP1 se determinó cuantificando cinco diferentes campos al microscopio con un lente de 20 X. Los resultados son expresados como medias (n = 5) y desviación estándar de tres experimentos independientes. Los cultivos se incubaron con suero preinmune de conejo o sin el primer anticuerpo para utilizarse como controles negativos.
InmunoblotPara determinar si las células DML-2 transfectadas con el gen CEMP1 expresaban este marcador, se llevaron a cabo Western blots utilizando anticuerpos, tanto monoclonal (Anti-His 6X C-term; Invitrogen, Carlsbad, CA) y policlonal anti hrCEMP1, los cuales se utilizaron para identificar las histidinas de la proteína recombinante y para reconocer específicamente la proteína CEMP1, respectivamente. Para probar cada anticuerpo se cargaron iguales cantidades de proteína (5 μg/pozo) en un gel SDS-PAGE al 12% de acuerdo a procedimientos estándares. La hrCEMP1-DML2 fue transferida a una membrana de nitrocelulosa Immobilon-P (PVDF) (Millipore Corp., Bedford, MA). Las membranas fueron bloqueadas durante una hora con un amortiguador, conteniendo 100mM Tris-HCl pH 7.5 y 5% de leche descremada. Posteriormente las membranas fueron incubadas con anti-hrCEMP1 (1:300) y anticuerpo monoclonal anti-His (1:5000). Las membranas fueron incubadas durante una hora a temperatura ambiente. Después de lavadas, las membranas fueron incubadas con un anticuerpo secundario conjugado anti-conejo o anti-ratón conjugado a peroxidasa de rábano (1:1000) durante una hora. Las membranas fueron lavadas y reveladas como se ha descrito previamente.
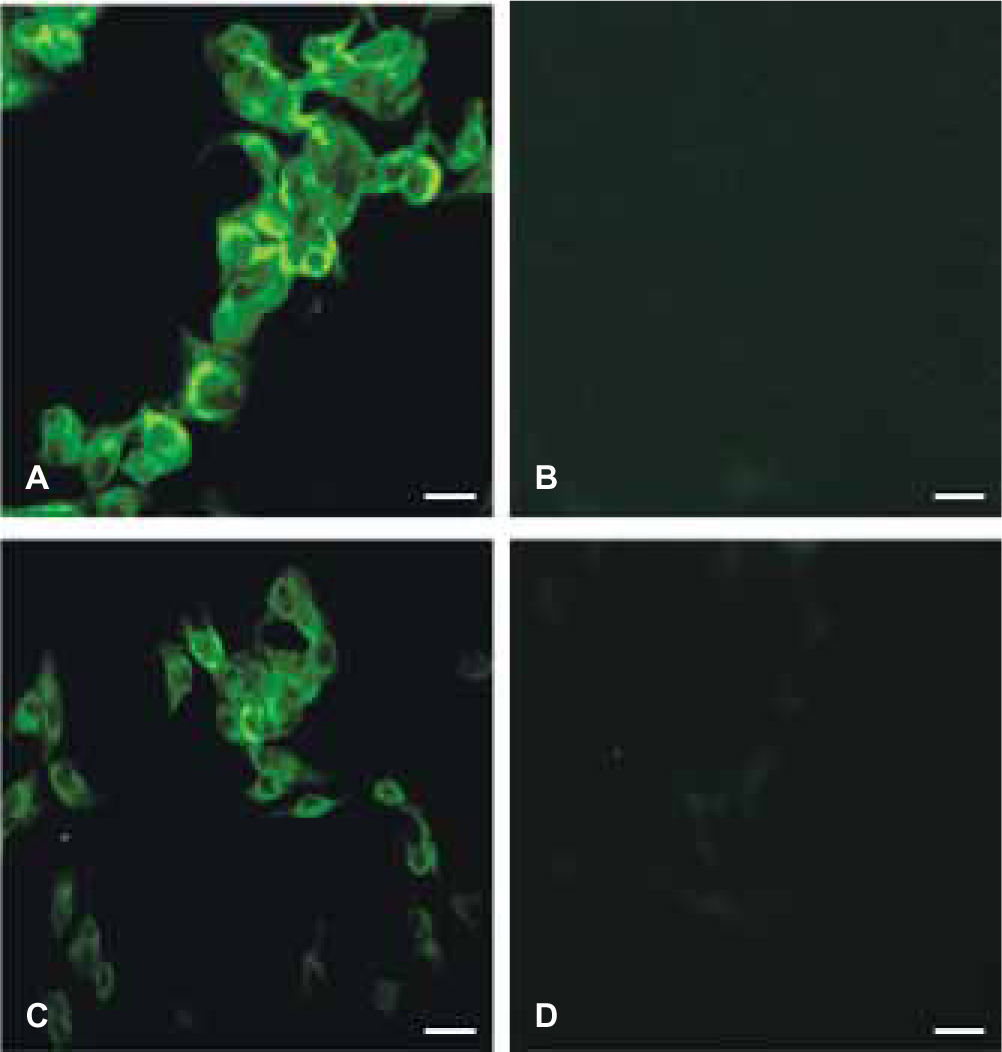
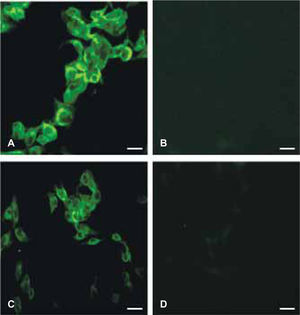
ResultadosTransfección del gen cemp1 en células dml-2Las células DML-2 una vez transfectadas, fueron sujetas de una expresión transitoria de la proteína CEMP1, incubando éstas en presencia de CuSO4, 500 μM deCuSO4/mL durante 48 horas, término al cual tanto las células como el medio condicionante fueron recolectados y procesados para SDS-PAGE e inmunoblot, como se describió anteriormente. Para obtener una línea celular con expresión estable de la proteína CEMP1, estas células fueron seleccionadas con higromicina B (600 μg/mL, durante 8 semanas) y la expresión de la proteína determinada como se detalla arriba. La inmunolocalización tanto de la proteína hrCEMP1 y la transfección exitosa del gen CEMP1, fue determinada por medio del uso de un anticuerpo monoclonal anti-His-COOH-conjugado a FITC. Nuestros resultados mostraron que la proteína CEMP1 se encontraba localizada en la membrana celular (Figuras 1A y 1B)), respectivamente. Los controles, utilizando suero preinmune de conejo y de ratón, no mostraron una reacción evidente (Figuras 1C y 1D).
A) Se observa que las células transfectadas con el gen de la proteína del cemento son reconocidas por el anticuerpo monoclonal anti 6X his. En la figura C) podemos observar la expresión de la proteína del cemento, utilizando un anticuerpo recombinante contra ésta. En B) y D) observamos que no existe reconocimiento positivo de esta proteína y corresponden a los controles negativos. Barra = 100 μm.
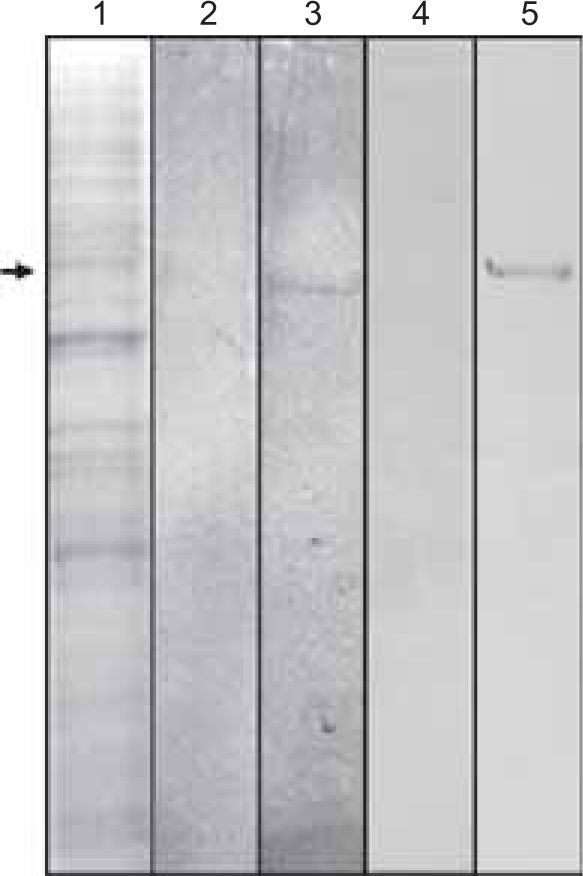
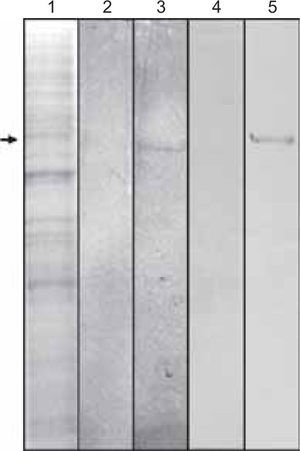
Para determinar la expresión de la proteína CEMP1 en células DMEL2, se realizaron inmunoblots utilizando anticuerpos contra la proteína rCEMP1 y anti-His-COOH. Se recolectó tanto el medio condicionante como el extracto celular. Nuestros resultados mostraron que a la tinción con Coomassie azul la banda más prominente se observó con un peso molecular aproximado de 55-60 kDa en el medio condicionante (Figura 2, línea 1). Asimismo, los inmunoblots con los anticuerpos antes mencionados, revelaron que reconocían especies de aproximadamente 55-60 kDa (Figura 2, líneas 3 y 5).
Se observa en la línea 1 la tinción con Coomassie azul de las proteínas expresadas por las células de Drosophila melanogaster y transfectadas con el gen de la proteína del cemento. La flecha indica la especie de 50 kDa. La línea 2 representa el control negativo de células que no expresan constitutivamente el gen de la proteína del cemento. La línea 3 nos muestra el reconocimiento de una banda de 50 kDa por medio del anticuerpo anti-6Xhis. La línea 4 representa el control negativo utilizando el anticuerpo recombinante contra la proteína del cemento. La línea cinco muestra una banda de 50 kDa reconocida por el anticuerpo antiproteína del cemento.
En esta investigación se describe la construcción y producción de una proteína recombinante humana derivada del cemento (CEMP1) en células de Drosophila melanogaster. Previamente se han descrito proteínas específicas del cemento como la CAP y la CP, y recientemente ha sido clonado, caracterizado y expresado el producto génico de esta última, a la cual hemos denominado «proteína del cemento» (CEMP1).9 Estudios preliminares sugieren que la proteína hrCEMP 1 en E. Coli tiene un efecto en la proliferación y quimiotaxis celular, y promueve la actividad de la fosfatasa alcalina en las células derivadas del periodonto humano in vitro.4,10 Sin embargo, dado que los sistemas procariontes de expresión como la E. Coli no poseen la maquinaria para realizar modificaciones postraduccionales de los productos génicos y con la finalidad de conocer éstas, planteamos la posibilidad de utilizar un sistema de expresión eucarionte utilizando células embrionarias derivadas de la mosca Drosophia melanoganster. Nosotros reportamos en este trabajo la expresión de la proteína del cemento (CEMP1) en las células antes mencionadas, cuya expresión estable servirá en un futuro para determinar las modificaciones postraduccionales de esta proteína, tales como fosforilaciones y glicosilaciones. La producción de la proteína fue corroborada en los geles SDS-PAGE teñidos con azul de Coomassie, Western blot utilizando anticuerpos específicos contra la proteína CEMP 1 y anticuerpo contra 6X histidinas. Nuestros resultados revelan que la proteína del cemento (CEMP1) tiene un Mr de 50,000 como se demostró por medio de los Western blots. Asimismo, nuestros resultados determinaron que esta proteína se encuentra localizada en la membrana celular de dichas células y también es secretada al medio condicionante.11 Estos hallazgos preliminares nos ofrecen la posibilidad de determinar si las modificaciones postraduccionales de la proteína CEMP1 podrían afectar su actividad biológica, y de un modo importante, la disponibilidad de este gen nos permitirá determinar los eventos celulares y moleculares que regulan el proceso de la cementogénesis durante el desarrollo y en el periodonto adulto, así como en los procesos regenerativos. Aún más podría proveer nuevas vías para el diseño de estudios preclínicos cuyo objetivo sea el lograr la cementogenesis de novo y la regeneración de los tejidos periodontales de un modo predecible. Como ha sido demostrado previamente, esta proteína parece estar asociada al proceso de mineralización, ya que regula la composición y morfología de los cristales de hidroxiapatita.12 Asimismo regula la expresión de la fosfatasa alcalina, factor asociado a las etapas tempranas del proceso de mineralización y sialoproteína, ósea está asociada al proceso de nucleación de los cristales de hidroxiapatita y al control del crecimiento de estos.12 Asimismo la proteína del cemento regula también la expresión de la osteopontina, proteína asociada a la regulación del proceso de mineralización, principalmente regulando el crecimiento del cristal de hidroxiapatita en los estadios tardíos del proceso de mineralización.
En conclusión, basados en los resultados de este trabajo de investigación, nosotros proponemos que la proteína del cemento podría jugar un papel regulador importante durante el proceso de la cementogénesis. Más importante aún son las posibilidades que ofrecen las características biológicas de esta novel proteína en el tratamiento predecible para promover la regeneración de los tejidos que conforman el periodonto.13 Esta proteína novel abre también nuevas vías para el implemento de terapéuticas diseñadas para la regeneración de tejidos mineralizados.